My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 n.11 Madrid Nov. 2005
|
TRABAJOS ORIGINALES |
Papel del Helicobacter pylori en el cáncer gástrico tras gastrectomía parcial por úlcera benigna
A. Seoane, X. Bessa, F. Alameda1, A. Munné1, M. Gallen2, S. Navarro3, E. O'Callaghan, A. Panadès, M. Andreu1 y F. Bory
Servicios de Aparato Digestivo, 1Anatomía Patológica, 2Oncología y 3Cirugía General. Hospital del Mar. Universidad Autónoma de Barcelona
RESUMEN
Objetivo: determinar la prevalencia de la infección por
Helicobacter pylori en pacientes gastrectomizados por enfermedad no neoplásica, y que han desarrollado posteriormente cáncer gástrico.
Material y métodos: estudio retrospectivo con reclutamiento de todos los pacientes con gastrectomía parcial por enfermedad péptica benigna que han sido sometidos a una exploración endoscópica entre 1995-2001. Se ha realizado una comparación de las principales características clínicas e histológicas y de la presencia de
Helicobacter pylori en los pacientes con y sin cáncer del remanente gástrico.
Resultados: se han estudiado un total de 73 pacientes en este periodo. Se han
encontrado 15 pacientes (20,5%) con cáncer en el remanente gástrico, 14 adenocarcinomas (71% tipo intestinal y 29% tipo difuso) y un linfoma. El tiempo transcurrido entre el diagnóstico de cáncer gástrico y la gastrectomía previa ha sido de 32 (14-48) años. Se ha detectado un alto porcentaje de infección por
Helicobacter pylori (100% en los pacientes con cáncer vs. 81,5% en los pacientes sin cáncer, p < 0,07). No se ha observado relación entre el tipo de reconstrucción gástrica (Billroth I o II) y el porcentaje de infección por
Helicobacter pylori.
Conclusiones: la infección por Helicobacter pylori es frecuente en pacientes gastrectomizados por patología benigna. Los resultados de este estudio sugieren que la infección por Helicobacter pylori podría jugar un papel en el cáncer gástrico.
Palabras clave: Cáncer de muñón gástrico. Helicobacter pylori.
Financiado por una beca del instituto Carlos III C03/02.
INTRODUCCIÓN
En 1994 el grupo de consenso de la Organización Internacional de la Salud y la Agencia Internacional de la Investigación del Cáncer establecieron que existen suficientes evidencias epidemiológicas e histológicas para clasificar al Helicobacter pylori (H. pylori) como un carcinógeno (1). En este sentido, varios metanálisis han sugerido que la infección crónica por H. pylori induce a un incremento dos o tres veces superior en el riesgo de desarrollar cáncer gástrico (2-4), y un reciente estudio prospectivo ha evidenciado que la infección por H. pylori está asociada con el desarrollo de cáncer gástrico (5).
En los pacientes sometidos a gastrectomía parcial por enfermedad péptica benigna se ha descrito que, después de un largo periodo de tiempo, existe un riesgo aumentado para desarrollar cáncer en el remanente gástrico (6,7) y un metanálisis sugiere que el riesgo es más alto una vez han transcurrido quince años desde la cirugía gástrica (8). En contraste con el cáncer gástrico desarrollado en el estómago intacto, donde el H. pylori representa el factor carcinógeno más importante, tras una gastrectomía parcial, el papel carcinógeno principal lo desempeña el reflujo biliar, una consecuencia invariable de las operaciones que resecan o provocan un by-pass del píloro (9).
El papel del H. pylori en el cáncer del remanente gástrico se ha valorado en diferentes estudios, pero este no ha quedado aún clarificado. Existen estudios donde se describe que el reflujo biliar y el H. pylori tienen un papel sinérgico en la proliferación celular. Se ha sugerido que el pH alcalino intragástrico inducido por el reflujo biliar produce un microambiente desfavorable para la colonización por el H. pylori (10,11). En este sentido, se ha descrito que las sales biliares tienen un efecto bactericida en el H. pylori, y tras las resección tipo Billroth, la infección por H. pylori desaparece rapidamente del remanente gástrico (12). Estos datos, junto a la baja incidencia de la infección por H. pylori detectada en el remanente gástrico en estudios previos, apoyan la hipótesis de que la proliferación celular resultante del reflujo biliar es el principal factor implicado en la patogénesis de cáncer en el remanente gástrico (13-15).
El objetivo de este estudio retrospectivo ha sido determinar la prevalencia de la infección por H. pylori en el remanente gástrico de los pacientes tratados quirúrgicamente por enfermedad ulcerosa péptica benigna.
MATERIAL y MÉTODOS
Diseño del estudio y selección de pacientes
El estudio se ha llevado a cabo retrospectivamente. Se han revisado los Archivos de la Unidad de Endoscopia correspondientes a las fechas comprendidas entre enero de 1995 y diciembre de 2001, con el fin de detectar a aquellos pacientes sometidos a una endoscopia digestiva alta posteriormente a una gastrectomía parcial por úlcera péptica benigna, reclutando un total de 116 pacientes. En el Servicio de Anatomía Patológica se ha revisado la disponibilidad de muestra histológica de tejido gástrico obtenida entre dichas fechas en estos pacientes (biopsias endoscópicas o especimen quirúrgico), disponiéndose de muestra en 73 de ellos (63%), que han constituido los pacientes incluidos finalmente en el estudio. Los pacientes intervenidos inicialmente por carcinoma de cardias y aquellos sometidos a una endoscopia digestiva alta en un tiempo menor a 10 años tras la gastrectomía han sido excluídos.
En orden a establecer el papel de la infección por H. pylori en el cáncer gástrico tras una gastrectomía parcial, se han constituído dos subgrupos para el análisis: grupo 1 (pacientes con cáncer en el remanente gástrico) y grupo 2 (pacientes sin cáncer). Se ha llevado a cabo una comparación de las principales variables clínicas (sexo, edad, causa de gastrectomía y tipo de reconstrucción gástrica) e histológicas (presencia de gastritis, metaplasia e infección por H. pylori).
Manejo histológico e identificación de Helicobacter pylori
Las muestras de biopsia y los especímenes obtenidos por gastrectomía han sido colocadas en formol al 10%, procesados de forma rutinaria y teñidos con hematoxilina y eosina. La tinción modificada de Giemsa y Tricrómico de Masson fue usada para detectar la infección por H. pylori. El tipo histológico de cáncer fue determinado usando la clasificación de Lauren (intestinal, difuso o mixto) (16). La mucosa no neoplásica fue examinada, valorándose la presencia de inflamación crónica, atrofia glandular y metaplasia intestinal, de acuerdo con la clasificación de Sydney. El examen histológico y el estado de infección por H. pylori han sido evaluados independientemente por dos patólogos.
Métodos estadísticos
Las variables continuas han sido expresadas como media ± desviación estándar. Las variables cualitativas han sido evaluadas mediante el test de χ2 (Chi cuadrado), aplicando la corrección de Yates cuando ha sido necesario. Las variables continuas con distribución paramétrica y no-paramétrica fueron comparadas por medio del test t de Student y del test de Mann-Whitney, respectivamente.
RESULTADOS
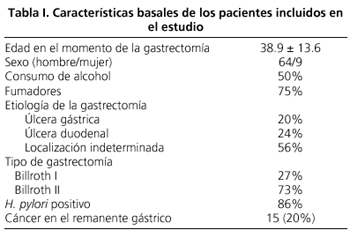
Las características basales de los pacientes estudiados se describen en la tabla I. Globalmente, la infección por H. pylori ha sido detectada en el remanente gástrico en 63 pacientes (86%). Se ha detectado cáncer gástrico en 15 pacientes (20.5%), todos localizados cerca de la gastroenteroanastomosis, 14 adenocarcinomas (71% tipo intestinal y 29% tipo difuso) y 1 linfoma T. La colonización por H. pylori ha sido detectada en todos los pacientes (100%) con cáncer.
El tiempo medio entre la gastrectomía y el diagnóstico de cáncer gástrico ha sido de 32 (14-48) años, sin diferencias con el tiempo transcurrido entre la gastrectomía y el último control endoscópico en el grupo sin diagnóstico de cáncer
(Tabla II).
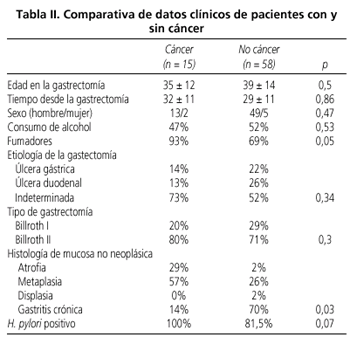
Aunque la condición de fumador ha sido mas prevalente en el grupo con cáncer (93 vs. 69%, p < 0,05), no se han observado diferencias en cuanto a la edad, sexo, consumo de alcohol, etiología de la gastrectomía y tipo de reconstrucción tipo Billroth entre ambos grupos de pacientes: con cáncer y sin cáncer
(Fig. 1,
Tabla II). La atrofia y la metaplasia intestinal han sido más frecuentes en la mucosa no-neoplásica de pacientes con cáncer del remanente gástrico que en la mucosa de los pacientes sin cáncer (29 y 57% vs. 2 y 26%, respectivamente). Aunque no se alcanza significación estadística, la detección de H. pylori ha sido más alta en los pacientes con cáncer (100 vs. 81,5%, p < 0,07)
(Fig. 2). No se ha observado relación entre el tipo de reconstrucción gástrica (Billroth I o II) y el porcentaje de detección histológica de H. pylori
(Fig. 3).
DISCUSIÓN
Después de una gastrectomia parcial existe un riesgo aumentado de desarrollar cáncer gástrico y este riesgo parece aumentar proporcionalmente con la duración del intervalo de tiempo postoperatorio (6-8). La patogénesis no está clara, pero el incremento en la proliferación celular de las celulas de la mucosa gástrica asociado con un reflujo biliar crónico parece ser un factor carcinogénico importante (17,18) habiéndose descrito la presencia de metaplasia intestinal en asociación con el reflujo bilar tras una cirugía gástrica (19). La hipótesis dominante en la actualidad es que la metaplasia intestinal es una condición precancerosa, ocurriendo como resultado de la exposición a mutágenos en un jugo gástrico hipoclorhídrico.
Aunque en el estómago intacto la infección por H. pylori se ha considerado como un factor que incrementa el riesgo de cáncer gástrico (2-5), su rol en el desarrollo de cáncer del remanente gástrico en pacientes tratados quirúrgicamente por enfermedad benigna ulcerosa es incierta. Múltiples estudios han evaluado la prevalencia de H. pylori en pacientes con cáncer gástrico (2-5) pero en muy pocos se ha valorado la prevalencia de la infección por H. pylori en pacientes con cáncer del remanente gástrico, en los que ha sido estimada en alrededor de un 38% (14,20-25). Sólo un estudio (26), usando el método de reacción en cadena de la polimerasa (PCR) para la detección de la infección por H. pylori, ha observado una alta prevalencia (62,4%), aunque en este estudio se han incluido pacientes con gastrectomía parcial por cáncer gástrico y no solamente por patología benigna.
Se ha sugerido que el incremento de reflujo de ácidos biliares después de una gastrectomía parcial, que es más prevalente en pacientes con reconstrucción tipo Billroth II, produce un microambiente desfavorable para la infección por H. pylori y su colonización, lo que podría explicar en estos pacientes la baja detección de la infección por H. pylori. Además, se ha demostrado que después de la resección tipo Billroth la infección por H. pylori desaparece rápidamente de la gastroenteroanastomosis (12,27). En función de estos hechos, la proliferación celular resultante del reflujo de ácidos biliares se ha propuesto como el principal factor implicado en la patogénesis del cáncer del remanente gástrico (13-15). Debido a la naturaleza retrospectiva de nuestro estudio, no ha sido posible establecer la cuantía del reflujo biliar en nuestros pacientes, pero como en todos los pacientes con operaciones con resección o by-pass del píloro, nuestros pacientes podrían tener un pH intragástrico alto (9).
Nuestros resultados, con una notoria alta prevalencia de infección por H. pylori en el remanente gástrico, argumentan en contra del efecto deletereo de un pH intragástrico alcalino en la colonización por H. pylori. Del mismo modo, puede ser razonable pensar que la infección por H. pylori fue adquirida antes de la gastrectomía dado que todos los pacientes fueron intervenidos por una enfermedad benigna ulcerosa intratable o complicada. Por último, teniendo en cuenta que la infección puede ser poco densa e irregular en su distribución en la cavidad gástrica, otra posibilidad es que las diferencias en la prevalencia de la infección por H. pylori hayan sido debidas al hecho de que el tamaño de los fragmentos estudiados han sido mucho más grandes en el grupo con cáncer gástrico.
Del mismo modo a como se ha descrito previamente (10,21,28), los pacientes con reconstrucción Billroth I de nuestro estudio han tenido una mayor prevalencia de infección por H. pylori que los pacientes con reconstrucción Billroth II, aunque este dato no alcanza significación estadística probablemente en relación con un bajo número de casos incluidos. La colonización por H. pylori en el remanente gástrico no se ha correlacionado con ninguna de las variables evaluadas (edad, sexo, causa de gastrectomía, tipo de anastomosis o intervalo de tiempo entre la cirugía y valoración de la infección por H. pylori).
En nuestro estudio, la gastritis crónica ha sido detectada en el 70% de los pacientes sin cáncer gástrico. Aunque la infeccion por H. pylori no ha sido implicada en la recidiva ulcerosa en pacientes gastrectomizados por patología péptica benigna (23), la infección persistente produce una gastritis residual en el remanente gástrico y una proliferación celular en el cuerpo gástrico (20). Un estudio sugiere que la erradicación de la infección por H. pylori induce a regresión de gastritis del remanente (28), y que la gastritis inducida por H. pylori tiene un efecto sinérgico con el reflujo biliar en el estímulo de la proliferación celular en el remanente gástrico (20,21). Además, un estudio de proliferación celular en pacientes con gastrectomía previa, ha mostrado que aquellos pacientes positivos para la infección por H. pylori tienen niveles más altos de proliferación celular que aquellos en los que el test de infección es negativo (22), sugiriendo que ambos factores pueden estar implicados en la carcinogénesis gástrica de estos pacientes.
Aunque en el presente estudio la diferencia de la prevalencia de infección por H. pylori entre ambos grupos (pacientes con cáncer y sin cáncer) no ha alcanzado significación estadística, la alta prevalencia de infección por H. pylori en pacientes con cáncer gástrico (100% de los pacientes) merece alguna atención. Probablemente, con un mayor número de pacientes, las diferencias podrían alcanzar significación estadística. Por otro lado, la alta prevalencia de infección por H. pylori, y la eficacia demostrada de diferentes tratamientos (29), podría reforzar la indicación de la erradicación de la infección por H. pylori en pacientes con gastrectomía parcial por enfermedad ulcerosa benigna, ya no sólo por el simple hecho del antecedente ulceroso, sino como medida para prevenir el cáncer gástrico.
En conclusión, la colonización por H. pylori en pacientes sometidos a gastrectomía parcial por enfermedad ulcerosa benigna no parece verse influida por el reflujo biliar, y por lo tanto los resultados del presente estudio sugieren que el H. pylori podría tener un papel en la carcinogénesis gastrica de los pacientes gastrectomizados.
BIBLIOGRAFÍA
1. International Agency for Research on Cancer liver flukes and Helicobacter pylori: IARC monographs on the evaluation of the carcinogenic risks to humans.Vol 61. Lyon, France,1994. [ Links ]
2. Danesh J. Helicobacter pylori and gastric cancer; systematic review of epidemiological studies. Aliment Pharmacol Ther 1999; 13: 851-6. [ Links ]
3. Eslick GD, Lim LL, Byles JE, Xia HH, Talley NJ. Association of Helicobacter pylori infection with gastric carcinoma: a meta-analysis. Am J Gastroenterol 1999; 94: 2373-9. [ Links ]
4. Huang JQ, Sridhar S, Chen Y, Hunt RM. Meta-analysis of the relationship between Helicobacter pylori seroposivity and gastric cancer. Gastroenterology 1999; 114: 1169-79. [ Links ]
5. Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001; 345: 784-9. [ Links ]
6. Viste A, Bjornestad E, Opheim P, Skarstein A, Thunold J, Hartveit F, et al. Risk of carcinoma following gastric operations for benign disease. A historical cohort study of 3470 patients. Lancet 1986; 2: 502-5. [ Links ]
7. Lundegardh G, Adami HO, Helmick C, Zack M, Meirik O. Stomach cancer after partial gastrectomy for benign ulcer disease. N Engl J Med 1988; 319: 195-200. [ Links ]
8. Tersmette AC, Offerhaus GJA, Tersmette KWF, Giardiello FM, Moore GW, Tytgat GM, et al. Meta-analysis of the risk of gastric stump cancer: detection de high risk patient subsets for stomach cancer after remote partial gastrectomy for benign conditions. Cancer Res 1990; 50: 6486-9. [ Links ]
9. Weiman TJ, Max MH, Vogles CR, Burrows GH. Diversion of duodenal contents. Its effect on the production of experimental gastric cancer. Arch Surg 1980; 115: 959-61. [ Links ]
10. Loffeld RJ, Loffeld BC, Arends JW, Flendrig JA, van Spreeuwel JP. Retrospective study of Campilobacter-like organisms of patients undergoing partial gastrectomy. J Clin Pathol 1988; 41: 1313-5. [ Links ]
11. O'Connor HJ, Newbold KM, Alexander-Williams J, Thompson H, Drumm J, Donovan IA. Effect of Roux-en-Y biliary diversion on Campylobacter pylori. Gastroenterology 1989; 97: 958-64. [ Links ]
12. Offerhaus GJ, Rieu PN, Jansen JB, Joosten HJ, Lamers CB. Prospective comparative study of the influence of bile reflux on human mucosal histology and campilobacter pylori infection. GUT 1989; 30: 1552-7. [ Links ]
13. Leivonen M, Nordling S, Haglund C. The course of Helicobacter pylori infection after partial gastrectomy for peptic ulcer disease. Hepatogastroenterology 1998; 45: 587-91. [ Links ]
14. Rino Y, Imada T, Shiozawa M, Takahashi M, Fukuzawa K, Hasuo K, et al. Helicobacter pylori of the remnant stomach and its eradication. Hepatogastroenterology 1999; 46: 2069-73. [ Links ]
15. Schilling D, Adamek HE, Wilke J, Schauwecker P, Martin WR, Arnold JC, et al. Prevalence and clinical importance of Helicobacter pylori infection in patients after partial gastric resection for peptic ulcer disease. A prospective evaluation of Helicobacter pylori infection on 50 resected patients compared with matched nonresected controls. Z Gastroenterol 1999; 37: 127-32. [ Links ]
16. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-cell type carcinoma. Acta Pathol Microbiol Scand 1965; 64: 31-40. [ Links ]
17. Offerhaus GJ, van de Stadt J, Huibregtse K, Tersmette AC, Tytgat GN. The mucosa of the gastric remnant harboring malignancy. Histologic findings in the biopsy specimens of 504 asymptomatic patients 15 to 46 years after partial gastrectomy with emphasis on nonmalignant lesions. Cancer 1989; 64: 698-703. [ Links ]
18. Tersmette AC, Offerhaus GJ, Tersmette KW, Giardiello FM, Moore GW, Tytgat GN, et al. Meta-analysis of the risk of gastric stump cancer: detection of high risk patient subsets for stomach cancer after remote partial gastrectomy for benign conditions. Cancer Res 1990; 50: 6486-9. [ Links ]
19. Houghton PW, Mortensen NJ, Thomas WE, Cooper MJ, Morgan AP, Burton P. Intragastric bile acids and histological changes in gastric mucosa. Br J Surg 1986; 73: 354-6. [ Links ]
20. Lynch DA, Mapstone NP, Clarke AM, Jackson P, Dixon MF, Quirke P, et al. Cell proliferation in the gastric corpus in Helicobacter pylori associated gastritis and after gastric resection. Gut 1995; 36: 351-3. [ Links ]
21. Leivonen M, Nordling S, Haglund C. Does Helicobacter pylori in the gastric stump increase the cancer risk after certain reconstruction types? Anticancer Res 1997; 17: 3893-6. [ Links ]
22. Baas IO, van Rees BP, Musler A, Graanen ME, Tytgat GN, van der Berg FM, et al. Helicobacter pylori and Epstein-Barr virus infection and the p53 tumour supresor pathway in gastric stump cancer compared with carcinoma in the non-operated stomach. J Clin Pathol 1998; 51: 662-6. [ Links ]
23. Lee YT, Sung JJY, Choi CL, Chan FK, Ng EK, Ching JY, et al. Ulcer recurrence after gastric surgery: is Helicobacter pylori the culprit? Am J Gastroenterol 1998; 93: 928-31. [ Links ]
24. Kawakita N, Nagahata Y, Azumi Y, Wada T, Numata N, Saitoh Y. Residual gastritis after gastrectomy and Helicobacter pylori -its clinical significance. Nippon Shokakibyo Gakkai Zasshi 1995; 92: 862-9. [ Links ]
25. Kato T, Motoyama H, Akiyama N. Helicobacter pylori infection in gastric remnant cancer after gastrectomy. Nippon Rinsho 2003; 61: 30-5. [ Links ]
26. Tomtitchong P, Onda M, Matsukura N, Tokunaga A, Kato S, Matsuhisa T, et al. Helicobacter pylori infection in the remnant stomach after gastrectomy: with special reference to the difference between Billroth I and II anastomoses. J Clin Gastroenterol 1998; 27: S154-58. [ Links ]
27. Fukuhara K, Osugi H, Takada N, Takemura M, Lee S, Taguchi S, et al. Duodenogastric reflux eradicates Helicobacter pylori after distal gastrectomy. Hepato-gastroenterology 2004; 51: 1548-50. [ Links ]
28. Lynch DA, Mapstone NP, Clarke AM, Sobala GM, Jackson P, Morrison L, et al. Cell proliferation in Helicobacter pylori associated gastritis and the effect of eradication therapy. Gut 1995; 36: 346-50. [ Links ]
29. Matsukura N, Tajiri T, Kato S, Togashi A, Masuda G, Fujita I, et al. Helicobacter pilory eradication therapy for the remnant stomach after gastrectomy. Gastric Cancer 2003; 6: 100-7. [ Links ]











 text in
text in