My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.99 n.7 Madrid Jul. 2007
TRABAJOS ORIGINALES
Validación de método simplificado de la prueba en aliento con urea-13C para diagnóstico de infección por Helicobacter pylori
Validation of a simplified method of the 13C urea breath test for diagnosis of Helicobacter pylori
N. X. Ortiz-Olvera Nayeli1,2, S. Morán Villota1,2, I. Gallardo Wong2, J. M. Blancas Valencia3 y L. Cabrera Muñoz4
1Universidad Autónoma del Estado de México. 2Laboratorio de Investigación en Gastroenterología. Hospital de Pediatría.
Servicios de 3Endoscopia Gastrointestinal y 4Anatomía Patológica. Hospital de Especialidades Dr. Bernardo Sepúlveda.
Centro Médico Nacional Siglo XXI. Instituto Mexicano del Seguro Social. Ciudad de México. México
Este proyecto fue parcialmente financiado por el Instituto Mexicano del Seguro Social (Apoyo FFOI-IMSS: 2004/071 y 2005/1/I/132).
Dirección para correspondencia
RESUMEN
Objetivo: validar un método simplificado de la prueba en aliento con urea-13C (PAU-13Cs) para el diagnóstico de infección por Helicobacter pylori (H. pylori), con administración simultánea de 50 mg de urea-13C y 2 g de ácido cítrico.
Material y métodos: se estudiaron 88 pacientes (49 mujeres y 39 hombres); con promedio de edad 45 ± 15 años, referidos para endoscopia gastrointestinal y toma de biopsias. La PAU-13Cs se realizó en ayuno. Se recolectaron las muestras de aire espirado en tubos de cristal de 10 ml, antes y 30 minutos después de administrar simultáneamente 50 mg de urea-13C y 2 g de ácido cítrico disueltos en 200 ml de agua. Las muestras se analizaron por espectrometría de masas. El diagnóstico de infección se consideró cuando el cultivo y/o la biopsia y serología fueron positivas para H. pylori.
Resultados: cincuenta y un pacientes (57,95%) fueron positivos, 30 (34,10%) negativos para H. pylori y 7 (7,95%) casos se consideraron indeterminados. La sensibilidad, especificidad, valor predictivo positivo y negativo de PAU-13Cs fue de 90,2, 93,3, 95,8 y 84,8%, respectivamente. Con exactitud de 91,4%.
Conclusión: la administración simultánea de 50 mg de urea-13C y 2 g de ácido cítrico, representa una alternativa para el diagnóstico no invasivo de infección por H. pylori, debido a que conserva la certeza diagnóstica de la PAU-13C.
Palabras clave: Helicobacter pylori. Urea-13C. Prueba en aliento. Ácido cítrico.
ABSTRACT
Objective: to validate a simplified 13C-urea breath test (13C-UBT) method for the diagnosis of H. pylori infection.
Material and methods: patients referred for gastrointestinal endoscopy and biopsy were included, and a 13C-UBT was performed after a 6-hour fast. Breath samples were collected in 10 ml glass tubes before and 30 min after the simultaneous administration of 50 mg of 13C-urea and 2 g of citric acid in 200 ml of water. All breath samples were analyzed using isotope ratio mass spectrometry. The diagnosis of H. pylori infection was established with a positive culture and/or positive histology and serology.
Results: eighty-eight patients were included, 49 female and 39 male with a mean age of 45 ± 15 yrs. Fifty-one patients (57.95%) were positive and 30 (34.1%) negative for H. pylori. Seven cases (7.95%) were considered undetermined. The sensitivity, specificity, positive predictive value, and negative predictive value for 13C-UBT were 90.2, 93.3, 95.83, and 84.8%, respectively. Accuracy was 91.4%.
Conclusions: the simultaneous administration of 50 mg of 13C-urea and 2 g of citric acid represents an alternative for the non-invasive diagnosis of H. pylori infection.
Key words: Helicobacter pylori. 13C-urea. Breath test. Citric acid.
Introducción
La infección por Helicobacter pylori (H. pylori) es la causa principal de gastritis y enfermedad ulcerosa en adultos, y se ha asociado al desarrollo de cáncer y linfoma gástrico (1). Para el diagnóstico se cuenta con diferentes métodos: los invasivos que requieren la realización de endoscopia y toma de biopsia para estudio histopatológico, cultivo y/o PCR; y los no invasivos que incluyen la determinación de anticuerpos en suero, antígenos en heces y las pruebas en aliento con urea marcada con carbono 14 (PAU-14C) y carbono 13 (PAU-13C) (1-3).
La PAU-13C se introdujo en 1987 y se fundamenta en la actividad de la ureasa del H. pylori que permite desdoblar la urea-13C en amonio y dióxido de carbono marcado (13CO2) (3,4). Actualmente, se considera que la PAU-13C es un método altamente confiable para el diagnóstico no invasivo de infección por H. pylori, ideal para quienes no requieren estudio de endoscopia o para el seguimiento de pacientes que han recibido tratamiento de erradicación para H. pylori. La PAU-13C se realiza con facilidad y seguridad, sin exponer al paciente a radioactividad (5-9).
Desde la descripción original se han realizado diferentes modificaciones para simplificar, optimizar y perfeccionar la prueba, con el propósito de mejorar su costo-efectividad mediante la disminución en la dosis de urea y/o modificación de la forma y composición de la comida de prueba pero, siempre tratando de conservar su certeza diagnóstica (5-15) (Tabla I).
El objetivo de este estudio fue validar un método simplificado de la PAU-13C con la administración simultánea de 50 mg de urea-13C y 2 g de ácido cítrico.
Material y métodos
Población de estudio
De febrero del 2004 a marzo del 2005 se evaluaron en forma prospectiva 88 pacientes, entre 18 y 75 años de edad, programados para estudio de endoscopia digestiva alta por síntomas de dispepsia, enfermedad ácido péptica y hemorragia digestiva alta, que aceptaron participar en el estudio y dieron su consentimiento informado por escrito. Se excluyeron los pacientes: que habían recibido tratamiento previo (antibióticos y/o inhibidores de la bomba de protones 30 días antes de la endoscopia, o antagonistas H2 un día antes de la endoscopia); con diagnóstico endoscópico de esofagitis grado C o D (clasificación de los Ángeles) o con úlceras complicadas (clasificación de Forrest I y II, perforadas y/o penetradas); con antecedente de gastrectomía parcial o completa; y con historia de tratamiento de erradicación para H. pylori. Se eliminaron los pacientes que no tuvieron datos completos para su análisis al final del estudio. El proyecto fue aprobado por el comité local de investigación del Hospital de Especialidades del Centro Médico Nacional Siglo XXI, IMSS, México; realizado de acuerdo al protocolo y a las guías de buenas prácticas médicas y a lo estipulado en el Reglamento de la Ley General de Salud en materia de Investigación en Salud.
Métodos diagnósticos
Endoscopia gastrointestinal alta y biopsias
Todos los estudios de endoscopia fueron realizados e interpretados por el mismo grupo de endoscopistas. Para la endoscopia se utilizó equipo de video endoscopia Fujinon® EG 201FP y pinza de biopsias BF2416SF (Inc, Japón). Durante la endoscopia se tomaron 7 biopsias gástricas: tres en la región prepilórica (1-2 cm del píloro), dos en el cuerpo gástrico (curvatura mayor y cara posterior), una de la incisura angularis y una del cardias. Una muestra de cuerpo y una de antro se fijaron inmediatamente en formalina al 10% por separado para estudio histopatológico y las otras 5 se colocaron en viales para cultivo (16,27).
Histología
Las dos muestras de biopsia fijadas en formalina al 10%, fueron teñidas de forma rutinaria con hematoxilina-eosina y Giemsa modificada (17,18). La revisión de laminillas fue asignada en forma ciega y al azar a un grupo de patólogos experimentados. El resultado histológico fue establecido con base a los criterios actualizados del sistema de clasificación de gastritis de Sydney (19). El diagnóstico histológico de infección se estableció cuando se encontraron cuerpos bacterianos, de forma curva o en S, compatibles con H. pylori en cualquiera de los sitios muestreados.
Cultivo
Cada espécimen fue colocado de manera independiente en un recipiente con caldo de Brucella con 30% de glicerol como medio de transporte y se congelaron a -70 ºC hasta su siembra en el medio de cultivo en un tiempo entre 24-48 horas después de la toma de la biopsia. Para la siembra, las biopsias se homogenizaron e inocularon en placas de medio agar soya trypticaseína suplementado con 7,5% de sangre de borrego. Las placas se incubaron entre 35 y 37 ºC hasta diez días en condiciones microaeróbicas (5% de O2, 100 ml de CO2, y 85% de N2). El cultivo se consideró positivo en aquellos casos que crecieron colonias de bacterias con morfología típica, con pruebas de ureasa, catalasa y oxidasa positivas, incluyendo la tinción de Gram, durante los primeros 7-10 días.
Serología
A todos los pacientes se les tomó una muestra de sangre venosa de 10 ml, la cual se colocó en tubos no heparinizados para obtener suero y determinar la presencia de anticuerpos de tipo Ig G anti-H. pylori por técnica de ELISA. La concentración de anticuerpos igual o mayor a 15 U/ml fue considerada como positiva.
Prueba en aliento con urea-13C
La prueba en aliento con urea-13C simplificada (IntecSalud, México) se realizó 3 a 5 días después de la endoscopia, con ayuno mínimo de 6 horas. Como bebida de prueba se utilizó una solución que contenía 2 g de ácido cítrico (Citra-LP, San Miguel de proyectos agropecuarios S.P.R. México) y 50 mg de urea-13C al 99% (Isotec Inc®, Ohio, USA), disueltos en 200 ml de agua. Las muestras fueron colectadas antes (basal) y 30 minutos después (post) de administrar la bebida de prueba. Para la toma de muestras los pacientes soplaron directamente a través de una pajilla en un tubo exetainer® de 10 ml, (LabCo Limited®, Buckinghamshire UK). Todas las muestras se tomaron por duplicado y se analizaron por espectrometría de masas isotópicas (Breath-Mat plus Finningan, Bremen, Germany) en el Laboratorio de Gastroenterología.
Los resultados fueron expresados en unidades delta (d), que es la expresión en tantos por mil (‰) de la relación de 13C/12C del post y la basal.
Diagnóstico de infección por H. pylori
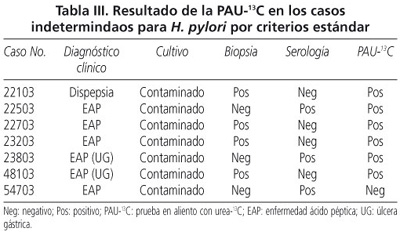
El diagnóstico de infección por H. pylori se estableció cuando el resultado del cultivo fue positivo y/o cuando los resultados de la histología y la serología fueron simultáneamente positivos. Se consideraron como negativos para infección por H. pylori a los pacientes con cultivo, biopsia y serología negativos, y como casos indeterminados aquellos con resultado del cultivo contaminado, con biopsia positiva y serología negativa, o con serología positiva y biopsia negativa (20,21).
Análisis estadístico
Los datos fueron expresados como medianas (intervalos), promedios (± desviación estándar) y proporciones.
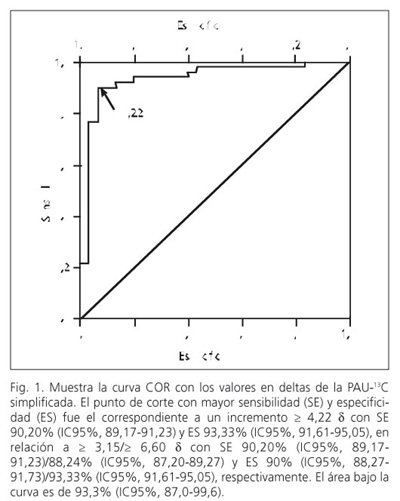
La curva de características operativas para el receptor (curva COR) fue construida utilizando los d de cada paciente y el diagnóstico de infección por H. pylori establecido de acuerdo a los criterios estándar. El punto de corte óptimo para la PAU-13C fue definido como el punto con la mayor sensibilidad, especificidad y certeza diagnóstica para identificar a los pacientes con y sin infección por H. pylori.
Se calculó sensibilidad (SE), especificidad (ES), valor predictivo positivo (VPP), valor predictivo negativo (VPN), razón de verosimilitud positiva (RVP) y negativa (RVN) e intervalo de confianza al 95% (IC95%) de la PAU-13C, inicialmente tomando únicamente los casos que de acuerdo al estándar de referencia se clasificaron como positivos o negativos y luego se hizo el análisis incluyendo los casos clasificados como indeterminados pero tomando como diagnóstico de referencia el resultado del estudio histopatológico.
El análisis se realizó utilizando el paquete estadístico SPSS para Windows (versión 12.0; SPSS, Chicago, IL, USA).
Resultados
Se incluyeron 88 pacientes (49 mujeres y 39 hombres), con promedio de edad 45 ± 15 años, que contaban con las cuatro pruebas diagnósticas al finalizar el estudio. La indicación de endoscopia fue: enfermedad ácido péptica (69,3%), dispepsia (26,2%) y hemorragia digestiva alta en estudio (4,5%). Los hallazgos histopatológicos reportados fueron: gastritis crónica activa (54,5%), gastritis crónica superficial (38,6%), gastritis aguda (1,2%) y mucosa normal (5,7%).
Con base a los criterios estándar para establecer el diagnóstico de infección por H. pylori (19-20), 51 (57,95%) casos fueron considerados positivos, de los cuales 26 tuvieron cultivo positivo (51%) y 25 (49%) casos tuvieron simultáneamente histología y serología positivas. Treinta casos (34,10%) fueron negativos y 7 (7,95%) se clasificaron como casos indeterminados. La prevalencia de infección por H. pylori fue de 62,96% (IC95%, 62,28-63,64).
De los 26 casos con cultivo positivo, se identificó al H. pylori en cuerpo y antro en 17 casos (66%); en 5 casos sólo en antro (19%) y en 4 casos sólo en cuerpo (15%). El cultivo se reportó sin crecimiento en 35 casos y contaminado en 20 casos. Por histología se identificó al H. pylori en cuerpo y/o antro en 49 pacientes, con gastritis crónica activa en el 72,5% de los casos; en los pacientes H. pylori negativos predominó la gastritis crónica superficial (64,5%) y la gastritis crónica activa (19,4%). La determinación de Ig G anti-H. pylori fue positiva en 47 casos y negativa en 34 casos.
Punto de corte para la prueba en aliento con urea-13C simplificada
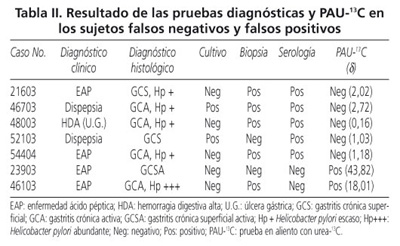
El incremento de 4,22 d representó el punto de corte con mayor certeza diagnóstica (Fig. 1), con SE de 90,20% (IC95%, 89,17-91,23), ES de 93,33% (IC95%, 91,61-95,05), VPP de 95,83% (IC95%, 94,76-96,91), VPN de 84,8% (IC95%, 83,3-86,4), razón de verosimilitud positiva de 13,53 (IC95%, 13,42-13,64) y razón de verosimilitud negativa de 0,11 (IC95%, 0,10-0,11). Con exactitud de 91,4%. Encontrando 5 casos falsos negativos y dos casos falsos positivos (Tabla II).
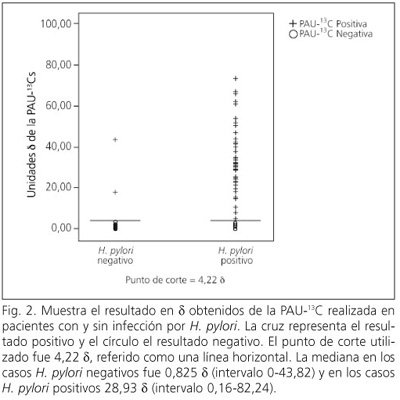
En los 30 casos definidos como negativos para H. pylori por medio de los criterios estándar, la mediana de deltas fue de 0,825 d y en los 51 casos H. pylori positivos, la mediana de deltas fue de 28,93 d (Fig. 2).
Incluyendo los 7 casos indeterminados por criterios estándar (Tabla III), tomando como referencia el resultado del estudio histopatológico y como punto de corte óptimo de la PAU-13Cs 4,22 d, se determinó SE de 91,23% (IC95%, 90,31-92,15), ES de 90,32% (IC95%, 88,65-92,00), VPP de 94,55% (IC95%, 93,6-95,49) y VPN de 84,8% (IC95%, 83,3-86,4). Con exactitud de 90,9%.
La prueba en aliento con urea-13C simplificada fue bien tolerada por todos los pacientes y no se reportaron eventos adversos.
Discusión
Este estudio confirma la utilidad de la prueba en aliento simplificada utilizando dosis menores de urea-13C y ácido cítrico para el diagnóstico de infección por H. pylori, debido a que conserva la certeza diagnóstica (SE 90,20% y ES 93,33%) de manera similar a lo reportado previamente con dosis mayores (7-10,14).
Desde la descripción original de la PAU-13C por Graham y cols., quienes utilizaron 350 mg (5 mg/kg) de urea-13C y tomó muestras de aire espirado cada 10 minutos por 3 horas (3), varias modificaciones se han realizado utilizando diferentes dosis de urea, cambiando la composición de la comida de prueba, simplificando la técnica de recolección de las muestras de aire espirado y utilizando diferentes métodos para la medición del carbono 13. Estas modificaciones han sido propuestas para simplificar y optimizar la prueba, con el propósito de disminuir los costos de la misma y ampliar su aplicación (3-15).
En 1991, Logan y cols. estandarizaron la prueba en aliento administrando 100 ml de una bebida rica en grasas; 10 minutos después se recolectaba la primera muestra de aire espirado e inmediatamente se administraban 100 mg de urea-13C disuelta en 50 ml de agua y 30 minutos después se recolectaba la segunda muestra con este método lograron alcanzar sensibilidad del 98% y especificidad del 92% (6). Inicialmente se consideró que la comida de prueba mejoraba el resultado porque inducía retraso del vaciamiento gástrico, con lo cual se incrementaba la distribución de los sustratos en el estómago, se prolongaba la duración y el área de contacto entre la bacteria y la urea (6-8). En 1997, se validó la prueba con 75 mg de urea-13C y 4,5 g de ácido cítrico con sensibilidad y especificidad de 95,6 y 96,6%, respectivamente (9). El efecto del ácido cítrico sobre la excreción de CO2 fue atribuido al retraso en el vaciamiento gástrico (9-10); sin embargo, se ha descrito que el ácido cítrico puede producir un incremento en la actividad de la ureasa citoplasmática del H. pylori, dependiente del pH del medio ácido, y recientemente se ha sugerido que su efecto también podría estar relacionado con las propiedades del níquel (22-24). Actualmente se siguen publicando estudios de validación de la prueba utilizando diferentes dosis de urea y ácido cítrico, demostrando que al disminuir la dosis de los sustratos se conserva la certeza diagnóstica y se disminuye el costo de la prueba (5,8-15).
En el presente estudio se validó la prueba administrando simultáneamente 50 mg de urea-13C y 2 g de ácido cítrico. La dosis de 50 mg de urea-13C se ha utilizado por diferentes autores, con sensibilidad y especificidad siempre mayor al 90%. En 1999, Graham y cols. (24) describen en su estudio que 1, 2 y 4 g de ácido cítrico incrementan la actividad de la ureasa del H. pylori con un significativo incremento del 13CO2 en el aire espirado; sugieren que la dosis del ácido cítrico puede disminuirse (> 1 g/200 ml), para simplificar y mejorar la palatabilidad de la prueba. Sin embargo; refieren la necesidad de realizar otros estudios para probar su certeza. La disminución de la dosis de ácido cítrico a 2 g, se llevó a cabo con la finalidad de mejorar la palatabilidad de la bebida de prueba y por consiguiente incrementar la aceptación por parte del paciente. Con estas modificaciones en la metodología se conservó la certeza diagnóstica de la prueba (sensibilidad y especificidad mayor al 90%). Recientemente se ha sugerido la posibilidad de realizar la prueba utilizando dosis menores de urea-13C (25 mg y 15 mg) (25).
En el presente estudio de acuerdo a los hallazgos de la curva COR, el punto de corte con mayor certeza diagnóstica para la PAU-13Cs fue el de 4,22 d. Se han sugerido valores entre 2 a 5 d, lo cual depende de las condiciones y el método empleado para realizar la prueba (5,6,10,26).
Los resultados de este estudio sugieren que la prueba en aliento con urea-13C simplificada, con dosis de 50 mg de urea-13C y 2 g de ácido cítrico, representa una buena alternativa para el diagnóstico no invasivo de infección por H. pylori; con esta modificación se conserva la certeza diagnóstica de la prueba.
Bibliografía
1. Peterson WL, Graham DY. Helicobacter pylori. In: Feldman M, Friedman LS, Sleisenger MH, editors. Sleisenger and Fordtran's Gastrointestinal and liver disease: Pathophysiology, diagnosis, management. 7th ed. Philadelphia: Saunders; 2002. p. 732-46. [ Links ]
2. Goddard AF, Logan RP. Review article: Urea breath tests for detecting Helicobacter pylori. Aliment Pharmacol Ther 1997; 11: 641-9.
3. Graham DY, Klein PD, Evans DJ Jr, et al. Campylobacter pylori detected noninvasively by the 13C-urea breath test. Lancet 1987; 1: 1174-7.
4. Walsh JH, Peterson WL. The treatment of Helicobacter pylori infection in the management of peptic ulcer disease. N Engl J Med 1995; 333: 984-91.
5. Peng NJ, Lai KH, Liu RS, et al. Capsule 13C-urea breath test for the diagnosis of Helicobacter pylori infection. World J Gastroenterol 2005; 11: 1361-4.
6. Logan RP, Dill S, Bauer FE, et al. The European 13C-urea breath test for the detection of Helicobacter pylori. European J Gastroenterol & Hepatol 1991; 3: 915-21.
7. Klein PD, Malaty HM, Martin RF, et al. Noninvasive Detection of Helicobacter pylori Infection in Clinical Practice: The 13C-Urea Breath Test. Am J Gastroenterol 1996; 91: 690-4.
8. Graham DY, Malaty HM, Cole RA, et al. Simplified 13C-urea breath test for detection of Helicobacter pylori infection. Am J Gastroenterol 2001; 96: 1741-5.
9. Dominguez-Muñoz JE, Leodolter A, Sauerbruch T, et al. A citric acid solution is an optimal test drink in the 13C-urea breath test for the diagnosis of Helicobacter pylori infection. Gut 1997; 40: 459-62.
10. Leodolter A, Domínguez-Muñoz JE, Arnim UV, et al. Validity of a modified 13C-urea breath test for pre-and posttreatment diagnosis of Helicobacter pylori infection in the routine clinical setting. Am J Gastroenterol 1999; 94: 2100-4.
11. Liao CC, Lee CL, Chiang TC, et al. The 13C-urea breath test to detect Helicobacter pylori infection: A validated simple methodology with 50 mg 13C-urea. Aliment Pharmacol Ther 2002; 16: 787-92.
12. Gatta L, Vakil N, Ricci C, et al. A rapid, low-dose, 13C-urea tablet for the detection of Helicobacter pylori infection before and after treatment. Aliment Pharmacol Ther 2003; 17: 793-8.
13. Wong WM, Lam SK, Lai KC, et al. A rapid-release 50-mg tablet-based 13C-urea breath test for the diagnosis of Helicobacter pylori infection. Aliment Pharmacol Ther 2003; 17: 253-7.
14. Levine A, Shevah O, Miloh T, et al. Validation of a novel real time 13C-urea breath test for rapid evaluation of Helicobacter pylori in children and adolescents. J Pediatr 2004; 145: 112-4.
15. Canete A, Abunají Y, Álvarez-Calatayud G, et al. Breath test using a single 50-mg dose of 13C-urea to detect Helicobacter pylori infection in Children. J Pediatr Gastroentrol Nutr 2003; 36: 105-11.
16. Monés J, Gisbert JP, Borda F, et al. Indicaciones, métodos diagnósticos y tratamiento erradicador de Helicobacter pylori. Recomendaciones de la II Conferencia Española de Consenso. Rev Esp Enferm Dig 2005; 97: 363-74.
17. Brown KE, Peura DA. Diagnosis of Helicobacter pylori infection. Gastroenterol Clin North Am 1993; 22: 105-15.
18. Gray SF, Wyatt JL. Simplified techniques for identifying Campylobacter pyloridis. J Clin Pathol 1986; 39: 1279-80.
19. Dixon MF, Genta RM, Correa P, et al. Classification and grading of gastritis. The Updated Sydney system. Am J Surg Pathol 1996; 20: 1161-81.
20. Cutler AF, Havstad S, Ma CK, et al. Accuracy of invasive and noninvasive tests to diagnose Helicobacter pylori infection. Gastroenterol 1995; 109: 136-41.
21. Hirschl A.M. Microbiología de Helicobacter pylori: aspectos generales, diagnóstico y resistencia. En: Pajares JM, Gisbert JP, Correa P, editores. Helicobacter pylori. 1998. p. 17-38.
22. Pantoflickova D, Scott DR, Sachs G, et al. 13C urea breath test (UBT) in the diagnosis of Helicobacter pylori: Why does it work better with acid test meal? Gut 2003; 52: 933-7.
23. Graham DY, Klein PD. Accurate diagnosis of Helicobacter pylori 13C-urea breath test. Gastroenterol Clinics 2000; 29: 885-94.
24. Graham DY, Runke D, Anderson SY, et al. Citric acid as the test meal for the 13C-urea breath test. Am J Gastroenterol 1999; 94: 1214-7.
25. Gatta L, Ricci C, Tampieri A, et al. Accuracy of breath tests using low doses of 13C-urea to diagnose Helicobacter pylori infection; a randomized controlled trial. Gut 2006; 55: 457-62.
26. Gisbert JP, Olivares D, Jiménez I, Pajares JM. Long-term follow-up of 13C-urea breath test results alter Helicobacter pylori eradication: Frequency and significance of borderline d-13CO2 values. Aliment Pharmacol Ther 2006: 23: 275-80.
27. Guidelines for clinical trials in the management of Helicobacter pylori infection (Working party of the European Helicobacter pylori study Group). Technical annex: Tests used to assess Helicobacter pylori infection. Gut 1997; 41: S10-S-17.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Segundo Morán Villota
Laboratorio de Investigación en
Gastroenterología del Hospital de Pediatría
Avda. Cuauhtémoc, 330
Colonia Doctores. Del. Cuauhtémoc
06720 Mexico, D.F.
E-mail: segundomoran@hotmail.com
Recibido: 27-06-06.
Aceptado: 09-02-07.