My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.101 n.3 Madrid Mar. 2009
Factores predictivos de mala respuesta precoz a la ciclosporina endovenosa en la colitis ulcerosa grave corticorrefractaria
Predictive factors of poor response to intravenous cyclosporine in steroid-refractory ulcerative colitis
J. W. Huamán Ríos, F. Casellas Jordá y J. R. Malagelada Benaprés
Unitat d'Atenció Crohn-Colitis. Servicio de Digestivo. Hospital Universitari Vall d'Hebron. Barcelona. Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (Ciberehd)
Dirección para correspondencia
RESUMEN
Introducción: el tratamiento de los brotes graves de colitis ulcerosa (CU) incluye medidas como la hospitalización y corticoides e.v., a pesar de ello, en una cuarta parte de los pacientes no se consigue inducir la remisión. Dada la disponibilidad de diferentes estrategias terapéuticas en los pacientes con CU corticorrefractaria (ciclosporina, infliximab, aféresis, cirugía) se hace necesario predecir que tratamiento será el más eficaz para cada paciente.
Objetivos: determinar de forma precoz qué factores clínicos o biológicos permiten discriminar los enfermos con CU corticorrefractaria que no responderán a ciclosporina.
Métodos: se han incluido 41 brotes de CU corticorrefractaria (35 pacientes) tratados con ciclosporina e.v. La respuesta se evaluó al día 10 de tratamiento con el índice de actividad de Truelove-Witts modificado. Para el análisis univariante se compararon los grupos con respuesta completa y mala respuesta. Las variables independientes con significación pronóstica se determinaron mediante análisis de regresión lineal múltiple.
Resultados: de los 41 brotes el 48% tuvieron una respuesta completa, el 22% tuvieron una respuesta parcial y el 29% tuvieron mala respuesta. El análisis univariante demostró diferencia significativa en cuatro factores predictivos: mayor edad (p = 0,008), trombocitosis (p = 0,01), extensión de la enfermedad (pancolitis versus colitis izquierda (p = 0,04)) y haber recibido ciclosporina previamente (p = 0,01). Sin embargo, en el análisis de regresión lineal múltiple no se confirmó la extensión de la enfermedad como factor predictivo de mala respuesta.
Conclusión: una mayor edad, la trombocitosis y el uso previo de ciclosporina predisponen a una mala respuesta a la ciclosporina endovenosa en los brotes graves de CU corticorrefractaria.
Palabras clave: Ciclosporina. Colitis ulcerosa. Corticorrefractaria. Factores predictivos.
ABSTRACT
Background: the treatment of severe ulcerative colitis (UC) flares includes measures such as hospitalization and intravenous steroids. Despite this, a quarter of patients are refractory to treatment. Given the availability of new therapeutic strategies in patients with steroid-refractory UC (cyclosporine, infliximab, apheresis, surgery) it is necessary to predict which treatment will be most effective for each patient.
Objectives: to determine which clinical or biological factors discriminate the lack of response to cyclosporine in steroid-refractory UC.
Methods: forty one flares of steroid-refractory UC in 35 patients treated with intravenous cyclosporine have been included. The response to cyclosporine was assessed at day 10 of treatment by using the modified Truelove and Witts disease activity score. Variables with prognostic significance were determined by a univariate analysis comparing groups with complete response and no-response, and an analysis of multiple linear regression.
Results: complete response was obtained in 41 flares (48%), partial response in 22%, and lack of response in 29%. The univariate analysis showed a significant difference in four predictive factors: higher age (p = 0.008), thrombocytosis (p = 0.01), disease extent (pancolitis vs. left-sided disease (p = 0.04)), and having received cyclosporine previously (p = 0.01). A multiple linear regression analysis confirmed the significance of higher age, thrombocytosis, and having received cyclosporine previously as predictive factors of poor response.
Conclusion: higher age, thrombocytosis and previous use of cyclosporine predispose to poor response to intravenous cyclosporine in severe flares of steroid-refractory UC.
Key words: Cyclosporine. Ulcerative colitis. Steroid refractory. Predictive factors.
Introducción
La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica del intestino caracterizada por periodos de remisión alternando con episodios de recaídas que ocurren con intensidad variable, caracterizados por diarrea, rectorragia, dolor abdominal y fiebre (1,2).
Aproximadamente el 15% de pacientes con CU presentan un brote grave que requiere hospitalización durante su enfermedad, y requieren como terapia de primera línea dosis altas de corticoides endovenosos (3,4). A pesar de los corticoides endovenosos, los brotes graves tienen una alta tasa de colectomía que varían desde el 20 al 47% (5,6).
Desde 1994 la ciclosporina A se ha mostrado efectiva para reducir la necesidad de cirugía en los pacientes con brote grave de CU refractaria a esteroides (7). Sin embargo, el 70% de pacientes que inicialmente respondieron a ciclosporina requirieron colectomía dentro de los 6 a 12 meses siguientes (8). Además, el uso de ciclosporina A se relaciona con efectos adversos frecuentes como la hipertensión arterial o la insuficiencia renal (9,10). Por otro lado, existen otras estrategias terapéuticas alternativas a la ciclosporina para los brotes graves de CU corticorrefractarios, como el infliximab (11-16) o la aféresis leucocitaria (17-19). Por todo ello, es necesario disponer de parámetros que permitan facilitar la decisión terapéutica de forma precoz en los casos de brotes graves de CU.
Se han establecido en varias investigaciones los factores predictivos de CU grave que no responderán al tratamiento con corticoides sistémicos en: más de 8 deposiciones al día, frecuencia cardiaca mayor de 100 por minuto, temperatura mayor de 38 ºC, albúmina menor de 3 mg/dl o falta de disminución de la proteína C reactiva (20,21). Sin embargo, en el caso de la ciclosporina no están bien establecidos qué criterios permitirían discriminar aquellos pacientes con CU refractaria grave que responderían al tratamiento (22).
El objetivo del presente estudio fue determinar qué factores clínicos y/o biológicos permiten discriminar los enfermos con CU corticorrefractaria grave que no responderán a ciclosporina de forma precoz.
Material y métodos
Pacientes
Se revisaron retrospectivamente, los registros de los pacientes procedentes del Servicio de Aparato Digestivo del Hospital Universitario Vall d'Hebron de Barcelona, diagnosticados de colitis ulcerosa grave corticorrefractaria tratados con ciclosporina endovenosa durante el periodo 2000-2006 por falta de respuesta al tratamiento con dosis de 1 mg/kg de corticoides e.v., durante 1 semana.
Para realizar el diagnóstico de colitis ulcerosa se utilizaron los criterios convencionales, que incluyen aspectos clínicos, endoscópicos, radiológicos y anatomopatológicos (23-25).
La severidad de la enfermedad fue definida de acuerdo al Índice de actividad de enfermedad de Truelove-Witts modificado (mTLW) (26,27): de la suma de los nueve parámetros se obtiene una puntuación que estratifica la severidad de la enfermedad en remisión (puntuación inferior a 11), brote leve (puntuación entre 11 y 15), brote moderado (puntuación entre 16 y 21) y brote grave (puntuación entre 22 y 27).
Procedimiento
Protocolo de administración de ciclosporina
La dosis de corticoides no fue modificada, añadiéndose la ciclosporina a dosis de 4 mg/kg/día e.v. repartidos en 2 dosis (en 250 cc SG 5% a pasar en 4 horas) (28). La dosis fue ajustada según los niveles de ciclosporinemia a las 48 horas (valores normales de ciclosporinemia: 100-400 ng/ml, determinada por RIA). Si se obtuvo respuesta, definida como una disminución en el mTLW de al menos 10 puntos, se cambió a ciclosporina oral a dosis de 5 mg/kg/día en dos tomas durante tres meses (29), con controles de los niveles de ciclosporinemia semanales hasta el alta y luego mensuales. Al iniciar el tratamiento oral se añadió azatioprina oral (2-2,5 mg/kg/día) con controles analíticos periódicos.
Recogida de datos relacionados con la enfermedad
Se registraron en cada paciente parámetros demográficos: edad, sexo, hábito tabáquico (nunca ha fumado, fumador, exfumador), historia familiar de enfermedad inflamatoria intestinal. Características de la enfermedad: extensión de la enfermedad (pancolitis vs. colitis izquierda) (30), duración de la enfermedad en meses, número y severidad de brotes previos, número de hospitalizaciones previas, número de transfusiones sanguíneas, si ha usado corticoides, 5-ASA, 6-mercaptopurina, azatioprina o antibióticos en brotes previos y si habían usado previamente ciclosporina. Características del brote actual: se recogieron los datos al iniciar ciclosporina e.v.: temperatura, frecuencia cardiaca, número de deposiciones, intensidad del dolor abdominal, síndrome rectal, presencia de úlceras profundas por sigmoidoscopia (al inicio), mTLW (al inicio del tratamiento con ciclosporina), manifestaciones extraintestinales, número de transfusiones sanguíneas y peso corporal; parámetros de laboratorio (hemoglobina, número de leucocitos, neutrófilos no segmentados, albúmina, VSG, fibrinógeno, PCR, número de plaquetas), presencia de toxina de Clostridium difficile en heces.
También se registraron las complicaciones de la ciclosporina como mayores o menores (31). En las complicaciones mayores fue necesario retirar la ciclosporina mientras que las complicaciones menores se resolvieron ajustando la dosis.
Criterios de respuesta
En función de la respuesta a la ciclosporina a los 10 días se definieron tres grupos de pacientes: no respuesta al tratamiento con ciclosporina e.v., definida como no mejora clínica significativa y con una disminución de 5 o menos puntos de mTLW después de 10 días de iniciado el tratamiento. Respuesta parcial definida como una disminución superior a 5 puntos de mTLW pero sin alcanzar la remisión (mTLW > 10 puntos). Respuesta completa, definida como remisión clínica cuando la puntuación del mTLM ha sido inferior a 11, después de 10 días de iniciado el tratamiento.
Análisis estadístico
Los registros con la información de los casos incluidos se gestionaron mediante hoja de cálculo Excel. Los análisis estadísticos de los datos se realizaron mediante el programa computarizado GraphPad InStat. Un valor de p < 0,05 fue considerado significativo.
Se utilizó el test exacto de Fischer para variables cualitativas y el test de Mann-Whitney para variables cuantitativas y para comparar los grupos con respuesta completa o con mala respuesta a la ciclosporina. En las variables que alcanzaron significación estadística (p < 0,05), el siguiente paso fue hacer un análisis de regresión lineal múltiple para identificar los factores predictivos independientes de mala respuesta al tratamiento con ciclosporina.
Resultados
Las características de los pacientes incluidos se muestran en la tabla I. Se incluyeron en el estudio 35 pacientes con CU grave corticorrefractaria que habían recibido ciclosporina e.v., de los cuales 6 también habían recibido ciclosporina e.v. en algún brote previo, por lo que se ha analizado un total de 41 brotes. Quince pacientes (42,8%) fueron mujeres y 20 pacientes (57,8%) fueron hombres. La mediana de la edad a la admisión fue de 34) (26-40). Cinco pacientes (14,3%) eran fumadores y 21 pacientes (60%) eran no fumadores. Habían recibido tratamiento de mantenimiento con azatioprina 8 pacientes (22,9%).
De los 41 brotes de CU grave corticorrefractaria, se obtuvo respuesta completa a los 10 días a la ciclosporina e.v. en 20 brotes (48,8%), respuesta parcial en 9 brotes (22%) y mala respuesta en 12 brotes (29,2%) (Tabla II).
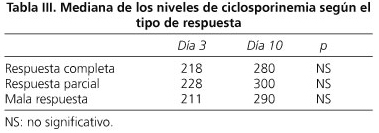
No hubo diferencias estadísticamente significativas entre los grupos de tipo de respuesta a la ciclosporina y los niveles de ciclosporina en sangre los días 3 y 10 de tratamiento (Tabla III).
Factores asociados con mala respuesta clínica
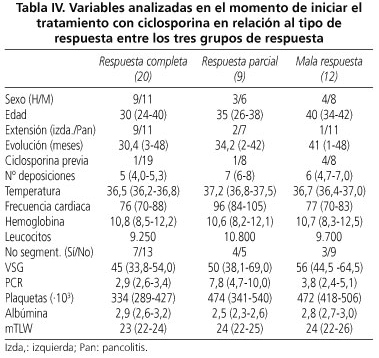
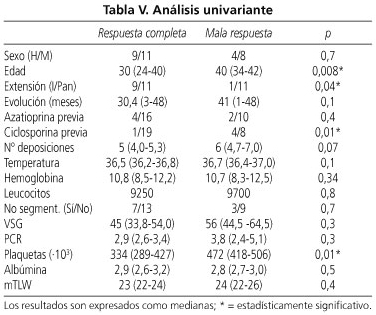
Para determinar si algún parámetro epidemiológico, clínico o de laboratorio podía definir a los pacientes que responderán mal a la ciclosporina e.v., se analizaron diferentes variables clínico-epidemiológicas (Tabla IV) para comparar el grupo de los pacientes con respuesta completa y mala respuesta (Tabla V) mediante análisis univariante.
Los pacientes que tuvieron una buena respuesta fueron significativamente más jóvenes comparados con los que tuvieron una mala respuesta 30 (24-40) años vs. 40 (34-42) años, p < 0,001). El sexo, el hábito tabáquico, tratamiento de mantenimiento previo y la duración de la enfermedad antes de recibir ciclosporina no influyeron en la respuesta clínica. En cambio, la extensión de la enfermedad (pancolitis vs. colitis izquierda), el grado de trombocitosis y haber recibido ciclosporina e.v. en un brote previo, se asociaron de forma estadísticamente significativa (p < 0,05) con una mala respuesta a la ciclosporina.
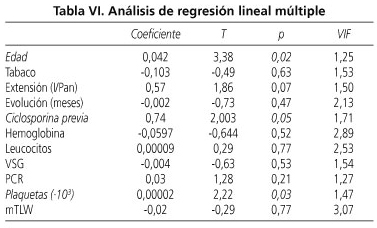
En la tabla VI se indican las variables incluidas en el análisis de regresión lineal múltiple. En dicho análisis, sólo la edad (p = 0,02), haber recibido previamente ciclosporina endovenosa (p = 0,05) y el número de plaquetas (p = 0,03) fueron factores predictivos independientes de mala respuesta precoz a la ciclosporina endovenosa en paciente con colitis ulcerosa grave corticorrefractaria. Según estos resultados, los pacientes con CU refractaria de mayor edad, que habían recibido ciclosporina en brotes previos y que en la actualidad presentaran trombocitosis, serían los pacientes mal respondedores a la ciclosporina.
Discusión
Hay una considerable evidencia de la eficacia de la ciclosporina en el tratamiento de la colitis ulcerosa corticorrefractaria, con tasas de respuesta inicial que oscilan entre el 60 y el 85% (7,32-36). En nuestro estudio se obtuvo la remisión clínica en cerca de la mitad de los pacientes, resultado que consideramos bueno puesto que se evalúa la respuesta en sólo 10 días de tratamiento. Otros estudios que han analizado los resultados obtenidos con ciclosporina en la CU refractaria entre las dos semanas y los tres meses han obtenido mayores tasas de respuesta, lo que sugiere la importancia de la duración del tratamiento en su eficacia.
Varios estudios han identificado los factores predictivos de mala respuesta a corticoides endovenosos: lesiones endoscópicas severas, valores de PCR superiores a 45 mg/l después de 3 días de tratamiento intensivo, más de 8 deposiciones al día, megacolon tóxico, niveles bajos de albúmina y una larga duración del brote actual (20,37-39). Sin embargo para factores predictivos de respuesta a la ciclosporina existe muy poca información. Nuestro estudio ha identificado tres variables de mala respuesta a la ciclosporina, una biológica (trombocitosis) y 2 epidemiológicas (la edad y haber recibido ciclosporina previamente).
Rowe y cols. (40) han publicado un estudio retrospectivo en 36 pacientes en el que identificaron tres factores predictivos de mala respuesta a la ciclosporina: taquicardia, hipoalbuminemia y alto porcentaje de neutrófilos no segmentados. Recientemente se han publicado dos estudios que valoran factores predictivos de respuesta a ciclosporina. El estudio de Cacheux y cols. (41) identificó tres variables (taquicardia, fiebre y PCR superior a 45 mg/dl) como factores predictivos de colectomía y la colonoscopia fue decisiva para cambiar el tratamiento. El estudio de Aceituno y cols. (42) demostró la asociación de la colectomía con la elevación de la PCR.
La falta de concordancia entre las variables detectadas en nuestro estudio con las publicadas en los otros estudios referidos anteriormente podría atribuirse al hecho de valorarse la respuesta a muy corto plazo y a posibles limitaciones en el diseño del trabajo como el hecho de ser retrospectivo y no incluir colonoscopia previa al inicio de la ciclosporina (43). La endoscopia no fue realizada sistemáticamente en todos los pacientes, dado el riesgo de complicaciones graves por el procedimiento en este tipo de pacientes, por lo que nosotros no incluimos el estado de la mucosa dentro de los factores predictivos.
En conclusión, el presente estudio ha identificado tres variables asociadas a mala respuesta precoz en los pacientes con CU corticorrefractaria que recibieron ciclosporina endovenosa: trombocitosis, mayor edad y haber recibido previamente ciclosporina. Por lo tanto, en estos casos habría que plantearse otras alternativas terapéuticas, aunque de este estudio no se puede indicar una pauta concreta.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Francesc Casellas.
Unitat d'Atenció Crohn-Colitis.
Servicio de Digestivo.
Hospital Universitari Vall d'Hebron.
Pso. Vall d'Hebron, 119.
08035 Barcelona, Spain.
e-mail: fcasella@vhebron.net
Recibido: 12-01-09.
Aceptado: 15-01-09.
Bibliografía
1. Nikolaus S, Schreiber S. Diagnostics of inflammatory bowel disease. Gastroenterology 2007; 133: 1670-89. [ Links ]
2. Loftus E. Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences. Gastroenterology 2004; 126: 1504-17. [ Links ]
3. Edwards FC, Truelove SC. The course and prognosis of ulcerative colitis. Gut 1963; 41: 299-315. [ Links ]
4. Abu-Suboh M, Casellas F, Vilaseca J, Malagelada JR. Response of first attack of inflammatory bowel disease requiring hospital admission to steroid therapy. Rev Esp Enferm Dig 2004; 96: 539-47. [ Links ]
5. Benazzato L, D'Incà R, Grigoletto F, Perissinotto E, Medici V, Angriman I, et al. Prognosis of severe attacks in ulcerative colitis: effect of intensive medical treatment. Dig Liver Dis 2004; 36: 461-6. [ Links ]
6. Truelove SC, Jewell DP. Intensive intravenous regimen for severe attacks of ulcerative colitis. Lancet 1974; 1: 1067-70. [ Links ]
7. Lichtiger S, Present DH, Kornbluth A, Gelernt I, Bauer J, Galler G, et al. Cyclosporine in severe ulcerative colitis refractory to steroid therapy. N Engl J Med 1994; 330: 1841-5. [ Links ]
8. Carbonnel F, Boruchowicz A, Duclos B, Soulé JC, Lerebours E, Lémann M, et al. Intravenous cyclosporine in attacks of ulcerative colitis: short-term and long-term responses. Dig Dis Sci 1996; 41: 2471-6. [ Links ]
9. Conor G, Laurence J. Cyclosporine, tacrolimus, and mycophenolate mofetil in the treatment of inflammatory bowel disease. Gastroenterol Clin North Am 2004; 33: 141-69. [ Links ]
10. Sandborn WJ. Cyclosporine therapy for inflammatory bowel disease: definitive answer and remaining questions. Gastroenterology 1995; 109: 1001-3. [ Links ]
11. Järnerot G, Hertervig E, Friis-Liby I, Blomquist L, Karlén P, Grännö C, et al. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: A randomized, placebo-controlled study. Gastroenterology 2005; 128: 1805-11. [ Links ]
12. Rutgeers P, Sandborn W, Reinisch W, Olson A, Johanns J, Travers S, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353: 2462-76. [ Links ]
13. Ferrante M, Vermeire S, Katsanos KH, Noman M, Van Assche G, Schnitzler F, et al. Predictors of early response to infliximab in patients with ulcerative colitis. Inflamm Bowel Dis 2007; 13: 123-8. [ Links ]
14. Aberra F, Lichtenstein G. Infliximab in ulcerative colitis. Gastroenterol Clin North Am 2006; 33: 821-36. [ Links ]
15. Rutgeerts P, Van Assche G. Review article: infliximab therapy for inflammation bowel disease-seven years on. Aliment Pharmacol Ther 2006; 23: 451-63. [ Links ]
16. Willert R, Lawrance I. Use of infliximab in the prevention and delay of colectomy in severe steroid dependant and refractory ulcerative colitis. World J Gastroenterol 2008; 14: 2544-9. [ Links ]
17. Ricart E, Esteve M, Andreu M, Casellas F, Monfort D, Sans M, et al. Evaluation of 5 versus 10 granulocyteaphaeresis sessions in steroid-dependent ulcerative colitis: A pilot, prospective, multicenter, randomized study. World J Gastroenterol 2007; 13: 2193-7. [ Links ]
18. Susuki Y, Yoshimura N, Fukuda K, Shirai K, Saito Y, Saniabadi AR. A retrospective search for predictors of clinical response to selective granulocyte and monocyte apheresis in patients with ulcerative colitis. Dig Dis Sci 2006; 51: 2031-8. [ Links ]
19. Takemoto K, Kato J, Kuriyama M, Nawa T, Kurome M, Okada H, et al. Predictive factors of efficacy of leukocytapheresis for steroid-resistant ulcerative colitis patients. Dig Liver Dis 2007; 39: 422-9. [ Links ]
20. Travis SPL, Farrant JM, Ricketts C, Nolan DJ, Mortensen NM, Ke-ttlewell MG, et al. Predicting outcome in severe ulcerative colitis. Gut 1996; 38: 905-10. [ Links ]
21. Bernal I, Mañosa M, Domenech E, García-Planella, Navarro M, Cabré E, et al. Predictors of clinical response to systemic steroids in active ulcerative colitis. Dig Dis Sci 2006; 51: 1434-8. [ Links ]
22. Carbonnel F, Gargouri D, Lémann M, Beaugerie L, Cattan S, Cosnes J, et al. Predictive factors of outcome of intensive intravenous treatment for attacks of ulcerative colitis. Aliment Pharmacol Ther 2000; 14: 273-8. [ Links ]
23. Lennard-Jones JE. Classification of inflammatory bowel disease. Scand J Gastroenterol Suppl 1989; 170: 2-6. [ Links ]
24. Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines in adults (update): American College of Gastroenterology Practice and Parameters committee. Am J Gastroenterol 2004; 99: 1371-85. [ Links ]
25. Stange EF. European evidence-based Consensus on the diagnosis and management of ulcerative colitis. J Crohn Colitis 2008; 2: 1-62. [ Links ]
26. Truelove SC, Witts LJ. Cortisone in ulcerative colitis: final report on a therapeutic trial. Br Med J 1955; 2: 1041-8. [ Links ]
27. D'Haens, Sandborn WJ, Feagan BG, K, Hanauer SB, Irvine EJ, Lémann M, et al. A review of activity indices and efficacy end points for clinical trials of medical therapy in adults with ulcerative colitis. Gastroenterology 2007; 132: 763-86. [ Links ]
28. Van AG, D`Haens G, Noman M Vermeire S, Hiele M, Asnong K, et al. Randomized double-blind comparison of 4 mg/kg versus 2 mg/kg intravenous cyclosporine in severe ulcerative colitis. Gastroenterology 2003; 125: 1025-31. [ Links ]
29. Weber A, Fein F, Koch S, Dupont-Gossart AC, Mantion G, Heyd B, et al. Treatment of ulcerative colitis refractory to steroid therapy by oral microemulsion cyclosporine (Neoral). Inflamm Bowel Dis 2006; 12: 1131-5. [ Links ]
30. Silverberg MS, Sattsangi J, Ahmad T, Arnott ID, Bernstein CN, Brant SR, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a working party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19(Supl. A): 5A-36A. [ Links ]
31. Stein R, Cohen R, Hanauer S. Complications during cyclosporine therapy for inflammatory bowel disease. Gastroenterology 1997; 112: A1096. [ Links ]
32. Cohen RD, Stein R, Hanauer SB. Intravenous cyclosporine in ulcerative colitis: A five-year experience. Am J Gastroenterol 1999; 94: 1587-92. [ Links ]
33. Santos J, Baudet S, Casellas F, Guarner L, Vilaseca J, Malagelada JR. Efficacy of intravenous cyclosporine for steroid refractory of ulcerative colitis. J Clin Gastroenterol 1995; 90: 2093-6. [ Links ]
34. Message L, Bourrelle A, Lahaire D, Quinton A, Galmiche JP, Lamouliatte H, et al. Efficacy of intravenous cyclosporine in moderately severe ulcerative colitis refractory to steroids. Gastroenterol Clin Biol 2005; 29: 231-5. [ Links ]
35. Sands B. New Therapies for the treatment of inflammatory bowel disease. Surg Clin North Am 2006; 86: 1045-64. [ Links ]
36. Actis G, Fadda M, David E, Sapino A. Colectomy rate in steroid-refractory colitis initially responsive to cyclosporine: a long-term retrospective cohort study. BMC Gastroenterology 2007; 7: 1-6. [ Links ]
37. Ho GT, Mowat C, Goddard CJ, Fennell JM, Shah NB, Prescott RJ, Satsangi J. Predicting the outcome of severe ulcerative colitis: development of a novel risk score to aid early selection of patients for second-line medical therapy or surgery. Aliment Pharmacol Ther 2004; 19: 1079-87. [ Links ]
38. Solem CA, Loftus Jr EV, Tremaine WJ, Harmsen WS, Zinsmeister AR, Sandborn WJ. Correlation of C-reactive protein with clinical, endoscopic, histologic and radiographic activity in inflammatory bowel disease. Inflamm Bowel Dis 2005; 11: 707-12. [ Links ]
39. Chang J, Cohen R. Medical management of severe ulcerative colitis. Gastroenterol Clin North Am 2004; 33: 235-50. [ Links ]
40. Rowe FA, Walker JH, Karp LC, Vasiliauskas EA, Plevy SE, Targan SR. Factors predictive of response to cyclosporine treatment for severe, steroid-resistant ulcerative colitis. Am J Gastroenterol 2000; 95: 2000-8. [ Links ]
41. Cacheux W, Seksik P, Lemmann M, Marteau P, Nion-Larmurier I, Afchain P, et al. Predictive factors of response to cyclosporine in steroid-refractory ulcerative colitis. Am J Gastroenterol 2008; 103: 637-42. [ Links ]
42. Aceituno M, García-Planella E, Heredia C, Zabana Y, Feu F, Domènech E, et al. Steroid-refractory ulcerative colitis: Predictive factors of response to cyclosporine and validation in an independent cohort. Inflamm Bowel Dis 2008; 14: 347-52. [ Links ]
43. Ando T, Nishio Y, Watanabe O, Maeda O, Ishiguro K, Ishikawa D, et al. Value of colonoscopy for prediction of prognosis in patients with ulcerative colitis. World J Gastroenterol 2008; 14: 2133-8. [ Links ]











 text in
text in