My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 n.9 Madrid Sep. 2010
Reactivación de la hepatitis B y su impacto clínico actual
Hepatitis B reactivation and current clinical impact
B. Álvarez Suárez1, J. de la Revilla Negro1, B. Ruiz Antorán2 y J. L. Calleja Panero1
1Servicio de Gastroenterología y Hepatología y 2Servicio de Farmacología Clínica. Hospital Universitario Puerta de Hierro. Majadahonda, Madrid. Universidad Autónoma de Madrid
Dirección para correspondencia
RESUMEN
La reactivación del virus de la hepatitis B se debe a un aumento de la replicación del virus en pacientes portadores inactivos o con infecciones pasadas de VHB. La reactivación puede producirse espontáneamente o de manera secundaria a tratamientos de quimioterapia, inmunomoduladores o inmunosupresores. La reactivación puede manifestarse de manera asintomática pero en algunos casos puede causar hepatitis agudas e incluso hepatitis agudas graves. El mejor tratamiento es la prevención por lo que se debe realizar un cribado del VHB mediante una serología a todos los pacientes que vayan a someterse a cualquier tratamiento inmunomodulador, de quimioterapia o inmunosupresor. El tratamiento profiláctico antiviral ha demostrado ser eficaz en los pacientes portadores inactivos y en algunos pacientes con infecciones pasadas de VHB sometidos a ciertos tratamientos inmunosupresores.
Palabras clave: Hepatitis B. Inmunosupresores. AntiTNF. Quimioterapia. Profilaxis.
ABSTRACT
Hepatitis B virus (HBV) reactivation results from increased viral replication in inactive carriers or patients with prior infection with HBV. Reactivation may occur spontaneously or secondary to immunomodulating or immunosuppressive chemotherapy. Reactivation may manifest with no symptoms but on occasion results in acute or even severe acute hepatitis. Prevention is the best management approach, hence HBV screening using serology should be performed for all patients undergoing any immunomodulating, immunosuppressive or chemotherapeutic treatment. Antiviral prophylaxis has proven effective in inactive carriers and in some patients with former infection with HBV undergoing selected immunosuppressive therapies.
Key words: Hepatitis B. Inmunosupresores. AntiTNF. Quimioterapia. Profilaxis.
Introducción
La historia natural de la infección por VHB es muy heterogénea y depende de la interacción entre factores virales, del huésped y factores ambientales. Cuando el virus de la hepatitis B infecta a una persona susceptible, el virus penetra en el hepatocito y su ADN se integra en el ADN hepatocitario transformándose en una forma de ADN convalente, circular, cerrado (ADN ccc). El ADN ccc se transcribe en el núcleo del hepatocito formando ARN que posteriormente se traduce en el citoplasma formando nuevas partículas virales. Así el ADN ccc sirve de molde para la formación de nuevos virus que infectarán nuevos hepatocitos y permanecerá siempre en el núcleo del hepatocito hasta que este sea destruido. La replicación del virus B no es directamente citotóxica para las células. Esto explica el hecho de que a pesar de la alta replicación viral los portadores de virus B pueden estar asintomáticos y presentar daño hepático mínimo.
Durante la replicación viral se expresan varios antígenos en el interior del hepatocito; algunos se expresan en la membrana celular (HBcAg) y otros se liberan como partículas circulantes al torrente sanguíneo (HBsAg y HBeAg). El sistema inmunitario del huésped reconoce estos antígenos como extraños y desencadena una respuesta inmune. Por un lado, se activa una respuesta Th1 que activa los linfocitos CD-8 y la formación de TNF-alfa provocando la destrucción de los hepatocitos infectados. Por otro lado, se activa la respuesta Th-2 donde los linfocitos B producen anticuerpos frente a distintos antígenos que neutralizan los virus circulantes evitando la infección de nuevos hepatocitos.
Si la respuesta inmune es eficaz se destruirán todos los hepatocitos infectados y se conseguirá la resolución de la infección. Si por el contrario la respuesta inmune no es suficiente la infección se cronifica evolucionando en 5 fases.
La fase de inmunotolerancia se caracteriza por una alta replicación viral (ADN de virus B alto, HBsAg y HBeAg positivo) favorecida por una pobre respuesta inmune que justifica la ausencia de daño histológico y la normalidad de las transaminasas. La duración de esta fase depende de la edad de adquisición de la infección, siendo larga en las infecciones perinatales y corta en las infecciones contraídas en la niñez o edad adulta.
Cuando esta tolerancia inmunológica se pierde, el sistema inmune destruye los hepatocitos infectados produciendo una elevación de transaminasas, un descenso progresivo en la viremia y necroinflamación hepática. Esta es la fase de inmunoactividad que clínicamente se correlaciona con la hepatitis crónica HBeAg positivo.
Una consecuencia importante de la fase inmunoactiva es la seroconversión del HBeAg, caracterizada por la negatividad del HBeAg, la positividad del antiHBe, niveles bajos o indetectables del VHB y una estabilización de la lesión hepática. Esta fase, conocida como estado de portador inactivo puede durar muchos años, produciéndose en un 1-2% de los pacientes anualmente la seroconversión del HBsAg (hepatitis B pasada). Sin embargo estos pacientes suelen mantener ADN ccc en algunos hepatocitos (1).
En algunas circunstancias los portadores inactivos pueden sufrir una reactivación de la replicación viral manteniendo el antiHBe positivo, que puede relacionarse con mutaciones virales espontáneas, inducidas o con situaciones de pérdida del control inmunológico. En esta situación el HBeAg se mantiene negativo, el antiHBe positivo, el ADN viral se incrementa junto con las transaminasas e histológicamente se asocia a un daño hepatocitario mayor. Esta fase es la denominada hepatitis crónica HBeAg negativo.
En los últimos años se ha incorporado una nueva fase de la infección crónica denominada fase de HBsAg negativo (o VHB oculto). Suele darse en portadores inactivos de muchos años de evolución en los que su sistema inmune consigue eliminar el HBsAg aunque persistiendo el ADN viral circulante a unos niveles muy escasos o exclusivamente detectable en el tejido hepático (ADN ccc). Estos casos no suelen tener lesión histológica significativa aunque pueden mostrar secuelas de procesos necroinflamatorios previos. En ciertas situaciones de inmunosupresión este grupo de pacientes, y excepcionalmente los pacientes con un perfil serológico de hepatitis B pasada, pueden sufrir reactivaciones del VHB caracterizadas por una elevación de la carga viral en sangre (≥ 1 log UI/ml), la reaparición del HBeAg y del HBsAg y un incremento de las transaminasas por encima de la cifra basal. Estas reactivaciones suelen ser asintomáticas, aunque en ocasiones pueden derivar en una hepatitis clínica definida por una elevación de la ALT 3 veces por encima de su valor basal junto con la aparición de ictericia y otros síntomas de hepatitis aguda (2,3).
En la tabla I se muestran los perfiles serológicos de la infección crónica por el VHB y los escenarios en los que se puede producir la reactivación del virus B.
La alteración en la relación entre el sistema inmune del huésped y el VHB es la responsable de este fenómeno de reactivación. Un 20-30% de los portadores inactivos pueden experimentar reactivaciones espontáneas relacionadas con el propio virus. Las reactivaciones también se pueden producir por alteraciones de la respuesta inmune inducidas por situaciones de inmunosupresión secundaria a tratamientos farmacológicos, como ocurre en los trasplantes de órganos sólidos y médula ósea, durante los tratamientos quimioterápicos en las enfermedades oncológicas o por el uso de tratamientos biológicos en enfermedades de base inmunológica.
Impacto epidemiológico de la infección crónica por VHB
A nivel mundial se estima que entre 350 y 400 millones de personas son portadoras del HBsAg. Esta población se encuentra distribuida en tres zonas de diferente endemicidad según la prevalencia de HBsAg, siendo el Sudeste asiático y África los de mayor prevalencia. España se engloba dentro de los países de endemicidad intermedia. En 1980 la prevalencia en España de portadores del HBsAg y de hepatitis B pasada era de un 1,2-2 y de un 20% respectivamente. Tras la instauración de los programas de vacunación universal contra el VHB, inicialmente en la adolescencia y posteriormente en los neonatos, la prevalencia en el año 2007 de portadores del HBsAg y de hepatitis B pasada ha disminuido radicalmente a un 0,7 y un 8,7%, respectivamente (4). Estos porcentajes aumentan en grupos de edad más avanzada y en población inmigrante. La prevalencia en España de antiHBc positivo entre población procedente de zonas de endemicidad alta, como Asia y África, es de 27,6% para la población asiática y de 18,8% para la africana (5). Con el aumento progresivo de la tasa de inmigración observado en nuestro país esta prevalencia puede seguir elevándose. La prevalencia de la infección por virus B oculto varía mucho de unos estudios a otros, entre un 0-89% en pacientes VIH y entre un 0-36,8% en pacientes en hemodiálisis (6).
Siendo esta situación epidemiológica un factor de riesgo para el desarrollo de una reactivación del VHB, la población susceptible es muy numerosa, lo que obliga a optimizar las medidas de prevención y tratamiento de este fenómeno. Por otra parte las mejoras en las medidas de prevención, promoción de la salud y los avances terapéuticos han conseguido que la esperanza de vida de la población general, y de los portadores del HBsAg en particular, se vea incrementada, con el mayor riesgo de desarrollar enfermedades oncológicas subsidiarias de tratamiento quimioterápico.
Aspectos epidemiológicos y clínicos de la reactivación del virus de la hepatitis B
Epidemiología y factores asociados a la reactivación
Se han descrito reactivaciones en tres grupos de pacientes:
- Pacientes sometidos a quimioterapia para tumores sólidos y hematológicos: hepatocarcinoma (7), tumores nasofaringeos (8), cáncer de mama (9), leucemias (10), linfomas (11) y trasplante de médula ósea (12,13).
- Pacientes tratados con inmunomoduladores (metotrexate) (14) o tratamientos biológicos (antiTNF-α)(15,16).
- Pacientes sometidos a inmunosupresión por trasplante de órganos sólidos (17,18).
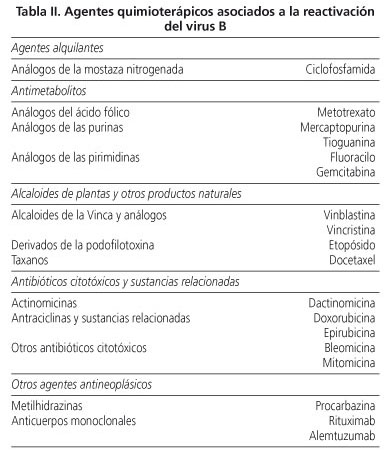
Por su actividad inmunosupresora cualquier agente quimioterápico podría ser susceptible de favorecer una reactivación (19). En la tabla II se detallan aquellos fármacos quimioterápicos que se han asociado a la reactivación del virus B.
La reactivación de VHB en portadores inactivos es de un 50% en pacientes sometidos a tratamiento de quimioterapia (20-23) y entre un 50-96% en los pacientes trasplantados renales y cardiacos (2,24) mientras que la reactivación por VHB de pacientes antiHBc positivo es menor, entre 6-10% y un 0,9% en pacientes tratados con quimioterapia (25,26) y pacientes que se trasplantan por órganos sólidos respectivamente (27).
La reactivación no se produce en todos los pacientes portadores del HBsAg o con antiHBc positivo. Diversos factores relacionados con el virus, el huésped y con el tipo de tratamiento (grado de inmunosupresión) se han asociado con la reactivación del virus B. Los pacientes con una carga viral basal mayor de 104 copias/ml o portadores de HBeAg positivo son más susceptibles de reactivación (20,23-26,28) así como el sexo masculino o pertenecer a una franja de edad más joven (20,28).
Por otro lado, se ha descrito un aumento de reactivación de virus B en pacientes sometidos a tratamientos inmunosupresores más agresivos, como es la quimioterapia, asociado a corticoides o el tratamiento con rituximab. En un estudio publicado por Cheng y cols. (2003) se aleatorizaron a los pacientes con linfoma no Hodgkin y HBsAg positivo a recibir tratamiento quimioterápico (epirubicina, ciclofosfamida, etopóxido) asociado o no a corticoides. Este segundo grupo tuvo una mayor incidencia de reactivación de virus B (un 73 frente a un 38%) y de hepatitis (44 frente a un 13%) (10).
El rituximab es un anticuerpo monoclonal contra el antígeno CD 20 que se expresa en la superficie de los linfocitos B. Este fármaco depleciona la población linfocitaria B y el nivel de anticuerpos, disminuyendo la respuesta inmune y favoreciendo la replicación del virus B. Por este motivo los tratamientos con rituximab, asociados o no a corticoides, tienen mayor riesgo de reactivación como se demostró en un estudio realizado por Hui y cols. (2006) (25) en el que 12% de los pacientes tratados con rituximab presentaron una reactivación frente a un 1% en el resto de pacientes. Otro estudio más reciente apoya esta observación; un 25% de los pacientes con linfoma y AntiHBc positivo tratados con ciclofosfamida, doxorubicina, vincristina, prednisona (CHOP) y rituximab reactivaron el virus B frente a ningún paciente de los que se trataron exclusivamente con CHOP (26).
La reactivación del virus B en pacientes sometidos a trasplante de médula ósea es casi universal en pacientes HBsAg positivos, de aproximadamente el 50% en pacientes con antiHBc positivo y del 20% en pacientes con hepatitis B pasada (2,12,29-31). Esto se relaciona con las altas dosis de quimioterapia administradas durante la fase de acondicionamiento pretrasplante y la consolidación posterior.
Clínica y diagnóstico de la reactivación por virus B
La reactivación puede aparecer en cualquier momento del tratamiento aunque es más frecuente al inicio del mismo o después de finalizar el tratamiento debido al fenómeno de reconstitución inmunológica. Generalmente, la reactivación de virus B pasa por tres fases (Tabla III):
1. Replicación: aumento de los niveles de ADN del VHB, por encima de 1 log respecto al valor basal o un valor mayor de 20.000 UI/ml, que corresponde a la transición de un portador inactivo con carga viral indetectable, a una replicación activa del virus con reaparición de HBeAg y negativización de AntiHBe (fenómeno de seroreversión).
2. Hepatitis: aumento de la cifra de transaminasas 3 veces por encima del valor basal que ocurre 2-3 semanas tras el aumento de ADN. En esta fase el paciente puede presentar síntomas como astenia, malestar general, ictericia o incluso signos de hepatitis aguda grave.
3. Recuperación: si el paciente no fallece, el ADN de virus B y las transaminasas vuelven a su estado basal generalmente tras la suspensión del tratamiento oncológico o tras la introducción de terapia antiviral.
La reactivación en pacientes con un antiHBc positivo puede cursar sólo con elevación de carga viral sin elevación de transaminasas (2).
Consecuencias clínicas de la reactivación por VHB
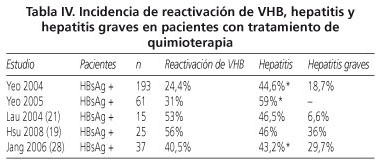
La reactivación del VHB puede tener dos consecuencias importantes en pacientes en tratamiento con quimioterapia. Por un lado está el riesgo de desarrollar una hepatitis aguda y en algunos casos hepatitis aguda grave con la consiguiente morbimortalidad asociada. La mortalidad directa por reactivación de virus B se relaciona fundamentalmente con fallo hepático agudo hasta un año después de suspendido el tratamiento. En el metaanálisis de Kazt y cols. en el que se incluyen 21 estudios, se reporta que entre un 24-100% de los pacientes que reactivan el virus B desarrollan hepatitis aguda y entre un 0-50% de la mortalidad en estos pacientes estaba relacionada con el VHB. En la tabla IV se describe la incidencia de reactivación, hepatitis y hepatitis grave de los principales estudios.
La otra consecuencia de la reactivación del VHB se relaciona con la necesidad de retrasar o incluso suspender la quimioterapia, con el impacto clínico negativo que puede suponer en la supervivencia total. En este mismo metaanálisis entre un 10-19% de los pacientes se les interrumpió el tratamiento (32).
La reactivación por VHB en el contexto de un trasplante de órgano sólido también puede tener graves repercusiones, no sólo en relación con un incremento de la mortalidad por cualquier causa (RR: 2,49 IC 95%: 1,64-3,78) sino también por un aumento del riesgo de fallo del injerto (RR: 1,44 IC 95%: 1,02-2,04), como se observó en el metaanálisis de Fabrizi y cols. (33) en pacientes con un trasplante renal.
La presentación clínica de la reactivación en los pacientes sometidos a trasplante de médula ósea suele manifestarse con más frecuencia como hepatitis grave y presentarse de una forma más tardía, con periodos entre 1 y 3 años tras el trasplante (12,29,31).
Para intentar evitar estos eventos clínicos desfavorables la recomendación actual según la guía europea y los últimos documentos de consenso es realizar un cribado serológico del VHB a todos los pacientes que van a someterse a tratamientos de quimioterapia, tratamientos inmunosupresores (principalmente en pacientes trasplantados) y tratamientos biológicos (anti-factor de necrosis tumoral) (2,34,35).
El cribado del virus B en esta población de riesgo no es una práctica universalmente establecida como se demostró en el estudio realizado por Tran y cols. En una encuesta realizada a 265 oncólogos estadounidenses, un 20% nunca realizaba serología para VHB y el 30% sólo la solicitaba si el paciente presentaba alguna alteración de las pruebas de función hepática; además si el paciente era portador de un VHB, hasta un 15% de los especialistas no pautaba tratamiento profiláctico ni remitía al hepatólogo (36).
Impacto estimado de la reactivación del VHB en poblaciones de riesgo
Para hacer una adecuada aproximación de la importancia epidemiológica y clínica que puede tener el fenómeno de la reactivación del VHB en nuestro país sería necesario conocer con exactitud el número de pacientes expuestos a cada grupo farmacológico con potencial capacidad para inducir la reactivación. Sin embargo obtener esta información es muy complicado, puesto que no se disponen de datos de consumo de estos fármacos por pacientes. Tan sólo se pueden manejar datos de prevalencia de las enfermedades relacionadas (especialmente oncológicas y trasplantes) y datos de unidades consumidas de fármacos para las terapias biológicas.
A modo de aproximación del importante problema para la salud pública que puede llegar a suponer la reactivación del VHB y con el fin de concienciar a la opinión médica de la necesidad de realizar cribado del VHB en estas poblaciones de riesgo, vamos a presentar algunos datos epidemiológicos.
Pacientes expuestos a fármacos antineoplásicos
La única aproximación que puede hacerse para estimar el número de pacientes suspectibles de haber recibido o estar recibiendo alguno de los fármacos quimioterápicos recogidos en la tabla II, se basa en la prevalencia de las neoplasias en las que estos fármacos están indicados. Dada la gran variabilidad de grupos farmacológicos incluidos en la lista, estos están prácticamente indicados en todos los tipos de neoplasias.
Según los datos del informe El Cáncer en España (37), publicado por la SEOM (Sociedad española de Oncología Médica) en enero de 2010, se calcula que la prevalencia total actual de cáncer en España es de más de 1.500.000 personas. El porcentaje aproximado de pacientes que reciben quimioterapia se sitúa en torno al 25-30% (38). Se puede calcular que el total de pacientes expuestos a quimioterapia estaría entre 375.000 y 450.000.
Adicionalmente disponemos de datos de incidencia de cáncer en registros españoles en el periodo 1998-2002, entre 324 y 511 casos/100.000 hombres/año y entre 204 y 286 casos/100.000 mujeres/año. Considerando el porcentaje que va a recibir tratamiento se puede calcular la incidencia de hombre y mujeres españolas que van a estar expuestas a tratamientos con quimioterapia, 100-150 casos/100.000 hombres/año y 60-85 casos/100.000 mujeres /año.
Exposición a tratamientos biológicos
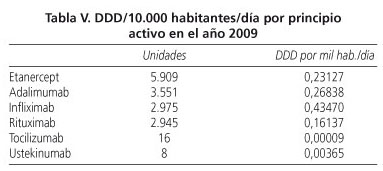
La estimación de exposición a estos fármacos se puede obtener a partir del número de envases consumidos en el último año. El cálculo de este parámetro se basa en el número de DDD (dosis diaria definida) por mil habitantes día, que proporciona una estimación del número de pacientes tratados diariamente con un determinado fármaco (39). Disponemos de los valores de DDD de nuestra Área Sanitaria (Área 6 de la Comunidad de Madrid), que atiende a una población aproximada de 621.395 habitantes (http://vocaliamadrid.wordpress.com/area-6/). Si se consideran todos los tratamientos biológicos comercializados en España, el DDD/1.000 habitantes/día en el año 2009 es de aproximadamente 1; es decir, en el área 6, en el año 2009, cada día, de cada 1.000 habitantes, 1 recibió una DDD de un fármaco biológico (Tabla V).
Otra aproximación se podría realizar en base a la información procedente de los pacientes que acuden a la unidad de dispensación de medicación a pacientes externos del servicio de farmacología hospitalaria para retirar medicación. En nuestra área sanitaria, en el mes de febrero de 2010, 240 pacientes con alguna de las principales indicaciones de terapia biológica (artritis reumatoide, espondilitis, psoriasis y enfermedad de Crohn) retiraron alguno de estos fármacos de la farmacia del hospital. Mensualmente este número puede incrementarse en torno a 8-10 pacientes nuevos al mes, por lo que la estimación anual podría situarse en unos 340 pacientes/año. Además durante el año 2009 se dispensó a 160 personas infliximab hospitalariamente (o en el Hospital de Día Médico). Dado que nuestra área sanitaria da cobertura a una población 621.395 habitantes, se pueden extrapolar los datos para estimar la población global expuesta a estos fármacos siendo de 80 pacientes expuestos por cada 100.000 habitantes al año.
Exposición a tratamientos inmunosupresores entre población trasplantada
Todos los pacientes trasplantados por cualquier indicación reciben tratamiento inmunosupresor, que lo van a mantener a lo largo de toda su vida.
Para estimar la exposición a inmunosupresores en este grupo de pacientes utilizaremos exclusivamente los datos de nuevas exposiciones en el último año, en base al número total de trasplantes realizados en España por todas las indicaciones (40).
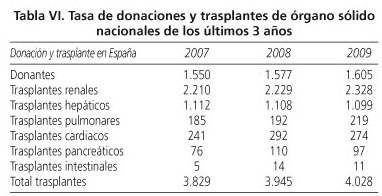
En la tabla VI se recogen los datos en relación al número de trasplantes de órgano sólido realizados en los tres últimos años.
Como se puede observar, en torno a 4.000 nuevos pacientes en el último año han estado expuestos a tratamiento inmunosupresor en España en relación con el trasplante de órgano sólido. También disponemos del número de pacientes con enfermedades hematológicas que en el año 2008 fueron sometidos a un trasplante de médula ósea (2.124 pacientes).
Como conclusión, en base a todos los datos expuestos anteriormente, se puede hacer una aproximación de la importancia real que puede suponer el problema de la reactivación del VHB entre la población española susceptible. En el ámbito de los trasplantes tenemos 4.028 de órgano sólido y 2.012 de médula ósea (datos de 2009 y 2008 respectivamente); en el entorno de la oncología alrededor de 46.000 pacientes al año van a recibir quimioterapia (aproximadamente 100/100.000 habitantes), mientras que aproximadamente 37.013 personas van a estar en tratamiento con terapias biológicas por las principales indicaciones (500/621.395 habitantes). Si sumamos todos los grupos de pacientes tendremos una población global en España sometida a fármacos en riesgo de inducir una reactivación del VHB de 89.053 personas nuevas al año. De esta población se puede calcular que 623 van a ser portadores del VHB (0,7% de HBsAg positivo en España) y 7.748 tendrán el antiHBc positivo (8,7% de AntiHBc positivo en España). Si no se aplican las recomendaciones de cribado del VHB en estos grupos de población de riesgo y no se toman las medidas preventivas contra la reactivación que se van a exponer más adelante podríamos tener anualmente, en base a los valores de incidencia expuestos en la tabla IV, sólo entre los portadores del VHB (HBsAg positivo) 187 casos nuevos de reactivación, de los cuales 80 se manifestarán clínicamente como una hepatitis y entre 5 y 25 tendrán un curso grave. Si este análisis se realiza con la población antiHBc positivo en riesgo las cifras se podrían multiplicar por 10 (Población española enero de 2010: 45.989.016 http://www.ine.es/jaxiBD/tabla.do).
Tratamiento de la reactivación de la hepatitis B
Tras el diagnóstico de la reactivación del virus B la primera medida debería ser la suspensión del tratamiento quimioterápico para restablecer el sistema inmune. Sin embargo esta acción puede derivar en una disminución de la eficacia del tratamiento con aumento de la mortalidad. Por lo tanto antes de tomar esta decisión se deben considerar todos los riesgos y beneficios.
La siguiente medida es la instauración de tratamiento antiviral. La mayoría de los estudios publicados han utilizado la lamivudina por ser un fármaco disponible desde hace años (41-46). Sin embargo, la lamivudina presenta una alta tasa de resistencias (14% al primer año, 65% a los 5 años) lo que la relega en la actualidad a un segundo plano terapéutico. Actualmente los fármacos de primera elección para el tratamiento de una reactivación del VHB deben ser los mismos empleados para el tratamiento de la hepatitis crónica B. Se deben administrar de inicio aquellos fármacos con una mayor potencia antiviral y con la menor tasa de resistencias a largo plazo descritas. Hoy en día los dos fármacos que cumplen estos requisitos y que deberían ser los utilizados como primera línea terapéutica son el entecavir y el tenofovir. Estos fármacos deben mantenerse de forma indefinida hasta que se alcancen los objetivos virológicos y serológicos establecidos por las principales guías de consenso de manejo de la hepatitis B (34,47). Actualmente existen tan sólo dos casos publicados de reactivación del VHB tratados con entecavir como primera línea, con excelentes resultados clínicos y virológicos (48,49). También se ha publicado recientemente un caso de reactivación de hepatitis B tratado con telbivudina con éxito (50).
Si nos basamos en los estudios publicados con lamivudina, las tasas de mortalidad asociada al VHB a pesar de emplear la lamivudina como tratamiento, se sitúan entre el 13 y el 80%. Esta mortalidad tan elevada pone de manifiesto la importancia de las estrategias de prevención de la reactivación, como una medida para reducir las complicaciones y la mortalidad asociadas a la reactivación instaurada.
Prevención de la reactivación del virus B
Pacientes tratados con agentes quimioterápicos (tumores de órganos sólidos y trasplantes de médula ósea)
Pacientes HBsAg positivo
Muchos estudios retrospectivos y prospectivos sin controles y con controles históricos han confirmado la disminución de incidencia de reactivación de virus B y de mortalidad asociada de pacientes portadores inactivos que han sido tratados de manera profiláctica con análogos de nucleósidos, siendo la lamivudina el fármaco más empleado (19). La lamivudina inhibe la replicación viral disminuyendo el riesgo de desarrollar hepatitis clínica y la mortalidad asociada. Sin embargo tan sólo se han publicado 3 estudios prospectivos controlados en portadores inactivos tratados con quimioterapia por diferentes indicaciones.
El primer estudio prospectivo aleatorizado se publicó en el año 2003 por Lau y cols. Treinta pacientes con HBsAg positivo y linfoma fueron aleatorizados a recibir lamivudina 100 mg al día desde una semana antes del inicio del tratamiento con la quimioterapia hasta 6 semanas después o a recibir este tratamiento cuando hubiera evidencia de reactivación. Las diferentes líneas de tratamiento de quimioterapia fueron ciclofosfamida, epirubicina, vincristina, prednisona (CEOP); adriamicina, bleomicina, vinblastina, dacarbazina (ABVD); ciclofosfamida, vincristina, procarbazina y prednisona (COPP) y CHOP. El 53% de los pacientes que no recibieron tratamiento preventivo presentaron reactivación del virus B (7% hepatitis) frente a ninguno de los pacientes del grupo con tratamiento profiláctico (22).
En otro estudio controlado (20) 51 portadores inactivos de virus B diagnosticados de linfoma no Hodgkin fueron aleatorizados a recibir tratamiento profiláctico con lamivudina 100 mg al día desde el comienzo del tratamiento con quimioterapia (CHOP) hasta dos meses después de finalizar el tratamiento o a recibirlo en caso de hepatitis. Un 7,7% de pacientes en el grupo de profilaxis y un 48% de los pacientes sin tratamiento preventivo presentaron hepatitis por reactivación de virus B. Tras suspender la profilaxis con lamivudina 5 pacientes desarrollaron reactivación por virus B y 2 de ellos fallecieron por hepatitis aguda.
El grupo de Jang y cols. aleatorizaron a los pacientes con VHB y hepatocarcinoma que iban a ser sometidos a quimioembolización a recibir lamivudina 100 mg/día desde el inicio del tratamiento de quimioembolización o a no recibir el tratamiento preventivo. La reactivación se produjo en un 2,8% de los pacientes sometidos a tratamiento profiláctico frente a un 29,7% de los pacientes que no fueron asignados a lamivudina (23).
La evidencia científica favorable al empleo de lamivudina como prevención de la reactivación del VHB ha sido apoyada por la publicación de dos metaanálisis (32,51), que incluyen un total de 35 estudios. En ambos metaanálisis se confirma una disminución de la tasa de hepatitis por reactivación de virus B, una disminución de la mortalidad por cualquier causa y específicamente de la mortalidad relacionada con el virus B en el grupo de pacientes con tratamiento profiláctico.
Por lo tanto, todos los pacientes portadores inactivos que van a ser tratados con quimioterapia deben recibir tratamiento antiviral profiláctico. No existen estudios específicamente diseñados para determinar la duración del tratamiento preventivo. Una aproximación a esta cuestión se puede obtener de la revisión de dos estudios (52,53) en los que se incluyeron un total de 161 portadores inactivos del VHB con tumores hematológicos o sólidos que recibieron profilaxis con lamivudina desde 1 semana antes hasta 1-6 meses después de finalizar la quimioterapia. Durante el seguimiento sin profilaxis de estos pacientes entre el 13 y el 24% sufrieron una reactivación. Al analizar los factores basales relacionados con la reactivación se observó que los pacientes con HBeAg positivo, una carga viral basal elevada (> 2.000-20.000 UI/ml) y tratados por un tumor hematológico presentaban mayor riesgo de reactivación. En base a estas observaciones las guías recomiendan iniciar la profilaxis desde 1 semana antes de la quimioterapia hasta 6-12 meses después de haber finalizado el tratamiento.
Respecto al antiviral profiláctico de elección, la mayoría de los estudios han empleado lamivudina. Sin embargo, se han descrito episodios de reactivación hasta en un 9,6% de los pacientes portadores inactivos tratados con lamivudina profiláctica, algunos de ellos relacionados con mutaciones genotípicas demostradas frente a la lamivudina. El riesgo de fallo de la lamivudina se ha relacionado con la carga viral basal, siendo significativamente superior para viremias mayores de 20.000 UI/ml (HR 3,91 IC: 1,63-9,39 p = 0,002) (51). La aparición de los nuevos análogos de nucleós(t)idos más potentes y con menos resistencias hace esperable que estos se incorporen a las medidas de prevención de la reactivación.
En base a esta evidencia, las principales asociaciones científicas de hepatología (33,45,52,54) recomiendan que todos los portadores del HBsAg que vayan a ser tratados con quimioterapia deban recibir profilaxis con lamivudina si el tratamiento tiene una duración estimada de 12 meses y la carga viral basal es indetectable. Si por el contrario se estima que el tratamiento va a tener una duración mayor de 12 meses se recomienda entecavir o tenofovir. Durante el tratamiento profiláctico se aconseja monitorizar la cifra de ALT cada 4 semanas y el ADN del VHB cada 3 meses o si se produce una elevación de la ALT. Si la viremia se incrementa 1 log por encima del valor basal se debe considerar la posibilidad de desarrollo de resistencias y modificar el tratamiento antiviral según lo establecido en las guías de consenso. Debido al riesgo de reac-tivaciones tardías tras la suspensión del tratamiento profiláctico se debe continuar la monitorización analítica hasta 1 año después de finalizar el tratamiento.
Pacientes HBcAc positivos +/- HBsAc
Se han publicado 4 estudios en los que se ha evaluado la evolución de pacientes con perfil serológico de AntiHBc positivo ± AntiHBs tratados con quimioterapia. En el único estudio prospectivo observacional (Borentain) el 8% de los pacientes incluidos presentó una reactivación (7/84), de los cuales 3 (47%) fallecieron por fallo hepático a pesar del tratamiento con lamivudina (55). Los otros estudios (25,26,56) incluyeron a un total de 303 pacientes diagnosticados de tumores hematológicos. Los porcentajes de reactivación descritos oscilan entre 3 y 24%, y el único factor común asociado a este fenómeno fue en todos ellos el empleo de rituximab (25,26).
Otros factores relacionados con la reactivación han sido la presencia de un ADN de VHB pretratamiento detectable (25), el recibir más de una línea de quimioterapia, el ser receptor de un TMO o el tener un título de AntiHBs menor de 10 UI/ml en pacientes con serología de hepatitis B pasada (55).
Como se ha comentado previamente, los pacientes sometidos a trasplante de médula ósea presentan una tasa de reactivación mayor por la agresividad del tratamiento inmunosupresor, de forma que hasta un 50% de los pacientes con AntiHBc positivo pueden sufrir reactivaciones del virus B (2).
En base a esta información las recomendaciones de profilaxis en los pacientes HBsAg negativo/AntiHBc positivo que van a recibir tratamiento quimioterápico y/o inmunosupresor se basan en la monitorización de la ALT y la carga viral del VHB durante el tratamiento, iniciando el empleo de análogos de los nucleós(t)idos si se produce una elevación de la viremia. Los pacientes que se van a someter a un trasplante de médula ósea o que van a recibir una inmunosupresión agresiva deben iniciar tratamiento profiláctico con lamivudina desde el inicio (2,34).
Pacientes en tratamiento con terapias biológicas
Los pacientes portadores inactivos o con antiHBc positivo con enfermedades reumatológicas, dermatológicas, digestivas o alérgicas en tratamiento inmunosupresor pueden sufrir reactivaciones del VHB aunque con una menor incidencia (2). La reactivación asociada a fármacos inmunomoduladores es rara aunque está descrita (14,57,58). Sin embargo el grupo farmacológico inmunosupresor que con más frecuencia se asocia a reactivaciones es el formado por los anticuerpos antifactor de necrosis tumoral alfa (antiTNF alfa). Los linfocitos T citotóxicos junto con el TNF alfa y el interferón gamma desempeñan un papel fundamental en la inhibición de la replicación del VHB y en la eliminación de los hepatocitos infectados. La interacción del TNF alfa y el interferón gamma suprime la replicación viral y contribuye a la eliminación del VHB al actuar sobre todos sus antígenos. El TNF alfa destruye los hepatocitos infectados activando mecanismos apoptóticos. Estos efectos antivirales del TNF alfa pueden ser bloqueados mediante el empleo de anticuerpos monoclonales antiTNF alfa, provocando una reactivación de la replicación viral y el riesgo de una hepatitis sintomática (1,15). Los fármacos antiTNF alfa comercializados en España son el infliximab, adalimumab y el etanercep.
La incidencia de reactivación es incierta ya que no existen estudios prospectivos y la mayoría de las publicaciones son series de casos. La experiencia con infliximab es la más amplia, que incluye a 21 pacientes (14,58-68). Ninguno de los pacientes que recibió profilaxis con lamivudina o entecavir (60) desarrolló una reactivación, mientras que la mayoría de los pacientes no tratados sufrieron un episodio de reactivación clínica, con algún caso de hepatitis fulminante, muerte o trasplante hepático (61).
La evidencia disponible con etanercept es menor. Desde el 2006 a 2009 se han reportado 7 casos de pacientes portadores del VHB con enfermedades reumatológicas tratados con etanercept. Tan sólo se ha descrito un caso de reactivación grave en un paciente con una serología de hepatitis B pasada con excelente respuesta a lamivudina (68). El resto de casos (15,68-70) sufrieron una reactivación exclusivamente virológica sin repercusión clínica y con buena evolución posterior. Ninguno de los pacientes tratados con lamivudina profiláctica presentó reactivación (68).
Respecto al adalimumab tan sólo existen dos publicaciones que incluyen 3 pacientes con VHB (70,71). Sólo uno presentó reactivación sin hepatitis clínica, otro recibió profilaxis y no se reactivó y el tercero no ha presentado datos de reactivación tras el seguimiento.
Para intentar conocer el impacto clínico real que puede tener la reactivación del VHB en el grueso de población susceptible tratada con antiTNF alfa se han publicado dos estudios. En el primero, realizado en una serie de 103 pacientes con enfermedades reumatológicas tratados con alguno de los 3 antiTNF alfa descritos, se reportó un caso de reactivación del VHB entre los 8 portadores inactivos de la cohorte (72). El paciente había recibido infliximab. Ninguno de los restantes pacientes tratados con adalimumab o etanercept se reactivó. El segundo, realizado en España en una serie de 80 pacientes con enfermedad inflamatoria intestinal tratados con infliximab, detectó 3 pacientes portadores del HBsAg. Los dos pacientes tratados con infliximab que no recibieron profilaxis frente al VHB presentaron reactivación del virus mientras que el paciente al que se le pautó lamivudina no desarrolló reactivación (16).
Como conclusión se puede afirmar que la indicación de profilaxis en los pacientes tratados con inmunosupresores clásicos (esteroides, azatiopriona o metotrexate) no está claramente establecida por la baja frecuencia de reactivación. El uso de profilaxis en los portadores inactivos que van a ser tratados con infliximab está indicado por la evidencia disponible. Aunque la experiencia con adalimumab y etanercept no parece demostrar un riesgo de reactivación tan elevado, la escasez de casos descritos y los mecanismos de acción que comparten este grupo farmacológico hace recomendable el uso de profilaxis con el empleo de estos fármacos. El fármaco antiviral de elección para la profilaxis en este grupo de pacientes no está claramente establecido. Dado que la duración del tratamiento con antiTNF alfa suele ser prolongada y conocidas las tasas de resistencias descritas con lamivudina, parece lógico emplear fármacos con un bajo perfil de resistencias a medio-largo plazo como son el entecavir o el tenofovir.
Pacientes en tratamiento inmunosupresor por trasplante de órganos sólidos
En este apartado sólo se va a comentar la experiencia existente con el trasplante de órganos sólidos diferentes del hígado. El manejo profiláctico y terapéutico del trasplante hepático por VHB supone una complejidad tan importante que merece ser desarrollado en un capítulo independiente.
Los pacientes que se someten a trasplante de órganos sólidos a menudo precisan de una inmunosupresión prolongada para evitar el rechazo, lo que puede favorecer la reactivación del virus B.
Por este motivo, en todo paciente evaluado para incluirse en lista de espera para trasplante renal, cardiaco o pulmonar debe realizarse una determinación de transaminasas, una serología completa del VHB y una carga viral si fuera portador del VHB. Si el paciente es HBsAg positivo se debe comenzar tratamiento con antivirales orales, en el momento del trasplante si el órgano procede de donante cadáver o 4-6 semanas antes del trasplante si procede de donante vivo. LA ALT y el ADN del VHB deben vigilarse cada 3 meses desde el trasplante y de forma más estrecha durante los cambios o intensificaciones de inmunosupresión. Aunque los estudios se han realizado con lamivudina, su alta tasa de resistencias y la duración prolongada del tratamiento inmunosupresor, hacen que actualmente se recomiende el uso de antivirales con menor tasa de resistencias (entecavir o tenofovir) (34,35). En los pacientes con un perfil serológico de hepatitis B pasada (AntiHBs y AntiHBc positivos) se debe valorar el título de anticuerpos antiHBs. Si el título es mayor de 100 UI/ml se recomienda seguimiento con monitorización de transaminasas; si el título es menor de 100 UI/ml se debe considerar nueva inmunización. En los pacientes AntiHBc positivo y AntiHBs negativo las posibilidades de reactivación clínica son menores. En un estudio realizado en 38 pacientes con antiHBc positivo/HBsAg negativo sometidos a un trasplante de órgano sólido, aunque 44% presentaron viremia detectable postrasplante sólo 5% positivizaron el HBsAg y ninguno presentó evidencia clínica de hepatitis (73). En base a estos datos sólo se debe considerar la profilaxis en los periodos de máxima inmunosupresión, como durante el tratamiento de los episodios de rechazo (35).
Conclusiones
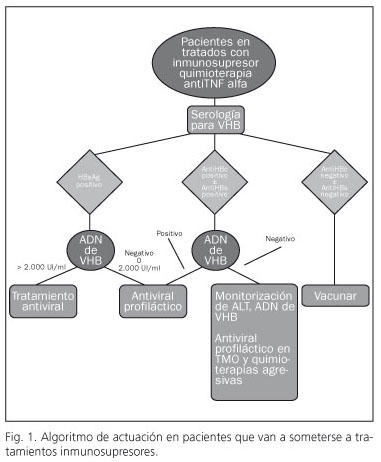
El riesgo de la reactivación en pacientes portadores inactivos o con antiHBc positivo que se someten a tratamiento inmunosupresor es alto. Esto puede provocar un aumento de la morbimortalidad de los pacientes. Por ello, en todos los pacientes que van a ser sometidos a tratamiento inmunosupresor o a trasplante se debe realizar una serología para virus B.
Si el paciente tiene una serología negativa es susceptible de infectarse y se deberá vacunar.
Si el paciente tiene HBsAg positivo se debe solicitar ADN de virus B. Si el ADN de virus B es mayor de 2.000 UI/ml debe seguir tratamiento antiviral convencional con los análogos de los nucleós(t)idos de primera elección. Si el ADN es menor de 2.000 UI/ml o indetectable se recomienda tratamiento profiláctico con lamivudina si el tiempo estimado del tratamiento es menor de 12 meses o entecavir/tenofovir si el tratamiento va a ser mayor de 12 meses.
Si el paciente presenta AntiHBc positivo con o sin AntiHBs se debe solicitar ADN de virus B. Si el ADN es detectable o el tratamiento inmunosupresor es muy agresivo (trasplante de médula ósea) se recomienda tratamiento profiláctico. En el caso contrario se deben monitorizar las transaminasas y ADN de virus B trimestralmente durante el tiempo que dure el tratamiento inmunosupresor, iniciando tratamiento antiviral si se produce una elevación de la viremia.
En la figura 1 se muestra el algoritmo de actuación recomendado para el manejo de pacientes que van a ser sometidos a tratamientos inmunosupresores.
 Dirección para correspondencia:
Dirección para correspondencia:
José Luis Calleja Panero.
Servicio de Aparato Digestivo.
Hospital Universitario Puerta de Hierro.
C/ Manuel de Falla, 1.
28222 Majadahonda, Madrid.
e-mail: jlcpan@terra.es
Recibido: 17-06-10.
Aceptado: 17-06-10.
Bibliografía
1. Ganem D, Prince AM. Hepatitis B Virus Infection - Natural History an Clinical Consequences. New England Journal of Medicine 2004: 350-1118-29. [ Links ]
2. Hoofnagle J. Reactivation of Hepatitis B. Hepatology 2009; 49 (5 Suppl): S156-65. [ Links ]
3. Simón Marco MA. Historia natural. Consenso para el tratamiento del virus B y C. Gastroenterología y Hepatología 2006; 29(Supl 2): 7-10. [ Links ]
4. Salleras L, Domínguez A, Bruguera M, Plans P, Costa J, Cardeñosa N, et al. Declining prevalence of hepatitis B virus infection in Catalonia (Spain) 12 years after the introduction of universal vaccination. Vaccine 2007; 25: 8726. [ Links ]
5. Salleras L, Dominguez A, Bruguera M, Plans P, Espuñes J, Costa J, et al. Seroepidemiology of hepatitis B virus infection in pregnant women in Catalonia (Spain). J Clin Virol 2009; 44: 329-32. [ Links ]
6. Raimondo G, Pollicino T, Cacciola I, Squadrito G. Occult hepatitis B virus infection. J Hepatol 2007; 46: 160-70. [ Links ]
7. Yeo W, Lam KC, Zee B, Chan PS, Mo FK, Ho WM, et al. Hepatitis B reactivation in patients with hepatocellular carcinoma undergoing systematic chematherapy. Ann Oncol 2004; 15: 1661-6. [ Links ]
8. Yeo W, Hui EP, Chan AT, Ho WM, Lam KC, Chan PK, et al. Prevention of hepatitis B virus reactivation in patients with nasopharyngeal carcinoma with lamivudine. Am J Clin Oncol 2005; 379-84. [ Links ]
9. Dai MS, Wu PF, Shyu RY, Lu JJ, Chao TY. Hepatitis B virus reactivation in breast cancer patients undergoing cytotoxic chemotherapy and the role of preemptive lamivudine administration. Liver Int 2004; 24: 540-6. [ Links ]
10. Cheng A, Hsiung C, Su I, Chen P, Chang M, Tsao C, et al. Steroid-Free Chemotherapy Decreases Risk of Hepatitis B virus (HBV) Reactivation in HBV-Carriers with lymphoma. Hepatology 2003; 37: 1320-8. [ Links ]
11. Persico M, De Marino F, Russo GD, Morante A, Rotoli B, Torella R, et al. Efficacy of lamivudine to prevent hepatitis reactivation in hepatitis B virus-infected patients treated for non-Hodgkin lymphoma. Blood 2002; 15: 724-5. [ Links ]
12. Onozawa M, Hashino S, Izumiyama K, Kahata K, Chuma M, Mori A, et al. Progresive disappearance of anti-hepatitis Surface antigen antibody and reverse seroconversion after allogeneic hematopoietic stem cell transplantation in patients with previous hepatitis B virus infection. Transplantation 2005; 79: 616-9. [ Links ]
13. Otero López-Cubero S, Espigado I, Aguilar Reina J, Parody R. Reactivation of HBV following allogeneic bone marrow trasplantation: new Outlook (the hepatitis B virus and the bone marrow trasplant). Rev Esp Enferm Dig 1999; 91: 229-230. [ Links ]
14. Ostuni P, Botsios C, Punzi L, Sfriso P, Todesco S. Hepatitis B reactivation in a chronic hepatitis B surface antigen carrier with rheumatoid arthritis treated with infliximab and low dose methotrexate. Ann Rheum Dis 2003; 62: 686-7. [ Links ]
15. Carroll MB, Bond MI. Use of Tumor Necrosis Factor α Inhibitors in Patients with Chronic Hepatitis B Infection. Semin Arthritis Rheum 2007; 38: 208-17. [ Links ]
16. Esteve M, Saro C, Gonzalez-Huix F, Suárez F, Forné M, Viver JM. Chronic hepatitis B reactivation following infliximab therapy in Crohn's disease patients: need for primary prophylaxis. Gut 2004; 53: 1363-5. [ Links ]
17. Marcellin P, Giostra E, Martino-Peignoux M, Loriot MA, Jaengle ML, Wolf P. Redevelopment of hepatitis B surface antigen after renal trasplantation. Gastroenterology 1991; 100: 1432-4 [ Links ]
18. Dickson RC, Everhart JE, Lake JR, Wei Y, Seaberg EC, Wiesner RH, et al. NIDDK Liver Transplantation Datebase. Transmission of hepatitis B by transplantation of livers from donors positive for antibody to hepatitis B core antigen. Gastroenterology 1997; 113: 1668-74 [ Links ]
19. Yeo W, Johnson PJ. Diagnosis, Prevention and Management of hepatitis B virus reactivation during anticancer therapy. Hepatology 2006; 43: 209-20. [ Links ]
20. Hsu C, Hsiung CA, Su IJ, Wang WS, Lin SF, Lin TH, et al. A revisit of prophylactic lamivudine for chemotherapy-associated hepatitis B reactivation in non-Hodgkin's lymphoma: a randomized trial. Hepatology 2008; 47: 844-53. [ Links ]
21. Lok AS, Liang RH, Chiu EK. Reactivation of hepatitis B virus replication in patients receiving cytotoxic therapy: report of a prospective study. Gastroenterology 1991; 100: 182-8. [ Links ]
22. Lau G, Yiu H, Fong D, Cheng H, Au W, Lai L, et al. Early is Superior to Deferred Preemptive Lamivudine Therapy for Hepatitis B Patients Undergoing Chemotherapy. Gastroenterology 2003; 125: 1742-9. [ Links ]
23. Jang JW, Choi JY, Bae SH, Yoon SK, Chang UI, Kim CW, et al. A randominzed controlled study of preemptive lamivudine in patients receiving Transarterial Chemo-Lipiodilization. Hepatology 2006; 43: 233-40. [ Links ]
24. Ko WJ, Chou NK, Hsu RB, Chen YS, Wang SS, Chu SH, et al. Hepatitis B Virus infection in heart transplant recipients in hepatitis B endemic area. J Heart Lung Trasplant 2001; 20: 865-75. [ Links ]
25. Hui CK, Cheung WW, Zhang H, Au W, Yueng Y, Leung A, et al. Kinetics and Risk of De Novo Hepatitis B infection in HBsAg-negative Patients Undergoing Cytotoxic Chemotherapy. Gastroenterology 2006; 131: 59-68. [ Links ]
26. Yeo W, Chan TC, Leung NW, Lam WY, Mo FK, Chu MT, et al. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol 2009; 27: 605-11. [ Links ]
27. Berger A, Preiser W, Kachel HG, Sturmer M, Doerr H. HBV reactivation after kidney transplantation. J Clin Virol 2005; 32: 162-5. [ Links ]
28. Yeo W, Chan P, Zhong S, Ho W, Steinberg JL, Tam L, et al. Frequency of Hepatitis B Virus Reactivation in Cancer Patients Undergoing Cytotoxic Chemotherapy: A Prospective Study of 626 patients with Identification of Risk Factors. J Med Virol 2000; 62: 299-307. [ Links ]
29. Dhedin N, Douvin C, Kuentz M, Saint Marc MF, Remen O, Rieux C, et al. Reverse seroconversion of hepatitis B alter allogeneic bone marrow transplantation: a retrospective study of 37 patients with pretransplant antiHBs and antiHBc. Transplantation 1998; 66: 616-9. [ Links ]
30. Seth P, Alrajhi AA, Kagevi I, Chaudhary MA, Colcol E, Sahovic E, et al. Hepatitis B reactivation with clinical flare in allogeneic stem cell transplant with chronic graft-versus-host disease. Bone Marrow Transplantion 2002; 30: 189-94. [ Links ]
31. A. Knöll, S. Boehm, J. Hahn, E. Holler, W. Jilg. Reactivation of resolved hepatitis B virus infection after allogeneic haematopoietic stem cell transplantation. Bone Marrow Transplant 2004; 33: 925-9. [ Links ]
32. Katz L, Fraser A, Gafter-Gvili A, Leibovici L, Tur-Kaspa R. Lamivudine prevents reactivation of hepatitis B and reduce mortality in immunosuppressed patients: systematic review and meta-analysis. J Viral Hepatitis 2008; 15: 89-102. [ Links ]
33. Fabrizi F, Martin P, Dixit V, Kanwal F, Dulai G. HBsAg seropositive status and survival after renal transplantation: meta-analysis of observational studies. Am J Transplant 2005; 5: 2913-21. [ Links ]
34. European Association of the study of the liver. EASL Clinical Practice Guidelines: Management of chronic hepatitis B. J Hepatol 2009; 50: 227-42. [ Links ]
35. Barclay S, Pol S, Multimer D, Benhamou Y, Mills P, Hayes P, et al. Erratum to "The management of chronic hepatitis B in the immunocompromised patient: Recommendations from a single topic meeting". Journal of Clinical Virology 2008; 42: 104-15. [ Links ]
36. Tran TT, Rakoski MO, Martin P, Poordad F. Screening for hepatitis B in chemotherapy patients: Surrey of current oncology practices. Aliment Pharmacol Ther 2010; 31: 240-6. [ Links ]
37. El Cáncer en España. SEOM. Enero 2010. http://www.seom.org/es/prensa/el-cancer-en-espanyacom. Acceso el 15 de marzo de 2010. [ Links ]
38. Cabanes Doménech A, Pérez-Gómez B, Aragonés N, Pollán N, López-Abente G. La situación del cáncer en España. 1975-2006. ISCIII. Madrid 2009. [ Links ]
39. WHO Collaborating Centre for Drug Statistics Methodology, Guidelines for ATC classification and DDD assignment, 2010. Oslo, 2009. [ Links ]
40. Evolución de la Actividad de Donación y Trasplante en España. Organización Nacional de Trasplantes. http://www.ont.es/Documents/Datos donacion y trasplante 2009 revisada.pdf Acceso 15 de marzo 2010. [ Links ]
41. Yeo W, Steinberg JL, Tam JS, Chan PK, Leung NW, Lam KC, et al. Lamivudine in treatment of hepatitis B reactivation during cytotoxic chemoterapy. J Med Virol 1999; 59: 263-9. [ Links ]
42. Petrelli E, Balducci M, Pieretti C, Rocchi MB, Clementi M, Manzin A. Lamivudine treatment failure in preventing fatal outcome of the novo severe acute hepatitis B in patients with haematological diseases. J Hepatol 2001; 35: 823-6. [ Links ]
43. Liao CA, Lee CH, Wu HC, Wang MC, Lu SN, Eng HL. Lamivudine for the treatment of hepatitis B virus reactivation following chemotherapy for non-Hodgkin's lymphoma. Br J Haematol 2002; 116: 166-9. [ Links ]
44. Marín E, Rendon P, De Diego L, Soria MJ, Martínez MC, Martín L. Role of lamivudine in reactivation of hepatitis B virus infection in immunodepressed patients. Rev Esp Enferm Dig 2003; 95: 799-803. [ Links ]
45. Llop E, de la Revilla J, Pons F, Peñas B, Martínez JL, Abreu L et al. Decrease in viral load at weeks 12 and 24 in patients in chronic hepatitis B treated with lamivudine o adefovir predicts virological response at week 48. Rev Esp Enferm Dig 2009; 101: 763-7. [ Links ]
46. Simpon ND, Simpon PW, Ahmed AM, Nguyen MH, Garcia G, Keeffe EB, et al. Prophylaxis against chemotherapy-induced reactivation of hepatitis B virus infecction with lamivudine. J Clin Gastroenterol 2003; 37: 68-71. [ Links ]
47. Lok A, McMahon B. Chronic Hepatitis B: Uptodate 2009. Hepatology 2009; 50: 1-36. [ Links ]
48. Sánchez MJ, Buti M, Homs M, Palacios A, Rodríguez-Frías F, Esteban R. Successful use of entecavir for a severe a case of reactivation of hepatitis B virus following polychemotherapy containing rituximab. J Hepatol 2009; 51: 1091-6. [ Links ]
49. Colson P, Borentain P, Cose D, Chebannon C, Tamalet C, Gerolami R. Entecavir as a first line treatment for HBV reactivation following polychemotherapy for lymphoma. Br J Hematol 2008; 143: 148-50. [ Links ]
50. Montineri A, Nigro L, Chiarenza A, Larocca L, La Rosa R, Lacobello C, et al. Telbivudine use in a patient affected by occult hepatitis B virus and B-cell non-Hodgkin lymphoma. Leuk Lymphoma 2010; 51: 554-7. [ Links ]
51. Loomba R, Rowley A, Wesley R, Liang J, Hoofnagle J, Pucino F, et al. Systematic Review: The effect of Preventive Lamivudine on Hepatitis B Reactivation during Chemotherapy. Ann Intern Med 2008; 148: 519-28. [ Links ]
52. Hui CK, Cheung WW, Lie AK, Zhang HY, Yueng YH, Wong BC, et al. Hepatitis B reactivation after withdrawal of pre-emptive lamivudine in patients with haematological malignancy on completion of cytotoxic chemotherapy. Gut 2006; 55: 1208-9 [ Links ]
53. Kim IK, Kim W, Kim BS, Jung YJ, Beng Jeong JB, Kim BG, et al. Clinical prediction of failure in antiviral prophylaxis for patients with hepatitis B infection undergoing cytotoxic chemotherapy for malignant tumors. J Hepatol 2009 (Supl. 1): S332. [ Links ]
54. M. Torres Salinas. Hepatitis B en situaciones especiales. Consenso para el tratamiento de virus B y B. Gastroenterología y Hepatología 2006; 29(Supl. 2): 76-81. [ Links ]
55. Borentain P, Colsen P, Cose D, Bories E, Charbonnier A, Stoppa AM, et al. Clinical and virological factors associated with hepatitis B virus reactivation in HBsAg negative and anti-HBc antibodies-positive patients undergoing chemotherapy and/or autologous stem transplantation for cancer. J Viral Hepat. Epud ahead of print. [ Links ]
56. Francisci D, Falcinelli F, Schianroli E, Capponi M, Belflari B, Flenghi L, et al. Management of hepatitis B virus reactivation in patients with haematological malignancies treated with chemotherapy. Infection 2010; 38: 58-61 [ Links ]
57. Ito S, Nakazono K, Murasawa A, Mita Y, Hata K, Saito N et al. Development of fulminant hepatitis B (precore variante mutante type) after the discontinuation of low-dose methotrexate therapy in a rheumatoid arthritis patients. Arthritis Rheum 2001; 44: 339-42. [ Links ]
58. Calabrese LH, Zein NN, Vassilopoulos D. Hepatitis B virus (HBV) reactivation with immunosuppressive therapy in rheumatic disease: assessment and preventive strategies. Ann Rheum Dis. 2006; 65: 983-9. [ Links ]
59. Anelli MG, Torres DD, Manno C, Scioscie C, Ionnane F, Covelli F, et al. Improvement of renal function and disappearance of hepatitis B virus ADN in a patients with rheumatoid arthritis and renal amyloidosis following treatment with infliximab. Arthitis Rheuma 2005; 52: 2519-20. [ Links ]
60. Conde-Taboada A, Pedraz J, Campos L, López-Bran E. Infliximab treatment for severe psoriasis in a patient with active hepatitis B virus infection. J Am Acad Dermatol 2009; 60: 1077-9. [ Links ]
61. Michel M, Duvoux C, Hezode C, Cherqui D. Fulminant Hepatitis After Infliximab in a Patient with Hepatitis B Virus Treated for an Adult Onset Still's disease. J Rheumatol 2003; 30: 1624-5. [ Links ]
62. Ojiro K, Naganuma M, Ebinuma H, Kunimoto H, Tada S, Ogata H, et al. Reactivation of hepatitis B in a patient with Crohn's disease treated using Infliximab. J Gastroenterol 2008; 43: 397-401. [ Links ]
63. Millonig G, Kern M, Ludwiczek O, Nachbaur K, Vogel W. Subfulminant hepatitis B after infliximab in Crohn's disease: Need for HBV-screening? World J Gastroenterol 2006; 12: 974-6. [ Links ]
64. Oniankitan O, Duvoux C, Challine D, Mallat A, Chevalier X, et al. Infliximab Therapy for Rheumatic Diseases in Patients with Chronic Hepatitis B or C chronic HBV or HCV infection. J Rheumatol 2004;31:107-9. [ Links ]
65. Roux CH, Brocq O, Breuil V, Albert C, Euller-Ziegler L. Safety of anti-TNF-a therapy in rheumatoid arthritis and spondylarthropathies with concurrent B or C chronic hepatitis. Rheumatol 2006; 45: 1294-7. [ Links ]
66. Sakellariou TG, Chatzigiannis I. Long-term anti-TNFα therapy for ankylosing spondylitis in two patients with chronic HBV infection. Clin Rheumatol 2007; 26: 950-2. [ Links ]
67. Ueno Y, Tanaka S, Shimamoto M, Miyanaka Y, Hiyana T, Ito M, et al. Infliximab Therapy for Crohn's Disease in a Patient with Chronic Hepatitis B. Dig Dis Sci 2005; 50: 163-6. [ Links ]
68. Wendling D, Di Martino V, Prati C, Toussirot E, Herbein G. Spondyloarthropathy and chronic B hepatitis. Effect of anti-TNF therapy. Joint Bone Spine 2009; 76: 308-11. [ Links ]
69. Martínez Montiel P, Solis JA, Chirinos JA, Casis B, Sánchez F, Rodríguez S. Hepatitis B virus reactivation during therapy with etanercept in an HBsAg-negative and anti-HBs-positive patient. Liver International 2008; 28: 718-20. [ Links ]
70. Li S, Kaur PP, Chan V, Berney S. Use of tumor necrosis factor-α (TNF-α) antagonists infliximab, etanercept, and adalimumab in patients with concurrent rheumatoid arthritis and hepatitis B or hepatitis C: a retrospective record review of 11 patients. Clin Rheumatol 2009; 28: 787-91. [ Links ]
71. Kaur PP, Chan VC, Berney SN. Histological evaluation of liver in two rheumatoid arthritis patients with chronic hepatitis B and C treated with TNF-alpha blockade: case reports. Clin Rheumatol 2008; 27: 1069-71. [ Links ]
72. Kim SJ, Park MC, Park YB, Lee SK. Reactivation of hepatitis B viral infection in inactive HBsAg carriers following anti-tumor necrosis factor-alpha therapy. J Rheumatol. 2009; 36: 2416-20. [ Links ]
73. Knöll A, Pietrzyk M, Loss M, Goetz WA, Jilg W. Solid-organ transplantation in HBsAg-negative patients with antibodies to HBV core antigen: low risk of HBV reactivation. Transplantation 2005; 79: 1631-3. [ Links ]











 text in
text in