My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 n.11 Madrid Nov. 2010
Hipótesis inmune del síndrome del intestino irritable. Primera parte: papel de los linfocitos y mastocitos
Irritable bowel syndrome immune hypothesis Part one: the role of lymphocytes and mast cells
M. Ortiz Lucas1, P. Saz Peiró1, J. J. Sebastián Domingo2
1Departamento de Microbiología, Medicina Preventiva y Salud Pública. Universidad de Zaragoza.
2Servicio de Digestivo. Hospital Royo Villanova. Zaragoza
Dirección para correspondencia
RESUMEN
Objetivo: Revisar la evidencia disponible sobre el papel de los linfocitos T y mastocitos en la etiopatogenia del Síndrome del Intestino Irritable. de las vías biliares.
Métodos: Recuperación bibliográfica en PubMed incluyendo los términos
"Irritable Bowel Syndrome, "Immune System", "T-Lymphocytes" y "Mast Cells".
Resultados: Se recuperaron 25 estudios casos-control y un ensayo clínico aleatorizado. A nivel sanguíneo destaca el aumento de células T activadas destinadas a migrar al intestino en estos pacientes. En la mucosa intestinal se describe un patrón elevado de linfocitos T, aunque los resultados de los estudios son en ocasiones contradictorios, y un aumento claro de mastocitos (y de su actividad) entre el íleon terminal y colon descendente
Conclusiones: La heterogeneidad de criterios diagnósticos y de métodos de experimentación podría explicar algunas de las diferencias en los resultados que se encuentran en las investigaciones seleccionadas. Existen indicios que conducen a pensar que existe una "inflamación intestinal de bajo grado" en estos pacientes, y se ha relacionado el aumento de linfocitos T y de mastocitos con trastornos encontrados en el SII como la comunicación entre el intestino y el sistema nervioso, el aumento de la permeabilidad intestinal y los cambios en la microbiota.
Palabras clave: Síndrome del Intestino Irritable. Sistema inmune. Linfocitos T. Mastocitos. Psiconeuroinmunología. Revisión sistemática.
ABSTRACT
Objective: To review the available evidence on the role of T-lymphocytes and mast cells in the etiopathogenesis of Irritable Bowel Syndrome.
Methods: Bibliographic retrieval on PubMed including the terms "Irritable Bowel Syndrome, "Immune System", "T-Lymphocytes" and "Mast Cells".
Results: Twenty-five case-control studies and one randomized controlled trial were retrieved. Noteworthy in the blood is the increase in activated T cells destined to migrate to the bowel in these patients. A high frequency of T-lymphocytes is described in the intestinal mucosa, although the study findings are, at times, contradictory. An evident increase in mast cells (and in their activity) between the terminal ileum and descending colon is also observed.
Conclusions: The heterogeneity of diagnostic criteria and experimentation methods could account for some of the differences in the results found in the selected research. There are indications that give reason to believe these patients have "low-grade intestinal inflammation", and the increase in T-lymphocytes and mast cells has been associated with disorders found in IBS such as the communication between the intestine and the nervous system, the increase in intestinal permeability and changes in the microbiota.
Key words: Irritable bowel syndrome. Immune system, T-lymphocytes. Mast cells. Psychoneuroimmunology. Systematic review.
Introducción
En abril de 2009, un grupo de médicos especialistas del Hospital Royo Villanova, de Zaragoza, creamos el "Grupo de Investigación en Trastornos Funcionales Digestivos y Psicoinmunología", dentro del Mapa de Investigación Biomédica del Instituto Aragonés de Ciencias de la Salud.
Nuestro objetivo es investigar las relaciones existentes entre los trastornos funcionales digestivos (TFD), en particular el síndrome del intestino irritable (SII), y la Psiconeuroinmunología (PNI).
Antes de poner en marcha nuestras líneas de investigación, hemos llevado a cabo una serie de revisiones sistemáticas basadas en la evidencia (RSBE). La primera de ellas sobre la probable hipótesis inmune del SII, cuyos resultados se ponen de manifiesto en este artículo y el siguiente.
El SII es un trastorno funcional del intestino delgado y grueso que se caracteriza por dolor/malestar abdominal, meteorismo con distensión abdominal y alteración en las evacuaciones intestinales con predominio de diarrea, estreñimiento o alternancia de estos signos, los cuales no pueden ser explicados por una anormalidad estructural o bioquímica (1). Se estima que alrededor de un 3% de las consultas de Atención Primaria y de un 16% a un 25% de las consultas de gastroenterología son debidas a esta afección (2).
Se desconocen su etiopatogenia y mecanismo fisiopatológico. Se han propuesto varios factores patogénicos responsables del SII, como factores genéticos y ambientales (3), alteraciones de la motilidad digestiva (4), hipersensibilidad visceral (5), mecanismos inflamatorios y postinfecciosos (6), morbilidad psicológica (7), abuso físico y sexual (8) y sobrecrecimiento bacteriano (9), entre otros. Sin embargo, ninguno de ellos parece que explique de forma clara los verdaderos mecanismos que desencadenan el síndrome. Las teorías más recientes apuntan que las posibles interacciones entre todos los factores implicados en el SII (psicología, hipersensibilidad visceral, inmunología, sistema inmunológico intestinal, microbiota y probióticos) podrían entenderse y explicarse desde el ámbito de la PNI (10).
La PNI es un campo científico interdisciplinar que se dedica al estudio e investigación de los mecanismos de interacción y comunicación entre el cerebro (mente/conducta) y los sistemas responsables del mantenimiento homeostático del organismo, los sistemas nervioso (central y autónomo), inmunológico y neuroendocrino, así como sus implicaciones clínicas (11).
Dentro de este contexto, el objetivo de esta revisión sistemática (RS) es evaluar las evidencias disponibles sobre el papel del sistema inmune en la etiopatogenia del SII.
Métodos
La búsqueda bibliográfica se realizó en la base de datos PubMed (www.pubmed.gov), en diciembre de 2009. En la estrategia de búsqueda se utilizaron los términos MeSH "Irritable Bowel Syndrome", "Immune System", "T-Lymphocytes" y "Mast Cells". La búsqueda no se restringió a ningún tipo de investigación específica puesto que nuestro objetivo, estudiar la etiopatogenia de la enfermedad, hacía necesario recoger no solamente ensayos clínicos, sino también estudios observacionales (12,13).
En la RS se incluyeron los estudios que cumplían los siguientes criterios y límites: estudiar un grupo de pacientes con SII en relación a un grupo control (GC) y/o a otras patologías; hacer referencia a la etiopatogenia del SII desde el punto de vista de una probable hipótesis inmune; estudios realizados en humanos, y artículos publicados en español o inglés. Se excluyeron aquellos artículos en los que no se encontraba ninguna relación con dicha probable hipótesis y aquellos realizados en animales.
Se obtuvo el artículo a texto completo si, tras leer el título y/o resumen, indicaba que podría cumplir los criterios de selección. Una vez leído el texto completo del artículo se decidía si se elegía o no para su evaluación final.
La calidad metodológica de los artículos se evaluó siguiendo las recomendaciones de la Colaboración Cochrane. No obstante, aquellas están dirigidas a evaluar la validez de los estudios clínicos y no se pueden aplicar de la misma forma en los estudios observacionales (13). El objetivo al evaluar la calidad metodológica no era dar una valoración global del grado de validez o no del estudio sino que se pudieran conocer, de una manera objetiva, los aspectos metodológicos más destacables en los estudios recuperados.
Para el análisis de los resultados se tuvo en cuenta si la determinación de los componentes inmunes se realizaba mediante examen de sangre y/o biopsia, diferenciándose la zona del intestino donde se realizó aquella y, de forma secundaria, siempre y cuando fuera posible, se analizó si existían diferencias entre los distintos subtipos de SII (diarrea [D], estreñimiento [E], alternante [A]), o entre la forma de instauración de la enfermedad (post infecciosa [PI], no PI).
Resultados
Se recuperaron un total de 26 artículos válidos relacionados con la probable hipótesis inmune del SII. Uno de ellos es un ensayo clínico aleatorizado (ECA) (14) y los 25 restantes, casos-controles (15-39). El ECA es de una gran validez metodológica, aunque no hace referencia a la representatividad de la muestra (14).
En todos los artículos se estudió el perfil inmune de los pacientes mediante la realización de un análisis de sangre (15,25,28,30,31,38,39) y/o con la toma de una biopsia de una o más partes del intestino (14,16-24,26-37,39). El diagnostico de SII se hizo siguiendo los Criterios de Roma I (14,18,19,22), Roma II (20,21,23-26,28-32, 34,35,37-39) o Roma III (33,36), excepto uno que utilizó los Criterios de Roma junto con los de Manning (27). En los dos estudios del año 1993 se emplearon los criterios de Manning (16) y los síntomas clínicos (15). Dos estudios utilizaron los criterios de Roma pero no fue posible saber cuál de ellos (17,27).
Los investigadores siguieron distintos criterios a la hora de estudiar el SII. Unos estudios seleccionaron todos los pacientes con SII sin tener en cuenta el subtipo de los mismos (15,25,27,38). Otros, diferenciaban entre pacientes con SII-PI y pacientes con SII-no PI (14,18,21-23,28,31) y, los últimos, diferenciaban a los pacientes según el predominio de la sintomatología (14,16,17, 19-22,24,26,28-37,39). A pesar de diferenciar entre los diferentes subtipos de patología, en la mayoría de los estudios, el tamaño de la muestra no era suficiente para establecer diferencias significativas en el perfil inmune entre los subgrupos. Tres estudios seleccionaron exclusivamente a pacientes con SII-PI (14,18,22) -uno de los cuales eligió, a su vez, a pacientes con SII post disentérico (18)-, un estudio a pacientes con SII-no PI (33) y cuatro estudios a pacientes con SII-D (20,29,30,32). Las características principales de los artículos recuperados se especifican en la tabla I.
Linfocitos
Los linfocitos son los responsables de la respuesta inmune específica. Éstos se diferencian en linfocitos B, que producen anticuerpos y son los responsables de la respuesta de anticuerpos frente al antígeno, y en linfocitos T, responsables de la respuesta inmune mediada por células y de otras funciones de cooperación para que se desarrollen todas las formas de respuesta inmune. Morfológicamente los linfocitos son indistinguibles, por lo que se emplean los marcadores de inmunoglobulinas de membrana (mIg) para diferenciar los linfocitos B y el receptor antigénico de las células T (TCR)-CD3 para los linfocitos T. Además, existe un elevado número de antígenos de diferenciación de leucocitos humanos, denominados clusters de diferenciación (CD), que permiten la diferenciación y detección de los distintos subtipos de linfocitos (40).
Son muchos los CD descritos, y no es objetivo de esta revisión referirnos a ellos. Sin embargo, se hará referencia a aquellos que se consideren relevantes para la exposición de esta revisión.
Todos los linfocitos T expresan el marcador CD3 y, a su vez, se diferencian en linfocitos T CD4+, denominados linfocitos T colaboradores (linfocitos Th), y linfocitos T CD8+, denominados linfocitos T citotóxicos. Ambos subtipos se diferencian, funcionalmente, por su acción de cooperación en todo tipo de respuesta inmune o por su acción citotóxica que produce la lisis celular, respectivamente. Tanto los linfocitos T CD4+ como los linfocitos T CD8+ expresan la molécula CD45 (interviene en la activación de los linfocitos T a través del receptor (TCR)-CD3) pudiendo expresar, a su vez, la isoforma CD45RA o CD45RO. La primera hace referencia a los linfocitos naive o vírgenes, que no han estado en contacto con el antígeno, y la isoforma CD45RO, a los linfocitos de memoria, que previamente han estado en contacto con aquél (41).
La activación crónica y persistente de los linfocitos Th hace que éstos se diferencien en linfocitos Th1 o linfocitos Th2. No existen marcadores fenotípicos que identifiquen estas células, lo que hace necesario su cultivo in vivo y el análisis de las citokinas que producen para poder diferenciar ambos subtipos (40).
El papel de los linfocitos en el SII
Muchos estudios han tratado de determinar si existe o no una mayor presencia de linfocitos, o de sus distintos marcadores, que pudieran diferenciar el comportamiento de las distintas poblaciones de linfocitos, en los pacientes con SII.
1. Linfocitos en sangre: La integrina β7 es un marcador que se expresa en las células T activadas en los nódulos linfáticos asociados al intestino y que media la migración de los linfocitos T a la mucosa intestinal mediante la unión a su ligando, la Molécula de Adhesión Celular Adresina de la Mucosa 1 (MAdCAM-1+), expresado en las células endoteliales del tracto gastrointestinal (28). HLA-DR es el receptor del complejo mayor de histocompatibilidad clase II (MHC-II) que se expresa en células T activadas. CD69 es el marcador de superficie celular expresado en una activación de células T reciente. CD25 es la cadena del receptor de la IL-2, que es un indicador de la activación celular. CD62 es el ligando que se expresa en las células vírgenes que circulan alrededor de los nódulos linfáticos (39).
Existen niveles normales de linfocitos totales, linfocitos T, linfocitos T CD4+ y linfocitos T CD8+ en la circulación periférica de los pacientes con SII (15,28,39) y niveles de células T citotóxicas, T colaboradoras y células B en parámetros normales tras la ingesta (25). Sin embargo, al estudiar los marcadores de los linfocitos T, se ha observado que existe una mayor frecuencia de células T CD4+ y CD8+ en sangre periférica que expresan la integrina β7 (28) que, además, coexpresan HLA-DR. También se describe un aumento de células T que expresan el marcador CD69, pero no de aquellas que expresan CD25 ni CD62L (39).
También se ha encontrado un aumento en los niveles de CD3+CD45RA+CD45R0+ en pacientes en los que la enfermedad había aparecido de forma aguda, con niveles normales en el resto de marcadores estudiados (31, 38,39).
Aparece una correlación negativa moderada entre la frecuencia de células T con elevada expresión de CD25 (cadena α del receptor de la IL-2, indicador de la activación celular) y la insatisfacción en el hábito intestinal y la severidad de los síntomas, lo que conduce a pensar que los pacientes con síntomas más severos tienen una mayor frecuencia de células T que expresan CD25 (39).
2. Linfocitos en el intestino: Se ha encontrado un número de linfocitos intraepiteliales (linfocitos IE) elevado en el colon ascendente, transverso, descendente y en el recto de pacientes con SII, en pacientes menores de 35 años con SII con histología normal -tanto con predominio de diarrea como en la forma alternante- y en los pacientes que tenían una historia de la enfermedad de más de 5 años (19). También se han detectado en mayor número en el recto de los pacientes con SII post disentérico (18) y en el yeyuno de pacientes con SII-D (30). Sin embargo, Dunlop y cols. no encuentran diferencias en el número de linfocitos IE en el recto entre pacientes con SII-PI y SII-no PI y la población sana (21,22), y los niveles de linfocitos IE en el duodeno de pacientes con SII-D eran normales (32). Tampoco se ha objetivado disminución de los linfocitos IE al administrar prednisolona o placebo (22).
En la lámina propia (LP) no se encontraron diferencias en la infiltración de linfocitos en el ciego, colon ascendente, colon descendente ni en el recto (17). Sin embargo, Piche y cols. (35) encuentran niveles de linfocitos de la LP elevados en el ciego de los pacientes con SII.
Asimismo, se ha encontrado un número mayor de linfocitos T en la LP del recto tanto en pacientes con SII-PI como en SII-no PI (21,22). Lee y cols. (36) encontraron dicho aumento de linfocitos T en el recto de los pacientes con SII-PI pero no en aquellos con SII-no PI. Al comparar el grupo de pacientes con SII-PI con un GC de individuos que tres meses antes habían tenido una infección por campylobacter, y que no habían desarrollado los síntomas del SII, no se encontraron diferencias en el número de linfocitos T en la LP del recto (22).
En los pacientes con SII-PI se encontró una disminución en el número de linfocitos en la LP del recto tras la administración de un corticosteroide oral, aunque no resultó significativa respecto a la reducción presentada en el GC (14). Cuando se estimularon policlonalmente las células T del colon se encontró una proliferación menor de linfocitos T de la LP en el grupo con SII, frente al GC, en el colon ascendente pero no en el sigmoide (39).
Se ha descrito un aumento de células CD3+ y CD25+ en la LP del colon ascendente, transverso, descendente y del recto en pacientes con SII, independientemente de si presentan o no algún grado de inflamación microscópica (19,37), así como un aumento de células CD4+ y CD8+ en la LP del colon descendente (37) y de CD8+ en el colon ascendente, pero no en el sigmoide (28). Otros estudios, por el contrario, no han encontrado dicho aumento de células T CD4+ ni CD4+CD25+ en la LP del colon ascendente ni del sigmoide en pacientes con SII, en ninguno de los subgrupos de estos pacientes (28,31). Sin embargo, destaca el hecho de que se ha encontrado una subpoblación de más del 40% de pacientes con SII con una frecuencia igual o superior al 38% de células T CD4+ de la LP, siendo este el mayor ratio encontrado respecto al GC (28).
Los pacientes en los que los síntomas se instauraron de forma gradual tenían más células CD25+ que aquellos en los que la instauración fue aguda. Por otro lado, el número de células CD3+ fue mayor en los pacientes con SII con histología normal y en aquellos con predominio de diarrea o forma alternante que en los que tenían estreñimiento (19).
Los pacientes con SII tenían frecuencias similares de células T CD4+ y CD8+ que expresaban la integrina β7 en la LP que el GC. Los niveles de la MAdCAM-1+ en el colon ascendente y sigmoide fueron mayores en el grupo de pacientes con SII, aunque en el colon sigmoide las diferencias con el GC no fueran significativas (28).
Todos estos resultados, junto con el aumento de células T sanguíneas que expresan la integrina β7, parecen indicar que los pacientes con SII tienen una frecuencia aumentada de células T circulantes destinadas a migrar al intestino (28).
La mayoría (70-99%) de todas las células T aisladas en la mucosa del colon ascendente y sigmoide tenían un fenotipo de memoria CD45RA-, mientras que la distribución de las células vírgenes colónicas (CD45RA+) en los pacientes con SII no difería respecto a los sujetos sanos (28).
Otros estudios (34) encuentran niveles elevados de células CD3 y normales de células CD4 en estos pacientes.
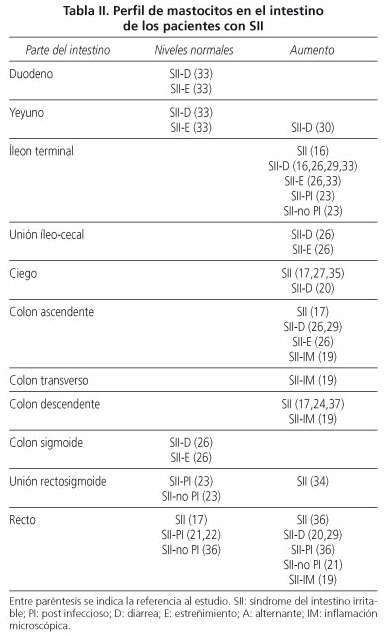
Mastocitos en el intestino
En la tabla II se describe el perfil de mastocitos (MC) en el intestino hallado en los pacientes con SII.
En el grupo de pacientes con SII-D, el número de MC en el íleon terminal, colon ascendente y recto fue mayor en el grupo sin hipersensibilidad rectal que en el grupo con hipersensibilidad rectal (29).
En los pacientes con SII se ha observado un aumento de la densidad de fibras nerviosas y de MC -en número y actividad- que rodean a aquéllas. Además, en el subgrupo SII-D, la tasa de activación de dichas células es mayor en la vecindad inmediata de los nervios entéricos que lejos de ellos, sin observarse estas diferencias en el GC. La tasa de degranulación de MC también fue superior.
En este mismo orden de cosas, se encontró una correlación positiva entre la tasa de degranulación de los MC y la proximidad de aquellos a los nervios, y entre la vecindad de los MC a los nervios y la severidad y frecuencia de dolor o disconfort abdominales (20,23,24).
Conclusiones de los autores
Esta revisión proporciona una visión de conjunto de los niveles de linfocitos y MC en los pacientes con SII.
El hecho de que el SII sea un TFD hace difícil establecer un criterio diagnóstico claro. Los estudios revisados han empleado distintos criterios para elegir su población diana, lo que puede explicar las diferencias halladas en los resultados de los mismos (los criterios Roma II son más amplios e incluyen a pacientes que los Roma I o III excluirían). Otro factor que podría explicar estas diferencias es el empleo de distintas técnicas de laboratorio para la medición de los niveles celulares.
En general, los tamaños muestrales no son grandes y los estudios tampoco realizan el cálculo del tamaño muestral siguiendo criterios estadísticos, lo que no permite llegar a una generalización de los resultados a la población general. Esto también es extensivo a la extrapolación de los resultados en los distintos subgrupos de pacientes con SII (D, E, A, PI, no PI).
El SII es una patología en la que, clásicamente, parecía existir una motilidad y sensibilidad visceral intestinal alteradas, aparentemente sin ninguna alteración orgánica. En la endoscopia, la mucosa intestinal es normal, sin alteraciones macroscópicas. No obstante, parece ser que hay factores celulares que hacen pensar en que existe una "inflamación intestinal de bajo grado" en esta patología.
Además, se añaden otros elementos como la comunicación del intestino con el sistema nervioso, el aumento de la permeabilidad intestinal y los cambios en la microbiota que aparecen en estos pacientes. En todos estos aspectos influye el elevado número de linfocitos T y de MC encontrados en los pacientes con SII.
Los resultados de los estudios demuestran un reclutamiento de linfocitos T hacia el intestino, que viene determinado por un aumento de la expresión de la integrina b7 en los linfocitos T activados sanguíneos y de la molécula MAdCAM-1 en el colon. Esto se corresponde con el hecho de que, a nivel intestinal, presentan niveles elevados de linfocitos T, tanto CD4+ como CD8+. La mayoría (70-99%) de todas las células T aisladas en la mucosa del colon tienen un fenotipo CD4+CD45RA- (memoria inmunológica).
Los resultados de la variación en el número de linfocitos y MC intestinales determinan que existe un área geográfica de máxima alteración de aquellos entre el íleon terminal y colon descendente, si bien ello no quiere decir que el resto de regiones del intestino no puedan presentar también alteraciones en estos niveles celulares.
Por otro lado, en estos pacientes también se describe un aumento de linfocitos IE en la zona comprendida entre el yeyuno y el colon descendente.
El estudio de los linfocitos LP no permite establecer un patrón de comportamiento particular de estas células en los pacientes con SII. Si bien se observa una alteración de estos linfocitos, no se puede definir claramente el tipo de aquellos, en qué zona del intestino se produce ni establecer una generalización. Se ha sugerido que las alteraciones de los niveles de estos linfocitos podrían conducir a mantener una actividad proinflamatoria subyacente.
Los MC se distribuyen, en elevado número, pegados a las terminaciones nerviosas de la mucosa intestinal en los pacientes con SII. Cuando se produce inflamación, aumenta el número de aquellas y su proximidad a las terminaciones nerviosas, haciéndose casi sináptica.
Es necesario continuar profundizando en las alteraciones celulares encontradas, realizando estudios prospectivos bien diseñados, planificados y dirigidos con este fin. Solo así se podrá llegar a conocer el grado de implicación del sistema inmune en la fisiopatología de esta enfermedad, tan frecuente como desconocida en nuestro medio.
 Dirección para correspondencia:
Dirección para correspondencia:
María Ortiz Lucas.
Medicina Preventiva.
Facultad de Medicina – Aulario B.
C/ DomingoMiral s/n.
E-mail:
mariaortizlucas@gmail.com
Recibido: 22-02-10.
Aceptado: 07-04-10.
Bibliografía
1. Thompson WG, Dotevall G, Drossman DA, Heaton KW, Kruis W. Irritable bowel syndrome: guidelines for the diagnosis. Gastroenterol Int 1989; 2 (2): 92-5. [ Links ]
2. Camilleri M, Heading RC, Thompson WG. Consensus report: Clinical perspectives, mechanisms, diagnosis and management of irritable bowel syndrome. Aliment Pharmacol Ther 2002; 16(8): 1407-30. [ Links ]
3. Morris-Yates A, Talley NJ, Boyce PM, Nandurkar S, Andrews G. Evidence of a genetic contribution to functional bowel disorder. Am J Gastroenterol 1998; 93 (8): 1311-7. [ Links ]
4. Zárate N, Mearin F. Síndrome del intestino irritable: Alteraciones motoras y correlación clínica. Med Clin (Barc) -Monografía- 2003; 4: 19-23. [ Links ]
5. Rey E, Díaz-Rubio M. Alteraciones de la sensibilidad visceral en el síndrome del intestino irritable. Med Clin (Barc) -Monografía- 2003; 4: 24-6. [ Links ]
6. Spiller RC. Postinfectious irritable bowel syndrome. Gastroenterology 2003; 124(6): 1662-71. [ Links ]
7. Barbara G, De Giorgio R, Stanghellini V, Cremon C, Salvioli B, Corinaldesi R. New pathophysiological mechanisms in irritable bowel syndrome. Aliment Pharmacol Ther 2004; 20(Suppl 2): 1-9. [ Links ]
8. Talley NJ, Helgesen S, Zinsmeister AR. Are sexual and physical abuse linked to functional gastrointestinal disorders? Gastroenterology 1992; 102: 52. [ Links ]
9. Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol 2000; 95(12): 3503-6. [ Links ]
10. Arebi N, Gurmany S, Bullas D, Hobson A, Stagg A, Kamm M. Review article: The psychoneuroimmunology of irritable bowel syndrome - an exploration of interactions between psychological, neurological and immunological observations. Aliment Pharmacol Ther 2008; 28(7): 830-40. [ Links ]
11. Ramos Linares V, Rivero Burón R, Piqueras Rodríguez JA, García López LJ, Oblitas Guadalupe LA. Psiconeuroinmunología: conexiones entre sistema nervioso y sistema inmune. Suma Psicológica 2008; 15 (1): 115-42. [ Links ]
12. Clarke M, Oxman AD, editores. Formulating the problem. Manual del Revisor Cochrane 4.1.6 [actualización enero 2003]. Section 4. En: The Cochrane Library, Número 1, 2003. Oxford: Update Software. Actualizado trimestralmente. [ Links ]
13. Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.1. [updated September 2008]. The Cochrane Collaboration, 2008. Available from www.cochrane-handbook.org. [ Links ]
14. Dunlop SP, Jenkins D, Neal KR, Naesdal J, Borgaonker M, Collins SM, et al. Randomized, double-blind, placebo-controlled trial of prednisolone in post-infectious irritable bowel syndrome. Aliment Pharmacol Ther 2003; 18 (1): 77-84. [ Links ]
15. Swiatkowski M, Rybakowski JK. Depression and T lymphocytes in patients with irritable bowel syndrome. J Affect Disord 1993; 28 (3): 199-202. [ Links ]
16. Weston AP, Biddle WL, Bhatia PS, Miner PB Jr. Terminal ileal mucosal mast cells in irritable bowel syndrome. Dig Dis Sci 1993; 38 (9): 1590-5. [ Links ]
17. O'Sullivan M, Clayton N, Breslin NP, Harman I, Bountra C, McLaren A, et al. Increased mast cells in the irritable bowel syndrome. Neurogastroenterol Motil 2000; 12 (5): 449-57. [ Links ]
18. Spiller RC, Jenkins D, Thornley JP, Hebden JM, Wright T, Skinner M, et al. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut 2000; 47 (6): 804-11. [ Links ]
19. Chadwick VS, Chen W, Shu D, Paulus B, Bethwaite P, Tie A, et al. Activation of the mucosal immune system in irritable bowel syndrome. Gastroenterology 2002; 122 (7): 1778-83. [ Links ]
20. Park CH, Joo YE, Choi SK, Rew JS, Kim SJ, Lee MC. Activated mast cells infiltrate in close proximity to enteric nerves in diarrhea-predominant irritable bowel syndrome. J Korean Med Sci 2003; 18 (2): 204-10. [ Links ]
21. Dunlop SP, Jenkins D, Spiller RC. Distinctive clinical, psychological, and histological features of postinfective irritable bowel syndrome. Am J Gastroenterol 2003; 98 (7): 1578-83. [ Links ]
22. Dunlop SP, Jenkins D, Neal KR, Spiller RC. Relative importance of enterochromaffin cell hyperplasia, anxiety, and depression in postinfectious IBS. Gastroenterology 2003; 125 (6): 1651-9. [ Links ]
23. Wang LH, Fang XC, Pan GZ. Bacillary dysentery as a causative factor of irritable bowel syndrome and its pathogenesis. Gut 2004; 53 (8): 1096-101. [ Links ]
24. Barbara G, Stanghellini V, De Giorgio R, Cremon C, Cottrell GS, Santini D, et al. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome. Gastroenterology 2004; 126 (3): 693-702. [ Links ]
25. Elsenbruch S, Holtmann G, Oezcan D, Lysson A, Janssen O, Goebel MU, et al. Are there alterations of neuroendocrine and cellular immune responses to nutrients in women with irritable bowel syndrome? Am J Gastroenterol 2004; 99 (4): 703-10. [ Links ]
26. Dong WZ, Zou DW, Li ZS, Zou XP, Zhu AY, Xu GM, et al. Study of visceral hypersensitivity in irritable bowel syndrome. Chin J Dig Dis 2004; 5 (3): 103-9. [ Links ]
27. Tunc B, Filik L, Altintas E, Turhan N, Ulker A, Dagli U. Mucosal mast cells in irritable bowel syndrome and inflammatory bowel disease. Acta Medica (Hradec Kralove) 2005; 48 (3-4): 163-4. [ Links ]
28. Öhman L, Isaksson S, Lundgren A, Simrén M, Sjövall H. A controlled study of colonic immune activity and beta7+ blood T lymphocytes in patients with irritable bowel syndrome. Clin Gastroenterol Hepatol 2005; 3 (10): 980-6. [ Links ]
29. Park JH, Rhee PL, Kim HS, Lee JH, Kim YH, Kim JJ, et al. Mucosal mast cell counts correlate with visceral hypersensitivity in patients with diarrhea predominant irritable bowel syndrome. J Gastroenterol Hepatol 2006; 21 (1 Pt 1): 71-8. [ Links ]
30. Guilarte M, Santos J, de Torres I, Alonso C, Vicario M, Ramos L, et al. Diarrhoea-predominant IBS patients show mast cell activation and hyperplasia in the jejunum. Gut 2007; 56 (2): 203-9. [ Links ]
31. Holmén N, Isaksson S, Simrén M, Sjövall H, Öhman L. CD4+CD25+ regulatory T cells in irritable bowel syndrome patients. Neurogastroenterol Motil 2007; 19 (2): 119-25. [ Links ]
32. Remes-Troche JM, Adames K, Castillo-Rodal AI, Ramírez T, Barreto-Zuñiga R, López-Vidal Y, et al. Intraepithelial gammadelta+ lymphocytes: a comparative study between celiac disease, small intestinal bacterial overgrowth, and irritable bowel syndrome. J Clin Gastroenterol 2007; 41 (7): 671-6. [ Links ]
33. Wang SH, Dong L, Luo JY, Gong J, Li L, Lu XL, et al. Decreased expression of serotonin in the jejunum and increased numbers of mast cells in the terminal ileum in patients with irritable bowel syndrome. World J Gastroenterol 2007; 13 (45): 6041-7. [ Links ]
34. Akbar A, Yiangou Y, Facer P, Walters JR, Anand P, Ghosh S. Increased capsaicin receptor TRPV1-expressing sensory fibres in irritable bowel syndrome and their correlation with abdominal pain. Gut 2008; 57 (7): 923-9. [ Links ]
35. Piche T, Saint-Paul MC, Dainese R, Marine-Barjoan E, Iannelli A, Montoya ML, et al. Mast cells and cellularity of the colonic mucosa correlated with fatigue and depression in irritable bowel syndrome. Gut 2008; 57 (4): 468-73. [ Links ]
36. Lee KJ, Kim YB, Kim JH, Kwon HC, Kim DK, Cho SW. The alteration of enterochromaffin cell, mast cell, and lamina propia T lymphocyte numbers in irritable bowel syndrome and its relationship with psychological factors. J Gastroenterol Hepatol 2008; 23 (11): 1689-94. [ Links ]
37. Cremon C, Gargano L, Morselli-Labate AM, Santini D, Cogliandro RF, De Giorgio R, et al. Mucosal immune activation in irritable bowel syndrome: gender-dependence and association with digestive symptoms. Am J Gastroenterol 2009; 104 (2): 392-400. [ Links ]
38. Kindt S, Van Oudenhove L, Broekaert D, Kasran A, Ceuppens JL, Bossuyt X, et al. Immune dysfunction in patients with functional gastrointestinal disorders. Neurogastroenterol Motil 2009; 21 (4): 389-98. [ Links ]
39. Öhman L, Isaksson S, Lindmark AC, Posserud I, Stotzer PO, Strid H, et al. T-cell activation in patients with irritable bowel syndrome. Am J Gastroenterol 2009; 104 (5): 1205-12. [ Links ]
40. Elenkov IJ, Chrousos GP. Stress Hormones, Th1/Th2 patterns, Pro/Anti-inflammatory Cytokines and Susceptibility to Disease. Trends in Endocrinology and Metabolism 1999; 10 (9):359-68. [ Links ]
41. Vives Puiggròs J, Gallart T, Algarra López de Diego I, Blanca Gómez M, Fresno Escudero M, Garrido Torres-Puchol F, et al. Inmunología. En: Rozman C, Cardellach F. Medicina Interna. 16a edición. Barcelona; 2008. [ Links ]











 text in
text in