My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.104 n.3 Madrid Mar. 2012
https://dx.doi.org/10.4321/S1130-01082012000300005
Tumores del estroma gastrointestinal (GISTs): patrón de tinción tipo Golgi de CD 117 Y PDGFRA en el reconocimiento del estado mutacional
Gastrointestinal stromal tumors (GISTs): role of CD 117 and PDGFRA Golgi-like staining pattern in the recognition of mutational status
Sara Jaramillo1, María José Ríos-Moreno1, Alicia Hernández2, Joaquín Amérigo3, Inmaculada Trigo-Sánchez1 y Ricardo González-Cámpora1
Servicio de Anatomía Patológica. 1Hospital Universitario Virgen Macarena. Sevilla. 2Hospital Infanta Cristina. Badajoz. 3Hospital Torrecárdenas. Almería
Esta investigación fue financiada por una subvención de Novartis, España.
Dirección para correspondencia
RESUMEN
Objetivo: determinar si las posibles correlaciones entre CD117 y PDGFRA podrían servir como una indicación de terapias dirigidas.
Material y métodos: la expresión inmunohistoquímica de CD117 y PDGFRA se evaluó en 99 GIST incluidos en parafina en conjunción con el estado mutacional de KIT y PDGFRA
Resultados: se observó tinción CD117-positivo en 93 de los 99 casos. El patrón de tinción predominante fue citoplasmático o de membrana; en el 44,5% de los casos, se evidencio patrón de tipo Golgi. Se encontraron correlaciones entre la mutación KIT tanto con la expresión de CD117 (p = 0,006) y con el patrón tipo Golgi (p = 0,026). Se detectó tinción citoplasmática PDGFRA-positiva en el 87% de los casos, con y sin acentuación de membrana, en el 8% se observó patrón de tinción tipo Golgi. Se observó una correlación significativa entre las mutaciones PDGFRA y el patrón de tinción tipo Golgi (p = 0,001). Por otra parte, el 95% de los GIST PDGFRA positivos también fueron CD117-positivo, lo que sugiere que la expresión de los dos marcadores no se excluyen mutuamente, la mayoría de ellos tenían mutaciones en el exón 11 de KIT. Los tumores PDGFRA-positivo/CD117-negativo tenían mutaciones en PDGFRA, principalmente en el exón 18. Se observó tinción PDGFRA-negativo/CD117-negativo en el 15% de los casos, todos los cuales revelaban mutaciones en el exón 11 de KIT. Los casos CD117-positivo/PDGFRA-negativo casos se caracteriza por mutaciones en KIT, principalmente en el exón 11.
Conclusiones: las tinciones CD117 y PDGFRA no son excluyentes, y la presencia de un patrón de tinción de Golgi, aunque no es patognomónica, es altamente sugestiva de GIST mutado en KIT y PDGFRA, respectivamente, y se puede utilizar con algunas reservas, como una indicación alternativa para la prescripción de terapias dirigidas.
Palabras clave: Tumores del estroma gastrointestinal. GISTs. CD117. PDGFRA. Estado mutacional. Patrón tipo Golgi.
ABSTRACT
Aims: determine whether potential correlations between CD117 to and PDGFRA might serve as an indication for targeted therapies.
Material and methods: immunohistochemical expression of CD117 and PDGFRA was evaluated in 99 paraffin-embedded GISTs in conjunction with KIT and PDGFRA mutational status.
Results: CD117-positive staining was noted in 93 out of 99 cases. The predominant staining pattern was cytoplasmic, either with or without membrane accentuation; in 44.5% of cases, a clear Golgi-like pattern was evident. Correlations were found be-tween KIT mutation and both CD117 expression (p = 0.006) and Golgi-like pattern (p = 0.026). Cytoplasmic PDGFRA-positive staining was detected in 87% of cases, both with and without membrane accentuation; in 8% cases an evident Golgi-like staining pattern was observed. A significant correlation was noted between PDGFRA mutations and Golgi-like staining pattern (p = 0.001). Moreover, 95% of PDGFRA-positive GISTs were also CD117-positive, suggesting that expression of the two markers is not mutually exclusive; most of these had mutations in KIT exon 11. PDGFRA-positive/CD117-negative tumors had mutations in PDGFRA, mainly in exon 18. PDGFRA-negative/CD117-negative staining was observed in 15% of cases, all of which displayed mutations in KIT exon 11. CD117-positive/PDGFRA-negative cases were characterized by mutations in KIT, mainly in exon 11.
Conclusions: CD117 and PDGFRA staining are not exclusive, and the presence of a Golgi-like staining pattern for either, whilst not pathognomonic, is highly suggestive of KIT and PDGFRA mutated GISTs, respectively, and may be used with some reservations as an alternative indication for prescribing targeted therapies.
Key words: Gastrointestinal stromal tumors. GISTs, CD117. PDGFRA. Mutational status. Golgi-like staining pattern.
Introducción
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales del tracto gastrointestinal que se diferencian en células intersticiales de Cajal o sus precursores, generalmente son KIT (CD117)-positivos, y muestran mutaciones en los genes KIT o PDGFRA (1,2). Muy ocasionalmente presentan mutaciones en otros genes, incluyendo a BRAF (3) y SDHB (4). Estos tumores recientemente han despertado un interés particular debido a su buena respuesta a las nuevas terapias dirigidas (5,6).
La expresión inmunohistoquímica de CD117 ha sido considerada como uno de los marcadores más sensibles para el diagnóstico de los GIST tanto mutantes y de tipo salvaje (2,7), pero poco se sabe acerca de su papel en la predicción de estado mutacional (8-10). La tinción PDGFRA, por el contrario, es a menudo considerada como no específicas, en todas partes y deficientes técnicamente, sin ningún papel en el diagnóstico de GIST (7,9,11,12). Sin embargo, estudios recientes han demostrado que un patrón de tinción de Golgi tipo, ya sea para CD117 o PDGFRA pueden ser predictivos del estado mutacional (7-9,11,12).
En este estudio, se evaluó la expresión inmunohistoquímica de CD117 y PDGFRA en 99 GIST incluidos en parafina, en relación con el estado mutacional de KIT PDGFRA, con el fin de determinar si las posibles correlaciones entre los dos podría servir como una indicación de terapias dirigidas.
Material y métodos
Selección de pacientes y las características clínicas
Las muestras representativas fueron seleccionados de un conjunto de quirúrgicos obtenidos a partir de 99 GIST especímenes fijados en formol e incluidos en parafina. Las muestras procedían de pacientes sometidos a cirugía en el Hospital Universitario Virgen Macarena (Sevilla) y Hospital Torrecárdenas (Almería) durante un período de 20 años (1989-2009). La recogida de muestras tumorales fue aprobada por los Comités Éticos de ambos hospitales. Las muestras teñidas con hematoxilina-eosina fueron revisadas y el diagnóstico patológico fue confirmado por la localización del tumor, la morfología, la inmunotinción para CD117 y el análisis molecular de KIT / PDGFRA estado. Se construyeron microarrays de tejidos (TMA) con una TMADesigner® versión 1.1 manual de tejido arrayer (Alphelys, Plaisir, Francia), se tomaron cinco núcleos de 0,6 mm de cada muestra de parafina.
Se accedió a los siguientes datos clínicos y patológicos: edad y sexo, localización del tumor (estómago, intestino grueso y delgado, extragastrointestinal), tamaño tumoral, tipo histológico (fusiforme, epitelioide, mixto), e índice mitótico en 50HPF.
Análisis inmunohistoquímico
Para el análisis inmunohistoquímico, secciones de 5 m seriadas se tiñeron con un panel de anticuerpos: CD117 (diagnóstico Biosystem, CA; prediluited), PDGFRA (Santa Cruz Biotechnology, EE. UU., dilución 1:100) utilizando la técnica de estreptavidina-biotina-peroxidasa. Se incluyeron en cada serie de portas controles negativos (se sustituyó el anticuerpo primario por suero normal de caballo) y controles positivos (secciones de un cáncer de mama humano). Todos los controles dieron resultados satisfactorios. Las muestras con inmunotinción difusa o focal se consideraron positivas. Los tumores con < 5% de células positivas se consideraron negativos. La tinción para anticuerpos individuales se clasificó como positivo o negativo.
Aislamiento de ADN y el análisis molecular
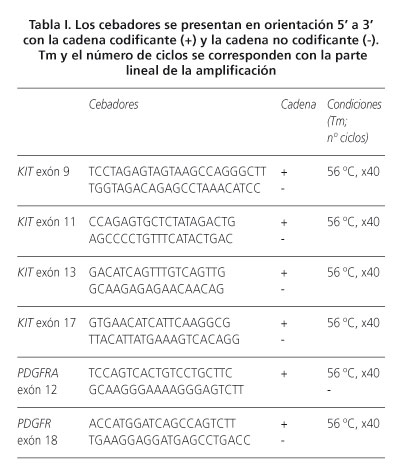
Se eligió un bloque de parafina para el análisis molecular del ADN que fue aislado utilizando el kit de ADN QIAmp FFPE Tissue de acuerdo con las indicaciones del fabricante (Quiagen, Hilden, Alemania). Se amplificaron los exones 9, 11, 13 y 17 de KIT y los exones 12 y 18 de PDGFRA por reacción en cadena de la polimerasa (PCR). La reacción de PCR se llevó a cabo utilizando una Taq PCR Master Mix (Quiagen, Hilden, Alemania), incluyendo 0,1-1 µg de ADN extraído y 0,2 µm de cebadores para un volumen total de 30 µl. Los cebadores y las condiciones experimentales se muestran en la tabla I. Los productos de PCR fueron examinados utilizando el kit QuiAXcel DNA High Resolution (Quiagen, Hilden, Alemania) y la secuenciación se realizó con un analizador automático (ABI PRISM 3130xl Genetic Analyzer, Applied Biosystems, EE. UU.). Los resultados de secuenciación de KIT y PDGFRA se compararon con las secuencias de genes en el NCBI genebank.
El análisis estadístico
Los datos clínicos e inmunohistoquímico fueron analizados utilizando el programa SPSS para Windows, versión 17.0 del paquete de software (SPSS Inc., Chicago, IL, EE. UU.). Se utilizo el test Chi-cuadrado para analizar las asociaciones entre variables. Se considero significación estadística para p menor de 0,05.
Resultados
Características clínicas y estado mutacional
Todos los tumores muestran características clínicas/patológicas consistentes con GIST, y expresaban CD117 y/o albergaban mutaciones KIT / PDGFRA. La edad media era 64 años (rango: 13-87), y las muestras procedían de 51 (51,5%) hombres y 48 (48,5%) mujeres. Cuarenta y ocho 48,5%) tumores se originaron en el estómago, 36 (36,1%) en el intestino delgado, 7 (7,2%) en el intestino grueso y 8 (8,2%) en lugares extragastrointestinales en el mesenterio y el epiplón. El diámetro medio tumoral fue de 7,65 cm (rango 1,0-25 cm). El diámetro del tumor presentó un tamaño menor de 2 cm en 60 (60,6%) de los casos, entre 2 y 5 cm en 31 casos (30,9%) (31,3%), entre 5 y 10 cm en 6 casos (6,1%) y más de 10 cm en 2 casos (2,1%). Histológicamente, el 78 (79,2%) fueron neoplasias de tipo fusiforme, 15 (15,1%) de tipo epitelioide y 5 (5,1%) mostraron citomorfología mixta. El índice de mitosis por 50CGA fue de 1 a 60 en 50 campos de alta potencia (50HPF): 54 muestras (55%) muestra < 2; 17 (17%) entre 2 y 5, y 28 (28%) > 5.
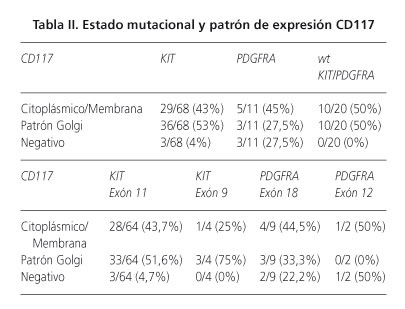
El análisis molecular reveló mutación en KIT en 68/99 (69%) de los casos, mutación en PDGFRA en 11/99 (11%) y de tipo salvaje-wild type (wt) KIT / PDGFRA en 20/99 (20%). Entre los casos con la mutación KIT, 64/68 (94%) tenían mutaciones en el exón 11 y 4/68 (6%) en el exón 9. Ningún caso presentó mutación en el exón 13 y 17. Entre los casos con mutación PDGFRA, 11/09 (82%) tenían mutaciones en el exón 18 y 2/11 (18%) en el 12. Todos los casos CD117 negativos tenían mutación en KIT (3, exón 11) o PDGFRA (2, exón 18, 1, exón 12).
Análisis inmunohistoquímico de CD117 y PDGFRA
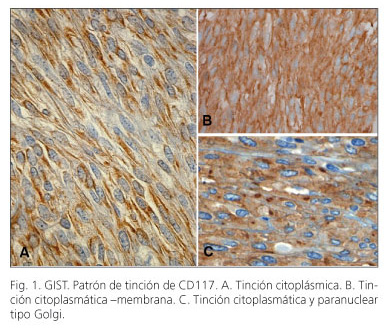
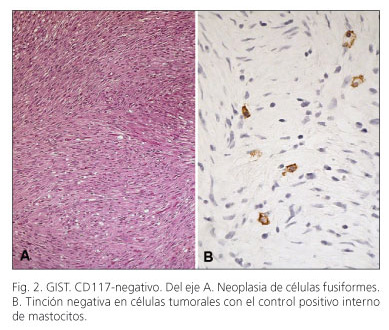
Un total de 93 de los 99 casos estudiados (94%) fueron positivos para CD117. La distribución fue la siguiente: el estómago, 43/48 (89,6%), intestino delgado, 35/36 (97,2%), intestino grueso 7,7 (100%), extragastrointestinal 8,8 (100%). La tinción fue difusa en su mayoría, pero ocasionalmente se observó tinción focal. El patrón de tinción fue predominantemente citoplasmático o de membrana, en 49/99 (49,5%) de los casos, se evidenció un citoplasma punteado o patrón de tinción tipo Golgi (Fig. 1). Los patrones de tinción de CD117 en función del estado mutacional se muestran en la tabla II. Se observó una clara correlación entre la mutación KIT tanto con la expresión de CD117 (p = 0,006) y con el patrón de Golgi de tipo (p = 0,026) (Tabla II. Fig. 2A). Aunque la mayoría de los tumores con un patrón de Golgi presentaban mutaciones en el exón 11, tres de los casos las presentaron en el exón 9 (Tabla II). De los seis casos con tinción negativa para CD117 (Fig. 2), 3 presentaban mutaciones en KIT y los otros 3 en PDGFRA (Tabla II).
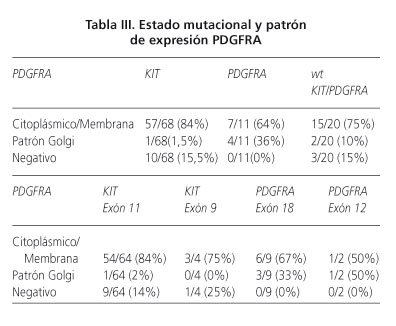
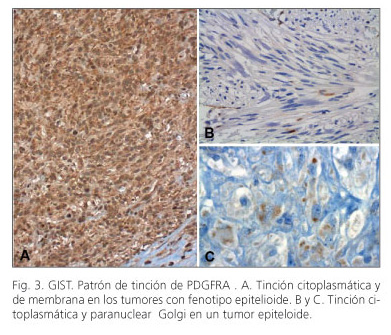
Ochenta y seis de los 99 casos (87%) se tiñeron positivamente para PDGFRA, con la siguiente distribución: el estómago 42/48 (87,5%), intestino delgado, 30/36 (83%), intestino grueso 7,7 (100%) y extragastrointestinal 07/08 (87,5%). La tinción fue principalmente difusa y citoplasmática o de membrana, en 7/86 (8%) de los casos se observó patrón de tinción tipo Golgi (Fig. 4). Aunque no se encontró correlación significativa entre la tinción citoplásmica difusa y el estado mutacional, hubo una correlación significativa entre las mutaciones PDGFRA y el patrón de tinción de Golgi de tipo (p = 0,001) (Tabla III). Ningún caso PDGFRA negativo tenía mutaciones en PDGFRA.
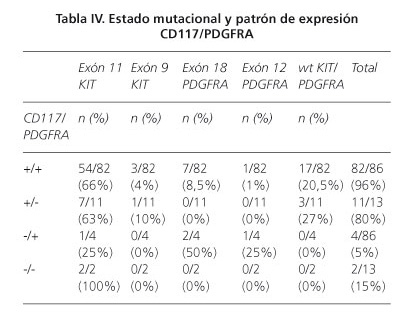
Curiosamente, el 95% de los GIST PDGFRA positivos también fueron CD117-positivo (82/86), lo que indica que la expresión de los dos marcadores no son mutuamente excluyentes (Tabla IV). La mayoría de los casos CD117-positive/PDGFRA-positive tenían mutaciones en KIT exón 11 (54/82, 66%), aunque la correlación no fue estadísticamente significativa. La mitad de los tumores PDGFRA positivo/negativo-CD117 (4/86) tenían mutaciones en PDGFRA, principalmente en el exón 18 (2/4). Todos los tumores PDGFRA-negativo/CD117-negativo (2/2) tenían mutaciones del exón 11 de KIT. Por último, CD117-positive/PDGFRA-negative tenían mutaciones KIT (8/11), principalmente en el exón 11 (64%) (Tabla IV).
Discusión
El término "stromal tumors" fue introducido en la literatura por Clark y Mazur, en 1983 (13), para denominar a un subgrupo de tumores mesenquimales gástricos que no presentaban diferenciación muscular ni Schwanniana; posteriormente el término se hizo extensivo para todos los tumores con semejantes características en todo el tubo digestivo y comenzó a utilizarse el acrónimo GIST (14). El interés actual por estos tumores radica en la respuesta favorable que presentan a la terapia con inhibidores de quinasas (15). Aunque es bien sabido que la respuesta clínica al imatinib está en función del estado mutacional (6,16-19), habitualmente el diagnóstico se realiza mediante el estudio histológico convencional complementado la técnica de inmunohistoquímica para la demostración del receptor KIT mediante el anticuerpo CD117 (2), ya que existen neoplasias no relacionadas con fenotipos o genotipos semejantes (20,21). En la pared del tubo digestivo normal solo se advierte inmunoreacción positiva al anticuerpo CD117 en las células intersticiales de Cajal y en ocasional mastocitos distribuidos por todo el espesor de la pared (2). En los GISTs la positividad puede ser difusa, parcheada o focal y la tasa de negatividad al CD117 se encuentra entre el 2,2-18% en función de las características de la series estudiadas (11,12,22-24). La tinción inmunohistoquímica al CD117 suele ser fácilmente valorable y puede presentar un patrón citoplásmico con/sin acentuación de la membrana o Golgi-like (20). Especial interés ha despertado en los últimos años el patrón Golgi-like puesto que se ha señalado que podría estar en relación con la acumulación de moléculas-KIT mutadas (21,25); de ahí haya sido considerado como un marcador de mutaciones en KIT y, por tanto, un indicador de tratamiento con imatinib (9-11). En nuestra serie, la tasa de positividad al CD117 fue del 94% (94/99), observándose el patrón de tinción Golgi-like en el 49,5% (49/99) de los casos. Aunque la mayoría de estos tumores presentaban mutaciones en KIT (73,0%) (36/49), también se observó en tumores wtKIT/PDGFRA (10/49) y con mutaciones en PDGFRA (3/49); por lo que no podemos mantener el carácter de exclusividad señalado por Miselli y cols. (9). Inicialmente, Emile y cols. (8) señalaron asociación significativa de este patrón con mutaciones en el exón 11 y con un estado de homocigosis pero estos hallazgos no han podido ser ratificados (8,9) En nuestra serie hemos encontrado asociación estadísticamente significativa del patrón Golgi-like con mutaciones en KIT pero sin exclusividad por el exón 11, ya que tres pacientes presentaban tumores con mutaciones en el exón 9 del KIT.
La existencia de tumores con morfología y clínica similar a la de los GISTs pero con inmunoreacción negativa al CD117 muestra las limitaciones de este anticuerpo como marcador universal de GISTs. Aunque una reacción negativa puede asociarse a expresión focal (biopsias pequeñas) o problemas técnicos (fijación, almacenamiento prolongado, errores técnicos), la biología molecular ha demostrado que también puede presentarse en tumores con mutaciones en KIT o PDGFRA desde su inicio o bien durante la progresión tumoral (26). Además, los GISTs congénitos, que son morfológicamente indistinguibles de los del adulto, característicamente son CD117-negativos (27,28); esto contrasta con lo que se observa en los GISTs pediátricos que mayoritariamente son CD117-positivos (3); por todo ello, es recomendable que en todos los casos de supuestos GIST, CD117-negativos, se realice estudio molecular. El primer estudio sobre GISTs CD117-negativos (29) puso en evidencia que la mayoría de estas neoplasias asentaban en estómago, mesenterio o epiplón, tenían fenotipo epitelioide y mostraban el siguiente perfil molecular: 72% tenían mutaciones en PDGFRA, 16% en KIT y 8% eran wt KIT/PDGFRA. En series más recientes, al ser menos selectivas, se advierte un aumento significativo de casos con mutaciones en KIT (30,31). En nuestro material, el 50% de los casos CD117-negativos expresaban mutaciones en KIT y el otro 50% en PDGFRA y casi todos (5/6) asentaban en el estómago.
En el tracto digestivo normal, la inmunoreacción positiva al PDGFRA muestra una distribución similar a la observada con la proteína S100, estando presente en células ganglionares, fibras nerviosas y células de Schwann (11). En los GISTs, el patrón tintorial del PDGFRA es variable pudiendo ser citoplásmico con/sin acentuación de la membrana o paranuclear (patrón Golgi-like) o una combinación ambos pero los resultados descritos en la literatura presentan cierto grado de discordancia. Rossi y cols. (12) han referido que la expresión de PDGFRA y de KIT son excluyentes y se presentan de acuerdo con las mutaciones en estos genes, mientras que Pauls y cols. (11), Peterson y cols. (31) y Miselli y cols. (9) han descrito que la tinción de PDGFRA es ubicua pero con ciertos matices. Según Pauls y cols. (11) el patrón tipo Golgi puede observarse tanto en tumores mutados (KIT o PDGFRA) como no mutados, pero es más común entre los mutados en PDGFRA, mientras que el patrón de tinción citoplásmico/membrana es ubicuo e independiente del estado mutacional. Misselli y cols. (9) sin embargo, han señalado que el patrón Golgi-like es exclusivo de los tumores con mutaciones en PDGFRA, mientras que el citoplásmico/membrana es el único que se observa en tumores con mutaciones en KIT o no mutados; además han indicado que los tumores con mutaciones en KIT la intensidad de tinción para PDGFRA es menor que en los mutados en PDGFRA (21 vs. 92%), mientras que la tinción para CD117 es más intensa que en los mutados en PDGFRA (78 vs. 12%); sin embargo, la tendencia a expresar ambos marcadores es más pronunciada en tumores con mutaciones en KIT que en PDGFRA. En nuestra serie hemos advertido esta tendencia a expresar ambos marcadores en los tumores KIT-mutados pero no hemos encontrado la exclusividad señalada por Miselli y cols. (8) del patrón Golgi-like por los tumores con mutaciones en PDGFRA aunque si hemos observado asociación estadísticamente significativa; por lo que nuestros resultados están más en línea de los aportados por Pauls y cols. (11).
Concluimos que las inmunotinciones al CD177 y PDGFRA no son excluyentes y que la presencia de tinción Golgi-like, tanto para CD117 como para PDGFRA, aunque no exclusivas, se asocian de modo significativo con mutaciones en los respectivos genes, por lo que podrían considerarse como muy sugestivas de cambios mutacionales. El uso de estos hallazgos como indicador de terapia dirigida debe hacerse con ciertas reservas, ya que hoy sabemos que determinadas mutaciones en KIT y PDGFRA no responden al imatinib (PDGFRA exon 18, Asp846Val; KIT exón 17, Asn822Lys) o lo hacen a dosis más elevadas (KIT, exón 9) (19).
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ricardo González-Cámpora.
Servicio de Anatomía Patológica.
Hospital Universitario Virgen Macarena.
Avda. Dr Fedriani s/n.
41009 Sevilla.
e-mail: rcampora@us.es
Recibido: 10-10-11.
Aceptado: 14-11-11.
Bibliografía
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors. Review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006;130:1466-78. [ Links ]
2. Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998;152:1259-69. [ Links ]
3. Agaram NP, Laquaglia MP, Ustun B, Guo T, Wong GC, Socci ND, et al. Molecular characterization of pediatric gastrointestinal stromal tumors. Clin Cancer Res 2008;14:3204-15. [ Links ]
4. Janeway KA, Kim SY, Lodish M, Nosé V, Rustin P, Gaal J, et al. Defects in succinate dehydrogenase in gastrointestinal stromal tumors lacking KIT and PDGFRA mutations. Proc Natl Acad Sci USA 2011;108:314-8. [ Links ]
5. Joensuu H, Roberts PJ, Sarlomo-Rikala M, Andersson LC, Tervahartiala P, Tuveson D, et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med 2001;344:1052-6. [ Links ]
6. Dematteo RP, Heinrich MC, El-Rifai WM, Demetri G. Clinical management of gastrointestinal stromal tumor: before and after STI-571. Hum Pathol 2002;33:466-77. [ Links ]
7. Díaz-Delgado M, Hernández-Amate A, Sánchez-León M, Pereira-Gallardo S, Prieto-Sánchez E, Jiménez-Sáenz M, et al. Multiple non-metastatic gastrointestinal stromal tumors. Differential features. Rev Esp Enferm Dig 2010;102:489-97. [ Links ]
8. Emile JF, Stock N, Corless CL, Sciot R, Schildhaus HU, Brahimi S, et al. Dotlike or Golgi-like KIT and PDGFRA staining in GIST. Am J Surg Pathol 2009;33:157-8. [ Links ]
9. Miselli F, Millefanti C, Conca E, Negri T, Piacenza C, Pierotti MA, et al. PDGFRA immunostaining can help in the diagnosis of gastrointestinal stromal tumors. Am J Surg Pathol 2008;32:738-43. [ Links ]
10. Negri T, Orsenigo, M, Conca E, et al. Dotlike or Golgi-like KIT and PDGFRA staining in GIST. Am J Surg Pathol 2009;33:158-9. [ Links ]
11. Pauls K, Merkelbach-Bruse S, Thal D, Büttner R, Wardelmann E. PDGFR alpha and c-kit-mutated gastrointestinal stromal tumours (GISTs) are characterized by distinctive histological and immunohistochemical features. Histopathology 2005;46:166-75. [ Links ]
12. Rossi G, Valli R, Bertolini F, Marchioni A, Cavazza A, Mucciarini C, et al. PDGFR expression in differential diagnosis between KIT-negative gastrointestinal stromal tumours and other primary soft-tissue tumours of the gastrointestinal tract. Histopathology 2005;46:522-31. [ Links ]
13. Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol 1983;7:507-19. [ Links ]
14. Markku M, Lasota J. Gastrointestinal stromal tumors: definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001;438:1-12. [ Links ]
15. Demetri GD. Differential properties of current tyrosine kinase inhibitors in gastrointestinal stromal tumors. Semin Oncol 2011;38(Supl. 1):S10-9. [ Links ]
16. Heinrich MC, Corless CL, Demetri GD, Blanke CD, von Mehren M, Joensuu H, et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncol 2003;21: 4342-9. [ Links ]
17. Debiec-Rychter M, Wasag B, Stul M, De Wever I, Van Oosterom A, Hagemeijer A, et al. Gastrointestinal stromal tumours (GISTs) negative for KIT (CD117 antigen) immunoreactivity. J Pathol 2004;202:430-8. [ Links ]
18. Debiec-Rychter M. Sunitinib -a new approach following failure of imatinib in patients with advanced gastrointestinal stromal tumor-. Nat Clin Pract Oncol 2007;4:342-3. [ Links ]
19. Lasota J, Miettinen M. Clinical significance of oncogenic KIT and PDGFRA mutations in gastrointestinal stromal tumours. Histopathology 2008;53:245-66. [ Links ]
20. Miettinen M, Sobin LH, Sarlomo-Rikala M. Immunohistochemical spectrum of GISTs at different sites and their differential diagnosis with a reference to CD117 (KIT). Mod Pathol 2000;13:1134-42. [ Links ]
21. Kirsch R, Gao Z-H, Riddell R. Gastrointestinal Stromal Tumors. Diagnostic challenges and practical approach to differential diagnosis. Adv Anat Pathol 2007;14:261-85. [ Links ]
22. Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998;279:577-80. [ Links ]
23. Wasag B, Debiec-Rychter M, Pauwels P, Stul M, Vranckx H, Oosterom AV, et al. Differential expression of KIT/PDGFRA mutant isoforms in epithelioid and mixed variants of gastrointestinal stromal tumors depends predominantly on the tumor site. Mod Pathol 2004;17:889-94. [ Links ]
24. Kang HJ, Nam SW, Kim H, Rhee H, Kim NG, Kim H, et al. Correlation of KIT and platelet-derived growth factor receptor alpha mutations with gene activation and expression profiles in gastrointestinal stromal tumors. Oncogene 2005;24:1066-74. [ Links ]
25. Corless CL, Heinrich MC. Molecular pathobiology of gastrointestinal stromal sarcomas. Annu. Rev Pathol Mech Dis 2008;3:557-86. [ Links ]
26. Pauwels P, Debiec-Rychter M, Stul M, De Wever I, Van Oosterom AT, Sciot R. Changing phenotype of gastrointestinal stromal tumours under imatinib mesylate treatment: a potential diagnostic pitfall. Histopathology 2005;58:41-7. [ Links ]
27. Bates AW, Feakins RM, Scheimberg I. Congenital gastrointestinal stromal tumors is indistinguishable from the adult form, but does not express CD117 and carries a favourable prognosis. Histopathology 2000;37: 316-22. [ Links ]
28. Geramizadeh B, Bahador A, Ganjei-Azar P, Asadi A. Neonatal gastrointestinal stromal tumor. Report of a case and review of literature J Pediatr Surg 2005;40:572-4. [ Links ]
29. Medeiros F, Corless CL, Duensing A, Hornick JL, Oliveira AM, Heinrich MC, et al. KIT-negative gastrointestinal stromal tumors proof of concept and therapeutic implications. Am J Surg Pathol 2004;28:889-94. [ Links ]
30. Motegi A, Sakurai S, Nakayama H, Sano T, Oyama T, Nakajima T. PKC theta, a novel immunohistochemical marker for gastrointestinal stromal tumors (GIST), especially useful for identifying KIT negative tumors. Pathol Int 2005;55:106-12. [ Links ]
31. Peterson MR, Piao Z, Weidner N, Yi ES. Strong PDGFRA positivity is seen in GIST but not in other intra-abdominal mesenchymal tumors: Immunohistochemical and mutational analysis. Appl Immunohistochem Mol Morphol 2006;14:390-6. [ Links ]











 text in
text in