My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.105 n.2 Madrid Feb. 2013
https://dx.doi.org/10.4321/S1130-01082013000200006
Vacunación de pacientes con enfermedad inflamatoria intestinal. Recomendaciones prácticas
Vaccination of patients with inflammatory bowel disease. Practical recommendations
Magda Campins1, Yolima Cossio1, Xavier Martínez1 y Natalia Borruel2
1Servicio de Medicina Preventiva y Epidemiología.
2Servicio de Digestivo.
Hospital Universitari Vall d'Hebron. Universitat Autònoma de Barcelona. Barcelona
Dirección para correspondencia
RESUMEN
Los pacientes con enfermedad inflamatoria intestinal (EII) tienen un mayor riesgo de infecciones, asociado tanto a la inmunosupresión endógena condicionada por su enfermedad de base, como a la exógena generada por los tratamientos que reciben. En los últimos años se han publicado guías y documentos de consenso sobre indicaciones de vacunación en estos pacientes, como medida de prevención primaria de infecciones. Sin embargo, las coberturas vacunales alcanzadas son bajas, probablemente por la falta de percepción del riesgo de infección y las dudas sobre la seguridad y eficacia de las vacunas en estos casos. La evidencia científica disponible muestra que la inmunización es segura para la mayoría de preparados y no se asocia a un incremento del riesgo de actividad de la enfermedad. En este documento se revisa la literatura científica disponible y se presentan unas recomendaciones de vacunación para pacientes adultos con EII.
Palabras clave: Enfermedad inflamatoria intestinal. Vacunación. Inmunizaciones.
ABSTRACT
Patients with inflammatory bowel disease (IBD) have a greater risk of infection associated with the endogenous immunosuppression brought about by their underlying disease as well as the exogenous immunosuppression resulting from their therapies. In the last few years guidelines and consensus papers have been issued on the indication of vaccines for these patients as primary prevention of infection. However, vaccine coverage is low, likely because the risk for infection and both safety and efficacy concerns regarding vaccines are scarcely perceived in such cases. The available scientific evidence shows that immunization is safe for most preparations, and bears no association with an increased risk for disease activity. This paper reviews the available scientific literature, and provides recommendations on the vaccination of adults with IBD.
Key words: Inflammatory bowel disease. Vaccination. Immunizations.
Introducción
Los pacientes con enfermedad inflamatoria intestinal (EII), tanto los afectos de colitis ulcerosa como de enfermedad de Crohn, tienen un mayor riesgo de infecciones, asociado tanto a la inmunosupresión endógena condicionada por su enfermedad de base, como a la exógena generada por los tratamientos que reciben (1-3). La alteración de la barrera intestinal y la malnutrición son factores de riesgo adicionales (4). Aunque la incidencia de infecciones prevenibles por vacunas en enfermos con EII no está bien establecida, se han descrito formas graves de infección neumocócica (sepsis fulminante) (5-7), neumonía causada por el virus varicela zóster (8,9), reactivación del virus de la hepatitis B en pacientes con infección latente (10,11), así como una mayor incidencia de herpes zóster (12,13). Además, existe un mayor riesgo de displasia y cáncer de cérvix (14,15), en especial en mujeres con enfermedad de Crohn, debido a una mayor prevalencia de infección por el virus del papiloma humano. El hipoesplenismo funcional que presentan los pacientes con colitis ulcerosa condiciona un mayor riesgo de infecciones por bacterias capsuladas (Streptococcus pneumoniae, Neisseria meningitidis y Haemophilus influenzae tipo b) (1,6). El aumento progresivo en la incidencia de nuevos casos de enfermedad inflamatoria intestinal, en el uso de fármacos inmunosupresores y la introducción de los fármacos biológicos (fundamentalmente anti-factor de necrosis tumoral (anti-TNF) condiciona un aumento de los pacientes en riesgo de sufrir infecciones. Además, estos medicamentos se utilizan más precozmente en la historia de la enfermedad, existe la tendencia a utilizar combinaciones de diferentes inmunosupresores para incrementar la eficacia y se utilizan programas de mantenimiento, imprescindibles para la remisión. En los últimos años se han publicado guías y documentos de consenso sobre indicaciones de vacunación en estos pacientes, como medida de prevención primaria de infecciones (1,16,17). No obstante, las evidencias científicas sobre la respuesta y seguridad vacunal son aún limitadas.
El objetivo de este documento es revisar la literatura científica disponible y ofrecer unas recomendaciones de vacunación para pacientes adultos con EII, considerando el tipo de enfermedad y su tratamiento, en relación a la efectividad y seguridad vacunales. Se incluirán en primer lugar las recomendaciones de vacunación sistemática del adulto en España y, en segundo lugar, las indicaciones específicas para pacientes con EII.
Principios generales de vacunación
Las enfermedades autoinmunes comparten cierta predisposición genética y mecanismos inflamatorios caracterizados por una disregulación de las citoquinas; para su control se usan tratamientos antiinflamatorios similares, que incluyen la administración de corticoides, inmunosupresores y terapias biológicas, como los fármacos anti-TNF (18). La terapia biológica ha revolucionado el tratamiento de estas enfermedades, pero su efecto sobre la respuesta inmune, que es lo que condiciona su beneficio terapéutico, produce también un incremento en el riesgo de infección.
El nivel de inmunosupresión depende de la intensidad, duración y tipo de tratamiento que reciba el paciente. La inmunoterapia altera fundamentalmente la inmunidad celular, mientras que la respuesta humoral permanece más o menos intacta (18). Desafortunadamente, no se dispone de parámetros clínicos o de laboratorio que permitan evaluar con certeza el estado inmunitario del paciente. En el caso de los corticoides, el grado de inmunosupresión se incrementa con la dosis y la duración del tratamiento; la dosis exacta de corticoides sistémicos y la duración de su administración necesarias para suprimir el sistema inmune no está bien definida, pero se considera que una dosis igual o superior a 2 mg/kg de peso corporal o una dosis total igual o superior a 20 mg/día de prednisona (o equivalente) inducen inmunosupresión clínicamente relevante (19).
La efectividad de la vacunación en pacientes con EII depende de la calidad de la respuesta inmune del enfermo a las infecciones, así como del grado de inmunocompromiso que genera su tratamiento sobre la respuesta inmune. Hay pocos estudios que analicen la respuesta vacunal en este grupo de pacientes, pero en general se recomienda la inmunización precoz, preferiblemente antes del inicio del tratamiento inmunomodulador/ inmunosupresor, y siempre que sea posible, realizar controles serológicos de la respuesta vacunal.
Es importante definir estrategias de inmunización adecuadas para estos pacientes, ya que las coberturas vacunales suelen ser bajas (20,21), probablemente por la falta de percepción del riesgo de infección y las dudas sobre la seguridad y eficacia de las vacunas en estos casos. El temor a que las vacunas provoquen brotes de la enfermedad, en especial en relación a las vacunas atenuadas, influye de forma importante en su infrautilización en pacientes con enfermedades autoinmunes; no obstante, la evidencia científica disponible muestra que la inmunización es segura y no se asocia a un incremento del riesgo de actividad de la enfermedad (22-25).
El esquema general a seguir para la inmunización de los pacientes con enfermedades autoinmunes es el siguiente:
Pacientes que reciben tratamiento inmunosupresor
Desde el punto de vista de la vacunación, se consideran inmunodeprimidos los pacientes que reciben tratamiento con fármacos biológicos (como infliximab, adalimumab o certolizumab) y/o inmunosupresores de mantenimiento (como azatioprina, 6-mercaptopurina, metrotexato, micofenolato, ciclosporina, tacrolimus, etc.), independientemente del principio activo y la dosis administrada. También se incluyen los enfermos que reciben tratamiento con corticoides durante más de 14 días a dosis iguales o superiores a 20 mg/día de prednisona (o dosis equivalentes de otros corticosteroides), y los pacientes con malnutrición importante (26).
Las vacunas atenuadas están contraindicadas en general en estos pacientes. Para su administración se requiere que haya transcurrido un mínimo de 3 meses desde la finalización del tratamiento inmunosupresor, excepto en el caso de los corticoides en que el intervalo requerido hasta la vacunación es solo 1 mes (26). Si se han administrado vacunas atenuadas antes del inicio del tratamiento inmunosupresor, se deberá respetar un intervalo mínimo de 4 semanas hasta iniciar la inmunosupresión.
En la tabla I se muestra la clasificación de las vacunas según tipo de antígeno y método de fabricación. Se incluyen dentro del grupo de vacunas atenuadas, las siguientes: triple vírica (sarampión, rubéola, parotiditis), varicela, BCG, rotavirus, fiebre amarilla, fiebre tifoidea oral (Ty21a), antipoliomielítica oral y vacuna del herpes zóster (no disponible aún en España).
Las vacunas inactivadas, las polisacarídicas y los toxoides se pueden administrar sin problemas de seguridad en pacientes inmunodeprimidos, pero la respuesta inmune puede ser menor que la alcanzada en personas sanas. Estas vacunas se pueden administrar en cualquier momento o fase de la enfermedad y/o tratamiento, aunque es preferible administrarlas antes del inicio de la inmunosupresión para garantizar una mejor respuesta inmune (2 semanas antes). En caso de vacunación durante el periodo de inmunosupresión se recomienda monitorizar la respuesta serológica al mes de la última dosis o repetir la vacunación al cabo de 3 meses de finalizado el tratamiento (26).
Calendario de vacunación sistemática del adulto
La valoración de las necesidades de vacunación de cualquier paciente afecto de una enfermedad crónica requiere de la realización de una historia vacunal completa que incluya los antecedentes de vacunación sistemática. Los pacientes con EII, al igual que la población general, deben recibir las vacunas correspondientes al calendario vacunal según edad y riesgo individual, teniendo siempre en cuenta las contraindicaciones y precauciones generales.
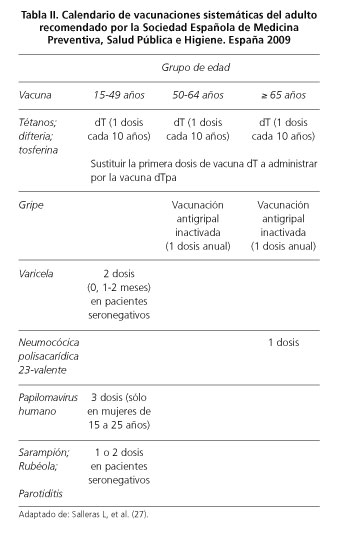
En la tabla II se muestra el calendario de vacunación sistemática del adulto en España (27).
Se considera que un adulto está correctamente vacunado si ha recibido las siguientes vacunas:
- 3 dosis de vacuna DTPa/dT, y la última dosis de recuerdo en los 10 años previos. Recientemente en la mayoría de comunidades autónomas se han eliminado las dosis de recuerdo decenales en los adultos que hayan recibido un mínimo de 5 dosis, y sólo se recomienda administrar 1 o 2 dosis de recuerdo adicionales a lo largo de la vida.
- 3 dosis de vacuna antipoliomielítica.
- 2 dosis de vacuna del sarampión (triple vírica) o inmunidad natural documentada.
- 2 dosis de vacuna de varicela, antecedente de padecimiento de la enfermedad o inmunidad natural documentada.
- 1 dosis de vacuna antigripal anual a partir de los 60-65 años.
- 1 dosis de vacuna antineumocócica 23-valente a partir de los 65 años.
En los pacientes con EII se recomienda realizar serología prevacunal en función de los antecedentes clínicos y/o vacunales del paciente frente a las siguientes enfermedades: varicela, sarampión, hepatitis B y hepatitis A.
Vacunas indicadas en los pacientes con enfermedad inflamatoria intestinal
Debido al riesgo específico de padecer algunas enfermedades inmunoprevenibles o sufrir complicaciones de las mismas, además de las vacunas sistemáticas, se recomienda considerar la inmunización del paciente afecto de EII frente a neumococo, gripe, hepatitis A y hepatitis B, varicela, herpes zóster y virus del papiloma humano. En los pacientes con tratamiento inmunosupresor se valorará además la vacunación frente a Neisseria meningitidis del serogrupo C y Haemophilus influenza tipo b (Hib).
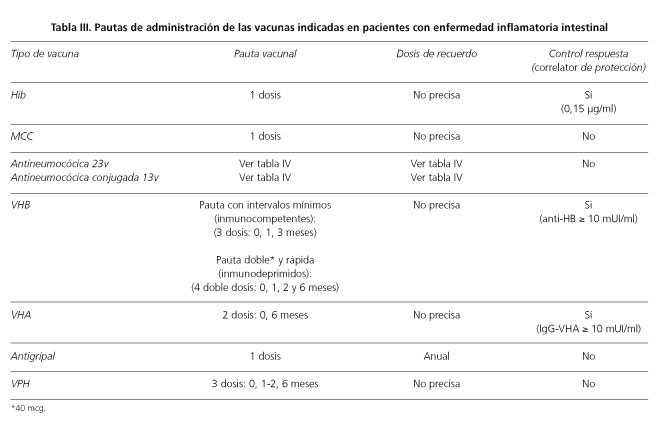
En la tabla III se muestran las indicaciones vacunales y las pautas de administración.
Vacuna frente a varicela y herpes zóster
La indicación de vacunación frente a la varicela en los pacientes con EII se fundamenta en el riesgo más elevado de complicaciones de esta infección en la edad adulta y en el huésped inmunodeprimido (8,28-31). Se debe determinar la existencia de antecedentes clínicos de la enfermedad o, incluso mejor, la presencia de inmunidad natural o vacunal mediante serología ya que la negatividad de haber pasado la varicela en la historia clínica es poco sensible para detectar los casos seronegativos (32). En caso de susceptibilidad, se procederá a la inmunización con 2 dosis de vacuna (pauta: 0, 1 mes). Al tratarse de una vacuna atenuada, se recomienda administrarla al menos 4 semanas antes de iniciar el tratamiento con inmunomoduladores o inmunosupresores (1,16,17). En caso de una exposición de riesgo en un paciente susceptible que está recibiendo tratamiento inmunosupresor o inmunomodulador, se recomienda realizar profilaxis postexposición con inmunoglobulina hiperinmune intramuscular (12,5 U/kg; 125-625 U) o polivalente (0,6-1,2 ml/kg; dosis máxima 20 ml) (33,34).
El herpes zóster aparece como reactivación de la infección latente por el virus varicela zóster. Una de cada tres personas desarrollarán un herpes zóster a lo largo de su vida, siendo este riesgo superior en personas inmunodeprimidas (35). Estudios realizados en pacientes con EII muestran una incidencia superior a la observada en controles sanos (13), tanto en los afectos de colitis ulcerosa [Rate Ratio: 1,21 (IC95 %): 1,05-1,40] como de enfermedad de Crohn [Rate Ratio: 1,61 (IC95 %: 1,35-1,92)]. El tratamiento con corticoides o con azatioprina/6-mercaptopurina se asocia a un incremento significativo del riesgo [Odds Ratio (OR): 1,5 (IC95 %: 1,1-2,2) y OR: 3,1 (IC95 %: 1,7-5,6), respectivamente] (13). La utilización de terapia combinada que incluya dos o tres fármacos (corticoides, inmunosupresores o anti-TNF) multiplica por tres el riesgo (36).
La vacuna del herpes zóster reduce la incidencia de la enfermedad en un 51 % y la de neuralgia postherpética en un 67 % en personas mayores de 60 años (37). Esta vacuna está autorizada en EE. UU. para personas mayores de 50 años, pero no está aún disponible en España. Debe valorarse cuidadosamente su administración a pacientes inmunodeprimidos, ya que se trata de una vacuna atenuada. Los corticoides a dosis inferiores a 20 mg/día de prednisona o equivalentes, dosis bajas de metotrexate (< 0,4 mg/kg/ semana), azatioprina (< 3 mg/kg/día) o 6-mercaptopurina (< 1,5 mg/kg/día) no contraindican la vacunación (35). Se desconoce la eficacia y seguridad de esta vacuna en pacientes en tratamiento con anti-TNF, por lo que se recomienda vacunar como mínimo un mes antes del inicio del tratamiento o posponer su administración hasta 3 meses después de la finalización del tratamiento.
Vacuna antigripal
El riesgo de complicaciones de la gripe en pacientes con EII no está bien documentado, pero es esperable que sea superior al de las personas sanas. Existe consenso a nivel internacional en recomendar la vacunación antigripal anual a todas las personas con enfermedades crónicas, en especial a los pacientes con inmunosupresión (38).
La seguridad de las vacunas antigripales en pacientes con enfermedades mediadas por el sistema inmune es similar a la observada en la población general. Estudios realizados en estos pacientes muestran que no hay relación entre la actividad clínica de la enfermedad y la vacunación (18,39). La respuesta inmune a la vacunación podría estar disminuida en pacientes con EII que reciben tratamiento inmunosupresor/inmunomodulador: Mamula y cols. analizaron la tasa de respuesta en niños con EII y observaron serocoversión entre el 33 y el 85 % de los vacunados, siendo el porcentaje de respuesta inferior en aquellos que recibían tratamiento combinado con inmunomoduladores e infliximab (40). Estudios recientes con la vacuna del virus influenza A H1N1 sugiere también que en los pacientes en tratamiento combinado con anticuerpos anti-TNF e inmunosupresores presentan una respuesta subóptima (tasa de seroconversión y concentraciones geométricas medias de anticuerpos menores) (41,42). Sin embargo, un trabajo similar realizado también en niños, muestra concentraciones geométricas medias de anticuerpos antihemaglutinina similares en todos los pacientes, independientemente del tratamiento recibido, excepto en los tratados con anti-TNF en que sólo un 14 % presentaron seroprotección frente a la cepa del virus influenza B incluida en la vacuna (43).
En España sólo se dispone en estos momentos de vacunas inactivadas frente a la gripe, por lo que pueden administrarse anualmente a todos los pacientes con EII, independientemente del tratamiento que reciban.
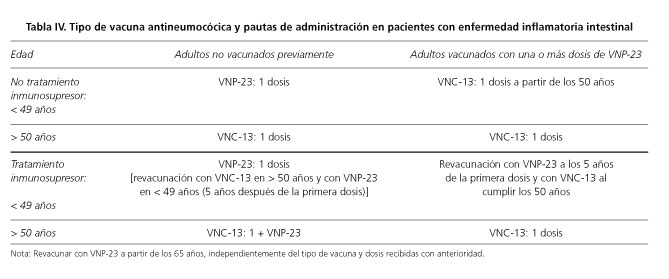
Vacuna antineumocócica
Los pacientes con enfermedades de base que condicionen cualquier grado de inmunosupresión, pueden tener mayor riesgo de desarrollar enfermedades neumocócicas, padecer formas graves y sufrir complicaciones. En especial, los pacientes tratados con inmunomoduladores son considerados de alto riesgo de desarrollar formas invasivas y fulminantes de la enfermedad (5-7). Existe un amplio consenso en la recomendación de vacunación antineumocócica a los pacientes con enfermedades mediadas por el sistema inmune y especialmente en aquellos que reciben o son candidatos a recibir tratamiento inmunosupresor/inmonumodulador (44,45).
Las guías de vacunación de pacientes con EII recomiendan la utilización de la vacuna antineumocócica polisacarídica 23 valente (PPSV-23) (16,17). Sin embargo, los datos de los estudios de eficacia y efectividad de esta vacuna, realizados durante los últimos 30 años, han sido poco concluyentes y controvertidos, por la discrepancia de resultados entre los ensayos clínicos y los estudios observacionales. En general, la efectividad vacunal oscila entre el 56-81 % para la prevención de la enfermedad neumocócica invasora en personas inmunocompetentes (46,47), pero su efecto protector se reduce de forma marcada en los inmunodeprimidos (48,49). Melmed y cols. analizaron la inmunogenicidad de esta vacuna en pacientes con enfermedad de Crohn según el tipo de tratamiento y observaron una respuesta adecuada sólo en el 45% de los enfermos que recibían terapia combinada con anti-TNF e inmunomodulares, en comparación con el 80-85 % en los no tratados con inmunosupresores y en los controles sanos (48). Otro estudio reciente obtiene resultados similares en los pacientes en tratamiento con infliximab en monoterapia o en combinación con inmunosupresores (50). Por este motivo, se recomienda su administración precoz, previa al inicio del tratamiento.
Recientemente se ha autorizado el uso en adultos mayores de 50 años de la vacuna antineumocócica conjugada 13 valente (PCV-13) (51,52). Con la conjugación de los polisacáridos contenidos en la vacuna se consigue inducir en el sujeto vacunado una respuesta inmune T-dependiente, que mejora la inmunogenicidad, actúa sobre la colonización nasofaríngea de la bacteria y permite generar memoria inmunológica en comparación con las vacunas de polisacáridos no conjugadas (53).
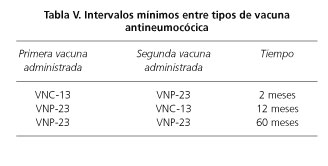
Las pautas de vacunación antineumocócica en adultos con EII según edad y tipo de tratamiento se muestran en la tabla IV. A partir de los 50 años de edad se recomienda la administración de una única dosis de PCV-13, independientemente de las dosis previas de vacuna antineumocócica polisacarídica no conjugada. Los intervalos mínimos para la administración de vacunas son de 2 meses (entre PCV-13 y PPSV-23), 12 meses (entre PPSV-23 y PCV-13) y 5 años (entre PPSV-23 y PPSV-23) (52) (Tabla V).
Vacuna frente a la hepatitis B (VHB)
Aunque la prevalencia de la infección por el virus de la hepatitis B en pacientes con EII es similar a la de la población (54,55), se ha descrito un mayor riesgo de reactivaciones (56) y de hepatitis B fulminante en pacientes que reciben tratamiento con inmunomoduladores (10,11). Además estos pacientes son sometidos frecuentemente a procedimientos invasivos que podría aumentar el riesgo de transmisión del virus (57,58).
Se recomienda realizar marcadores serológicos de infección por el virus de la hepatitis B a todos los pacientes con EII y vacunar a los susceptibles, con control posterior de la respuesta vacunal (17,44,59). Las concentraciones de anticuerpos de superficie frente al virus de la hepatitis B (anti-HB) iguales o superiores a 10 mUI/ml se consideran protectoras (60).
La respuesta a la vacuna VHB es inferior en pacientes inmunodeprimidos en comparación con la observada en la población general (60). En pacientes con EII se han descrito tasas de respuesta inferiores al 50 %, con una asociación significativa entre respuesta vacunal y tipo de tratamiento (61-64). Se han investigado pautas vacunales modificadas, dosis superiores y nuevas vacunas con adyuvantes (65,66), como estrategias para mejorar la calidad de la respuesta. Algunos estudios sugieren que pautas con doble dosis de antígeno (40 mcg) en pacientes no respondedores o que estén recibiendo tratamiento con inmunosupresor/inmunomodulador al inicio de la vacunación aumentan la tasa de respuesta en un 30-50 % (67-71).
Se recomienda iniciar la vacunación de forma precoz y completar la pauta vacunal, si es posible, previo al inicio del tratamiento inmunosupresor/inmunomodulador. El control de la respuesta vacunal se debe realizar entre uno y tres meses después de la última dosis (17). La pauta estándar consiste en la administración de 3 dosis, con un intervalo mínimo de un mes entre la primera y la segunda dosis, y de dos meses entre la segunda y la tercera (60). Pueden utilizarse las pautas rápida o acelerada en situaciones que requieran con mayor premura la inmunización, siguiendo los siguientes esquemas: 0, 1, 2 y 6-12 meses (pauta rápida) o 0, 7, 21 días y 12 meses (pauta acelerada) (72,73). En los pacientes inmunodeprimidos se recomienda iniciar la primovacunación con pauta rápida y con doble dosis de antígeno, ya que se consiguen mejores tasas de respuesta. Los pacientes inmunodepremidos que no hayan generado una respuesta adecuada deben recibir una segunda pauta completa de vacunación con doble dosis de antígeno (17,63,74,75).
Vacuna frente a la hepatitis A (VHA)
El riesgo de padecer una hepatitis A en los pacientes con EII es similar al de la población general, sin embargo la tasa de complicaciones es mayor en personas adultas y en inmunodeprimidos. Por este motivo, algunos autores consideran adecuado valorar la presencia de inmunidad y vacunar a los susceptibles (1,17).
En nuestro medio, la prevalencia de inmunidad natural es elevada en la edad adulta, con cifras superiores al 75 % en personas mayores de 35 años (76). Por tanto, resulta eficiente realizar cribado serológico prevacunal, mediante la determinación de anticuerpos de tipo IgG, en los pacientes mayores de 40 años y en aquellos procedentes de áreas de elevada endemicidad (77). Se dispone de preparados vacunales monovalentes y de vacuna combinada frente a las hepatitis A y B (78); la vacuna frente a la hepatitis A se considera tan inmunógena en pacientes con EII como en pacientes sanos, como demuestra un estudio realizado en población pediátrica por Radzikowski y cols. (79). En la tabla III se indica la pauta vacunal recomendada.
Vacuna frente el virus del papiloma humano (VPH)
El virus del papiloma humano es una causa necesaria (aunque no suficiente) para el cáncer de cérvix, vulva y ano. Se ha descrito una prevalencia mayor de anormalidades citológicas, displasias de alto grado y cáncer de cérvix en mujeres con EII en comparación con controles de similar edad, raza y paridad (42,5 vs. 7 % de mujeres con alteraciones citológicas del Papanicolau, respectivamente), especialmente en aquellas tratadas con inmunomoduladores (14,15,36,80,81). Un estudio caso-control de base poblacional mostró un incremento de riesgo de alteraciones citológicas cervicales en mujeres con enfermedad de Crohn que tomaban anticonceptivos orales [OR:1,66 (IC95%:1,08-2,54)], pero no en aquellas afectas de colitis ulcerosa; el tratamiento combinado con corticoides e inmunosupresores mostró también una asociación significativa [OR: 1,41 (IC 95%: 1,09-1,81)] (14). Más recientemente, Marehbian y cols. en un estudio caso-control que incluyó 22.310 pacientes con enfermedad de Crohn, observaron también que la monoterapia con corticoides, inmunosupresores o anti-TNF se asociaba con un aumento de riesgo de displasia de cérvix [OR: 1,5 (IC95 %: 1,2-2)] y que su uso combinado producía un incremento mayor de este riesgo [OR: 1,8 (IC95 %: 1,1-3)] (36).
Diversas guías y documentos de consenso incluyen la vacuna frente al VPH en las recomendaciones de vacunación de las pacientes con EII, especialmente si reciben tratamiento con inmunomoduladores o inmunosupresores (1,17,44,82).
No se dispone aún de datos publicados sobre la inmunogenicidad y seguridad de esta vacuna en pacientes con EII; sin embargo la eficacia y seguridad de la vacuna en población general es elevada, y por tratarse de un preparado recombinante se puede asumir su seguridad en pacientes inmunodeprimidos (82,83). Actualmente se están realizando ensayos clínicos en pacientes con infección por el VIH y con otros tipos de inmunodeficiencias secundarias.
Vacunas conjugadas frente a meningococo y a Haemophilus influenzae tipo b (Hib)
Las vacunas conjugadas frente a Haemophilus influenzae tipo b (Hib) y frente a meningococo del serogrupo C (MCC) están incluidas en el calendario de vacunación sistemática infantil de España y se recomiendan también en adultos de riesgo y en personas inmunodeprimidas (27). En nuestro país, los pacientes con EII que no hayan recibido estas vacunas durante su infancia, y que reciban o vayan a recibir tratamiento con fármacos inmunosupresores deben ser inmunizados con una dosis de vacuna MCC y una dosis de Hib (1,17,84). La vacuna MCC se sustituirá por la tetravalente conjugada en pacientes residentes o que viajen frecuentemente a países con circulación elevada de los serogrupos A, Y y W135 (p. ej. cinturón africano de la meningitis).
La duración de la protección de las vacunas polisacarídicas no conjugadas, como las antimeningocócicas bivalentes (A,C) y tetravalentes (A,C,Y,W135) disminuye a lo largo del tiempo, por lo que los pacientes de riesgo que hayan recibido alguna de estas vacunas deberán ser revacunados con el correspondiente preparado de vacuna conjugada (85).
Vacunas indicadas en viajeros con EII
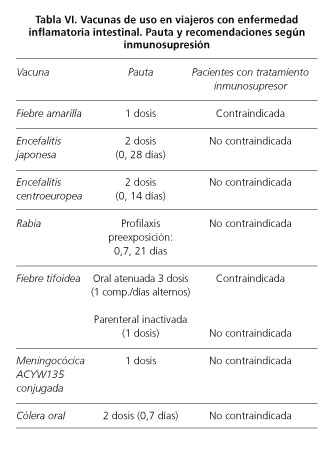
El número de viajeros internacionales ha aumentado de forma espectacular en las últimas décadas. Este aumento de viajes, tanto por motivos profesionales como de ocio, desde países de baja endemia a los de alta endemia de muchas enfermedades transmisibles, así como el contacto más frecuente entre los viajeros y la población local, hace que sea especialmente importante asegurar una correcta protección antes del inicio de viaje. La adopción de medidas de prevención es especialmente importante en las personas con mayor vulnerabilidad, entre las que se incluyen los pacientes con EII, y en especial los que reciben tratamiento inmunosupresor. Es muy recomendable que el paciente consulte antes del viaje en una unidad de vacunación internacional, donde se valorarán las vacunas indicadas según tipo de viaje y destino.
En la tabla VI se muestran las vacunas que pueden estar indicadas en viajeros afectos de EII.
Vacunas indicadas en convivientes de personas con EII
El personal sanitario y los convivientes de personas inmunodeprimidas deben vacunarse frente a determinadas enfermedades para minimizar el riesgo de transmisión de estas infecciones a sus pacientes y familiares.
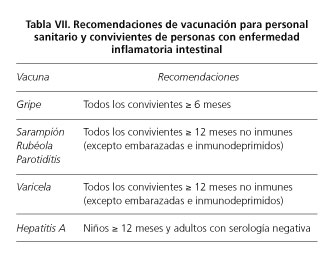
Un aspecto particular es la vacunación de lactantes hijos de mujeres con EII. Algunos inmunosupresores atraviesan la barrera placentaria y pueden detectarse en sangre de lactantes hasta los 6 meses de vida. Este hecho implica que algunas vacunas atenuadas, como la de rotavirus, estén contraindicadas en lactantes menores de 6 meses si la madre recibe tratamiento con infliximab, adalimumab o certolizumab (17,86).
En la tabla VII se muestran las vacunas indicadas en convivientes de pacientes con EII.
Conclusiones
La vacunación de los pacientes con EII es una medida de prevención efectiva y segura para el control de las infecciones; sin embargo, las coberturas vacunales son en general bajas en este grupo de población vulnerable. La inmunización precoz, antes del inicio del tratamiento inmunosupresor se asocia a una mejor respuesta inmune. Las vacunas atenuadas están en general contraindicadas en los pacientes que reciben tratamiento con inmunosupresores/inmunomoduladores. Se requieren más estudios que aporten un mayor conocimiento sobre la respuesta vacunal y las pautas de vacunación más adecuadas en estos pacientes.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Magda Campins Martí
Servicio de Medicina Preventiva y Epidemiología
Hospital Universitari Vall d'Hebron
Passeig de la Vall d'Hebron, 119-129
08035 Barcelona
e-mail:
mcampins@vhebron.net
Recibido: 22-12-2012
Aceptado: 14-02-2013
Bibliografía
1. Kotton CN. Vaccines and inflammatory bowel disease. Dig Dis 2010;28:525-35. [ Links ]
2. Viget N, Vernier-Massouille G, Salmon-Ceron D, Yazdanpanah Y, Colombel JF. Opportunistic infections in patients with inflammatory bowel disease: prevention and diagnosis. Gut 2008;57:549-58. [ Links ]
3. Toruner M, Loftus EV Jr, Harmsen WS, Zinsmeister AR, Orenstein R, Sandborn WJ, et al. Risk factors for opportunistic infections in patients with inflammatory bowel disease. Gastroenterology 2008;134:929-36. [ Links ]
4. Casanova JL, Abel L. Revisiting Crohn's disease as a primary immunodeficiency of macrophages. J Exp Med 2009;206:1839-43. [ Links ]
5. Ritz MA, Jost R. Severe pneumococcal pneumonia following treatment with infliximab for Crohn's disease. Inflamm Bowel Dis 2001;7:327. [ Links ]
6. Foster KJ, Devitt N, Gallagher PJ, Abbott RM. Overwhelming pneumococcal septicaemia in a patient with ulcerative colitis and splenic atrophy. Gut 1982;23:630-2. [ Links ]
7. Van der Hoeven JG, de Koning J, Masclee AM, Meinders AE. Fatal pneumococcal septic shock in a patient with ulcerative colitis. Clin Infect Dis 1996;22:860-1. [ Links ]
8. Deutsch DE, Olson AD, Kraker S, Dickinson CJ. Overwhelming varicella pneumonia in a patient with Crohn's disease treated with 6-mercaptopurine. J Pediatr Gastroenterol Nutr 1995;20:351-3. [ Links ]
9. Bernal I, Domènech E, García-Planella E, Cabré E, Gassull MA. Infecciones oportunistas en pacientes con enfermedad inflamatoria intestinal bajo tratamiento inmunosupresor. Gastroenterol Hepatol 2003;26:19-22. [ Links ]
10. Esteve M, Saro C, Gonzalez-Huix F, Suarez F, Forné M, Viver JM. Chronic hepatitis B reactivation following infliximab therapy in Crohn's disease patients: need for primary prophylaxis. Gut 2004;53:1363-5. [ Links ]
11. Milloning G, Kern M, Ludwiczek O, Nachbaur K, Vogel W. Subfulminant hepatitis B after infliximab in Crohn's disease: need for HBV-screening. World J Gastroenterol 2006;12:974-6. [ Links ]
12. Kotton CN. Nailing down the shingles in IBD. Inflamm Bowel Dis 2007; 13: 1178-9. [ Links ]
13. Gupta G, Lautenbach E, Lewis JD. Incidence and risk factors for herpes zoster among patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2006;4:1483-90. [ Links ]
14. Singh H, Demers AA, Nugent Z, Mahmud SM, Kliewer EV, Bernstein CN. Risk of cervical abnormalities in women with inflammatory bowel disease: a population-based nested case-control study. Gastroenterology 2009;136:451-8. [ Links ]
15. Kane S, Khatibi B, Reddy D. Higher incidence of abnormal pap smears in women with inflammatory bowel disease. Am J Gastroenterol 2008;103:631-6. [ Links ]
16. Sands BE, Cuffari C, Katz J, Kugathasan S, Onken J, Vitek C, et al. Guidelines for immunizations in patients with inflammatory bowel disease. Inflamm Bowell Dis 2004;10:677-92. [ Links ]
17. Wasan SK, Baker SE, Skoinik PR, Farraye FA. A practical guide to vaccinating the inflammatory bowel disease patient. Am J Gastroenterol 2010;105:1231-8. [ Links ]
18. Raier JF, Moutschen M, van Gompel A, van Ranst M, Louis E, Segaert S, et al. Vaccination in patients with immune-mediated inflammatory diseases. Rheumatology 2010;49:1815-27. [ Links ]
19. American Academy of Pediatrics. Immunization in special clinical circumstances. In: Pickering LK, Baker CJ, Kimberlin DW, Long SS, editors. Red Book: 2009 Report of the Committee on Infectious Diseases. 28th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2009. [ Links ]
20. Gluck T, Muller-Ladner U. Vaccination in patients with chronic rheumatic or autoinmune diseases. Clin Infect Dis 2008;46:1459-65. [ Links ]
21. Melmed GY, Ippoliti AF, Papadakis KA, Tran TT, Birt JL, Lee SK, et al. Patients with inflammatory bowel disease are at risk for vaccine-preventable illnesses. Am J Gastroenterol 2006;101:1834-40. [ Links ]
22. Wraith DC, Goldman M, Lambert PH. Vaccination and autoimmune disease: what is the evidence? Lancet 2003;362:1659-66. [ Links ]
23. Heijstek MW, Pileggi GC, Zonneveld-Huijssoon E, Armbrust W, Hoppenreijs EP, Uiterwaal CS, et al. Safety of measles, mumps and rubella vaccination in juvenile idiopathic arthritis. Ann Rheum Dis 2007;66:1384-7. [ Links ]
24. Molina V, Shoenfeld Y. Infection, vaccines and other environmental triggers of autoimmunity. Autoimmunity 2005;38:235-45. [ Links ]
25. Conti F, Rezai S, Valesini G. Vaccination and autoimmune rheumatic diseases. Autoimmun Rev 2008;8:124-8. [ Links ]
26. CDC. National Center for Immunization and Respiratory Diseases. General Recommendations on Immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2011;60(RR-2):1-64. [ Links ]
27. Salleras L, Campins M, Castrodeza J, Domínguez A, Domínguez V, Fernández-Crehuet J, et al. Calendario de vacunaciones sistemáticas del adolescente y el adulto recomendado por la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (Comité de Vacunas de la SEMPSPH). Medicina Preventiva 2010;1:76. [ Links ]
28. Arvin AM. Varicella-zoster virus. Clin Microbiol Rev 1996;9:361-81. [ Links ]
29. Balato N, Gaudiello F, Balato A, Ayala F. Development of primary varicella infection during infliximab treatment for psoriasis. J Am Acad Dermatol 2009;60:709-10. [ Links ]
30. Leung VS, Nguyen MT, Bush TM. Disseminated primary varicella after initiation of infliximab for Crohn's disease. Am J Gastroenterol 2004;99:2503-4. [ Links ]
31. Vonkeman H, ten Napel C, Rasker H, van de Laar M. Disseminated primary varicella infection during infliximab treatment. J Rheumatol 2004; 31: 2517-8. [ Links ]
32. Kopylov U, Levin A, Mendelson E, Dovrat S, Book M, Eliakim R, et al. Prior varicella zoster virus exposure in IBD patients treated by anti-TNFs and other immunomodulators: implications for serological testing and vaccination guidelines. Aliment Pharmacol Ther 2012;36:145-50. [ Links ]
33. Marin M, Guris D, Chaves SS, Schmid S, Seward JF. Prevention of varicella: Recommendations of the advisory committee on immunization practices (ACIP). MMWR Recomm Rep 2007;56:1-40. [ Links ]
34. Oliveras M, Moraga FA. Las inmunoglobulinas en la profilaxis de la varicela. An Esp Pediatr 2000;52:71-2. [ Links ]
35. Harpaz R, Ortega-Sánchez IR, Seward JF. Advisory Committee on Immunization Practices (ACIP) Centers for Disease Control and Prevention (CDC). Prevention of herpes zoster: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2008;57(RR-5):1-30. [ Links ]
36. Marehbian J, Arrighi HM, Hass S, Tian H, Sandborn WJ. Adverse events associated with common therapy regimens for moderate to severe Crohn's disease. Am J Gastroenterol 2009;104:2524-33. [ Links ]
37. Oxman MN, Levin MJ, Johnson GR, Schmader KE, Straus SE, Gelb LD, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005;352:2271-84. [ Links ]
38. Centers for Disease Control and Prevention (CDC). Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2011. MMWR Morb Mortal Wkly Rep 2011;60:1128-32. [ Links ]
39. Narula N, Yamamura DL, Marshall JK. Should my patient with inflammatory bowel disease on immunosuppressive therapy be vaccinated against influenza virus? Can J Gastroenterol 2010;24:121-5. [ Links ]
40. Mamula P, Markowitz JE, Piccoli DA, Klimov A, Cohen L, Baldassano RN. Immune response to influenza vaccine in pediatric patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2007;5:851-6. [ Links ]
41. Andrisani G, Frasca D, Romero M, Armuzzi A, Felice C, Marzo M, et al. Immune response to influenza A/H1N1 vaccine in inflammatory bowel disease patients treated with anti TNF-alpha agents: Effects of combined therapy with immunosuppressants. J Crohns Colitis 2012 (Epub ahead of print). [ Links ]
42. Cullen G, Bader C, Korzenik JR, Sands BE. Serological response to the 2009 H1N1 influenza vaccination in patients with inflammatory bowel disease. Gut 2012;61:385-91. [ Links ]
43. Lu Y, Jacobson DL, Ashworth LA, Grand RJ, Meyer AL, McNeal MM, et al. Immune response to influenza vaccine in children with inflammatory bowel disease. Am J Gastroenterol 2009;104:444-53. [ Links ]
44. Rahier JF, Ben-Horin S, Chowers Y, Conlon C, De Munter P, D'Haens G, et al. European evidence based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohn's Colitis 2009;3:47-91. [ Links ]
45. Nuorti JP, Whitney CG; Centers for Disease Control and Prevention (CDC). Updated Recommendations for Prevention of Invasive Pneumococcal Disease Among Adults Using the 23-Valent Pneumococcal Polysaccharide Vaccine (PPSV23) (ACIP). MMWR Recomm Rep 2010;59:1102-5. [ Links ]
46. Watson L, Wilson BJ, Waugh N. Pneumococcal polysaccharide vaccine: a systematic review of clinical effectiveness in adults. Vaccine 2002;20:2166-73. [ Links ]
47. Moberley SA, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev 2008 Jan. [ Links ]
48. Melmed GY, Agarwal N, Frenck RW, Ippoliti AF, Ibanez P, Papadakis KA, et al. Immunosuppression impairs response to pneumococcal polysaccharide vaccination in patients with inflammatory bowel disease. Am J Gastroenterol 2010;105:148-54. [ Links ]
49. Agarwal N, Ollington K, Kaneshiro M. Are immunosuppressive medications associated with decreased responses to routine immunizations? A systematic review. Vaccine 2012;30:1413-24. [ Links ]
50. Fiorino G, Peyrin-Biroulet L, Naccarato P, Szabò H, Sociale OR, Vetrano S, et al. Effects of immunosuppression on immune response to pneumococcal vaccine in inflammatory bowel disease: A prospective study. Inflamm Bowel Dis 2012;18:1042-7. [ Links ]
51. Food and Drug Administration. FDA expands use of Prevnar 13 vaccine for people ages 50 and older. Silver Spring, MD: US Department of Health and Human Services, Food and Drug Administration; 2011. Disponible en: http://www.fda.gov/newsevents/newsroom/pressannouncements/ucm285431.htm?source=govdelivery. Access Aug 18, 2012. [ Links ]
52. Centers for Disease Control and Prevention (CDC). Use of 13-Valent Pneumococcal Conjugate Vaccine and 23-Valent Pneumococcal Polysaccharide Vaccine for Adults with Immunocompromising Conditions: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep 2012;61:816-9. [ Links ]
53. Lazarus R, Clutterbuck E, Ly-Mee Yu, Bowman J, Bateman EA, Diggle L, et al. A Randomized Study Comparing Combined Pneumococcal Conjugate and Polysaccharide Vaccination Schedules in Adults. Clin Infect Dis 2011;52:736-42. [ Links ]
54. Loras C, Saro C, González F, Mínguez M, Merino O, Gisbert JP, et al. Prevalence and factors related to hepatitis B and C in inflammatory Bowel Disease Patients in Spain: A Nationwide, Multicenter Study. Am J Gastroenterol 2009;104:58-63. [ Links ]
55. Chevaux JB, Nani A, Oussalah A, Venard V, Bensenane M, Belle A, et al. Prevalence of hepatitis B and C and risk factors for non-vaccination in inflammatory bowel disease patients in Northeast France. Inflamm Bowel Dis 2010;16:916-23. [ Links ]
56. Pérez R, Díaz C, García F. Hepatitis B virus (HBV) reactivation in patients receiving tumor necrosis factor (TNF)-targeted therapy: Analysis of 257 cases. Medicine (Baltimore) 2011;90:359-71. [ Links ]
57. Bronowicki JP, Venard V, Botté C, Monhoven N, Gastin I, Choné L, et al. Patient-to-Patient Transmission of Hepatitis C Virus during Colonoscopy. N Engl J Med 1997;337:237-40. [ Links ]
58. Ponchon T. Transmission of hepatitis C and prion diseases through digestive endoscopy: evaluation of risk and recommended practices. Endoscopy 1997;29:199-202. [ Links ]
59. Hou JK, Velayos F, Terrault N, Mahadevan U. Viral Hepatitis and inflammatory Bowel disease. Inflamm Bowel Dis 2010;16:925-32. [ Links ]
60. Mast EE, Weinbaum CM, Fiore AE, Alter MJ, Bell BP, Finelli L, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: recommendations of the Advisory Committee on Immunization Practices (ACIP) Part II: immunization of adults. MMWR Recomm Rep 2006;55(RR-16):1-33. [ Links ]
61. Vida Pérez L, Gómez Camacho F, García Sánchez V, Iglesias Flores EM, Castillo Molina L, Cerezo Ruiz A, et al. Adequate rate of response to hepatitis B virus vaccination in patients with inflammatory bowel disease. Med Clin (Barc) 2009;132:331-5. [ Links ]
62. Altunöz ME, Senate E, Ye il A, Calhan T, Ovünç AO. Patients with inflammatory bowel disease have a lower response rate to HBV vaccination compared to controls. Dig Dis Sci 2012;57:1039-44. [ Links ]
63. Gisbert JP, Chaparro M, Esteve M. Review article: prevention and management of hepatitis B and C infection in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2011;33:619-33. [ Links ]
64. Gisbert JP, Villagrasa JR, Rodríguez-Nogueiras A, Chaparro M. Efficacy of hepatitis B vaccination and revaccination and factors impacting on response in patients with inflammatory bowel disease. Am J Gastroenterol 2012;107:1460-6. [ Links ]
65. Boland G, Beran J, Lievens M, Sasadeusz J, Dentico P, Nothdurft H, et al. Safety and immunogenicity profile of an experimental hepatitis B vaccine adjuvanted with AS04. Vaccine 2004;23:316-20. [ Links ]
66. Jacques P, Moens G, Desombere I, Dewijngaert J, Leroux-Roels G, Wettendorff M, et al. The immunogenicity and reactogenicity profile of a candidate hepatitis B vaccine in an adult vaccine non-responder population. Vaccine 2002;20:3644-9. [ Links ]
67. Cardell K, Akerlind B, Sallberg M, Frydén A. Excellent response rate to a double dose of the combined hepatitis A and B vaccine in previous nonresponders to hepatitis B vaccine. J Infect Dis 2008; 198:299-304. [ Links ]
68. Flynn PM, Cunningham CK, Rudy B, Wilson CM, Kapogiannis B, Worrell C, et al. Hepatitis B vaccination in HIV-infected youth: a randomized trial of three regimens. J Acquir Immune Defic Syndr 2011;56:325-32. [ Links ]
69. Pettit NN, De Pestel DD, Malani PN, Riddell J. Factors associated with seroconversion after standard dose hepatitis B vaccination and highdose revaccination among HIV-infected patients. HIV Clin Trials 2010;11:332-9. [ Links ]
70. Gisbert JP, Menchén L, García-Sánchez V, Marín I, Villagrasa JR, Chaparro M. Comparison of the effectiveness of two protocols for vaccination (standard and double dosage) against hepatitis B virus in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2012;35:1379-85. [ Links ]
71. Herranz MT, Sancho del Val L, Lorenzo P, et al. Vacunación del VHB con pauta rápida y doble en pacientes con Enfermedad Inflamatoria Intestinal/ Póster. XV Reunión Nacional de la Asociación Española de Gastroenterología, Madrid 21-23 de Marzo de 2012. [ Links ]
72. Bock HL. Rapid hepatitis B immunisation for traveller. Comparison of two accelerated schedules with a 2-months schedule. Biodrugs 2003; 17(Supl.1):11-13. [ Links ]
73. Northdurft HD, Dietrich M, Zuckerman JN, Knobloch J, Kern P, Sänger R. Rapid protection against hepatits A and B using accelerated vaccination schedule. Biodrugs 2003; 17(Supl.1):15-8. [ Links ]
74. Chaves SS, Daniels D, Cooper BW, Malo-Schlegel S, Immunogenicity of hepatitis B vaccine among hemodialysis patients: Effect of revaccination of non-responders and duration of protection. Vaccine 2011;29:9618-23. [ Links ]
75. Cossio Y, Martínez X, Campins M, et al. Inmunogenicidad de la vacuna frente a hepatitis B en pacientes con enfermedad inflamatoria intestinal. Comunicación oral en 6o Congreso de la Asociación Española de Vacunología, Santiago de Compostela 23-26 noviembre 2011. [ Links ]
76. Domínguez A, Bruguera M, Plans P, Espuñes J, Costa J, Plasencia A, et al. Declining hepatitis A seroprevalence in adults in Catalonia (Spain): A population-based study. BMC Infect Dis 2007;7:73-8. [ Links ]
77. Costas L, Vilella L, Trilla A, Serrano B, Vera I, Roldán M, et al. Vaccination strategies against hepatitis A in travelers older than 40 years: An economic evaluation. J Travel Med 2009;16:344-8. [ Links ]
78. Fiore AE, Wasley A, Bell BP. Prevention of hepatitis A through active or passive immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2006;55 (RR-7):1-23. [ Links ]
79. Radzikowski A, Banaszkiewicz A, Tazowska-Przeorek I, Grzybowska-Chlebowczyk U, Wo H, Pytrus T, et al. Immunogenecity of hepatitis A vaccine in pediatric patients with inflammatory bowel disease. Inflamm Bowel Dis 2011;17:1117-24. [ Links ]
80. Bhatia J, Bratcher J, Korelitz B, Vakher K, Mannor S, Shevchuk M, et al. Abnormalities of uterine cervix in women with inflammatory bowel disease. World J Gastroenterol 2006;12:6167-71. [ Links ]
81. Petry KU, Kochel H, Bode U, Schedel I, Niesert S, Glaubitz M, et al. Human papillomavirus is associated with the frequent detection of warty and basaloid high-grade neoplasia of the vulva and cervical neoplasia among immunocompromised women. Gynecol Oncol 1996;60:30-4. [ Links ]
82. Melmed GY. Vaccination strategies for patients with inflammatory bowel disease on immunomodulators and biologics. Inflamm Bowel Dis 2009;15:1410-6. [ Links ]
83. Markowitz LE, Dunne EF, Saraiya M, Lawson HW, Chesson H, et al, Centers for Disease Control and Prevention (CDC); Advisory Committee on Immunization Practices (ACIP). Quadrivalent Human Papillomavirus Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2007;56(RR-2):1-24. [ Links ]
84. Nix EB, Hawdon N, Gravelle S, Biman B, Brigden M, Malik S, et al. Risk of invasive Haemophilus influenzae type b (Hib) disease in adults with secondary immunodeficiency in the post-Hib vaccine era. Clin Vaccine Immunol 2012;19:766-71. [ Links ]
85. Centers for Disease Control and Prevention (CDC). Updated recommendations for use of meningococcal conjugate vaccines. Advisory Committee on Immunization Practices (ACIP), 2010. MMWR Morb Mortal Wkly Rep 2011;60:72-84. [ Links ]
86. Mahadevan U, Cucchiara S, Hyams JS, Steinwurz F, Nuti F, Travis SP, et al. The London Position Statement of the World Congressof Gastroenterology on Biological Therapy for IBD With the European Crohn's and Colitis Organization: Pregnancy and Pediatrics. Am J Gastroenterol 2011;106:214-23. [ Links ]











 text in
text in