My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.105 n.6 Madrid Jun. 2013
https://dx.doi.org/10.4321/S1130-01082013000600006
Linaclotida en el tratamiento de pacientes con síndrome del intestino irritable con estreñimiento: análisis de una oportunidad
Linaclotide in the treatment of patients with irritable bowel syndrome and constipation - analysis of an opportunity
Fernando Carballo
Comisión de Excelencia Clínica de la Sociedad Española de Patología Digestiva (SEPD).
Servicio de Medicina de Aparato Digestivo. Unidad de Gestión Clínica de Digestivo. Hospital Clínico Universitario Virgen de la Arrixaca de Murcia.
Instituto Murciano de Investigación Biosanitaria (IMIB)
Dirección para correspondencia
RESUMEN
La linaclotida es un secretagogo que asocia un efecto combinado sobre el dolor visceral. La European Medicines Agency ha aprobado su indicación en el tratamiento sintomático en adultos del síndrome del intestino irritable con estreñimiento moderado o grave. El objetivo de esta revisión es analizar el marco clínico de aplicación de linaclotida en nuestro medio, las características del fármaco, su desarrollo preclínico y los estudios clínicos que apoyan su uso, con el fin de establecer los correspondientes juicios de validez y aplicabilidad clínica. Los resultados indican que el único efecto adverso, no grave, del fármaco es la diarrea. En cuanto a su eficacia, linaclotida presenta consistentemente favorables y significativas diferencias de riesgo absolutas frente a placebo en todas las variables resultado objetivas marcadas por las agencias reguladoras, con una respuesta combinada a dolor y estreñimiento entre el 12,6% y el 22,8%, según la variable y el ensayo considerados. Esta respuesta es sostenida y vinculada al fármaco, pues desaparece tras su retirada. Se concluye que linaclotida presenta un perfil de seguridad y eficacia que justifica, desde una perspectiva clínica, su uso en pacientes que cumplan criterios de síndrome del intestino irritable con estreñimiento con sintomatología de intensidad significativa que no pueda resolverse con otros tratamientos menos específicos. En ausencia de reglas de predicción de respuesta se recomienda que, si tras un periodo de prueba el paciente no responde, debe considerarse que no es candidato a tratamiento con linaclotida, reservando indicación y continuidad del tratamiento solo a los respondedores objetivos.
Palabras clave: Síndrome del colon irritable. Estreñimiento. Dolor visceral.
ABSTRACT
Linaclotide is a secretagogue that provides a combined effect on visceral pain. The European Medicines Agency has authorized its indication for the symptomatic treatment of moderate to severe irritable bowel syndrome with constipation in adults. The purpose of this review is to discuss the clinical framework for linaclotide use in our setting, the drug's characteristics and pre-clinical development, and the clinical studies supporting its use in order to establish relevant views regarding its validity and clinical applicability. The results suggest that the only -non-severe- adverse effect associated with this drug is diarrhea. As regards effectiveness, linaclotide consistently shows favorable, significant differences in absolute risk versus placebo for all objective outcome variables described by regulatory agencies, with a combined pain and constipation response between 12.6% and 22.8% according to the variable and trial under consideration. This response is sustained and drug-related, as it goes away upon discontinuation. To conclude, linaclotide has a safety and efficacy profile that, from a clinical perspective, warrants its use for patients meeting irritable bowel syndrome and constipation criteria, with significant symptoms that cannot be relieved with other less specific measures. In the absence of predictive rules for response, it is recommended that, should the patient fail to respond, he or she should be considered not eligible for linaclotide therapy, and both indication and treatment continuity should be reserved for objective responders alone.
Key words: Irritable bowel syndrome. Constipation. Visceral pain.
ABREVIATURAS
EC: ensayos clínicos.
EMA: European Medicines Agency.
FDA: Food and Drug Administration.
GC-C: guanilato ciclasa tipo C.
GMPc: guanosín monofosfato cíclico.
IBS-QOL: Irritable Bowel Syndrome-Quality of Life.
NNT: número necesario a tratar.
SEPD: Sociedad Española de Patología Digestiva.
SII: síndrome del intestino irritable.
SII-D: síndrome del intestino irritable con diarrea.
SII-E: síndrome del intestino irritable con estreñimiento.
SII-M: síndrome del intestino irritable de tipo mixto.
Introducción
La linaclotida es un agonista del receptor de la guanilato ciclasa tipo C (GC-C) aprobado por la European Medicines Agency (EMA) para el tratamiento sintomático en adultos del síndrome del intestino irritable con estreñimiento (-SII-E) moderado o grave (1).
El SII-E es un problema de salud complejo tanto en su patogenia y fisiopatología como en su conceptualización clínica y fronteras diagnósticas (2). Su tratamiento actual es de limitada eficacia, mientras que el riesgo/beneficio de los primeros antagonistas del receptor 3 de la 5-HT (5-HT3) o de los agonistas de su receptor 4 (5-HT4) ha restringido su uso clínico (3). Linaclotida es un nuevo fármaco que explora un mecanismo de acción diferente a los previamente ensayados, siendo por tanto un medicamento first-in-class.
El objetivo de este original es revisar el marco clínico de aplicación de linaclotida en nuestro medio, analizando las características del fármaco, su desarrollo preclínico y los estudios clínicos que soportan su uso con el fin de establecer los correspondientes juicios de validez y aplicabilidad clínica de los resultados.
Marco clínico de aplicación
Los pacientes con síndrome del intestino irritable (SII) se agrupan, de acuerdo con los vigentes criterios de Roma III (Tabla I), en cuatro subtipos: SII con estreñimiento (-SII-E), SII con diarrea (SII- D), SII de tipo mixto (-SII-M) y SII no tipificado (4).
Un excelente metaanálisis estima una prevalencia mundial para el SII del 15%, que baja al 9% si solo se consideran pacientes con persistencia sintomática de al menos 12 meses (5), excluyendo por tanto las formas más inconsistentes o leves. En este mismo metaanálisis se establece una proporción del 22% para el subtipo SII-E respecto del total de SII (5). En España se han descrito prevalencias globales para el SII entre el 13,6% (6) y el 3,9%, aplicando en este último caso criterios Roma II (7). El estudio español más reciente, utilizando Roma III, establece una cifra intermedia del 8,3% (8). El SII induce alta demanda asistencial (9), elevados costes, absentismo y disminución de la calidad de vida (3,10-14). Respecto del subtipo -SII-E, y en el ámbito europeo, una revisión sistemática, en la que se incluye España, y un reciente estudio desarrollado en Francia, Italia y Reino Unido, confirman el significativo impacto de esta enfermedad, apuntando que su mejor manejo ofrecería mejoras significativas en salud y costes socioeconómicos (3,15).
Entre los mecanismos patogénicos involucrados en el SII se encuentran los trastornos de la motilidad, la hipersensibilidad visceral, la inflamación mediada por linfocitos, citoquinas y mastocitos, la existencia de infecciones intestinales previas, las alteraciones de la microflora, el sobrecrecimiento bacteriano, la hipersensibilidad alimentaria, la malabsorción de hidratos de carbono, la intolerancia al gluten, factores genéticos y disfunciones psicosociales. Esta gran variedad de aproximaciones fisiopatológicas tiene su lógico reflejo en una multitud de alternativas terapéuticas, que ya se ha comentado son de limitada eficacia. Entre las medidas generales debe incidirse en una adecuada relación clínico-terapéutica, en la educación del paciente, la actividad física e incluso en el abordaje psicosocial. Entre las modificaciones alimentarias la más extendida es el uso de fibra, pero también la exclusión de la lactosa, o la investigación de malabsorción de otros carbohidratos, el obviar alimentos flatulentos, e incluso en ciertos casos la manipulación dietética para la eliminación de potenciales alérgenos. También se ha postulado el uso de probióticos y el de antibióticos del tipo de la rifaximina. En el apartado de los tratamientos farmacológicos, la aproximación clásica incluye el uso de los espasmolíticos, los antidepresivos y los agentes laxantes o antidiarreicos según subtipo de SII. Dentro de estos abordajes clásicos los espasmolíticos han demostrado ser superiores a placebo, tanto en un metaanálisis (16), como en un reciente ensayo clínico (EC) con el otilonio de bromuro (17). Otro metaanálisis indica también ventaja significativa con el uso de antidepresivos (18), fármacos que son capaces de inducir neuromodulación y poseen capacidad analgésica con independencia de su efecto principal. Respecto de los antidiarreicos, la evidencia es de peor calidad, indicando beneficio en la frecuencia y consistencia de la deposición pero no en términos de mejoría global (19-21). Algo parecido ocurre con los expansores del bolo fecal y los laxantes, que pueden mejorar el estreñimiento pero no la sintomatología global (22).
En cuanto al tratamiento del SII con moléculas capaces de modular la hipersensibilidad visceral, los antagonistas de la 5-HT3 han demostrado eficacia en el tratamiento del SII, especialmente en mujeres y con perfil diarrea (23), pero uno de estos antagonistas, el alosetrón, se asoció a colitis isquémica y grave inducción de estreñimiento. En cuanto a los agonistas de la 5-HT4, capaces de estimular la motilidad colónica, tanto tegaserod como renzaprida han mostrado también eficacia en el alivio sintomático del SII, y en concreto en su subtipo SII-E, pero en ambos casos se han asociado igualmente a colitis isquémica y el tegaserod además a otros graves efectos adversos cardio-vasculares (3).
Finalmente, entre los secretagogos, además de la linaclotida, solo la lubiprostona, no disponible en Europa, ha sido ensayada en SII-E, reduciendo el dolor abdominal y mejorando el estreñimiento de forma significativa (24-26).
Características y desarrollo preclínico de la linaclotida
Como se ha ya señalado, la linaclotida es un agonista del receptor de la GC-C, enzima que se expresa en la superficie luminal de las células epiteliales intestinales capaz de sintetizar guanosín monofosfato cíclico (GMPc). El GMPc es un ubicuo segundo mensajero que entre otras muchas funciones fisiológicas estimula la secreción intestinal (27). Los primeros ligandos naturales activadores de la GC-C descubiertos fueron enterotoxinas termoestables de la Eschericia coli, siendo posteriormente descrita la guanilina como primer ligando endógeno (28). La linaclotida es un homólogo de enterotoxina termoestable de máxima potencia y alta resistencia a la degradación proteolítica (27). Durante el desarrollo de la linaclotida se confirmó, utilizando modelos experimentales con ratones privados del gen de la GC-C, que esta enzima es la diana molecular de todos los efectos observables para el fármaco (28).
Los estudios farmacocinéticos en modelos experimentales in vivo con ratas demuestran que la linaclotida es solo mínimamente absorbible (29), dato corroborado durante el desarrollo clínico, lo que garantiza baja toxicidad.
Los efectos de la linaclotida sobre la motilidad intestinal se evaluaron mediante estudios de farmacodinamia en modelos animales, demostrándose en ratas un incremento del tránsito intestinal dosis-dependiente (29). Además, de la exposición al medicamento de asas ligadas de intestino delgado se dedujo un significativo incremento de la secreción de líquidos que se acompañó de un también significativo aumento de los niveles intraluminales de GMPc (29).
Especial relevancia por sus implicaciones para el desarrollo clínico tuvieron los estudios en animales que mostraron reducción del dolor visceral. Eutamene y cols. (30), empleando hasta cuatro diferentes modelos de hipersensibilidad visceral en ratones, concluyeron que la linaclotida ejerce un potente efecto anti-nociceptivo gracias a la activación del receptor de la GC-C. Este efecto fue observado solo bajo condiciones de distensión colorrectal pero no en condiciones basales; además, el efecto se obtuvo solo a dosis bajas, lo que puede indicar una pérdida de especificidad para las dosis altas (28). Estos resultados sugieren que la GC-C participa también en la modulación de la respuesta sensitiva a la distensión solo en presencia de hipersensibiidad. Estos hallazgos contrastan con otros derivados de experimentos de ratones genéticamente condicionados para no expresar el gen de la GC-C que sugieren que la activación del receptor de la GC-C se relaciona con la sensibilidad en condiciones basales pero no en situaciones de hipersensibilidad (28). Estudios posteriores in vitro, realizados con diferentes dosis de linaclotida, han explorado la respuesta basal y en condiciones de hipersensibilidad tanto ante estímulos nociceptores de alto como de bajo umbral (31). Una posibilidad, derivada del conjunto de todos estos resultados, es que la activación de la GC-C juegue un papel tanto en condiciones de hipersensibilidad como también en la sensibilidad mecánica de bajo umbral en condiciones basales. De esta explicación podría extrapolarse una muy interesante aplicación de la linaclotida en humanos consistente en la mejora de la coordinación de la defecación en pacientes sin hipersensibilidad visceral y en la reducción del dolor en aquellos otros que sí la tengan (28).
Estudios clínicos que soportan el uso de la linaclotida
Los estudios clínicos realizados con linaclotida para su autorización por parte de la FDA y la EMA han sido once ensayos clínicos (EC), tres en fase I, cuatro en fase II y otros cuatro en fase III (28,32).
En voluntarios sanos se confirmaron en fase I una adecuada tolerancia y seguridad (32). También en voluntarios y en fase Ib se comprobó mediante dosis orales ascendentes disminución de la consistencia y aumento del peso fecal, acorde con el esperado efecto sobre la secreción intestinal (32). Otro estudio en fase Ib objetivó que este efecto es dosis-dependiente (28,32,33).
En fase II se realizó en primer lugar un EC piloto, aleatorizado, controlado con placebo y doble ciego, diseñado para la evaluación de seguridad, tolerabilidad y exploración de eficacia, comprobando una respuesta dosis-dependiente con incremento en la frecuencia de las deposiciones y disminución de la consistencia fecal, obteniéndose también mejoría clínica en las molestias abdominales, intensidad del estreñimiento y alivio sintomático general (34). El segundo EC fue multicéntrico e igualmente doble ciego y controlado con placebo. Todas las dosis de linaclotida mejoraron la frecuencia semanal de deposiciones espontáneas, que fue el indicador de resultado primario; además, la linaclotida mejoró significativamente la tasa semanal de deposiciones completas, la consistencia de las heces, la dificultad de expulsión de las mismas, las molestias abdominales, el meteorismo, así como la evaluación sintomática global y la calidad de vida. El efecto adverso más frecuente fue la diarrea, pero solo seis pacientes interrumpieron el tratamiento por ello (35). El beneficio terapéutico se obtuvo en todas las variables con dosis de 150 μg o superiores, mientras que la mayor prevalencia de diarrea y el menor efecto sobre las molestias abdominales y el meteorismo se dio a la dosis de 600 μg. Esta ausencia de efecto dosis respuesta en los síntomas derivados de la percepción dolorosa visceral es coherente con los resultados descritos en experimentación animal.
El primero de los estudios fase II en SII-E fue un EC aleatorizado, controlado con placebo y doble ciego, en fase IIa, diseñado para evaluar el tránsito gastrointestinal mediante escintigrafía. Se realizó en 36 mujeres con dosis diarias de linaclotida de 100 y 1.000 μg. Con 1.000 μg, pero no con 100 μg, se observó un significativo descenso en el tiempo medio de vaciamiento del colon derecho, así como incremento del tránsito colónico a las 48 horas, pero no a las 24 horas. Igualmente se observaron efectos significativos en el aumento de la frecuencia y facilidad para la deposición, en el acortamiento del tiempo transcurrido hasta la primera evacuación, así como disminución de la consistencia fecal. Todo ello sin que se identificaran efectos adversos (36).
El segundo fue un EC multicéntrico, controlado con placebo y doble ciego de rango de dosis entre 75 y 600 μg de linaclotida. Se incluyeron 420 pacientes, sobre todo mujeres, con SII-E con criterios Roma II, quienes fueron aleatorizados a placebo o linaclotida a dosis de 75, 150, 300, o 600 μg, durante 12 semanas. Las variables para evaluación fueron la frecuencia defecatoria, los síntomas abdominales y la evaluación sintomática global. La variable principal de resultado fue la de la defecación espontánea completa. Se observó mejoría significativa del hábito intestinal en cualquiera de las dosis de linaclotida, incluida la frecuencia, las deposiciones completas, la facilidad defecatoria y la consistencia fecal. El dolor abdominal también disminuyó de forma significativa frente al placebo. El efecto máximo del tratamiento se observó con 300 μg. La eficacia respecto de los síntomas de dolor, las molestias abdominales o la hinchazón no fue mayor con la dosis de 600 μg. Los pacientes que refirieron dolor intenso (4-5 sobre 5) al menos la mitad de los días del periodo basal son los que experimentaron una mayor reducción en el dolor abdominal durante el tratamiento. Más de un tercio (37%) de los pacientes tratados con linaclotida tuvieron una mejoría clínicamente significativa en el IBS-QOL (≥ 14 puntos). Los efectos del tratamiento se observaron ya en la primera semana y se mantuvieron durante las 12 semanas de duración del EC. La diarrea, leve o moderada, fue el único efecto adverso que mostró diferencias con respecto al grupo placebo, siendo dosis-dependiente. Solo un 4% de los pacientes tuvieron que discontinuar el tratamiento por este motivo (37).
Teniendo en cuenta los resultados de la fase II se seleccionaron para la fase III las dosis de 150 y 300 μg pero ajustadas a 145 y 290 μg tras desarrollar mejoras en la medición del contenido de linaclotida en las cápsulas (38).
En fase III se realizaron dos EC multicéntricos aleatorizados, controlados con placebo y doble ciego en pacientes con estreñimiento publicados conjuntamente (39). En total se incluyeron 1.272 pacientes. El resultado de eficacia primario se alcanzó en un 21,2% y un 16% de los pacientes que recibieron 145 μg de linaclotida y en un 19,4% y un 21,3% de los pacientes que recibieron 290 μg de linaclotida, en comparación con el 3,3% y el 6% de los que recibieron placebo (p < 0,01). El efecto terapéutico se observó desde el primer día de tratamiento y se mantuvo estable durante todo el tratamiento. La incidencia de eventos adversos fue similar en todos los grupos de estudio, con la excepción de la diarrea, que motivó la interrupción del tratamiento en el 4,2% de los casos.
La linaclotida, a dosis de 290 μg oral diaria, ha sido ensayada en fase III específicamente en pacientes con SII-E en otros dos EC multicéntricos aleatorizados, controlados con placebo y doble ciego (40,41). En uno de los estudios (estudio 31) la duración del tratamiento fue de 12 semanas (40) y en el otro (estudio 302) de 26 semanas (estudio 302) (41). En el diseño se tuvieron en cuenta hasta cuatro variables primarias de eficacia, pensando tanto en las recomendaciones de la U.S. Food and Drug Administration (FDA) como en las establecidas por la EMA (42,43). Por ello a las publicaciones separadas de los dos EC (40,41) se siguió una tercera en la que se comunicaron conjuntamente los resultados de ambos EC bajo el prisma del análisis de eficacia europeo (44).
En el estudio 31 (40) se estableció un periodo adicional de 4 semanas de retirada aleatorizada. Las variables de resultado principales y secundarias consideradas en este estudio pueden consultarse en la tabla II. Este EC incluyó un total de 800 pacientes (89,5% de sexo femenino). Sus resultados ofrecen diferencias significativas frente a placebo en todas las variables de respuesta principales (Tabla III). La variable compuesta principal de resultado (FDA) se alcanzó en un 33,6% de los pacientes tratados con linaclotida frente al 21% del grupo placebo (NNT = 8); al descomponer sus componentes, un 48,6% frente a un 29,6% (NNT = 5,3) consiguieron al menos una deposición espontánea completa más respecto de la cifra basal, y un 50,1% frente al 37,5% un alivio del dolor de al menos un 30% (NNT = 7,9). También se observaron diferencias significativas en todas las variables secundarias. La respuesta terapéutica empezó durante la primera semana de tratamiento, siendo máxima desde el primer momento para la función intestinal; el dolor mejoró significativamente también en la primera semana pero alcanzó su máximo alivio a partir de la sexta semana. Durante el periodo de retirada aleatorizada los pacientes con linaclotida mantuvieron o desarrollaron mejoría y los que pasaron a recibir placebo volvieron a presentar síntomas, sin que tampoco en este caso se observara empeoramiento respecto del nivel basal o fenómenos de rebote. No existieron efectos adversos graves. Se reportó diarrea en el 19,5% de los sujetos tratados con linaclotida frente al 3,5% del grupo placebo, pero solo un 5,7% de los afectos tuvieron que dejar el tratamiento.
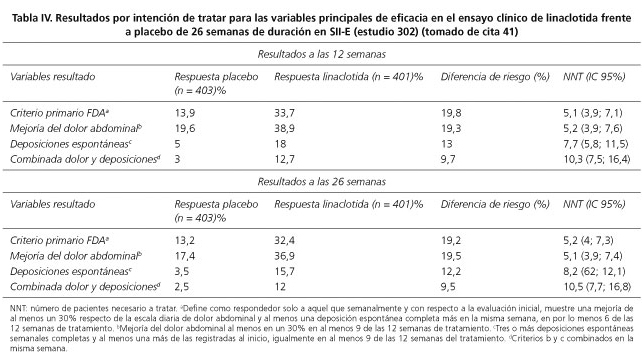
Por su parte, el estudio 302 (41) incluyó 804 pacientes, de los cuales un 90% fueron mujeres, mostrando una consistente tendencia en cuanto al perfil de pacientes incluibles. El objetivo fue también evaluar la eficacia y la seguridad de la linaclotida en el SII-E pero en este caso por un periodo de tratamiento ampliado a 26 semanas. Se consideraron las mismas variables de resultado principales y secundarias que en el estudio 31 (Tabla II), evaluadas durante las primeras 12 semanas de tratamiento. Además, se realizó una evaluación adicional de estas variables primarias y secundarias a las 26 semanas. También se tuvieron en cuenta otras medidas, tanto para las 12 como para las 26 semanas, como plenitud abdominal, dolor cólico, intensidad sintomática para SII, gravedad del estreñimiento, alivio adecuado de los síntomas del SII-E, grado de satisfacción con el alivio para los síntomas del SII y del tratamiento en general.
Los resultados de este segundo EC fase III también fueron concluyentes acerca de la eficacia de linaclotida en todas las variables, primarias o secundarias, considerando tanto 12 como 26 semanas. En la tabla IV se muestran estos resultados en lo referente a las variables principales de eficacia. En este caso, la variable compuesta de eficacia principal recomendada por la FDA ofreció un resultado en las primeras 12 semanas de 33,7% de los pacientes tratados con linaclotida frente al 13,9% del grupo placebo (NNT = 5,1) mientras que sus componentes mostraron valores de 47,6% frente al 22,6% (NNT = 4) en el incremento de al menos una deposición espontánea completa y de 48,9% frente al 34,5% (NNT = 6,9) para un alivio del dolor de al menos un 30%. Al igual que en el estudio 31, la respuesta terapéutica empezó durante la primera semana de tratamiento, siendo máxima desde el primer momento para la función intestinal, en tanto que el máximo efecto para el dolor se alcanzó en la octava semana. Las diferencias con el placebo se mantuvieron constantes durante las 26 semanas. Al final del tratamiento el 45% de los pacientes tratados con linaclotida declararon estar muy o bastante satisfechos con el tratamiento en comparación con un 20% de pacientes tratados con placebo. Además, el 56% frente al 33% referían un adecuado alivio de los síntomas atribuibles al SII; este porcentaje subía al 72% frente al 45% si se consideraba cualquier tipo de alivio. La incidencia de efectos adversos fue similar entre los grupos de tratamiento, excepto para la diarrea (19,7% frente a 2,5%), aunque solo provocó la interrupción en el 4,5% de los pacientes del grupo linaclotida frente al 0,2% de los pacientes tratados con placebo, sin que en ningún caso el efecto adverso fuera grave.
Ya se ha señalado la existencia de un tercera publicación (44) que aporta el análisis conjunto de los dos EC precedentes desde la perspectiva de las variables principales de resultado sugeridas por la EMA (Tabla V). Teniendo en cuenta estas variables primarias, el resultado obtenido para la respuesta de eficacia en el alivio del dolor fue del 58,4% en el grupo linaclotida frente al 41,8% en el grupo placebo en el estudio 31, y del 54,1% frente al 38,5% en el estudio 302 (p < 0,001 en ambos casos). En cuanto al alivio sintomático, respondieron el 37% de los tratados con linaclotida frente al 18,5% en el grupo control en el estudio 31, y el 39,4% frente al 16,6% en el estudio 302 (p < 0,0001 en ambos casos). Adicionalmente, en el estudio 302, un número significativamente mayor de pacientes tratados con linaclotida respondieron más allá de la semana 13 respecto del placebo: 53,6% para el dolor o molestias frente al 36%; 37,2 vs. 16,9% para el alivio sintomático (p < 0.0001 en ambos casos). El porcentaje de respuesta sostenida (proporción de pacientes respondedores que mantuvieron su respuesta al menos dos de las últimas cuatro semanas de tratamiento) fue también significativamente mayor en el grupo linaclotida en ambos estudios (p < 0,001).
Validez y aplicabilidad clínica de los resultados
En la fase de desarrollo preclínico fue relevante, en cuanto a seguridad, la comprobación de una muy baja biodisponibilidad del medicamento, lo que sugería improbabilidad de toxicidad sistémica. Los resultados de los ensayos en humanos confirmaron la prácticamente nula presencia en sangre de linaclotida tras de su toma oral. Esto es coherente con el hecho de que en ninguno de los EC de la fase clínica se observaran diferencias significativas en los efectos adversos entre placebo y grupo experimental, excepto en aquellos derivados del propio efecto del fármaco, como es la diarrea. Es decir, no pudo atribuirse a la linaclotida ninguna toxicidad por exposición sistémica.
La diarrea, el efecto adverso más frecuentemente descrito, puede considerarse, en cierto modo, un resultado terapéutico en exceso, vinculado al mecanismo de acción del medicamento, más que una inesperada consecuencia no deseada del mismo. Desde una perspectiva clínica, el hecho de que un paciente previamente estreñido pase a referir diarrea debe ser examinado caso a caso en una doble vertiente: la de la gravedad objetiva de la diarrea y la de la percepción del evento y tolerancia al mismo por parte del paciente. Los EC con linaclotida han demostrado que en ningún caso la diarrea fue un efecto adverso grave, y de hecho ni siquiera justificaba la suspensión del tratamiento salvo en un pequeño porcentaje de casos. Parece por tanto razonable asumir que en la práctica clínica la aparición de diarrea, tras la toma de linaclotida, puede entenderse como un factor relacionado con la evolución sintomática de un cuadro previo de estreñimiento y por tanto manejado sin mayores dificultades, al no ser grave y generalmente no tan intenso como para interrumpir el tratamiento.
En el desarrollo preclínico de la linaclotida se pudieron aclarar satisfactoriamente prácticamente todos los aspectos de interés de cara a la fase clínica. La reserva cabe establecerla solo respecto de la dilucidación completa del mecanismo íntimo que justifica el doble y favorable efecto de la linaclotida en tanto no solo incrementa la secreción intestinal, sino que también disminuye el dolor de origen visceral. Conceptualmente este es un tema relevante en cuanto al conocimiento objetivo básico, pero no tanto con respecto al juicio sobre pertinencia de un desarrollo clínico basado en el doble objetivo terapéutico de alivio de estreñimiento y dolor. Durante la fase preclínica la secuencia de los acontecimientos ha sido la lógica: identificación de la molécula, comprobación del efecto secretor, observación del efecto analgésico como un hallazgo adicional y redefinición preclínica de las eventuales dianas terapéuticas. El que la explicación del efecto analgésico sea especulativa, aunque muy bien fundada y basada en experimentos de alta calidad, no invalida en absoluto la validez de la observación experimental. Por tanto, fue perfectamente plausible trasladar al desarrollo clínico la exploración del alivio del dolor abdominal. Los resultados clínicos han sido consistentes en esta línea hasta el punto que la EMA considera que precisamente la indicación de linaclotida es el SII-E, cuadro clínico en el que es paradigmática la obtención del doble efecto señalado. No obstante, dado que las fronteras entre estreñimiento crónico con molestias y SII-E pueden ser difusas, es también lógica la posición de la FDA aceptando tanto la indicación de SII-E como la de estreñimiento crónico.
Respecto del desarrollo clínico en sí, cabe hablar de corrección metodológica en todas y cada una de las fases y respecto de los resultados de una alta consistencia en la dirección del efecto, e incluso en su magnitud. Centrándonos en la fase III, todos los ensayos realizados cumplen con los habitualmente exigentes requisitos tanto en la selección de los pacientes, como en su asignación aleatoria a los grupos experimental y placebo, enmascaramiento, ocultamiento de las secuencias de aleatorización y clara definición de objetivos y variables resultado.
Respecto de la selección de los pacientes se realizó un esfuerzo especial en que se cumplieran los criterios diagnósticos obligados para que los resultados fueran extrapolables posteriormente a la indicación explorada. De ahí la esperada reducción entre elegibles y aleatorizables. Esta buena selección explica también la consistente proporción elevada de mujeres, que no es más que reflejo del perfil clínico de las enfermedades consideradas, sin que de los resultados, o conocimiento previo establecido, se deduzca que quepa esperar un efecto terapéutico diferente por género.
Las variables de resultado principales no se eligieron por conveniencia metodológica en búsqueda de una mayor probabilidad de diferencia, sino en función de los criterios objetivos recomendados por las agencias evaluadoras, lo que da a los EC el valor añadido de conformidad a estándares de resultado previamente establecidos.
Justo esta afortunada conjunción de población representativa y objetivos relevantes, determinados de manera independiente a los intereses de los promotores e investigadores, es la que permite interpretar mejor el sentido y magnitud de los resultados obtenidos.
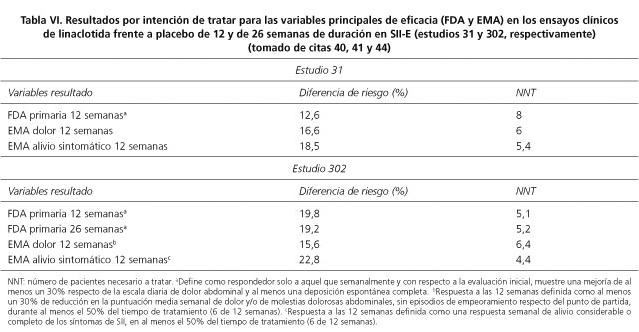
Los resultados demuestran la indudable eficacia de linaclotida, pero deben ser sometidos a escrutinio de relevancia. En lo que se refiere al SII-E, en general y simplificando, se puede decir que aproximadamente la mitad de los pacientes responden al tratamiento y que hasta tres cuartas partes consideran que se han visto aliviados por el mismo. No obstante, con mayor rigor, cabe asumir que las diferencias objetivas entre placebo y tratamiento, contemplando solo las variables principales de resultado (Tabla VI) van del 12,8 al 22,8% (NNT 8 a 4,4). Podemos aceptar que, a efectos operativos y aproximadamente, al menos un 13%, pudiendo alcanzar el 20%, de los pacientes responderán combinadamente a dolor y estreñimiento (resultados FDA), y que consistentemente en las variables EMA, el 16% responderá con mejoría objetiva del dolor, que puede alcanzar un 20%, en el alivio sintomático. Por otra parte, es claro el efecto del tratamiento desde su inicio, alcanzando máxima eficacia precoz para la función intestinal y más tardía para el alivio del dolor. La sostenibilidad de la respuesta y la ausencia de rebote sintomático vuelven a demostrar, junto a la ya menciona consistencia de la dirección de efecto, que existe una diana terapéutica específica en la población seleccionada.
En resumen, y respecto del SII-E, la mayoría de los pacientes perciben mejoría sintomática, pero la respuesta objetiva completa, medida por las variables de resultado principales contempladas en los EC frente a placebo, se obtiene en aproximadamente un 16-18% de los sujetos. Dada la complejidad clínica del SII-E y la interacción de diversos mecanismos en su patogenia, es probable que estos pacientes que obtienen respuesta objetiva sean precisamente aquellos en los que el mecanismo fisiopatológico dominante en ellos es revertido por linaclotida y por tanto en los que este fármaco no solo ofrece alivio marginal sino efecto terapéutico directo e unívoco. Una continuación lógica de este planteamiento es aceptar la pertinencia en la práctica clínica de la indicación y uso de la linaclotida en este tipo de pacientes.
No obstante, hay dos temas relevantes a considerar para ser desarrollados en la etapa postautorización, junto a los aspectos de farmacovigilancia, especialmente del efecto adverso diarrea, exigidos por la EMA. El primero se refiere a cuál debe ser el periodo de tratamiento recomendado en los respondedores. Sabemos que la respuesta se espera que sea sostenida al menos durante 26 semanas, pero no disponemos de datos de seguimiento a más largo plazo. Dadas las características de benignidad de la enfermedad, su posibilidad de curso natural en etapas de exacerbación junto con otras de mejoría, la ausencia de fenómenos de rebote tras supresión del medicamento y el rápido efecto del mismo, parece razonable asumir que en el uso clínico de la linaclotida probablemente se seguirán pautas de retirada/reintroducción en función de etapas sintomáticas en cada paciente, más que un patrón de uso continuado, o indefinido, del mismo. Pero, en cualquier caso, esta relevante cuestión de la duración óptima del tratamiento debería ser prospectivamente evaluada en el inmediato futuro. El segundo tema se refiere a la clarificación de las diferencias entre respondedores y no respondedores. De los EC realizados no se deducen características que permitan predecir qué paciente puede responder a linaclotida y cuál no. Precisamente porque la linaclotida es un medicamento que explora un mecanismo de acción específico al que responde un grupo de pacientes y otro no, sería muy relevante proseguir la investigación clínica de este producto intentando definir las características asociadas a la no respuesta, o a la respuesta, según quiera enfocarse. Lo ideal hubiera sido disponer de esta información a priori, pero esperar a estudios más amplios, o diseñados específicamente para ello, no parece justificar suficientemente el retraso en la incorporación del medicamento a la práctica clínica para aquellos pacientes que sí pueden beneficiarse de ello, tal como parece que han considerado tanto la EMA como la FDA.
En la práctica, en consecuencia con todo lo anterior, es evidente que la ausencia de reglas de predicción de respuesta no elimina la necesidad de seleccionar los pacientes que pueden beneficiarse de manera específica por la linaclotida. En este sentido, el desarrollo clínico y autorización de la linaclotida nos ofrece claves alternativas para una aceptable hoja de ruta. En primer lugar, y como premisa obligada, cabe incluir como candidatos solo pacientes según indicación, es decir que cumplan criterios de SII-E Roma-III con enfermedad de moderada a grave. Una interpretación clínica razonable adicional lleva a considerar que el perfil de estos pacientes se identifica con aquellos que no son respondedores a los tratamientos habituales previos con expansores/laxantes y espasmolíticos, siempre tras haber excluido mecanismos específicos de enfermedad para el SII, acorde con lo señalado en la primera parte de este informe. Situados ya en el escenario de un paciente que cumple criterios SII-E, presenta sintomatología significativamente intensa y no responde adecuadamente a tratamientos específicos según perfil de mecanismo o generales con expansores/laxantes y espasmolíticos, lo razonable es empezar tratamiento con linaclotida, dada su ausencia de efectos adversos significativos excepto la diarrea, que ya se ha comentado que es una exacerbación del efecto propio del medicamento. En el caso de que haya respuesta terapéutica sabemos que aparecerá precozmente, de forma que si no hay tal respuesta no tendría sentido prolongar el tratamiento más allá del primer ciclo de 4 semanas. Por tanto, este periodo de prueba puede ser en la práctica el mejor método de selección de los pacientes, siempre tras los pasos previos señalados.
Agradecimientos
El informe original, base de esta revisión, fue comentado, mejorado y validado por diferentes miembros directivos de la SEPD, a los que el autor agradece su contribución.
Conflictos de intereses
Este original es una versión adaptada para publicación de un informe interno previamente elaborado por el autor en calidad de responsable del Comité de Excelencia Clínica de la Sociedad Española de Patología Digestiva (SEPD). El objetivo perseguido por la SEPD fue disponer de un juicio propio, científico, independiente y objetivo, sobre la oportunidad de la introducción de la linaclotida en nuestro país para el tratamiento de pacientes con síndrome de intestino irritable con estreñimiento (SII-E). Ni la SEPD ni el autor tienen cualquier tipo de relación o interés con Ironwood Pharmaceuticals, desarrolladora inicial de Linaclotida. El autor no mantiene ningún tipo de relación contractual o de interés con Almirall, S.A. Tanto el informe original como este artículo se han elaborado con fuentes propias sin intervención o colaboración directa o indirecta de Ironwood Pharmaceuticals o Almirall, o cualquier otro agente relacionado. La SEPD mantiene con Almirall, S.A., acuerdos que exclusivamente se refieren a la organización de actividades formativas dentro de su congreso anual. Ni el informe, ni este original han sido elaborados a instancias de las previamente citadas empresas farmacéuticas. No se ha establecido ningún tipo de contrapartidas, ni existe ninguna vinculación o acuerdo específico sobre linaclotida. No obstante, la SEPD desea poner en valor este informe por lo que ha autorizado la redacción de la presente versión.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fernando Carballo.
Servicio de Medicina del Aparato Digestivo.
Hospital Clínico Universitario Virgen de la Arrixaca.
Carretera Madrid-Cartagena, s/n.
30120 El Palmar, Murcia
e-mail: luisf.carballo@carm.es
Recibido: 12-06-2013
Aceptado: 26-06-2013
Bibliografía
1. CHMP summary of positive opinion for Constella. EMA/CHMP/604998/2012. 2012. (Consultado 26/02/2013). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Summary_of_opinion_-_Initial_authorisation/human/002490/WC500132840.pdf. [ Links ]
2. Mearin F, Lacy BE. Diagnostic criteria in IBS: Useful or not? Neurogastroenterol Motil 2012;24:791-801. [ Links ]
3. Fortea J, Prior M. Irritable bowel syndrome with constipation: A European-focused systematic literature review of disease burden. J Med Econ 2013;16:329-41. [ Links ]
4. Longstreth GF, Thompson WG, Chey WD, Houghton LA, Mearin F, Spiller RC. Functional bowel disorders. Gastroenterology 2006;130:1480-91. [ Links ]
5. Lovell RM, Ford AC. Global prevalence of and risk factors for irritable bowel syndrome: A meta-analysis. Clin Gastroenterol Hepatol 2012;10:712-21 e4. [ Links ]
6. Caballero-Plasencia AM, Sofos-Kontoyannis S, Valenzuela-Barranco M, Martín-Ruiz JL, Casado-Caballero FJ, López-Manas JG. Irritable bowel syndrome in patients with dyspepsia: A community-based study in southern Europe. Eur J Gastroenterol Hepatol 1999;11:517-22. [ Links ]
7. Mearin F, Badia X, Balboa A, Baro E, Caldwell E, Cucala M, et al. Irritable bowel syndrome prevalence varies enormously depending on the employed diagnostic criteria: Comparison of Rome II versus previous criteria in a general population. Scand J Gastroenterol 2001;36:1155-61. [ Links ]
8. Rey E, Mearin F. Prevalencia de trastornos funcionales intestinales en la población española y su asociación con síntomas digestivos altos. Rev Esp Enferm Dig 2012;104 (Supl. I):89-90. [ Links ]
9. Mearin F. Without doubt, functional digestive disorders constitute one of the main reasons for consultation in both gastroenterology and primary health care. Foreword. J Clin Gastroenterol 2011;45 (Supl.):S81. [ Links ]
10. Fedorak RN, Vanner SJ, Paterson WG, Bridges RJ. Canadian Digestive Health Foundation Public Impact Series 3: Irritable bowel syndrome in Canada. Incidence, prevalence, and direct and indirect economic impact. Can J Gastroenterol 2012;26:252-6. [ Links ]
11. Mitra D, Davis KL, Baran RW. All-cause health care charges among managed care patients with constipation and comorbid irritable bowel syndrome. Postgrad Med 2011;123:122-32. [ Links ]
12. Agarwal N, Spiegel BM. The effect of irritable bowel syndrome on health-related quality of life and health care expenditures. Gastroenterol Clin North Am 2011;40:11-9. [ Links ]
13. Rey E, García-Alonso MO, Moreno-Ortega M, Álvarez-Sánchez A, Díaz-Rubio M. Determinants of quality of life in irritable bowel syndrome. J Clin Gastroenterol 2008;42:1003-9. [ Links ]
14. Pique JM, Lanas A. Sindrome del intestino irritable: una enfermedad con una elevada carga socioeconomica y sanitaria. Aten Primaria 2006;38:69-71. [ Links ]
15. Dibonaventura MD, Prior M, Prieto P, Fortea J. Burden of constipation-predominant irritable bowel syndrome (IBS-C) in France, Italy, and the United Kingdom. Clin Exp Gastroenterol 2012;5:203-12. [ Links ]
16. Poynard T, Regimbeau C, Benhamou Y. Meta-analysis of smooth muscle relaxants in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2001;15:355-61. [ Links ]
17. Clave P, Acalovschi M, Triantafillidis JK, Uspensky YP, Kalayci C, Shee V, et al. Randomised clinical trial: Otilonium bromide improves frequency of abdominal pain, severity of distention and time to relapse in patients with irritable bowel syndrome. Aliment Pharmacol Ther 2011;34:432-42. [ Links ]
18. Ford AC, Talley NJ, Schoenfeld PS, Quigley EM, Moayyedi P. Efficacy of antidepressants and psychological therapies in irritable bowel syndrome: Systematic review and meta-analysis. Gut 2009;58:367-78. [ Links ]
19. Cann PA, Read NW, Holdsworth CD, Barends D. Role of loperamide and placebo in management of irritable bowel syndrome (IBS). Dig Dis Sci 1984;29:239-47. [ Links ]
20. Hovdenak N. Loperamide treatment of the irritable bowel syndrome. Scand J Gastroenterol Suppl 1987;130:81-4. [ Links ]
21. Efskind PS, Bernklev T, Vatn MH. A double-blind placebo-controlled trial with loperamide in irritable bowel syndrome. Scand J Gastroenterol 1996;31:463-8. [ Links ]
22. Tack J, Fried M, Houghton LA, Spicak J, Fisher G. Systematic review: The efficacy of treatments for irritable bowel syndrome -a European perspective. Aliment Pharmacol Ther 2006;24:183-205. [ Links ]
23. Andresen V, Montori VM, Keller J, West CP, Layer P, Camilleri M. Effects of 5-hydroxytryptamine (serotonin) type 3 antagonists on symptom relief and constipation in nonconstipated irritable bowel syndrome: A systematic review and meta-analysis of randomized controlled trials. Clin Gastroenterol Hepatol 2008;6:545-55. [ Links ]
24. Johanson JF, Drossman DA, Panas R, Wahle A, Ueno R. Clinical trial: Phase 2 study of lubiprostone for irritable bowel syndrome with constipation. Aliment Pharmacol Ther 2008;27:685-96. [ Links ]
25. Drossman DA, Chey WD, Johanson JF, Fass R, Scott C, Panas R, et al. Clinical trial: Lubiprostone in patients with constipation-associated irritable bowel syndrome -results of two randomized, placebo-controlled studies. Aliment Pharmacol Ther 2009;29:329-41. [ Links ]
26. Chey WD, Drossman DA, Johanson JF, Scott C, Panas RM, Ueno R. Safety and patient outcomes with lubiprostone for up to 52 weeks in patients with irritable bowel syndrome with constipation. Aliment Pharmacol Ther 2012;35:587-99. [ Links ]
27. Potter LR. Regulation and therapeutic targeting of peptide-activated receptor guanylyl cyclases. Pharmacol Ther 2011;130:71-82. [ Links ]
28. Corsetti M, Tack J. Linaclotide: A new drug for the treatment of chronic constipation and irritable bowel syndrome with constipation. United European Gastroenterology Journal 2013;1:7-20. [ Links ]
29. Busby RW, Bryant AP, Bartolini WP, Cordero EA, Hannig G, Kessler MM, et al. Linaclotide, through activation of guanylate cyclase C, acts locally in the gastrointestinal tract to elicit enhanced intestinal secretion and transit. Eur J Pharmacol 2010;649:328-35. [ Links ]
30. Eutamene H, Bradesi S, Larauche M, Theodorou V, Beaufrand C, Ohning G, et al. Guanylate cyclase C-mediated antinociceptive effects of linaclotide in rodent models of visceral pain. Neurogastroenterol Motil 2010;22:312-e84. [ Links ]
31. Brierley SM. Guanylate cyclase-C receptor activation: Unexpected biology. Curr Opin Pharmacol 2012;12:632-40. [ Links ]
32. Vazquez Roque M, Camilleri M. Linaclotide, a synthetic guanylate cyclase C agonist, for the treatment of functional gastrointestinal disorders associated with constipation. Expert Rev Gastroenterol Hepatol 2011;5:301-10. [ Links ]
33. Busby RW, Kessler MM, Bartolini WP, Bryant AP, Hannig G, Higgins CS, et al. Pharmacologic properties, metabolism, and disposition of linaclotide, a novel therapeutic peptide approved for the treatment of irritable bowel syndrome with constipation and chronic idiopathic constipation. J Pharmacol Exp Ther 2013;344:196-206. [ Links ]
34. Johnston JM, Kurtz CB, Drossman DA, Lembo AJ, Jeglinski BI, MacDougall JE, et al. Pilot study on the effect of linaclotide in patients with chronic constipation. Am J Gastroenterol 2009;104:125-32. [ Links ]
35. Lembo AJ, Kurtz CB, Macdougall JE, Lavins BJ, Currie MG, Fitch DA, et al. Efficacy of linaclotide for patients with chronic constipation. Gastroenterology 2010;138:886-95 e1. [ Links ]
36. Andresen V, Camilleri M, Busciglio IA, Grudell A, Burton D, McKinzie S, et al. Effect of 5 days linaclotide on transit and bowel function in females with constipation-predominant irritable bowel syndrome. Gastroenterology 2007;133:761-8. [ Links ]
37. Johnston JM, Kurtz CB, Macdougall JE, Lavins BJ, Currie MG, Fitch DA, et al. Linaclotide improves abdominal pain and bowel habits in a phase IIb study of patients with irritable bowel syndrome with constipation. Gastroenterology 2010;139:1877-86 e2. [ Links ]
38. Johnston JM, Schneier HA. Clarification of trial end points presented in a recent review of linaclotide. Expert Rev Gastroenterol Hepatol 2012;6:13-4. [ Links ]
39. Lembo AJ, Schneier HA, Shiff SJ, Kurtz CB, MacDougall JE, Jia XD, et al. Two randomized trials of linaclotide for chronic constipation. N Engl J Med 2011;365:527-36. [ Links ]
40. Rao S, Lembo AJ, Shiff SJ, Lavins BJ, Currie MG, Jia XD, et al. A 12-week, randomized, controlled trial with a 4-week randomized withdrawal period to evaluate the efficacy and safety of linaclotide in irritable bowel syndrome with constipation. Am J Gastroenterol 2012;107:1714-24. [ Links ]
41. Chey WD, Lembo AJ, Lavins BJ, Shiff SJ, Kurtz CB, Currie MG, et al. Linaclotide for irritable bowel syndrome with constipation: A 26-week, randomized, double-blind, placebo-controlled trial to evaluate efficacy and safety. Am J Gastroenterol 2012;107:1702-12. [ Links ]
42. European Medicines Agency. Points to Consider on the Evaluation of Medicinal Products for the Treatment of Irritable Bowel Syndrome. 2003. (Consultado 26/02/2013). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003187.pdf. [ Links ]
43. Guidance for industry: irritable bowel syndrome - clinical evaluation of drugs for treatment. Food and Drug Administration. 2012. (Consultado 26/02/2013). Disponible en: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM205269.pdf. [ Links ]
44. Quigley EM, Tack J, Chey WD, Rao SS, Fortea J, Falques M, et al. Randomised clinical trials: Linaclotide phase 3 studies in IBS-C - A prespecified further analysis based on European Medicines Agency-specified endpoints. Aliment Pharmacol Ther 2013;37:49-61. [ Links ]











 text in
text in