My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
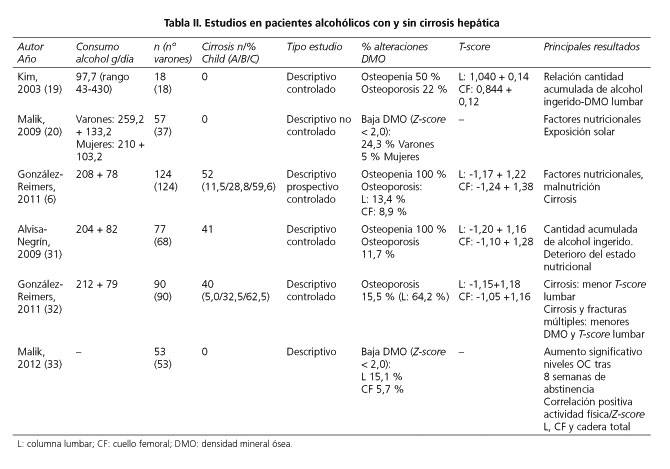
Similars in Google
Share
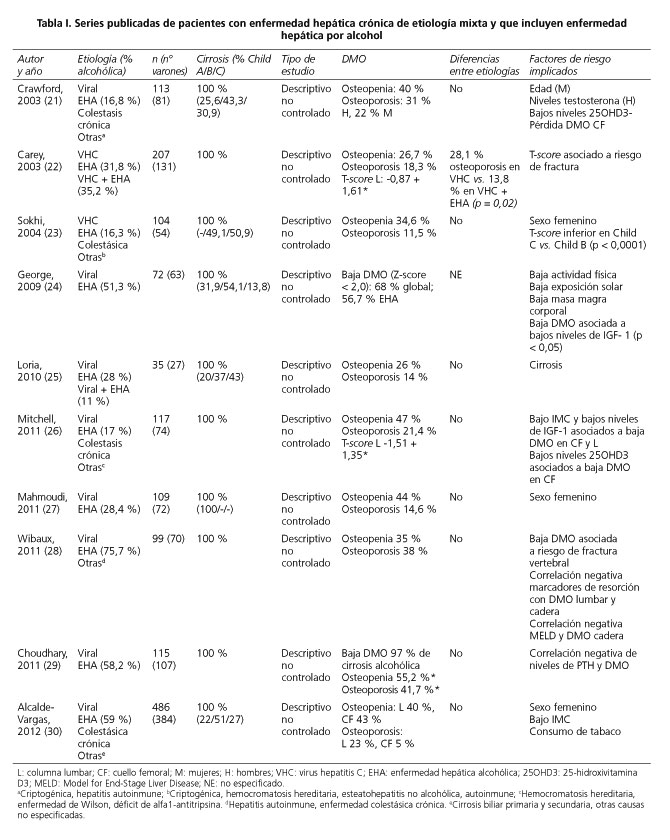
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.105 n.10 Madrid Nov./Dec. 2013
https://dx.doi.org/10.4321/S1130-01082013001000006
PUNTO DE VISTA
Enfermedad hepática alcohólica y alteraciones de la densidad mineral ósea
Alcoholic liver disease and changes in bone mineral density
Germán López-Larramona1, Alfredo J. Lucendo2 y Laura González Delgado3
Servicios de 1Medicina Interna y 2Aparato Digestivo. Hospital General de Tomelloso. Tomelloso, Ciudad Real.
3Atención Primaria. Gerencia de Atención Integrada. Tomelloso, Ciudad Real
Dirección para correspondencia
RESUMEN
La osteoporosis y la osteopenia son alteraciones de la densidad mineral ósea (DMO) que se desarrollan frecuentemente en la enfermedad hepática crónica (EHC). Dichas alteraciones han sido estudiadas predominantemente en la enfermedad colestásica crónica y en la cirrosis hepática. El consumo de alcohol es un factor de riesgo independiente para la aparición de osteoporosis, cuya prevalencia estimada en pacientes con enfermedad hepática por alcohol (EHA) varía entre un 5 % y un 40 %. La pérdida de DMO en la EHA se produce por un disbalance entre formación y resorción ósea. Su etiopatogenia es multifactorial y comprende la toxicidad del alcohol sobre el hueso, las alteraciones endocrinológicas y nutricionales secundarias al alcoholismo y el déficit de osteocalcina, vitamina D e IGF-1, entre otras. El diagnóstico de las alteraciones de la DMO en la EHA se basa en su medición mediante densitometría ósea. El tratamiento incluye el abandono del alcohol y medidas generales de tipo nutricional, abandono del tabaco y ejercicio físico. La suplementación con calcio y vitamina D se recomienda en todos los pacientes con EHA y osteoporosis. Los bisfosfonatos son los principales fármacos para el tratamiento específico de esta entidad. Otras alternativas son el raloxifeno, el tratamiento hormonal sustitutivo y la calcitonina.
La presente revisión abordará los aspectos más relevantes para el manejo clínico de las alteraciones de la DMO en el contexto de la EHA, incluyendo su prevalencia, etiopatogenia y diagnóstico. Por otra parte, se efectuará una revisión del tratamiento de la osteoporosis en la EHC en general, incidiendo en los aspectos específicos relacionados con la pérdida de masa ósea en la EHA.
Palabras clave: Osteopenia. Osteoporosis. Densidad mineral ósea. Hepatopatía alcohólica. Hepatopatía crónica. Alcohol.
ABSTRACT
Osteoporosis and osteopenia are alterations in bone mineral density (BMD) that frequently occur in the context of chronic liver disease (CLD). These alterations have been studied predominantly in chronic cholestatic disease and cirrhosis of the liver. Alcohol consumption is an independent risk factor for the onset of osteoporosis, whose estimated prevalence in patients with alcoholic liver disease (ALD) ranges between 5 % and 40 %. The loss of BMD in ALD is the result of an imbalance between bone formation and resorption. Its pathogenesis is multifactorial and includes the toxic effects of alcohol on bone and endocrine and nutritional disorders secondary to alcoholism and a deficiency of osteocalcin, vitamin D and insulin growth factor-1. The diagnosis of BMD alterations in ALD is based on its measurement using bone densitometry. Treatment includes smoking and alcohol cessation and general measures such as changes in nutrition and exercise. Calcium and vitamin D supplements are recommended in all patients with ALD and osteoporosis. Bisphosphonates are the most commonly prescribed drugs for the specific treatment of this condition. Alternatives include raloxifene, hormone replacement therapy and calcitonin.
This review will address the most important aspects involved in the clinical management of abnormal BMD in the context of ALD, including its prevalence, pathogenesis and diagnosis. We will also review the treatment of osteoporosis in CLD in general, focusing on specific aspects related to bone loss in ALD.
Key words: Osteopenia. Osteoporosis. Bone mineral density. Alcoholic liver disease. Chronic liver disease. Alcohol.
Abreviaturas
CPB: cirrosis biliar primaria.
DMO: densidad mineral ósea.
EHA: enfermedad hepática alcohólica.
EHC: enfermedad hepática crónica.
IGF-1: Insulin growth factor-1.
IL-1β: Interleuquina 1-beta.
IL-6: interleuquina-6.
IMC: índice de masa corporal.
OC: osteocalcina.
OPG: osteoprotegerina.
PTH: hormona paratifoidea.
RANK: receptor activator of NF-KappaB.
RANKL: ligando del
receptor activator of NF-KappaB.
SHBG: globulina ligadura de hormonas sexuales.
THO: trasplante hepático ortotópico.
TNF-α: factor de necrosis tumoral-alfa.
VDR: receptor de vitamina D.
VHC: virus de hepatitis C.
Introducción
La enfermedad hepática crónica (EHC) es una importante causa de morbilidad y mortalidad a nivel mundial. Conlleva complicaciones de tipo hemodinámico y metabólico, como insuficiencia hepática, hipertensión portal, encefalopatía, ascitis, síndrome hepatorrenal y hemorragia digestiva por varices esofágicas (1). La EHC es también un factor de riesgo para el desarrollo de osteoporosis y fracturas óseas. El término "osteodistrofia hepática" se ha utilizado para denominar de forma general a las distintas alteraciones óseas que se desarrollan en la hepatopatía crónica. Dentro de dicha entidad se agrupan la osteopenia, la osteoporosis y la osteomalacia. Las dos primeras se caracterizan por una pérdida de densidad mineral y un deterioro de la microarquitectura ósea que predispone a fracturas por fragilidad. Sin embargo, la osteomalacia, caracterizada por una mineralización ósea deficiente, se observa muy infrecuentemente en la EHC (2). La pérdida de DMO y el consiguiente aumento del riesgo de fractura se han descrito principalmente en las enfermedades colestásicas crónicas -cirrosis biliar primaria (CBP), y colangitis esclerosante primaria-, y en los estadios avanzados de la cirrosis hepática (3). Sin embargo, en los últimos años son cada vez más las observaciones publicadas sobre alteraciones de la DMO en enfermedades hepáticas de otras etiologías y en fase no cirrótica, como hepatitis virales (4), esteatohepatitis grasa no alcohólica (5), enfermedad hepática alcohólica (EHA) (6) y hemocromatosis (7,8).
La EHA supone una importante causa de mortalidad de origen hepático en el mundo occidental (9), y abarca un amplio espectro de manifestaciones clínicas y analíticas, que van desde el hígado graso asintomático hasta la hepatitis alcohólica o la cirrosis con insuficiencia hepática, ictericia, alteraciones de la coagulación y encefalopatía. El American College of Gastroenterology ha elaborado una guía clínica con recomendaciones para el diagnóstico de EHA, que otorgan una especial importancia a la anamnesis, los signos clínicos y los datos de laboratorio (10). Los factores de riesgo que favorecen la evolución a insuficiencia hepática avanzada deben ser conocidos; entre ellos destaca la alta prevalencia de infección por virus de hepatitis C (VHC) descrita entre los alcohólicos (entre un 25 y un 65 %), favoreciendo la progresión de la fibrosis hepática y la comorbilidad asociada (11).
El consumo de alcohol constituye un factor de riesgo para la aparición de osteoporosis y se ha asociado a un mayor riesgo de fractura ósea osteoporótica en varones, con independencia de la existencia de cirrosis e hipogonadismo (12-14). Un estudio que incluyó a 96 varones alcohólicos detectó osteoporosis radiológica en un 47 %, la mayoría con edades entre 46 y 62 años (15). Otro estudio que comparaba a 39 varones alcohólicos con 19 individuos sanos no consumidores de alcohol describió osteopenia en el 23 % de los bebedores de > 100 gramos/día de alcohol durante más de 10 años. Además, el grupo de alcohólicos presentó niveles significativamente menores de proteína ósea Gla y su densidad mineral ósea (DMO) se correlacionó de forma inversa con la ingesta acumulada de alcohol (16). La existencia de alteraciones en la DMO entre pacientes alcohólicos ha sido posteriormente estudiada en distintos trabajos con resultados dispares: mientras que algunas series no han encontrado alteraciones relevantes de la masa ósea (17,18), otros autores han descrito una disminución de DMO entre los individuos con alcoholismo activo (19,20).
La prevalencia de alteraciones de la DMO en pacientes con EHA es variable en las series publicadas que incluyen a pacientes cirróticos con hepatopatía crónica de distintas etiologías. En estas series, la prevalencia de osteoporosis alcanza el 41 % y la osteopenia se sitúa entre el 26 % y el 47 % (21-30) (Tabla I). Existen investigaciones específicas sobre individuos alcohólicos con hepatopatía asociada en una proporción muy dispar (cirrosis entre 0 y 52 %), en las que la incidencia de osteoporosis es de 11-22 % y la osteopenia llega a afectar al 100 % de los pacientes (6,19,20,31-33) (Tabla II). La hepatopatía por alcohol abarca un amplio espectro de enfermedad, y por ello es difícil precisar una prevalencia exacta para cada una de sus fases. Atendiendo a lo descrito en EHC de otras etiologías, la mayor incidencia de pérdida de DMO correspondería a los casos de cirrosis. Por tanto, se deberá prestar especial atención al riesgo de osteopenia y osteoporosis en el paciente con cirrosis alcohólica establecida. Las series publicadas describen un predominio en el sexo masculino, aunque también predomina entre los alcohólicos en la población general. Los factores de riesgo implicados en la pérdida de DMO son diversos entre los diferentes estudios, y se resumen en las tablas I y II.
Etiopatogenia
La pérdida de DMO en la hepatopatía crónica producida por el alcohol es multifactorial, y viene determinada en gran medida por un defecto en la formación de tejido óseo. La mayor parte de los estudios sobre osteoporosis en la EHC definen un déficit de la función osteoblástica como el mecanismo patogénico predominante, como se ha comprobado en estudios histomorfométricos de biopsias óseas de individuos con CBP (34,35). El déficit de función osteoblástica también se refleja en los bajos niveles de osteocalcina (OC) y en el déficit de IGF-1 (insulin growth factor-1) observados en EHC de distintas etiologías (36). Sin embargo, un aumento de la actividad osteoclástica también podría influir en el desarrollo de la afectación ósea, como han mostrado también análisis histomorfométricos desarrollados en enfermedad colestásica crónica (37,38). Además, tanto el suero como la bilirrubina de pacientes ictéricos con CBP y con EHC en estadio avanzado aumentan la expresión génica de factores relacionados con la osteoclastogénesis en cultivos de osteoblastos humanos y de células SAOS-2 de osteosarcoma (39). El consumo crónico de alcohol también favorece la actividad osteoclástica en modelos murinos, a través de la inducción del sistema RANKL (receptor activator of NF-KappaB ligand) mediada por interleuquina (IL)-6 (40).
Desde el punto de vista etiopatogénico, existen tres grandes grupos de factores predisponentes a la aparición de alteraciones de la masa ósea en el paciente con hepatopatía alcohólica:
1. El etanol posee un efecto tóxico directo dosis-dependiente sobre las células osteoblásticas que inhibe la formación y el remodelado óseo (31). El efecto negativo del alcohol sobre la proliferación de cultivos osteoblásticos se ha comprobado tanto en individuos sanos como en modelos animales (41). En dichos modelos se observó un deterioro de las características biomecánicas del hueso y una reducción de la DMO cortical femoral, así como un disbalance entre formación y resorción ósea (42). En un grupo de 32 alcohólicos la prevalencia de osteoporosis fue de un 34 %, con reducción significativa de la DMO a nivel lumbar y femoral, y disminución de la formación ósea asociada a bajos niveles de proteína GLA, análoga a la osteocalcina (OC) por su actividad osteoformadora, y cuyo déficit revirtió con la abstinencia alcohólica (43).
Investigaciones más recientes han descrito un aumento de los niveles de esclerostina sérica en alcohólicos; dicha molécula inhibe la vía osteocitaria de la catenina Wnt/β, y con ello la diferenciación, función y vida media de los osteoblastos. Los niveles de esclerostina se correlacionan positivamente con los de marcadores de resorción ósea como el telopéptido N-terminal y de forma inversa con las concentraciones de osteocalcina (44).
2. El alcoholismo puede producir alteraciones del estado nutricional y déficit de vitamina D: ambos factores, junto con la pérdida de masa muscular secundaria al consumo de alcohol, se han asociado a un aumento del riesgo de fracturas óseas (32). Las alteraciones de los hábitos dietéticos con ingestas irregulares y déficit de proteínas contribuyen también a la pérdida de masa ósea (45), y favorecen bajos niveles séricos de calcio, fósforo y magnesio (46). El sobrecrecimiento bacteriano intestinal aparece tanto en el alcoholismo como en la cirrosis hepática, y contribuye al deterioro del estado nutricional al producir un síndrome de malabsorción. El aumento total de la flora intestinal y sus alteraciones cualitativas favorecen los trastornos de la digestión y de la absorción de nutrientes. En este contexto se ve afectada la absorción de grasas por desconjugación de ácidos biliares, lo cual afecta de forma negativa a la absorción de lípidos, proteínas y carbohidratos (47).
3. Tanto el alcoholismo como la enfermedad hepática per se conllevan una serie de alteraciones endocrinológicas y metabólicas, y favorecen la liberación de citoquinas con efecto deletéreo sobre el metabolismo óseo. Distintas alteraciones hormonales implicadas en la homeostasis ósea, como hiperparatiroidismo, hipogonadismo con bajas concentraciones de testosterona libre, hipercortisolismo y disregulación del eje hipotálamo-hipofisario-gonadal están presentes en el pacientes con EHA (19). Se ha descrito un déficit de IGF-1 en enfermedades hepáticas de diversas etiologías, lo cual incide negativamente sobre la mineralización al no estimular la proliferación osteoblástica y la síntesis de colágeno en la matriz ósea (48). El déficit de vitamina D asociado a la EHC es multifactorial (3,49) y se asocia a hiperparatiroidismo secundario, aumento del turnover óseo y pérdida de DMO. Se han descrito bajos niveles séricos de 25-hidroxi-vitamina D en pacientes con cirrosis alcohólica, con una incidencia estimada de un 32 % de casos con niveles de vitamina D3 por debajo de 20 ng/ml (50). Los niveles de 25-hidroxi-vitamina D continúan disminuyendo a medida que la cirrosis progresa (51) y, aunque su déficit raramente produce osteomalacia, tal y como se ha descrito en algunos análisis morfométricos óseos de pacientes con cirrosis alcohólica (52). Pese a todo, y aunque la hipovitaminosis es frecuente en la EHC, la mayoría de estudios no han hallado una correlación significativa entre niveles séricos de vitamina D y desarrollo de osteopenia, por lo que la contribución de este déficit vitamínico a la patogenia de la osteodistrofia hepática podría ser escasa (53), al igual que la función de ciertos polimorfismos del gen del receptor de vitamina D (54). El papel lesivo de ciertos ácidos biliares sobre la viabilidad osteoblástica a través de su interferencia con la función de los receptores de la vitamina D también ha sido estudiado: el ácido litocólico, que puede aumentar sus concentraciones en EHC avanzada, interfiere en la función de dichos receptores afectando a la función de la vitamina D e inhibiendo la expresión de genes pro-osteogénicos como el de la OC (55).
La vitamina K es un cofactor en la síntesis de OC por parte de los osteoblastos. El tratamiento con vitamina K previno la pérdida de masa ósea en un grupo de mujeres con cirrosis viral (56), pero otras investigaciones sobre pacientes con CBP no han demostrado la relación entre vitamina K y la pérdida de DMO (57).
El hipogonadismo es frecuente en la hepatopatía alcohólica y en la hemocromatosis debido al bajo nivel de liberación de gonadotropina hipotalámica y a la disfunción gonadal primaria (13). Los varones con cirrosis alcohólica presentan niveles reducidos de testosterona, lo cual aumenta el riesgo de fractura de cadera (58). Las mujeres amenorreicas con EHA también muestran bajos niveles séricos de hormona luteinizante (LH), foliculoestimulante (FSH) y de estradiol, que predispondrían a una mayor pérdida de masa ósea (57).
El sistema RANK/RANKL/OPG ejerce una importante acción moduladora del remodelado óseo. La activación del receptor RANK por parte su ligando RANKL estimula la diferenciación osteoclástica a partir de las células osteoblásticas. Por el contrario, la unión de la osteoprotegerina (OPG) al ligando RANKL inhibe la activación de los osteoclastos y la apoptosis osteoblástica, y actúa como un mecanismo protector de la DMO (59,60). Los alcohólicos presentan niveles séricos significativamente elevados de TNF-α, IL- 1β e IL-6, con independencia del estadio de la enfermedad hepática (61). Estas citoquinas son liberadas por el efecto directo del etanol y de la propia enfermedad hepática (40) y regulan el sistema RANK/OPG favoreciendo la producción del ligando RANKL y la osteoclastogénesis (62,63). En pacientes alcohólicos también se han descrito niveles séricos aumentados de OPG, lo cual supondría un mecanismo compensador frente al aumento de la concentración de citoquinas prorresortivas (64).
Diagnóstico
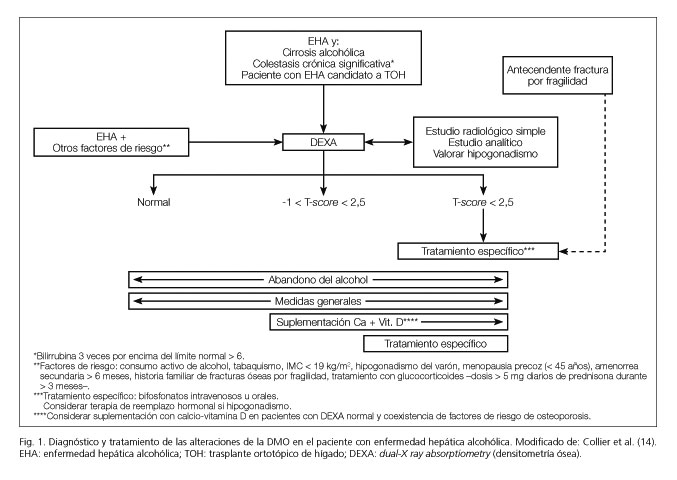
La EHC, sobre todo en estadio de cirrosis, es un factor de riesgo para el desarrollo de osteoporosis y fracturas óseas. Las alteraciones del metabolismo mineral óseo deben ser consideradas siempre en cirróticos y en la enfermedad colestásica crónica, especialmente CBP (65). La aproximación diagnóstica al paciente con EHA y sospecha de baja DMO debe contemplar todos los factores de riesgo presentes para el desarrollo de osteoporosis: abuso de alcohol y cantidad diaria ingerida, tabaquismo, índice de masa corporal (IMC) < 19 kg/m2, hipogonadismo en varones, menopausia precoz (antes de los 45 años), amenorrea secundaria de más de 6 meses de duración, historia familiar de fracturas óseas por fragilidad y tratamiento con glucocorticoides (dosis superiores a 5 mg diarios de prednisona durante más de tres meses) (14).
Otro aspecto importante es la valoración del riesgo de fractura osteoporótica en estos pacientes: al igual que en la población general, la herramienta de cálculo de riesgo más difundida es el Fracture Risk Assessment (FRAX), diseñado por la Organización Mundial de la Salud (OMS) a partir de datos de cohortes procedentes de distintos países, y disponible en la web: www.shef.ac.uk/FRAX/tool.jsp. Esta aplicación permite calcular el riesgo de fractura global y de cadera a los 10 años, a partir de la estimación de varios factores de riesgo, entre los que se encuentran el consumo de 3 o más dosis diarias de alcohol (considerando una dosis equivalente a 8-10 gramos de alcohol) y la hepatopatía crónica como causa de osteoporosis secundaria (66). Entre las ventajas de FRAX está la posibilidad de utilizarla sin disponer de los valores de DMO, permitiendo estimar el riesgo de fractura antes de tener acceso a los resultados de una densitometría (67). Respecto a sus limitaciones, FRAX incorpora únicamente la DMO del cuello femoral y no contempla otros factores de riesgo como las caídas frecuentes. Además, no existen estudios multicéntricos específicos respecto al uso de FRAX en poblaciones con EHC.
El diagnóstico definitivo de la osteoporosis en EHA se efectuará tras una densitometría ósea (dual energy X-ray absorptiometry, DEXA), considerada el patrón oro para la medición de la densidad ósea. Según los criterios de la OMS de 1994, la DMO se clasifica en tres categorías basadas en el T-score (desviación estándar respecto a la media de la DMO en el adulto joven): DMO normal si el T-score es mayor o igual a -1, osteopenia si el T-score se encuentra entre -1 y -2,5, y osteoporosis si el T-score es igual o menor a -2,5 (68). El alcoholismo crónico, la presencia de algún factor de riesgo para osteoporosis en un paciente con EHA, o la existencia de colestasis crónica, cirrosis hepática o fractura por fragilidad previa son indicaciones para realizar una DEXA de columna lumbar y cadera (36). Las mujeres postmenopáusicas con enfermedad hepática por alcohol y presencia de factores de riesgo adicionales, o los candidatos a trasplante hepático ortotópico (THO) son también subsidiarios de estudio mediante DEXA (53).
En aquellos pacientes con un elevado volumen de ascitis, la DEXA lumbar puede mostrar resultados de DMO falsamente disminuidos, como se ha comprobado en un estudio sobre 25 pacientes con cirrosis avanzada (24 % de origen enólico), a los que se sometió a DEXA antes y después de una paracentesis evacuadora: se produjo un aumento del 7 % en la DMO lumbar post-evacuación entre los individuos con paracentesis superior a 4 litros, frente al 1,5 % entre los de menor volumen evacuado (p < 0,001). Esto se asoció a un cambio en el diagnóstico previo de osteoporosis u osteopenia en el 12 % de los casos, de lo que se desprende que la densitometría debería realizarse tras paracentesis, o bien sobre localizaciones alternativas, como el antebrazo (69).
El consumo de alcohol también es un factor de riesgo para el desarrollo de fracturas óseas (57,70,71). El 30 % de los varones alcohólicos con más de 20 años de consumo presentan fracturas vertebrales, aunque en la mayoría de los casos son asintomáticas (72). Distintos autores recomiendan realizar una radiografía simple lateral de columna dorsal y lumbar a los pacientes con EHC en busca de fracturas vertebrales (36,53,65). La existencia de fracturas radiológicas, junto con criterios densitométricos compatibles, permitirá diagnosticar una osteoporosis severa, lo cual supondrá a su vez una indicación de tratamiento específico para evitar futuras fracturas por fragilidad (36). Los estudios disponibles sobre la prevalencia de fracturas vertebrales en pacientes con EHC son escasos, habiéndose estimado que están presentes en un 23-36 % de los casos de cirrosis alcohólica en espera de TOH (28,73). Por otro lado, la incidencia estimada de fracturas vertebrales es de un 30 % en los primeros 6-12 meses postrasplante hepático, motivo por el que se recomienda un estudio radiológico del esqueleto axial en la valoración pretrasplante, y repetirlo con posterioridad al TOH si el paciente refiere pérdida de estatura o dolor dorsal severo (74). Es también conocida la mayor incidencia de fracturas postrasplante entre los sujetos con fracturas radiológicas previas al mismo, lo que vendría a reforzar la importancia de implementar medidas de prevención y tratamiento en estos pacientes (65,75).
Los estudios analíticos recomendados en el paciente con EHA y osteoporosis incluyen los niveles de calcio, fósforo, 25-hidroxi-vitamina D y hormona paratiroidea (PTH), así como un estudio de función tiroidea y gonadal (estradiol, FSH y LH en mujeres; testosterona libre y ratio testosterona/SHBG -sex hormone binding globulin- en hombres) (74). Carecemos de evidencias firmes respecto al uso de marcadores de remodelado óseo en el estudio analítico de pacientes con EHA y sospecha de osteodistrofia hepática: tanto los marcadores de resorción (beta-crosslaps o telopéptido carboxilo-terminal del colágeno tipo I) como los de osteoformación (osteocalcina y fosfatasa alcalina total) pueden verse influidos por el grado de fibrosis hepática y, aunque pueden tener una cierta utilidad en la valoración de la respuesta al tratamiento antirresortivo, no existen estudios sobre su utilidad en la EHA y su relación con la pérdida de DMO y el riesgo de fractura (14,74,75).
Tratamiento
Las evidencias disponibles respecto al tratamiento de la osteopenia y la osteoporosis en pacientes con EHC se basan en gran medida en resultados y recomendaciones de trabajos y consensos sobre osteoporosis postmenopáusica, y en pequeñas series de pacientes con EHC de etiología mixta. Carecemos de ensayos clínicos controlados, y no existen trabajos específicos sobre el tratamiento de la osteoporosis en pacientes con EHA (14,49,53,74). Por este motivo, la mayor parte de las recomendaciones de tratamiento para la osteoporosis en la hepatopatía crónica en general se hacen extensivas a la EHA.
El tratamiento de la osteodistrofia en la EHA abarcará una serie de medidas generales, aplicables independientemente del grado de afectación ósea, y un tratamiento farmacológico específico cuya utilización dependerá del grado de pérdida de DMO y de la coexistencia de otros factores de riesgo como el hipogonadismo (14,74). Por otra parte, se deberá considerar la existencia de cirrosis y de escenarios clínicos poco frecuentes, como son el tratamiento de la osteoporosis del varón o de la mujer premenopáusica.
Medidas generales de tratamiento
Deberán identificarse todos aquellos factores que contribuyen a la pérdida de DMO. En caso de consumo activo de alcohol se emprenderán las medidas necesarias para su deshabituación. La abstinencia en pacientes con antecedentes de alcoholismo es capaz de aumentar los niveles séricos de vitamina D y de marcadores de osteoformación como la osteocalcina, y también detener la pérdida de masa ósea evitando la progresión de la osteopenia (31). La reversibilidad de los efectos tóxicos del etanol sobre el hueso se demostró en un estudio llevado a cabo en 53 pacientes alcohólicos sin cirrosis sometidos a tratamiento de deshabituación durante 8 semanas: se produjo un aumento significativo de la OC sérica tras el periodo de abstinencia alcohólica (21,47 g/l al inicio del tratamiento vs. 25,54 g/l a las 8 semanas, p < 0,001), sin detectarse cambios en la concentración sérica de beta-crosslaps (33). Los fármacos utilizados habitualmente para tratar la dependencia del alcohol no presentan efectos adversos significativos sobre el metabolismo óseo, pero el disulfiram, la naltrexona y el nalmefene están contraindicados en caso de insuficiencia hepática avanzada por su hepatotoxicidad (76).
Se debe fomentar el abandono del tabaco y, en caso de precisarse tratamiento con glucocorticoides por otros motivos, las dosis de estos serán las mínimas eficaces. Se recomendará la práctica de ejercicio físico moderado, preferentemente aquellas actividades que refuercen la musculatura dorso-lumbar (65). Los posibles déficits nutricionales del paciente con alcoholismo y EHC deberán ser evaluados y corregidos con medidas dietéticas y/o de suplementación, dada la elevada frecuencia de anorexia y malnutrición en estos individuos (77,78).
La suplementación con calcio y vitamina D en la EHC se ha estudiado predominantemente en la enfermedad colestásica crónica. En un estudio de 25 mujeres con CBP, 19 de ellas postmenopáusicas, el tratamiento con calcitonina o placebo y suplementos de 1 g diario de calcio, incrementó la DMO en ambos grupos (79). Por el contrario, en otro trabajo sobre 203 pacientes con CBP, 96 fueron aleatorizados para recibir calcio sin observarse diferencias en la DMO a nivel lumbar tras 12 meses de tratamiento (80).
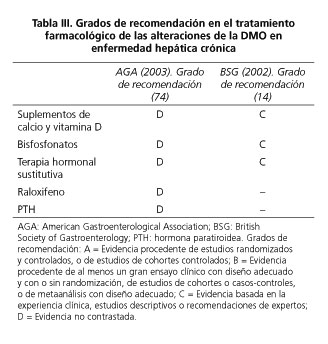
La administración de vitamina D en pacientes con CBP no ha demostrado prevenir la progresión de la osteopenia secundaria a la colestasis crónica, tal y como se observó en dos pequeños estudios prospectivos de tratamiento durante un año (81,82). En contraste, una investigación efectuada en 18 varones con cirrosis enólica demostró que los pacientes tratados con vitamina D2 (50.000 UI, 2-3 veces/semana) o con 25-hidroxi-vitamina D (20-50 mg/día) durante una media de 11 meses mejoraron significativamente su densidad mineral lumbar (50). Por tanto, aunque no existen datos que confirmen su eficacia sobre la pérdida de masa ósea, la administración de suplementos de calcio y vitamina D se recomienda en pacientes con EHC, en dosis diarias de 1.000-1.500 mg y 800 UI, respectivamente -grados de recomendación D (74) y C (14)-.
Tratamiento farmacológico específico
Terapia hormonal. Tratamiento del hipogonadismo
El tratamiento sustitutivo hormonal con estrógenos es efectivo en la prevención y tratamiento de la osteoporosis postmenopáusica y en la prevención de fracturas. La evidencia disponible sobre la eficacia y seguridad del tratamiento hormonal en pacientes con EHC es escasa, y no hay estudios desarrollados específicamente en pacientes con EHA.
El tratamiento transdérmico con estradiol y medroxiprogesterona, por su efecto antirresortivo sobre el hueso, produjo un incremento de la DMO tras periodos entre 1 y 2 años en mujeres postmenopáusicas con CBP y en pacientes sometidas a TOH (83-85). El tratamiento del hipogonadismo masculino con testosterona ha demostrado su eficacia en pacientes con hemocromatosis hereditaria. No obstante, se debe evaluar cuidadosamente su balance beneficio-riesgo antes de iniciarlo (86).
Las guías clínicas sobre enfermedad metabólica ósea en EHC establecen que el uso de terapia sustitutiva hormonal transdérmica, incluyendo los casos de EHA, podría considerarse en mujeres con hipogonadismo y menopausia precoz (antes de los 45 años). El hipogonadismo masculino se tratará con testosterona, siempre por vía transdérmica (grado de recomendación D en ambos casos) (53,74). El periodo de tratamiento recomendado para mujeres con hipogonadismo es de 5 a 10 años. Duraciones superiores deben ser valoradas exhaustivamente, dado el aumento de riesgo de cáncer de mama. Tras la aparición de los resultados de los estudios WHI (87) y HERS (88), y dado que actualmente se dispone de otras alternativas eficaces y con menos efectos adversos, la terapia hormonal no se considera una opción preferente en la osteoporosis del paciente con hepatopatía crónica (66,75).
Bisfosfonatos
Los bisfosfonatos son los fármacos antirresortivos de elección para tratar la osteoporosis, habiendo demostrado eficacia en la reducción del riesgo de fracturas vertebrales y no vertebrales, en osteoporosis postmenopáusica y en la secundaria a corticoides (89-91).
Los datos sobre la eficacia y seguridad de estos fármacos en el tratamiento de la osteoporosis asociada a EHC son todavía escasos y poco concluyentes, y derivan de un número reducido de estudios, incluyendo pocos pacientes, en su mayoría con enfermedad colestásica crónica (CBP). Sus resultados permiten concluir que, en CBP, el tratamiento durante 2 años con etidronato cíclico previene la pérdida de DMO (92), y que alendronato es capaz de aumentar significativamente la DMO a nivel lumbar y femoral, con una efectividad superior al etidronato cíclico (93). Recientemente se han publicado resultados favorables en pacientes con CBP tratados con dosis de 70 mg semanales de alendronato, que presentan mejor tolerancia que con pautas diarias (94). También existen trabajos sobre el uso de bisfosfonatos en EHC vírica en los que el etidronato cíclico redujo la incidencia de fractura en mujeres postmenopáusicas con hepatitis viral crónica, tras un seguimiento de 8 años (95).
Los bisfosfonatos pueden producir esofagitis y ulceración mucosa gastroesofágica (96), con el subsiguiente riesgo de sangrado digestivo, lo cual se debe considerar en los pacientes con varices esofágicas. Aunque dichos efectos parecen ser muy poco frecuentes (93), algunos autores recomiendan valorar su administración parenteral cuando se conozca la existencia de varices (57). Algunos estudios retrospectivos que han evaluado la administración parenteral de bisfosfonatos en pacientes con CBP concluyen que un 47 % de los pacientes que reciben este tratamiento presentan un incremento de la DMO de un 8,7 % a nivel lumbar frente al 0,8 % en fémur proximal (97). Además, el uso de bisfosfonatos parenterales previo al THO podría ser beneficioso para reducir la tasa de incidencia de fracturas postrasplante (98). Otros trabajos realizados con pamidronato, bisfosfonato parenteral con elevada potencia antirresortiva, mostraron resultados discordantes respecto a su eficacia para prevenir pérdida de DMO y fracturas en pacientes con EHC en periodo pre y postrasplante (99,100).
Pese a todo lo expuesto, el papel concreto de los bisfosfonatos en el tratamiento de la osteoporosis en la enfermedad hepática está todavía por definir, dada la escasez de estudios disponibles y su pequeño tamaño muestral. Del mismo modo, carecemos de evidencias procedentes del uso de bisfosfonatos en pacientes con EHA, tanto cirróticos como no cirróticos. Por este motivo, las pautas de manejo de bisfosfonatos en hepatopatía alcohólica deberían basarse en las guías generales de práctica clínica sobre osteoporosis y enfermedad hepática. A este respecto, el documento de consenso de la American Gastroenterological Association (AGA) de 2003 recomienda el uso de bisfosfonatos en pacientes con EHC y diagnóstico de osteoporosis, fractura vertebral, o en individuos con tratamiento esteroideo durante períodos superiores a tres meses (grado de recomendación D) (74). Las guías británicas de 2002 sobre el manejo de la osteoporosis asociada a EHC recomienda el tratamiento con bisfosfonatos en aquellos pacientes que presenten fracturas por fragilidad y en caso de un T-score menor de -2,5 (recomendación grado C) (14). En la tabla III se resumen los grados de recomendación establecidos por las diferentes sociedades científicas que han publicado guías sobre el tratamiento de la osteoporosis en la EHC.
Algunos efectos adversos de los bisfosfonatos descritos en la literatura son la osteonecrosis de mandíbula (75) y la supresión del remodelado óseo con el consiguiente riesgo de fracturas atípicas (101). No existen directrices concretas respecto a la duración del tratamiento en pacientes con EHC y EHA: en general, se recomienda un control densitométrico anual en las situaciones de EHC con riesgo de pérdida acelerada de masa ósea, como en pacientes con colestasis severa, en tratamiento esteroideo o trasplantados. En el resto de casos, debería repetirse la DEXA cada 2 o 3 años y proceder según sus resultados (36).
Otros tratamientos
Raloxifeno es un modulador selectivo de los receptores estrogénicos aprobado para el tratamiento y prevención de la osteoporosis postmenopáusica. La experiencia de uso del raloxifeno en EHC se limita a pequeños estudios en mujeres postmenopáusicas con CBP (102), y no se dispone de datos sobre la eficacia de este fármaco en la EHA.
La calcitonina inhibe la resorción ósea, y por vía subcutánea e intranasal ha sido utilizada para prevenir la osteoporosis postmenopáusica y esteroidea (103,104). Su uso en combinación con calcio y vitamina D redujo eficazmente la pérdida de masa ósea en un grupo de 36 mujeres con osteopenia y CBP (105). Por el contrario, su administración durante 6 meses a pacientes con osteopenia severa y CBP no fue eficaz para prevenir la pérdida de masa ósea trabecular (79). También se observan resultados discordantes en el uso de calcitonina en pacientes sometidos a THO: la administración intramuscular de 40 unidades diarias durante 1 año aumentó significativamente la DMO vertebral un 6,4 % en 120 pacientes postrasplantados (106), mientras que en otro grupo de 63 pacientes con enfermedad colestásica crónica en su primer año post-TOH el tratamiento con calcitonina no previno la pérdida de masa ósea y las fracturas espontáneas acontecidas en este periodo (107). Los resultados disponibles sobre la eficacia de la calcitonina en EHC son dispares, y no existen estudios específicos sobre su eficacia y seguridad en pacientes con EHA.
El tratamiento con PTH estimula la formación de tejido óseo a través de la activación osteoblástica. La teriparatida, molécula formada por los 34 primeros aminoácidos de la PTH, ha demostrado reducir la incidencia de fracturas vertebrales y no vertebrales en osteoporosis postmenopáusica, con un aumento de la DMO vertebral y femoral (108,109). Sin embargo, el papel de la PTH como tratamiento en la osteopenia asociada a la EHC no está bien definido porque solo existen algunos estudios experimentales en modelos animales con colestasis inducida (110). Por ello, no es posible hacer recomendaciones firmes para el tratamiento de la osteoporosis con PTH o teriparatida en el paciente con EHA.
Trasplante hepático ortotópico
La mayoría de los pacientes sometidos a THO sufren una pérdida de DMO en los primeros 3-6 meses postrasplante (111,112). La probabilidad de fractura ósea en este periodo oscila entre un 6 y un 65 % (113), con su mayor incidencia en los primeros 2 años y en la columna vertebral (75,114).
Los factores que predisponen a la pérdida de masa ósea tras THO incluyen el tratamiento esteroideo e inmunosupresor a altas dosis, las alteraciones nutricionales y la inmovilización perioperatoria (115). Sin embargo, y pese a la pérdida inicial de DMO, a medio y largo plazo se observa una mejoría de la misma. Es por ello que el THO se considera el tratamiento más eficaz frente a la osteoporosis del paciente con EHC.
Distintos bisfosfonatos como alendronato, risedronato, ácido zoledrónico y pamidronato, asociados en algunos casos a calcio y vitamina D, han sido objeto de múltiples estudios para el tratamiento y prevención de la osteoporosis post-THO. El alendronato semanal ha demostrado aumentar significativamente la DMO y prevenir pérdida de masa ósea post-THO, aunque sin efectos relevantes sobre la tasa de fracturas óseas (116,117). El pamidronato, administrado 1 y 12 semanas postrasplante, aumentó la DMO en columna lumbar (118), y el ácido zoledrónico (bisfosfonato de administración parenteral) mostró resultados favorables sobre la masa ósea lumbar, cuello femoral y cadera total en una pauta de tratamiento tras 1 semana y a los 1, 3, 6 y 9 meses post-THO, aunque con efectos adversos destacables, como hiperparatiroidismo secundario e hipocalcemia postinfusión (119). Es destacable que tanto pamidronato como ácido zoledrónico no mostraron efectos significativos sobre la incidencia de fracturas postrasplante en las primeras investigaciones, aunque estudios posteriores han descrito reducciones significativas de dicha incidencia utilizando dosis superiores de zoledronato durante los primeros 12 meses tras el TOH (120). Investigaciones más recientes han evaluado la eficacia del pamidronato en administración mensual junto con calcio y vitamina D para el tratamiento de la osteopenia postrasplante y su impacto sobre la incidencia de fracturas óseas. Se documentó un incremento significativo de la DMO lumbar y en el cuello femoral, además de una disminución de la tasa de fracturas postrasplante al 5,4 % (111). Hasta el momento, no existen ensayos diseñados para estudiar específicamente la efectividad del tratamiento con bisfosfonatos en pacientes con cirrosis alcohólica sometidos a TOH, y su capacidad para prevenir la pérdida de masa ósea y reducir la tasa de fracturas.
Áreas de incertidumbre. guías clínicas
Existe una gran variabilidad en la incidencia de alteraciones de la DMO en las distintas series publicadas, que agrupan generalmente hepatopatía crónica de etiologías diferentes en grupos de pequeño tamaño muestral. El carácter multifactorial de la pérdida de masa ósea en la EHC en general, y en la EHA en particular, hace que sus mecanismos patogénicos sean todavía poco conocidos. Por ello, deberían desarrollarse más estudios de carácter prospectivo y multicéntrico, en poblaciones homogéneas en cuanto a etiología y estadio de la EHC. Este aspecto es especialmente relevante en el caso de la EHA, dado el amplio espectro de daño hepático producido por el alcohol y puesto que, a tenor de lo descrito en otros estudios, la magnitud de la afectación ósea será mayor en la insuficiencia hepática alcohólica en estadio avanzado.
No existen algoritmos específicos para las alteraciones de la DMO en el paciente con EHA. Basándonos en las recomendaciones de las guías al respecto publicadas para EHC, proponemos un esquema orientativo de actuación adaptado al paciente con enfermedad hepática alcohólica (Fig. 1). En lo referente al tratamiento de la osteoporosis en el contexto clínico de la EHA, las evidencias actuales no proceden de estudios aleatorizados y controlados, sino de resultados de pequeños estudios en grupos reducidos de pacientes con EHC de distintas etiologías, predominando la enfermedad colestásica crónica y los grupos de pacientes con cirrosis avanzada y en espera de THO.
Se han publicado algunas guías de práctica clínica sobre el manejo de la osteopenia y la osteoporosis en EHC: en 2002 se publicó el consenso del grupo de trabajo de la Asociación Británica para el Estudio del Hígado y del British Liver Trust (13), y en 2003 la revisión técnica de la AGA sobre osteoporosis en enfermedades hepáticas (73). En ambos documentos se recogen las principales directrices y recomendaciones para el diagnóstico y el tratamiento de la osteodistrofia hepática. La revisión sistemática realizada concluyó que la evidencia científica existente en este campo es todavía muy escasa, tanto en los aspectos etiopatogénicos como en el manejo clínico de la osteoporosis secundaria a la EHC. No se efectúan recomendaciones específicas para las distintas etiologías de la EHC, y por tanto no se especifican pautas terapéuticas concretas para el paciente con EHA. Las recomendaciones reflejadas en la presente revisión (Fig. 1) son en su mayoría consistentes con las recogidas en las guías clínicas anteriormente citadas.
Conclusiones
La pérdida de DMO es una complicación frecuente de la EHC en general, y también de la EHA. El consumo de alcohol y la propia hepatopatía secundaria al mismo son factores predisponentes para la pérdida de DMO. La etiopatogenia de la osteoporosis en la EHA es multifactorial, y el déficit de formación ósea parece ser el mecanismo principal en la aparición de osteopenia, como consecuencia de la toxicidad directa del alcohol sobre el hueso, las alteraciones macro y micronutricionales acompañantes, las disfunciones endocrino-metabólicas secundarias al alcoholismo y a la EHC, y la liberación de diferentes citoquinas con efecto deletéreo sobre la masa ósea.
La densitometría ósea es fundamental para el diagnóstico de la osteoporosis, siendo además recomendable un estudio analítico que descarte alteraciones concomitantes de la función gonadal y de los niveles de vitamina D en todos los pacientes con EHA. Las principales indicaciones para la realización de un estudio de DMO en pacientes con EHA son: cirrosis alcohólica, presencia de colestasis significativa, y antecedente de fractura ósea por fragilidad. Asimismo, es importante realizar una densitometría en los pacientes candidatos a THO, ya que una baja DMO y la existencia de fracturas previas aumentan el riesgo de pérdida de masa ósea en el periodo postrasplante. Por último, aquellos pacientes con EHA y otros factores de riesgo para la osteoporosis son también subsidiarios de una valoración de la DMO mediante DEXA.
En la prevención y tratamiento de la osteoporosis del paciente con EHA es clave la deshabituación y abstinencia alcohólica, que ha demostrado su capacidad para detener la progresión de la osteopenia. También deben corregirse los déficits nutricionales asociados, recomendándose la suplementación con calcio y vitamina D. No existen pautas concretas para el tratamiento farmacológico de la osteoporosis en la EHA. Los bisfosfonatos, que han demostrado su eficacia para aumentar la DMO en enfermedad colestásica crónica y en el paciente postrasplantado con un buen perfil de seguridad, son actualmente la principal opción de tratamiento antirresortivo específico.
Las guías de práctica sobre DMO y hepatopatía crónica recogen recomendaciones de diagnóstico y tratamiento, pero no incluyen la evidencia procedente de las series y estudios sobre la materia publicados en los últimos años. Sería deseable disponer de estudios aleatorizados, prospectivos y multicéntricos, realizados sobre grupos homogéneos de pacientes con enfermedad hepática crónica alcohólica en sus diferentes estadios. El desarrollo de estudios sobre el tratamiento con bisfosfonatos y con nuevos agentes antiosteoporóticos en pacientes con EHA sería de utilidad para mejorar el manejo clínico de la osteoporosis en dicha población. Por otra parte, también sería necesario conocer las alteraciones específicas de la DMO en pacientes con EHA en fase pre- y postrasplante, así como la utilidad de los fármacos antirresortivos en la prevención de fracturas y en el tratamiento de la osteoporosis en estos pacientes.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Germán López-Larramona.
Servicio de Medicina Interna.
Hospital General de Tomelloso.
Vereda de Socuéllamos, s/n.
13700 Tomelloso, Ciudad Real
e-mail: germll2003@yahoo.es
Recibido: 11-03-2013
Aceptado: 03-06-2013
Bibliografía
1. Alter MJ. Hepatitis C virus infection in the United States. J Hepatol 1999;31:88-91. [ Links ]
2. Sanchez AJ, Aranda-Michel J. Liver disease and osteoporosis. Nutr Clin Pract 2006;21:273-8. [ Links ]
3. Gasser RW. Cholestasis and metabolic bone disease - a clinical review. Wien Med Wochenschr 2008;158:553-7. [ Links ]
4. Schiefke I, Fach A, Wiedmann M, Aretin AV, Schenker E, Borte G, et al. Reduced bone mineral density and altered bone turnover markers in patients with non-cirrhotic chronic hepatitis B or C infection. World J Gastroenterol 2005;11:1843-7. [ Links ]
5. Moon SS, Lee YS, Kim SW. Association of nonalcoholic fatty liver disease with low bone mass in postmenopausal women. Endocrine 2012;42:423-9. [ Links ]
6. González-Reimers E, Alvisa-Negrín J, Santolaria-Fernandez F, Ros-Vilamajó R, Martín-González MC, Hernández-Betancor I, et al. Prognosis of osteopenia in chronic alcoholics. Alcohol 2011;45:227-38. [ Links ]
7. Guggenbuhl P, Fergelot P, Doyard M, Libouban H, Roth MP, Gallois Y, et al. Bone status in a mouse model of genetic hemochromatosis. Osteoporos Int 2011;22:2313-9. [ Links ]
8. Rueda Adel C, Grande NC, Fernández EA, Enríquez de Salamanca R, Sala LA, Jiménez MJ. Mutations in HFE and TFR2 genes in a Spanish patient with hemochromatosis. Rev Esp Enferm Dig 2011;103:379-82. [ Links ]
9. Paula H, Asrani SK, Boetticher NC, Pedersen R, Shah VH, Kim WR. Alcoholic liver disease-related mortality in the United States: 1980-2003. Am J Gastroenterol 2010;105:1782-7. [ Links ]
10. O'Shea RS, Dasarathy S, McCullough AJ; Practice Guideline Committee of the American Association for the Study of Liver Diseases, Practice Parameters Committee of the American College of Gastroenterology. Alcoholic liver disease. Hepatology 2010;51:307-28. [ Links ]
11. Koff RS, Dienstag JL. Extrahepatic manifestations of hepatitis C and the association with alcoholic liver disease. Semin Liver Dis 1995;15:101-9. [ Links ]
12. Poor G, Atkinson EJ, O'Fallon WM, Melton LJ 3rd. Predictors of hip fractures in the elderly. J Bone Miner Res 1995;10:1990-7. [ Links ]
13. Diamond T, Stiel D, Lunzer M, Wilkinson M, Posen S. Ethanol reduces bone formation and may cause osteoporosis. Am J Med 1989;86:282-8. [ Links ]
14. Collier JD, Ninkovic M, Compston JE. Guidelines on the management of osteoporosis associated with chronic liver disease. Gut 2002;50(Supl. 1):i1-9. [ Links ]
15. Spencer H, Rubio N, Rubio E, Indreika M, Seitam A. Chronic alcoholism. Frequently overlooked cause of osteoporosis in men. Am J Med 1986;80:393-7. [ Links ]
16. González-Calvin JL, García-Sánchez A, Bellot V, Muñoz-Torres M, Raya-Álvarez E, Salvatierra-Ríos D. Mineral metabolism, osteoblastic function and bone mass in chronic alcoholism. Alcohol Alcohol 1993;28:571-9. [ Links ]
17. Laitinen K, Karkkainen M, Lalla M, Lamberg-Allardt C, Tunninen R, Tahtela R, et al. Is alcohol an osteoporosis-inducing agent for young and middle-age women? Metabolism 1993;42:875-81. [ Links ]
18. Odvina CV, Safi I, Wojtowicz CH, Barengolts EI, Lathon P, Skapars A, et al. Effect of heavy alcohol intake in the absence of liver disease on bone mass in black and white men. J Clin Endocrinol 1995;80:2499-503. [ Links ]
19. Kim MJ, Shim MS, Kim MK, Lee Y, Shin YG, Chung CH, et al. Effect of chronic alcohol ingestion on bone mineral density in males without liver cirrhosis. Korean J Inter Med 2003;18:174-80. [ Links ]
20. Malik P, Gasser RW, Kemmler G, Moncayo R, Finkenstedt G, Kurz M, et al. Low bone mineral density and impaired bone metabolism in young alcoholic patients without liver cirrhosis: a cross-sectional study. Alcohol Clin Exp Res 2009;33:375-81. [ Links ]
21. Crawford BAL, Kam C, Donaghy AJ, McCaughan GW. The heterogeneity of bone disease in cirrhosis: A multivariate analysis. Osteoporos Int 2003;14:987-94. [ Links ]
22. Carey E, Balan. Metabolic bone disease in patients with liver disease. Curr Gastroenterol Rep 2003;5:71-7. [ Links ]
23. Sokhi RP, Anantharaju A, Kondaveeti R, Creech SD, Islam KK, van Thiel D. Bone mineral density among cirrhotic patients awaiting liver transplantation. Liver Transpl 2004;10:648-53. [ Links ]
24. George J, Ganesh HK, Acharya S, Bandgar TR, Shivane V, Karvat A, et al. Bone mineral density and disorders of mineral metabolism in chronic liver disease. World J Gastroenterol 2009;15:3516-22. [ Links ]
25. Loria I, Albanese C, Giusto M, Galtieri PA, Giannelli V, Lucidi C, et al. Bone disorders in patients with chronic liver disease awaiting liver transplantation. Transplant Proc 2010;42:1191-3. [ Links ]
26. Mitchell R, McDermid J, Ma MM, Chik CL. MELD score, insulin-like growth factor 1 and cytokines on bone density in end-stage liver disease. World J Hepatol 2011;3:157-63. [ Links ]
27. Mahmoudi A, Sellier N, Reboul-Marty J, Chalès G, Lalatonne Y, Bourcier V, et al. Bone mineral density assessed by dual-energy X-ray absorptiometry in patients with viral or alcoholic compensated cirrhosis. A prospective study. Clin Res Hepatol Gastroenterol 2011;35:731-7. [ Links ]
28. Wibaux C, Legroux-Gerot I, Dharancy S, Boleslawski E, Declerck N, Canva V, et al. Assessing bone status in patients awaiting liver transplantation. Joint Bone Spine 2011;78:387-91. [ Links ]
29. Choudhary NS, Tomar M, Chawla YK, Bhadada SK, Khandelwal N, Dhiman RK, et al. Hepatic osteodystrophy is common in patients with noncholestatic liver disease. Dig Dis Sci 2011;56:3323-7. [ Links ]
30. Alcalde-Vargas A, Pascasio-Acevedo JM, Gutiérrez-Domingo I, García-Jiménez R, Sousa-Martín JM, Ferrer-Ríos MT, et al. Prevalence and characteristics of bone disease in cirrhotic patients under evaluation for liver transplantation. Transplant Proc 2012;44:1496-8. [ Links ]
31. Alvisa-Negrín J, González-Reimers E, Santolaria-Fernández F, García-Valdecasas-Campelo E, Alemán-Valls MR, Pelazas-González R, et al. Osteopenia in alcoholics: Effect of alcohol abstinence. Alcohol Alcohol 2009;44:468-75. [ Links ]
32. Gonzalez-Reimers E, Alvisa-Negrín J, Santolaria-Fernández F, Martín-González MC, Hernández-Betancor I, Fernández-Rodríguez CM, et al. Vitamin D and nutritional status are related to bone fractures in alcoholics. Alcohol Alcohol 2011;46:148-55. [ Links ]
33. Malik P, Gasser RW, Moncayo R, Kemmler G, Fleischhaker WW. Markers of bone resorption and formation during abstinence in male alcoholic patients. Alcohol Clin Exp Res 2012;36:2059-64. [ Links ]
34. Guañabens N, Pares A, Marinosos L. Factors influencing the development of metabolic bone disease in primary biliary cirrhosis. Am J Gastroenterol 1990;85:1356-62. [ Links ]
35. Guichelaar MM, Malinchoc M, Sibonga JD, Clarke BL, Hay JE. Bone histomorphometric changes after liver transplantation for chronic cholestatic liver disease. J Bone Miner Res 2003;18:2190-9. [ Links ]
36. Guañabens N, Parés A. Osteoporosis in liver cirrhosis. Gastroenterol Hepatol 2012;35:411-20. [ Links ]
37. Cuthbert JA, Pak CY, Zerwekh JE, Glass KD, Combes B. Bone disease in primary biliary cirrhosis: Increased bone resorption and turnover in the absence of osteoporosis or osteomalacia. Hepatology 1984;4:1-8. [ Links ]
38. Hodgson SF, Dickson ER, Eastell R, Eriksen EF, Bryant SC, Riggs BL. Rates of cancellous bone remodelling and turnover in osteopenia associated with primary biliary cirrhosis. Bone 1993;14:819-27. [ Links ]
39. Ruiz-Gaspà S, Martínez-Ferrer A, Guañabens N, Dubreuil M, Peris P, Enjuanes A, et al. Effects of bilirubin and sera from jaundiced patients on osteoblasts: Contribution to the development of osteoporosis in liver diseases. Hepatology 2011;54:2104-13. [ Links ]
40. Dai J, Lin D, Zhang J, Habib P, Smith P, Murtha J, et al. Chronic alcohol ingestion induces osteoclastogenesis and bone loss through IL-6 in mice. J Clin Invest 2000;106:887-95. [ Links ]
41. Turner RT. Skeletal response to alcohol. Alcohol Clin Exp Res 2000;24:1693-701. [ Links ]
42. Wezeman FH, Emanuele MA, Moskal SF, Steiner J, Lapaglia N. Alendronate administration and skeletal response during chronic alcohol intake in the adolescent male rat. J Bon Miner Res 2000;15:2033-41. [ Links ]
43. Peris P, Parès A, Guañabens N, Pons F, Martínez de Osaba MJ, Caballeria J, et al. Reduced spinal and femoral bone mass and deranged bone mineral metabolism in chronic alcoholics. Alcohol Alcohol 1992;27:619-25. [ Links ]
44. González-Reimers E, Martín-González C, De la Vega-Prieto MJ, Pelazas-González R, Fernández-Rodríguez C, López-Prieto J, et al. Serum sclerostin in alcoholics: A pilot study. Alcohol Alcohol 2013;48:278-82. [ Links ]
45. Molina-Pérez M, González-Reimers E, Santolaria-Fernandez F, Martínez-Riera A, Rodríguez-Moreno F, Rodríguez-Rodríguez E, et al. Relative and combined effects of ethanol and protein deficiency on bone hsitology and mineral metabolism. Alcohol 2000;20:1-8. [ Links ]
46. Fitzpatrick LA. Secondary causes of osteoporosis. Mayo Clin Proc 2002;77:453-68. [ Links ]
47. de los Santos-Moreno A, Romero-Cores P, Navarro F, Girón-González JA. Malabsorption syndrome (II). Celiac disease. Lactose intolerance. Bacterial overgrowth. Medicine (Barc) 2012;11:206-13. [ Links ]
48. Reed BY, Zerwekh JE, Sakhaee K, Breslau NA, Gottschalk F, Pak CY. Serum IGF- 1 is low and correlated with osteoblastic surface in idiopathic osteoporosis. J Bone Miner Res 1995;10:1218-24. [ Links ]
49. López-Larramona G, Lucendo AJ, González-Castillo S, Tenias JM. Hepatic osteodystrophy: An important matter for consideration in chronic liver disease. World J Hepatol 2011;3:300-7. [ Links ]
50. Mobarhan SA, Russell RM, Recker RR, Posner DB, Iber FL, et al. Metabolic bone disease in alcoholic cirrhosis: A comparison of the effect of vitamin D2, 25-hydroxyvitamin D or supportive treatment. Hepatology 1984;4:266-73. [ Links ]
51. Masuda S, Okano T, Osawa K, Shinjo M, Suematsu T, Kobayashi T. Concentrations of vitamin D binding protein and vitamin D metabolites in plasma of patients with liver cirrhosis. J Nutr Sci Vitaminol (Tokyo) 1989;35:225-34. [ Links ]
52. Jorge-Hernández JA, González-Reimers E, Torres-Ramírez A, Santolaria-Fernández F, González-García C, et al. Bone changes in alcoholic liver cirrhosis. A histomorphometrical analysis of 52 cases. Dig Dis Sci 1988;33:1089-95. [ Links ]
53. Hay JE, Guichelaar MMJ. Evaluation and management of osteoporosis in liver disease. Clin Liver Dis 2005;9:747-66. [ Links ]
54. Pares A, Guañabens N, Rodés J. Gene polymorphisms as predictors of decreased bone mineral density and osteoporosis in primary biliary cirrhosis. Eur J Gastroenterol Hepatol 2005;17:311-15. [ Links ]
55. Ruiz-Gaspà S, Guañabens N, Enjuanes A, Peris P, Martinez-Ferrer A, de Osaba MJ. Lithocolic acid downregulates vitamin D effects in human osteoblasts. Eur J Clin Invest 2010;40:25-34. [ Links ]
56. Shiomi S, Nishiguchi S, Kubo S, Tamori A, Habu D, Takeda T, et al. Vitamin K2 (menatetrenone) for bone loss in patients with cirrhosis of the liver. Am J Gastroenterol 2002;97:978-81. [ Links ]
57. Hay JE. Osteoporosis in liver diseases and after liver transplantation. J Hepatol 2003;38:856-65. [ Links ]
58. Diamond T, Stiel D, Lunzer M, Wilkinson M, Roche J, Posen S. Osteoporosis and skeletal fractures in chronic liver disease. Gut 1990;31:82-7. [ Links ]
59. Moschen AR, Kaser A, Stadlmann S, Millonig G, Kaser S, Mühlechner P, et al. The RANKL/OPG system and bone mineral density in patients with chronic liver disease. J Hepatol 2005;43:973-83. [ Links ]
60. Gonzalez-Calvin JL, Mundi JL, Casado-Caballero FJ, Abadia AC, Martin-Ibañez JJ. Bone mineral density and serum levels of soluble tumor necrosis factors, estradiol, and osteoprotegerin in postmenopausal women with cirrhosis after viral hepatitis. J Clin Metab 2009;94:4844-50. [ Links ]
61. Diez Ruiz A, Santos Perez JL, Lopez Martinez G, Gonzalez-Calvin JL, Gil Extremera B, Gutierrez Gea F. Tumor necrosis factor, interleukin- 1 and interleukin-6 in alcoholic cirrhosis. Alcohol Alcohol 1993;28:319-23. [ Links ]
62. Boyle WJ, Simonet WS, Lacey DL. Osteoclast differentiation and activation. Nature 2003;423:337-42. [ Links ]
63. Bu R, Borysenko CW, Li Y, Cao L, Sabokbar A, Blair HC. Expression and function of TNF-family proteins and receptors in human osteoblasts. Bone 2003;33:760-70. [ Links ]
64. Garcia-Valdecasas-Campelo E, Gonzalez-Reimers E, Santolaria-Fernandez F, De la Vega-Prieto MJ, Milena-Abril A, Sanchez-Perez MJ, et al. Serum osteoprotegerin and RANKL levels in chronic alcoholic liver disease. Alcohol Alcohol 2006;41:261-6. [ Links ]
65. Parés A, Guañabens N. Treatment of bone disorders in liver disease. J Hepatol 2006;45:445-53. [ Links ]
66. del Pino Montes J. Tratamiento de la osteopenia y la osteoporosis. Medicine (Barc) 2011;10:6221-9. [ Links ]
67. Kanis JA, Oden A, Johansson H, Borgstrom F, Strom O, McCloskey E. FRAX and its applications to clinical practice. Bone 2009;44:734-43. [ Links ]
68. WHO Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser 1994;843:1-129. [ Links ]
69. Guañabens N, Monegal A, Muxi A, Martínez-Ferrer A, Reyes R, Caballeria J, et al. Patients with cirrhosis and ascites have false values of bone density. Implications for the diagnosis of osteoporosis. Osteoporos Int 2012;23:1481-7. [ Links ]
70. Wosje KS, Kalkwarf HJ. Bone density in relation to alcohol intake among men and women in the United States. Osteoporos Int 2007;18:391-400. [ Links ]
71. Gonzalez-Reimers E, Garcia-Valdecasas-Campelo E, Santolaria-Fernandez F, Milena-Abril A, Rodriguez-Rodriguez E, Martinez-Riera A, et al. Rib fractures in chronic alcoholic men: Relationship with feeding habits, social problems, bone alterations, and liver dysfunction. Alcohol 2005;37:113-7. [ Links ]
72. Peris P, Guanabens N, Parès A, Pons F, Del Río L, Monegal A, et al. Vertebral fractures and osteopenia in chronic alcoholic patients. Calcif Tissue Int 1995;57:111-4. [ Links ]
73. Carey EJ, Balan V, Kremers WK, Hay JE. Osteopenia and osteoporosis in patients with end-stage liver disease caused by hepatitis C and alcoholic liver disease: Not just a cholestatic problem. Liver Transpl 2003;9:1166-73. [ Links ]
74. Leslie WD, Bernstein CN, Leboff MS, American Gastroenterological Association Clinical Practice Commitee. AGA Technical review on osteoporosis in hepatic disorders. Gastroenterology 2003;125:941-66. [ Links ]
75. Collier J. Bone disorders in chronic liver disease. Hepatology 2007;46:1271-8. [ Links ]
76. Ávila-Escribano JJ, Marcos-Martín M, Pastor-Encinas I, Laso-Guzmán FJ. Treatment of alcohol dependence. Medicine (Barc) 2012;11:1412-20. [ Links ]
77. Kondrup J. Nutrition in end stage liver disease. Best Pract Res Clin Gastroenterol 2006;20:547-60. [ Links ]
78. Tsiaousi ET, Hatzitolios AI, Trygonis SK, Savopoulos CG. Malnutrition in end stage liver disease: Recommendations and nutritional support. J Gastroenterol Hepatol 2008;23:527-33. [ Links ]
79. Camisasca M, Crosignani A, Baltezzati PM, Albisetti W, Grandinetti G, Pietrogrande L, et al. Parenteral calcitonin for metabolic bone disease associated with primary biliary cirrhosis. Hepatology 1994;20:633-7. [ Links ]
80. Crippin JS, Jorgensen RA, Dickson ER, Lindor KD. Hepatic osteodystrophy in primary biliary cirrhosis: Effects of medical treatment. Am J Gastroenterol 1994;89:47-50. [ Links ]
81. Herlong H, Recker R. Bone disease in primary biliary cirrhosis: Histologic features and response to 25-hydroxyvitamin D. Gastroenterology 1982;83:103-8. [ Links ]
82. Matloff DS, Kaplan, M, Neer RM, Goldberg MJ, Bitman W, Wolfe HJ. Osteoporosis in primary biliary cirrhosis: effects of 25-hydroxyvitamin D3 treatment. Gastroenterology 1982;83:97-102. [ Links ]
83. Pereira SP, O'Donohue J, Moniz C, Phillips MG, Abraha H, Buxton-Thomas M, et al. Transdermal hormone replacement therapy improves vertebral bone density in primary biliary cirrhosis. Aliment Pharmacol Ther 2004;19:563-70. [ Links ]
84. Ormarsdóttir S, Mallmin H, Naessén T, Petrén-Mallmin M, Broomé U, Hultcrantz R, et al. An open, randomized, controlled study of transdermal hormone replacement therapy on the rate of bone loss in primary biliary cirrhosis. J Intern Med 2004;256:63-9. [ Links ]
85. Isoniemi H, Appelberg J, Nilsson CG, Makela P, Risteli J, Hockerstedt K. Transdermal oestrogen therapy protects postmenopausal liver transplant women from osteoporosis. A 2-year follow-up study. J Hepatol 2001;34:299-305. [ Links ]
86. Diamond T, Stiel D, Posen S. Effects of testosterone and venesection on spinal and peripheral bone mineral in six hypogonadal men with hemochromatosis. J Bone Miner Res 1991;6:39-43. [ Links ]
87. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative randomized controlled trial. JAMA 2002;288:321-33. [ Links ]
88. American College of Obstetricians and Gynecologists. Statement on results of the HERS II trial on hormone replacement therapy. Ginecol Obstet Mex 2002;70:406-8. [ Links ]
89. Cranney A, Wells G, Willan A, Griffith L, Zytaruk N, Robinson V, et al. Meta-analysis of alendronate for the treatment of postmenopausal women. Endocr Rev 2002;23:508-16. [ Links ]
90. Adachi J, Bensen W, Brown J, Hanley D, Hodsman A, Josse R, et al. Intermittent etidronate therapy to prevent corticosteroid-induced osteoporosis. N Engl J Med 1997;337:382-7. [ Links ]
91. Watts NS, Harris ST, Genant HK, Wasnich RD, Miller PD, Jackson RD, et al. Intermittent cyclical etidronate treatment of postmenopausal osteoporosis. N Eng J Med 1990;323:73-9. [ Links ]
92. Wolfhagen FH, van Buuren HR, den Ouden JW, Hop WC, van Leeuwen JP, Schalm SW, et al. Cyclical etidronate in the prevention of bone loss in corticosteroid-treated primary biliary cirrhosis. A prospective, controlled pilot study. J Hepatol 1997;26:325-30. [ Links ]
93. Guañabens N, Pares A, Ros I, Alvarez L, Pons F, Caballeria L, et al. Alendronate is more effective than etidronate for increasing bone mass in osteopenic patients with primary biliary cirrhosis. Am J Gastroenterol 2003;98:2268-74. [ Links ]
94. Zein CO, Jorgensen RA, Clarke B, Wenger D, Keach JC, Angulo P, et al. Alendronate improves bone mineral density in primary biliary cirrhosis: A randomized placebo-controlled trial. Hepatology 2005;42:762-71. [ Links ]
95. Arase Y, Suzuki F, Suzuki Y, Akuta N, Kobayashi M, Kawamura Y, et al. Prolonged-efficacy of bisphosphonate in postmenopausal women with osteoporosis and chronic liver disease. J Med Virol 2008;80:1302-7. [ Links ]
96. Aibar Arregui MA, de Escalante Yangüela B, Muñoz Villalengua M, Garcés Horna V. Esophageal stenosis caused by alendronate. Rev Esp Enferm Dig 2011;103:338-9. [ Links ]
97. Treeprasertsuk S, Silveira MG, Petz JL, Lindor KD. Parenteral bisphosphonates for osteoporosis in patients with primary biliary cirrhosis. Am J Ther 2011;18: 375-81. [ Links ]
98. Reeves HL, Francis RM, Manas DM, Hudson M, Day CP. Intravenous bisphosphonate prevents symptomatic osteoprotic vertebral collapse in patients after liver transplantation. Liver Transpl Surg 1998;4:404-9. [ Links ]
99. Monegal A, Navasa M, Suárez M, Suárez-López S, García-González F, Serrano T. Effects of intravenous pamidronate on bone loss after liver transplantation. Calcif Tissue Int 2006;78:S148. [ Links ]
100. Dodidou P, Bruckner T, Hosch S, Haas M, Klar E, Sauer P. Better late than never? Experience with intravenous pamidronate in patients with low bone mass or fractures following cardiac or liver transplantation. Osteoporos Int 2003;14:82-9. [ Links ]
101. Yadav A, Carey EJ. Osteoporosis in chronic liver disease. Nutr Clin Pract 2013;28:52-64. [ Links ]
102. Levy C, Harnois DM, Angulo P, Jorgensen R, Lindor. Raloxifene improves bone mass in osteopenic woman with primary biliary cirrhosis: Results of a pilot study. Liver Int 2005;25:117-21. [ Links ]
103. Overgaard K, Hansen M, Jensen SB, Christiansen C. Effect of salcatonin given intranasally on bone mass and fracture rates in established osteoporosis: A dose-response study. BMJ 1992;305:556-61. [ Links ]
104. Cranney A, Tugwell P, Zytaruk N, Robinson V, Weaber B, Shea B, et al. Meta-analysis of calcitonin for the treatment of postmenopausal women. Endocr Rev 2002;23:540-51. [ Links ]
105. Floreani A, Zappala F, Fries W, Naccarato R, Plebani M, D'Angelo A, et al. A 3-year pilot study with 1,25-dihydroxyvitamin D, calcium and calcitonin for severe osteodystrophy in primary biliary cirrhosis. J Clin Gatroenterol 1997;24:239-44. [ Links ]
106. Valero MA, Loinaz C, Larrodera L. Calcitonin and bisphosphonates treatment in bone loss after liver transplantation. Calcif Tissue Int 1995;57:15-9. [ Links ]
107. Hay JE, Malinchoc M, Dickson ER. A controlled trial of calcitonin therapy for the prevention of post-liver transplantation atraumatic fractures in patients with primary biliary cirrhosis and primary sclerosing cholangitis. J Hepatol 2001;34:292-8. [ Links ]
108. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster GY, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344:1434-41. [ Links ]
109. Hodsman AB, Hanley DA, Ettinger MP, Bolognese MA, Fox J, Metcalfe AJ, et al. Efficacy and safety of human parathyroid hormone (1-84) in increasing bone mineral density in postmenopausal osteoporosis. J Clin Endocrinol Metab 2003;88:5212-20. [ Links ]
110. Dresner-Pollak R, Gabet Y, Steimatzky A, Hamdani G, Bab I, Ackerman Z, et al. Human parathyroid hormone 1-34 prevents bone loss in experimental biliary cirrhosis in rats. Gastroenterology 2008;134:259-67. [ Links ]
111. Ninkovic M, Skingle SJ, Bearcroft PW, Bishop N, Alexander GJ, Compston JE. Incidence of vertebral fractures in the first three months after orthotopic liver transplantation. Eur J Gastroenterol Hepatol 2000;12:931-5. [ Links ]
112. Guichelaar MM, Schmoll J, Malinchoc M, Hay JE. Fractures and avascular necrosis before and after orthotopic liver transplantation: Long-term follow-up and predictive factors. Hepatology 2007;46:1198-207. [ Links ]
113. Kaemmerer D, Schmidt B, Lehmann G, Wolf G, Hommann M, Settmacher U. Monthly ibandronate for the prevention of bone loss in patients after liver transplantation. Transplant Proc 2012;44:1362-7. [ Links ]
114. Compston JE. Osteoporosis after liver transplantation. Liver Transpl 2003;9:321-30. [ Links ]
115. Cheung AM. Post-liver transplantation osteoporosis. J Hepatol 2001;34:337-8. [ Links ]
116. Millonig G, Graziadei I, Eichler D, Pfeiffer KP, Finkenstedt G, Muehllechner P, et al. Alendronate in combination with calcium and vitamin D prevents bone loss after orthotopic liver transplantation: A prospective single-center study. Liver Transpl 2005;11:960-6. [ Links ]
117. Atamaz F, Hepguler S, Akyildiz M, Karasu Z, Kilic M. Effects of alendronate on bone mineral density and bone metabolic markers in patients with liver transplantation. Osteoporos Int 2006;17:942-9. [ Links ]
118. Monegal A, Guañabens N, Suárez MJ, Suárez F, Clemente G, García-González M, et al. Pamidronate in the prevention of bone loss after liver transplantation: A randomized controlled trial. Transpl Int 2009;22:198-206. [ Links ]
119. Crawford BAL, Kam C, Pavlovic J, Byth K, Handelsman DJ, Angus PW, et al. Zoledronic acid prevents bone loss after liver transplantation: A randomized, double-blind, placebo-controlled trial. Ann Inter Med 2006;144:239-48. [ Links ]
120. Bodingbauer M, Wekerle T, Pakrah B, Roschger P, Peck-Radosavljevic M, Silberhumer G, et al. Prophylactic bisphosphonate treatment prevents bone fractures after liver transplantation. Am J Transplant 2007;7:1763-9. [ Links ]











 text in
text in