My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.107 n.3 Madrid Mar. 2015
Validez y fiabilidad del conjunto mínimo básico de datos en la estimación de la gastroenteritis aguda nosocomial por rotavirus
Validity and reliability of the minimum basic data set in estimating nosocomial acute gastroenteritis caused by rotavirus
Olga Redondo González
Unidad de Apoyo a la Investigación. Hospital General La Mancha Centro. Alcázar de San Juan, Ciudad Real.
Grupo de Investigación Epidemiología Social y Cardiovascular. Facultad de Medicina. Universidad de Alcalá. Alcalá de Henares, Madrid
Dirección para correspondencia
RESUMEN
Introducción: la gastroenteritis aguda nosocomial por rotavirus (GEANOR) representa la principal causa de GEA nosocomial en menores de 5 años. El objetivo es evaluar la validez, fiabilidad y verosimilitud del conjunto mínimos básico de datos (CMBD) para estimarla y analizar posibles cambios en el primer trienio de comercialización de las vacunas Rotarix® y Rotateq® en España.
Material y métodos: estudio descriptivo-retrospectivo en el Hospital Universitario de Guadalajara en 2003-2009 mediante el CMBD (altas neonatales y pediátricas), los resultados positivos para rotavirus de microbiología (RPM) y las historias clínicas. Los métodos de estimación fueron: 1 (CIE9-MC 008.61 en los campos de diagnóstico secundario del CMBD); 2 (método 1 y/o RPM con ingreso actual-reciente); y método 3 o referencia (método 2 contrastado con las historias clínicas). Se determinó la validez de los métodos 1 y 2 y su concordancia con el método 3 (índice kappa). También, las razones de verosimilitud (LHR) de estos métodos. Además, se calculó la razón de tasas de incidencia de 2007-2009 respecto a 2003-2005.
Resultados: se encontraron 65 registros con DIAG2 008.61 y 62 casos probablemente nosocomiales por el método 2, cuyas historias clínicas fueron revisadas junto con 11 registros posiblemente nosocomiales. La sensibilidad del CMBD resultó del 67 %, la seguridad del 51 % y su fiabilidad y LHR negativo moderados (índice kappa 0,58 y LHR- 0,33). En 2007-2009, respecto a 2003-2005, la enfermedad se redujo en 5 casos por 103 ingresos y en 9 por 104 días de estancia. El método 2 sobreestimó el descenso en 1 por 103 ingresos y el descenso de riesgo por día de estancia en un 10 %. El CMBD no encontró diferencias intertrienios pero presentó al igual que el método 2, un excelente nivel de evidencia diagnóstica (LHR+ 67).
Conclusión: el CMBD junto a la microbiología es más exacto, seguro y consistente que el CMBD per se en la estimación de la GEANOR, y también más útil para descartarla. Sin embargo, el CMBD por sí mismo podría ser utilizado en la estimación de la infección nosocomial en contextos con diferentes prevalencias.
Palabras clave: Infecciones por rotavirus. Vacunas contra rotavirus. Gastroenteritis. Infección hospitalaria. Registros médicos. España.
ABSTRACT
Introduction: Rotavirus is the principal cause of nosocomial acute gastroenteritis (NAGE) under 5 years of age. The objective is to evaluate the validity and reliability of the minimum basic data set (MBDS) in estimating the NAGE caused by rotavirus (NAGER) and to analyze any changes during the three years that the Rotarix® and Rotateq® vaccines were used in Spain.
Material and methods: A descriptive, retrospective study was carried out in the University Hospital of Guadalajara (UHG) (Spain) between 2003-2009 using the MBDS, positive microbiological results for rotavirus (PMRs), and medical histories. Three methods of estimation were used: 1) An ICD-9-CM code 008.61 in the secondary diagnosis fields (DIAG2) of MBDS; 2) method 1 and/or PMRs with a current or recent hospitalization; and 3) the reference method or method 2 contrasted with patient medical histories. The validity of methods 1 and 2 was determined -sensitivity, specificity, predictive values and likelihood ratios (LRs)-, along with their agreement with method 3 (Kappa coefficient). In addition, the incidence rate ratio between the NAGER rate in 2007-2009 (commercialization period of both vaccines) was calculated with respect to 2003-2005 (pre-commercialization period).
Results: Method 1 identified 65 records with a DIAG2 of 008.61. Method 2 found 62 probable cases, and the reference method, 49 true cases. The sensitivity of the MBDS was 67 %, the positive predictive value was 51 %, and both negative LR (LR-) and reliability were moderate (LR- 0.33, Kappa coefficient 0.58). During 2007-2009, the NARGE decreased by 5 cases per 103 hospitalizations and by 9 per 104 days of hospitalization. Method 2 overestimated both the decline in incidence by 2 per 103 hospitalizations and the decreased risk per day of stay by 10 %. The MBDS found no differences between the two three-year periods, but, like method 2, showed an excellent level of diagnostic evidence (LR+ 67).
Conclusion: The MBDS taken together with microbiological results, is more exact, safer and more reliable than the MBDS alone in estimating NAGER; and more useful in ruling out it. Nevertheless, the MBDS alone may be used to estimate and compare such disease in contexts with different prevalences.
Key words: Rotavirus infections. Rotavirus vaccines. Gastroenteritis. Hospital infections. Medical registries. Spain.
Abreviaturas
CMBD: conjunto mínimo básico de datos;
DPRINCIP: campos de diagnóstico primario;
DSECUN: campos de diagnóstico secundario;
GEA: gastroenteritis aguda;
GEANOR: gastroenteritis aguda nosocomial por rotavirus;
HUG: Hospital Universitario de Guadalajara;
IC 95 %: intervalo de confianza al 95 %;
LHR: Likelihood ratio;
RPM: resultados positivos de microbiología para rotavirus;
RI: rango intercuartílico;
RTI: razón de tasas de incidencia;
TI: tasa de incidencia;
VPP: valor predictivo positivo;
VPN: valor predictivo negativo.
Introducción
La gastroenteritis aguda (GEA) nosocomial por rotavirus (GEANOR) ocurre en el 5 % de los niños hospitalizados, aumentando la estancia y consumo de recursos asistenciales (1-3). El rotavirus es la principal causa de GEA nosocomial en menores de 5 años (31-87%) (4-7). El 70 % ocurre en menores de 1 año (8). El patrón estacional coincide con el pico invernal de otras infecciones víricas pediátricas (4), aunque se extiende en el tiempo respecto de la GEA por rotavirus comunitaria, adelantándose en otoño y terminando a principios de la primavera (6).
La GEANOR debuta tras un periodo de incubación de unos 3 días (3). Un 20-40 % son asintomáticas o subclínicas (6), lo que unido a la enorme estabilidad del rotavirus, contribuye a la contagiosidad y menor efectividad de las medidas de control (9). En Europa, los casos nosocomiales representan el 14 %-51 % del total de infecciones por rotavirus en menores de 5 años, con una incidencia de 0,1 a 2,8 por cada 103 ingresos (neonatos: 4-7,3 por 103), y costes adicionales de 367 a 1.837 euros por caso (4-6,10-12). Las diferencias de incidencia entre países reflejan la heterogeneidad de los estudios y hacen difícil la comparación (10,11,13,14). También ocurre en España, donde hay pocos estudios sobre GEANOR (3,4,6,8). La tasa de incidencia promedio en Europa es de 4,6 por 104 días de estancia (rango 0,1-6,8 por 104), contribuyendo a prolongar la estancia entre 4 y 12 días (13). La tasa de ataque de infección sintomática puede alcanzar el 56 % en época de brote (14,15).
Las vacunas Rotarix® y Rotateq® se empezaron a comercializar en España en julio de 2006 y febrero de 2007, respectivamente (4). España no las incluyó en el calendario vacunal de 2007 (16) y tampoco en el de 2013 (17), por no ser coste-efectivas (18). Sin embargo, dada la morbilidad y la elevada carga sanitaria de la enfermedad, se siguen recomendando (19). Las nuevas vacunas se consideran seguras, habiéndose reducido con ellas 5-10 veces la intususpección (20), efecto adverso que se relacionó con Rotashield® en el pasado. Con un programa de vacunación universal y asumiendo una cobertura del 90 % se podría evitar en España hasta un 58 % de GEANOR en 5 años (21).
Se ha descrito un muy deficiente registro del rotavirus en los sistemas de información hospitalarios (5), en parte debido a la elevada incidencia de GEANOR asintomáticas (22). Además, la tasa de ataque de los casos que debutan postalta puede llegar al 16 %, y si son leves o asintomáticos no llegan a conocerse. Sin embargo, el conjunto mínimo básico de datos (CMBD) y otros equivalentes se han utilizado para evaluar su incidencia (8,10). Se desconoce si los campos de diagnóstico secundario (dsecun) del CMBD son un método válido para identificar la enfermedad, pues no informan del tiempo transcurrido desde el ingreso hasta el debut del evento y, además, hay diagnósticos microbiológicos que se dan postalta. Igualmente, en el CMBD habría casos codificados como diagnóstico principal, que corresponderían en realidad a infecciones adquiridas en ingresos recientes. Tampoco se conoce la consistencia de los dsecun para dar resultados siempre iguales (concordancia). Aunque existe un sistema establecido de codificación, la variabilidad entre codificadores depende de su experiencia y de cómo se cumplimentan las historias clínicas al alta.
El objetivo principal es evaluar la validez, fiabilidad y verosimilitud de los campos de diagnóstico secundario del CMBD para estimar la GEANOR. También, analizar los posibles cambios acontecidos en el primer trienio de comercialización de las vacunas contra rotavirus.
Material y métodos
Se trata de un estudio descriptivo-retrospectivo en el Hospital Universitario de Guadalajara (HUG) entre 2003 y 2009. Se utilizaron tres fuentes de datos:
1. CMBD del HUG: sistema de registro obligatorio con las altas acontecidas por cualquier motivo en los servicios de Pediatría y Neonatología.
2. Registro informático Modulab® del laboratorio de Microbiología del HUG: resultados positivos para rotavirus (RPM) por la "técnica rápida de inmunocromatografía para detección doble de rotavirus y adenovirus" (Kit VIKIA Rota-Adeno®, de bioMérieux). Tiene una reproducibilidad del 100 %, una sensibilidad y especificidad del 92 % (intervalo de confianza 95 % (IC 95 %), 84-99 %) y 91 % (IC 95 %, 78-100 %), respectivamente, y un valor predictivo positivo (VPP) y negativo (VPN) del 96 % (90-100 %) y 83 % (67-98 %), respectivamente.
3. Historias clínicas del archivo central del HUG: de los casos probablemente y posiblemente nosocomiales, que se definen más adelante en los métodos 2 y 3, respectivamente.
Este proyecto fue aprobado por el Comité Ético de Investigación Clínica del HUG.
Definición de la variable de interés y de los métodos de estimación
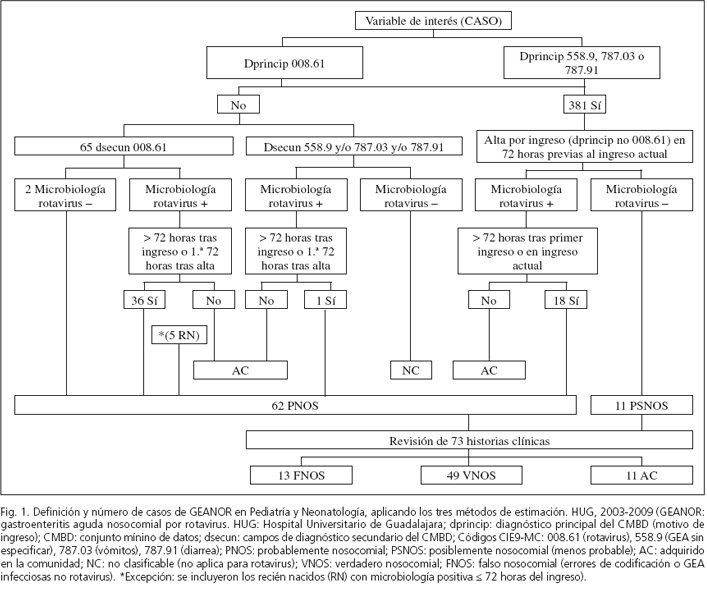
Se definió la GEANOR por el "desarrollo de síntomas desde 72 horas después del ingreso hasta 72 horas tras el alta hospitalaria" (3). Los métodos de estimación se definieron según estos criterios de selección de datos:
1. Método 1: registros con código CIE9-MC 008.61 (rotavirus) en cualquiera de los dsecun del CMBD, cuyo campo de diagnóstico principal (dprincip) fuera diferente de 558.9 (GEA no especificada), 787.03 (vómitos) o 787.91 (diarrea).
2. Método 2: método 1 y/o RPM coincidentes con ingreso actual-reciente (alta en los últimos 3 días) según CMBD. Se fusionaron los RPM con el CMBD, utilizando los números de historias clínicas como elemento de cruce. Se buscaron los códigos 008.61, 558.9, 787.03, 787.91 o 780.06 (fiebre) en el dprincip o en el dsecun, que coincidieran con RPM. Se definieron como casos probablemente nosocomiales los episodios (registros) del CMBD con:
- Dprincip diferente de 008.61 y dsecun 008.61 sin RPM.
- Dprincip diferente de 008.61 y dsecun 008.61, 558.9, 787.03 o 787.91 con RPM tras 72 horas de ingreso, o en las primeras 72 horas de alta. Como excepción, se incluyeron los recién nacidos con microbiología positiva ≤ 72 horas del ingreso.
- Dprincip 008.61, 558.9, 787.3 o 787.91 e ingreso previo con dprincip diferente de 008.61 con alta en las 72 horas previas y RPM desde 72 horas posteriores al primer ingreso o durante el segundo ingreso.
3. Método 3 (de referencia o "clínico"): método 2 contrastado con las historias clínicas. Para encontrar los casos verdaderos nosocomiales se revisaron las historias clínicas de los casos definidos por el método 2 como probablemente nosocomiales, y también las de los posiblemente nosocomiales: dprincip 008.61 558.9, 787.3 o 787.91 e ingreso previo de dprincip diferente de 008.61 con alta en las 72 horas previas, sin RPM. Se elaboró para la recogida de datos una ficha basada en otra utilizada en un estudio sobre GEANOR (6).
Los excluidos como verdaderos nosocomiales se definieron como falsos nosocomiales o bien, como adquiridos en la comunidad (ambos falsos positivos del método 2).
Análisis estadístico
Se calcularon los indicadores de frecuencia de GEANOR en Pediatría y Neonatología, globalmente y por servicios, grupos de edad, año de estudio y trienios (2003-2005 y 2007-2009); con sus IC 95 %, por cada método descrito. Para el cálculo de las tasas de incidencia (TI), se estimaron previamente los días de estancia.
Se determinaron la sensibilidad y especificidad (validez interna), los VPP y VPN (rendimiento, seguridad o validez externa) y el porcentaje de concordancia positiva de Chamberlain (% AP) (23) de los métodos 1 y 2. También, los likelihood ratios positivos y negativos (LHR+ y LHR-). Determinamos después la concordancia de los métodos 1 y 2 respecto del método de referencia, mediante el índice kappa. Para su interpretación se tomó como referencia la escala Altman (24).
Se describió el patrón estacional mediante la distribución mensual del número de casos. Para comparar la prevalencia de enfermedad entre grupos de edad pediátrica, trienios y métodos de estimación se utilizó el test chi2. Se comparó la TI de GEANOR del trienio de comercialización simultánea de las vacunas Rotarix® y RotaTeq® en España (2007-2009) respecto al previo (2003-2005), mediante razones de tasas de incidencia (RTI), por cada método. El 2006 se consideró de transición porque sólo se comercializaba Rotarix®.
Los análisis se realizaron con el software SPSS 15.0 y la aplicación Epi InfoTM 7 para Windows, considerando un nivel de significación de 0,05.
Resultados
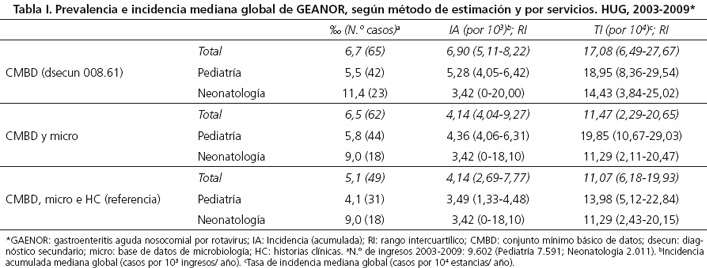
Entre 2003 y 2009 un total de 9.602 niños fueron ingresados por cualquier motivo en el HUG, el 21 % en Neonatología. El diagnóstico 008.61 aparecía codificado en el dprincip de 381 altas y en el dsecun de otras 65 (Fig. 1). Según el método 1, siete de cada 1.000 niños ingresados en 2003-2009 en el HUG habrían adquirido GEANOR; con una prevalencia un 6 ‰ mayor en Neonatología que en Pediatría (Tabla I).
No se encontraron registros con el código 780.06 en el dprincip o en el dsecun, que coincidieran con RPM. Dos de los 65 registros del CMBD con dsecun 008.61, de Pediatría, no tenían RPM. Encontramos 37 registros con dprincip diferente de 008.61 y RPM tras 72 horas de ingreso, 36 con dsecun 008.61 y 1 con dsecun 558.9, de Pediatría (Fig. 1). De los 36 dsecun 008.61 citados, 2 de los 23 registros procedentes de Pediatría correspondían al mismo paciente, pero eran episodios de años diferentes. Adicionalmente, hallamos 5 registros con dsecun 008.61 correspondientes a recién nacidos con RPM ≤ 72 horas del ingreso. Además, había 16 registros con dprincip 008.61 y 2 con dprincip 558.9, con RPM y antecedente de ingreso previo de dprincip diferente de rotavirus con alta en las 72 horas previas, todos de Pediatría (Fig. 1). El recuento final de casos probablemente nosocomiales fue 62 (18 Neonatología), todos menores de 5 años. Según el método 2, siete de cada 1.000 niños ingresados en 2003-2009 habrían adquirido GEANOR; con una prevalencia un 3 ‰ mayor en Neonatología (Tabla I).
Contabilizamos 11 registros con dprincip 008.61, 558.9, 787.3 o 787.91 e ingreso previo con dprincip diferente de 008.61 con alta en las 72 horas previas, sin RPM, que definimos como posiblemente nosocomiales y añadimos a los 62 casos probablemente nosocomiales (Fig. 1). En total se revisaron 73 historias clínicas. Los 2 casos probablemente nosocomiales con diagnóstico secundario 008.61 sin RPM resultaron ser errores de codificación y por tanto falsos nosocomiales. De los 37 registros del CMBD con dprincip diferente de 008.61 y RPM después de 72 horas de ingreso, 6 resultaron ser adquiridos en la comunidad y 31 verdaderos nosocomiales (todos los de Neonatología eran verdaderos nosocomiales). Los 5 recién nacidos con microbiología positiva ≤ 72 horas del ingreso también fueron verdaderos nosocomiales.
De los 18 episodios de ingreso con dprincip 008.61 o 558.9, con RPM y con antecedente de ingreso previo de dprincip diferente de rotavirus, con alta en las 72 horas previas, 5 resultaron adquiridos en la comunidad (entre ellos, los 2 codificados como 558.9) y 13 verdaderos nosocomiales. Los 11 supuestos casos posiblemente nosocomiales fueron historias clínicas no compatibles con GEANOR, y por tanto, falsos nosocomiales. Así pues, identificamos como verdaderos nosocomiales el 67,1 % de las historias clínicas revisadas (n 49) (Fig. 1). El 36,7 % (n 18) de los verdaderos nosocomiales ocurrieron en neonatos (Tabla I). Globalmente, el 51 % de los verdaderos nosocomiales eran varones; el 90 % (n 44) tenían menos de dos años; un 35 % (n 17) eran recién nacidos; y el 30 % (n 15, todos de Pediatría) habían tenido un ingreso con alta en las 72 horas previas al actual. Según el método de referencia, cinco de cada 1.000 niños ingresados en 2003-2009 habrían adquirido GEANOR; con una prevalencia un 5 ‰ mayor en Neonatología (Tabla I) y una tasa de ataque postalta del 2 ‰. Se evidenció una diferencia estadísticamente significativa entre el procedimiento utilizado y la prevalencia de GEANOR (p 0,001).
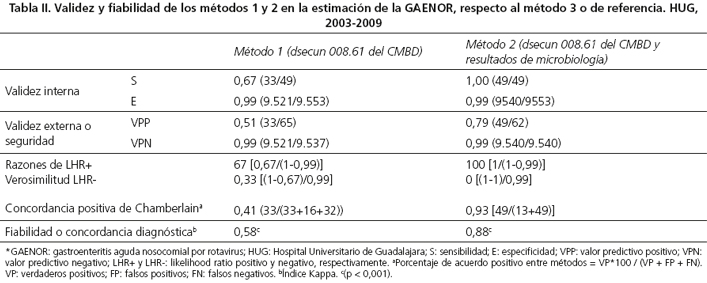
La sensibilidad y VPP del método 1 en la detección de GEANOR fueron 67 % y 51 %; y para el método 2, 100 % y 79 %, respectivamente. Los LHR+ y LHR- del método 1 resultaron 67 y 0,33, respectivamente, frente a 100 y 0 para el método 2. El grado de acuerdo positivo respecto al método de referencia fue un 52 % mayor por el método 1 (Tabla II). La fiabilidad del CMBD fue mayor cuando se contrastó con la microbiología (índice kappa 0,58 vs. 0,88) (Tabla II).
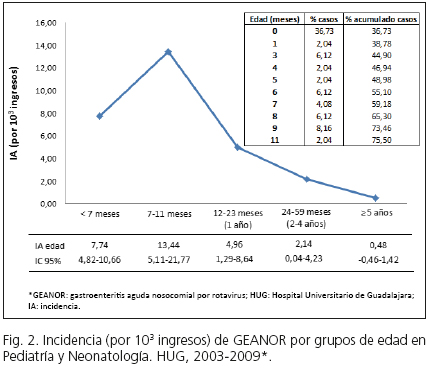
En Neonatología, la mediana de edad de los niños con GEANOR fue de 0 días (mín. 0, máx. 29) y en Pediatría, de 10 meses (mín. 1, máx. 89). El porcentaje acumulado en menores de un año fue del 75,5 % y la mayor incidencia se dio entre 7 y 11 meses (Fig. 2). La enfermedad se asoció significativamente a la edad: los menores de dos años presentaron 9 veces más riesgo de infectarse por rotavirus, que los de 2 años o mayores (p < 0,001). El principal motivo de ingreso en Neonatología fue "recién nacido pretérmino (prematuros)" (73 %), y en Pediatría, bronquiolitis/broncoespasmo (32 %) e infección respiratoria de vías bajas (19 %).
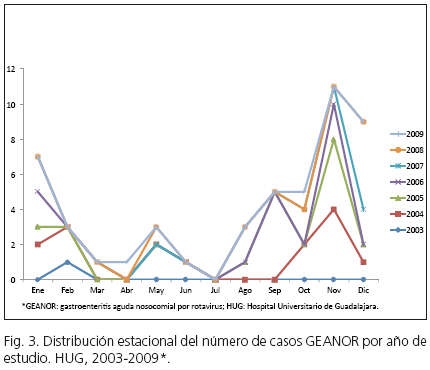
La GEANOR siguió un patrón estacional semejante a la GEA por rotavirus comunitaria con los mayores picos en la segunda mitad de otoño y primera mitad de invierno (noviembre-enero), periodo en el que se acumularon algo más de la mitad de los casos anuales; y hubo otros picos menores en primavera (Fig. 3). El mayor exceso de casos se produjo en noviembre. Hubo dos brotes estivales, en 2005 y 2007.
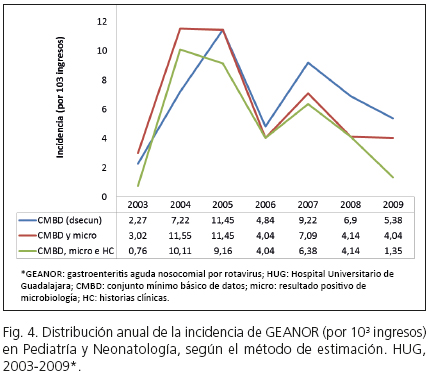
Entre 2003 y 2009 se produjo una mediana de 4,14 GEANOR por cada 103 ingresos al año (Tabla I). La incidencia resultó semejante por el método 2, y muy superior por el 1. La diferencia entre los métodos 1 y 2 respecto al clínico se encontró en Pediatría, donde dichos métodos estimaron 2 y 1 casos más por cada 103 ingresos/año que el método de referencia, respectivamente (Tabla I). Según este último, la incidencia alcanzó 2 picos máximos, uno en 2004 y otro menor en 2007. Descendió en 2008, y de forma no significativa en 2009 (Fig. 4). La distribución anual de la incidencia refleja una similitud entre métodos para evaluar evolución temporal (Fig. 4). La mediana de días de estancia hospitalaria/ingreso de los ingresos por cualquier motivo en 2003-2009 fue de 4 días (rango intercuartílico [RI] 3,7-4,3): 3 (2,5-3,4) en Pediatría y 7,9 (7,3-8,5) en Neonatología. En los casos con GEANOR fue 9 días (RI 5-20): 7 (4-9) en Pediatría y 25 (16-37,3) en Neonatología. En los prematuros, fue 29 (RI 20-39; mín. 15, máx. 44).
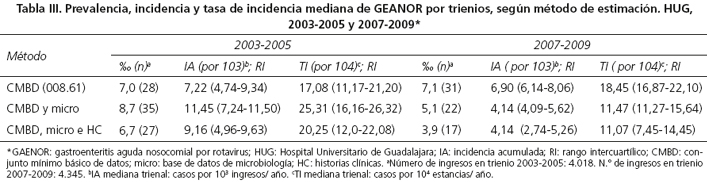
En 2007-2009 se produjo un descenso global de 5 casos por cada 103 ingresos (un 2,8 ‰ menos frecuente) respecto a 2003-2005 (p < 0,001). Por el método 2, el descenso fue mayor, del 3,6 ‰ (p < 0,001) (Tabla III). En cambio, no se encontraron diferencias significativas intertrienios por el método 1 (p = 0,33). Según el método clínico, la TI se redujo en 9 casos por cada 104 días de estancia (RTI2007-2009/2003-2005 = 0,55; IC 95 % 0,54-0,56; p < 0,001). La RTI entre trienios por el método 2 fue 0,45 (IC 95 % 0,44-0,46) y por el CMBD, 1,08 (IC 95 % 1,06-1,10) (Tabla III).
Discusión
Los dsecun del CMBD detectaron el 67 % de los casos de GEANOR del periodo 2003-2009, con una seguridad del 51 % y una fuerza de concordancia moderada respecto del método clínico. En cambio, el CMBD junto a la microbiología presentó una capacidad máxima de detección, con una seguridad un 28 % mayor y concordancia muy alta. Aunque ambos métodos presentan un excelente nivel de evidencia diagnóstica (LHR+ > 10), el método 1 resulta moderado para descartar la enfermedad (LHR- 0,33) cuando no la detecta. En el periodo de estudio, se evidenció una gran variabilidad en la incidencia mediana de GAENOR, entre un rango de 2,7 a 7,8 casos por cada 103 ingresos anuales; y en la TI mediana, de 7,0 a 77,7 casos por 104 días de estancia. La enfermedad fue un 5 ‰ más frecuente en Neonatología. En media, la estancia por episodio de ingreso en los niños que adquirieron GEANOR se alargó 2 días en Pediatría y 12 en Neonatología. En 2007-2009 la enfermedad resultó 3 veces menos prevalente respecto a 2003-2005; y el riesgo de contraerla por día de estancia disminuyó casi a la mitad. Por tanto, en el trienio de vacunación autofinanciada se redujeron anualmente un 55 % de casos/año. Programas de vacunación universales en Europa que han comparado el mismo periodo de vacunación, han descrito una prevención del 72 % de casos/año (25).
El periodo de estudio elegido resultó de la conveniencia de evaluar la efectividad de las vacunas antes de que la Agencia Española de Medicamentos y Productos Sanitarios limitase en 2010 el suministro de lotes de Rotarix® y Rotateq®, debido al hallazgo de circovirus porcino en marzo y junio de dicho año, respectivamente (18). La máxima cobertura vacunal, pese a la limitación de no estar subvencionada por el Estado español, coincidiría así con el inicio de su comercialización desde 2007 a 2009, momento en el que los pediatras de familia estaban exponiendo sus beneficios en la consulta del niño sano, y por tanto promoviendo su comercialización. Aunque en noviembre de 2010 se permitió de nuevo la liberación de lotes de Rotateq®, en el momento actual Rotarix® sigue sin comercializarse (17). Se decidió comparar 2007-2009 con un periodo inmediatamente anterior de igual duración, obviando como se comentó en métodos, el año 2006.
Globalmente, el CMBD per se sobreestimó la incidencia en 3 casos por cada 103 ingresos y la TI mediana, en 6 casos por 104 días de estancia y no detectó el descenso en el trienio comercial. Junto con la microbiología permitió evaluar dicho descenso, aunque lo sobreestimó en un caso por 103 y también sobreestimó el descenso de riesgo por día de estancia, en un 10 %. Resulta difícil comparar la incidencia encontrada respecto a otros estudios españoles, por lo heterogéneo del diseño y metodología de estos (3,4,6,8). En este sentido, la variabilidad de los métodos de evaluación supondría una fuente de error importante (26). Además, la mayoría son retrospectivos, con lo que hay que asumir la falta seguimiento en las 72 horas tras el alta del paciente y la no inclusión de casos leves-asintomáticos (4,8,10). Estudios basados únicamente en datos de alta hospitalaria con el código específico CIE-9-MC 008.61, infraestimaron la carga real de enfermedad (4). Para evaluar la validez y fiabilidad del CMBD consideramos como referencia las historias clínicas, porque contienen información completa de los episodios de ingreso y junto con los RPM, ofrecen una información más precisa. Y es que, como se expuso más arriba, casi un tercio de los casos habían sido dados de alta dentro de las 72 horas previas al ingreso en que se registró la GEANOR como dprincip; es decir, se hicieron sintomáticos postalta. La limitada comparabilidad entre estudios se hace mayor respecto a Europa, con discrepancias entre sistemas de salud y diferentes patrones epidemiológicos (5,10). Los cambios trienales que se han evaluado en este estudio, así como las comparaciones que se hacen con resultados nacionales e internacionales, deberían examinarse con prudencia debido al reducido número de casos de GEANOR y la baja potencia estadística de la muestra.
El HUG resultaba ideal porque el laboratorio de Microbiología es el único de referencia de la provincia. La recogida de muestras de heces en los niños para análisis de rotavirus se hace de forma rutinaria ante sospecha, al inicio de los síntomas de GEA. Por ello, la fecha del resultado de microbiología se equiparó a la del inicio de síntomas para estimar los casos probablemente nosocomiales, posiblemente nosocomiales y verdaderos nosocomiales (Fig. 1). A los registros que tenían un RPM en las primeras 72 horas tras un ingreso se les asignó un origen comunitario. No obstante, un RPM tras esas 72 horas, no indicaba necesariamente que fuera nosocomial, pues a veces pasa un tiempo entre el debut de los síntomas y el RPM, por eso estos casos se definieron como probablemente nosocomiales. Los que tenían un RPM en las primeras 72 horas tras un alta se consideraron nosocomiales, pero tenerla pasadas esas 72 horas, no nos permitía excluir que fuese nosocomial, ya que en caso de levedad de síntomas, la toma ambulatoria de muestra de heces puede demorarse en el tiempo o no llegar a hacerse. Para no perder estos casos, se revisaron todas las historias clínicas con RPM obtenidos hasta un mes después de un alta con dsecun 00.861 y/o 558.9 y/o 787.03 y/o 787.91. Como se dijo, se encontraron 37 casos con RPM en el tercer día postalta (36 dsecun 008.61 y otro dsecun 558.9) (Fig. 1). Cuando se siguen durante un mes las altas por rotavirus, en los casos que precisan readmisión esta se produce en los tres primeros días postalta (27). Aun así, habríamos perdido los casos leves-asintomáticos postalta, sin registro dsecun 558.9 y/o 787.03 y/o 787.91, y/o sin recogida de muestra para microbiología. En un futuro próximo se pretende incorporar una etiqueta "presente en el momento del ingreso" ("present on admission", POA) que acompañará a cada código diagnóstico y permitirá diferenciar los diagnósticos de ingreso (POA = S) de los que se originaron durante la estancia hospitalaria (POA = N).
La incidencia mediana de GEANOR que estimamos a través de los dsecun, de 6,90 por 103, es superior a la obtenida a nivel nacional, de 4,50 por 103, por el mismo método (8). Aunque la fiabilidad del CMBD sea moderada, la comparación reflejaría una alta incidencia en el HUG. Además, la TI mediana obtenida por el método clínico, de 11,07 por 104 (RI 7-77,72), dobla a la descrita en Europa occidental, de 4,6 por 104 (rango 0-6,8 por 104) (13). Este valor promedio europeo es semejante a la TI de estudios prospectivos (1,11). La incidencia del HUG, de 4,14 por 103, es muy baja si la comparamos con la de estudios prospectivos españoles (3,6,28). Esta diferencia podría deberse, cuando no hay seguimiento, a la ya comentada pérdida de casos leves-asintomáticos y de los sintomáticos no codificados en el CMBD por la falta de cumplimentación de las historias clínicas, o a la ausencia de determinación microbiológica. Se plantea así en este estudio un posible sesgo de selección. Incluso en estudios prospectivos que ofrecen sólo resultados de infección sintomática, la prevalencia sigue siendo mayor a la nuestra (3). Por tanto, la principal limitación es el tipo de información que ofrece el CMBD. De hecho, se ha estimado que el debut postalta de una GEANOR ocurre en 11 casos de cada 103 ingresos (29). Aun así, sería necesario un análisis de heces pre y postalta para contabilizar también los casos asintomáticos (30).
A todo lo anterior y en relación a la dificultad de establecer comparaciones, hay que añadir que la incidencia está influenciada por el periodo estacional seguido (estación epidémica vs. año completo) y el rango de edad de los pacientes (14). Los estudios de vigilancia dan una incidencia combinada de GEANOR que durante los meses epidémicos alcanza los 8,1 casos (IC 95 % 6,4-9,9) (31).
El uso de las historias clínicas como referencia plantea igualmente limitaciones, como podría ser el sesgo del entrevistador. La forma en que los clínicos recogen el inicio y curso de la sintomatología digestiva en las historias clínicas puede ser diferente según su interés por la patología, o la gravedad de su curso. Por ese motivo, se revisaron también las historias de enfermería, donde se recogen de forma más exhaustiva el número y consistencia de las deposiciones, o la presencia de vómitos. Además, la revisión de las historias las hizo una misma persona, no se evaluó la concordancia interobservador, lo que podría haber producido el sesgo del observador (clasificación errónea diferencial en la enfermedad). Este hecho se intentó minimizar elaborando una hoja con recogida de datos sistematizada. Este mismo error podría producirse en el proceso de codificación de la enfermedad, dependiente de la experiencia de los codificadores.
Hasta el momento no se habían realizado estudios que evaluasen específicamente la capacidad del CMBD como sistema de vigilancia de GEANOR. Sí se había utilizado en la vigilancia de otras infecciones nosocomiales, como las del sitio quirúrgico, las asociadas al sondaje urinario o a catéteres y la neumonía asociada a procedimientos/ventilación mecánica y de gérmenes relacionados con el cuidado sanitario (Staphylococcus aureus meticilín-resistente y Clostridium difficile) (32). También se había utilizado para determinar la prevalencia de infecciones nosocomiales (33) y se había evaluado su concordancia con otras fuentes de datos para detectar entidades como cáncer (34), patologías urgentes (35), factores de riesgo y efectos adversos postoperatorios (36), accidentes cerebrovasculares (37) o mortalidad quirúrgica (38), entre otros. Al igual que en este estudio, se había descrito una moderada sensibilidad y alta especificidad en la detección de Clostridium difficile e infección del sitio quirúrgico por parte de los sistemas de codificación (32). Debido a la baja prevalencia de la infección hospitalaria, el VPP de este tipo de registros como el CMBD sería baja.
Tampoco se había analizado el comportamiento de la GEANOR tras la comercialización de las vacunas frente a rotavirus en España. En países con programas nacionales de inmunización, se demostró el beneficio indirecto de la vacuna a la población no vacunada (39,40), pero no a nivel intrahospitalario. No obstante, el descenso encontrado en el trienio de comercialización podría deberse tanto a la inmunidad de rebaño como al "Programa de Lavado de Manos", impulsado por el HUG desde 2008, una herramienta que ha demostrado ser eficaz en la transmisibilidad intrahospitalaria del virus, aislado en las manos del 77 % de los trabajadores sanitarios (5,41). Sin embargo, sólo el 37 % del total de GEANOR que encontramos habían sido aisladas, todas neonatales. Otros habían estimado que la enfermedad se aísla sólo en el 50 % (14).
En este estudio se ha analizado por primera vez la validez, fiabilidad y verosimilitud de los dsecun del CMBD para estimar la GEANOR. El método clínico permitió descartar un 25 % de los clasificados como casos por este sistema. El CMBD junto a la microbiología, equivalente aquí al Sistema de Información Microbiológica (SIM), es más exacto, seguro, consistente que el CMBD per se, en la estimación de la GEANOR, y también mejor para descartarla. Sin embargo, al presentar un gran nivel de evidencia diagnóstica, el método 1 podría ser utilizado en la estimación de la infección nosocomial en contextos con diferentes prevalencias, aunque siempre con precaución. En este sentido, serían necesarios estudios futuros con mayor tamaño muestral que ampliasen estos hallazgos. Por otro lado, debemos concienciar al personal sanitario en la importancia del registro de las variables clínicas, para mejorar su codificación en los Sistemas de Información Asistencial. Si no podemos medir de forma válida y eficiente la calidad ofrecida, no se podrán diseñar planes de mejora en la vigilancia y control de la infección nosocomial. La implementación de un código específico para el registro de la misma en el CMBD sería de gran utilidad en este sentido.
Agradecimientos
A Antonio Clemente, del Departamento de Información Asistencial del Servicio de Admisión y Documentación del HUG, por facilitarme el CMBD y por su amabilidad y explicaciones. A Carmen Gimeno, del Servicio de Microbiología del HUG, por extraer los resultados positivos de GEA por rotavirus del periodo de estudio. A mis compañeros de la Unidad de Investigación del Hospital La Mancha Centro, por contribuir en la revisión final de este manuscrito. Y en general, a los técnicos del Archivo Central del HUG que trabajan en el préstamo de historias clínicas para estudios, y a las codificadoras del CMBD de dicho hospital por su disponibilidad a la hora de resolver dudas.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Olga Redondo González
Unidad de Apoyo a la Investigación
Hospital General La Mancha Centro
Avda. Constitución, 3
13600 Alcázar de San Juan, Ciudad Real
e-mail: oredgon@gmail.com
Recibido: 30-09-2014
Aceptado: 17-11-2014
Bibliografía
1. Verhagen P, Moore D, Manges A, Quach C. Nosocomial rotavirus gastroenteritis in a Canadian paediatric hospital: Incidence, disease burden and patients affected. J Hosp Infect 2011;79:59-63. [ Links ]
2. Gutiérrez-Gimeno MV, Martin-Moreno JM, Díez-Domingo J, Asensi-Botet F, Hernández-Marco R, Correcher-Medina P, et al. Nosocomial rotavirus gastroenteritis in Spain: A multicenter prospective study. Pediatr Infect Dis J 2010;29:23-7. [ Links ]
3. Román Riechmann E, Wilhelmi de Cal I, Cilleruelo Pascual ML, Calvo Rey C, García García ML, Sánchez-Fauquier A. Nosocomial gastroenteritis and asymptomatic rotavirus and astrovirus infection in hospitalized children. An Pediatr (Barc) 2004;60:337-43. [ Links ]
4. Hernández Pezzi G, Varela Martínez MC. Vigilancia epidemiológica de las gastroenteritis agudas víricas. Laia Alemany Vilches L, Moraga Llop F, García Jiménez S. En: Bellido Blasco JB, coordinador. 6a Monografía de la Sociedad Española de Epidemiología. EMISA 2007;7:65-77. [ Links ]
5. Gleizes O, Desselberger U, Tatochenko V, Rodrigo C, Salman N, Mezner Z, et al. Nosocomial rotavirus infection in European countries: A review of the epidemiology, severity and economic burden of hospital-acquired rotavirus disease. Pediatr Infect Dis J 2006;25(1 Supl.):S12-21. [ Links ]
6. Gutiérrez Gimeno MV. Gastroenteritis aguda por rotavirus en población infantil ingresada en unidades de lactantes de Valencia; 2009 (Internet). (Acceso: 24 febrero 2013). Disponible en: http://rodrigo.uv.es/handle/10550/15899. [ Links ]
7. Puacz E, Cwikla S, Piasecka-Twaróg M. Analysis of norovirus and rotavirus infections of patients hospitalized in the General Specialist Hospital in Lublin. Retrospective studies. Med Dosw Mikrobiol 2013;65:57-64. [ Links ]
8. Gil-Prieto R, San Martín M, de Andrés AL, Álvaro-Meca A, González A, de Miguel AG. Hospital-acquired rotavirus infections in Spain over a ten-year period (1998-2007). Hum Vaccin 2009;5:748-53. [ Links ]
9. Kramer A, Schwebke I, Kampf G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review. BMC Infect Dis 2006;6:130. [ Links ]
10. The Pediatric Rotavirus European Committee (PROTECT). The paediatric burden of rotavirus disease in Europe. Epidemiol Infect 2006;134:908-16. [ Links ]
11. Stefkovicová M, Simurka P, Juracková L, Hudecková H, Mad'ar R. Nosocomial rotaviral gastroenteritis in paediatric departments. Cent Eur J Public Health 2008;16:12-6. [ Links ]
12. Bentama I, Soussi I, Ghanimi Z, Riane S, Tligui H, Mdaghri Alaoui A, et al. Epidemic of nosocomial infection by rotavirus in a neonatology service. Rev Med Brux 2012;33:519-24. [ Links ]
13. Ogilvie I, Khoury H, Goetghebeur MM, El Khoury AC, Giaquinto C. Burden of community-acquired and nosocomial rotavirus gastroenteritis in the pediatric population of Western Europe: A scoping review. BMC Infect Dis 2012;12:62. [ Links ]
14. Forster J, Guarino A, Parez N, Moraga F, Román E, Mory O, et al. Hospital-based surveillance to estimate the burden of rotavirus gastroenteritis among European children younger than 5 years of age. Pediatrics 2009;123:e393-e400. [ Links ]
15. Bentama I, Soussi I, Ghanimi Z, Riane S, Tligui H, Mdaghri Alaoui A, et al. Epidemic of nosocomial infection by rotavirus in a neonatology service. Rev Med Brux 2012;33:519-24. [ Links ]
16. Consejo Interterritorial del Sistema Nacional de Salud. Calendario de Vacunaciones recomendado (2007). (Internet) (Acceso 20 abril 2012). Disponible en: http://www.msps.es/ciudadanos/proteccionSalud/infancia/vacunaciones/programa/vacunaciones.htm. [ Links ]
17. Consejo Interterritorial del Sistema Nacional de Salud. Calendario común de vacunación infantil (2013). (Internet) (Acceso 23 abril 2013). Disponible en: http://www.msc.es/gabinetePrensa/notaPrensa/pdf/21.03210313201619746.pdf. [ Links ]
18. Imaz Iglesia I, Cornejo Gutiérrez AM, Rubio González B, González Enríquez J. Análisis coste-utilidad de la introducción de la vacunación universal frente al rotavirus en España. Madrid: AETS - Instituto de Salud Carlos III, Madrid; 2011. [ Links ]
19. Moreno-Pérez D, Álvarez García FJ, Arístegui Fernández J, Barrio Corrales F, Cilleruelo Ortega MJ, Corretger Rauet JM, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2013. An Pediatr 2013;78:59.e1-27. [ Links ]
20. Parez N, Giaquinto C, Du Roure C, Martinon-Torres F, Spoulou V, Van Damme P, et al. Rotavirus vaccination in Europe: Drivers and barriers. Lancet Infect Dis 2014;14:416-25. [ Links ]
21. Diez-Domingo J, Suriñach NL, Alcalde NM, Betegón L, Largeron N, Trichard M. Burden of paediatric rotavirus gastroenteritis (RVGE) and potential benefits of a universal Rotavirus vaccination programme with a pentavalent vaccine in Spain. BMC Public Health 2010; 10:469. [ Links ]
22. Gianino P, Mastretta E, Longo P, Laccisaglia A, Sartore M, Russo R, et al. Incidence of nosocomial rotavirus infections, symptomatic and asymptomatic, in breast-fed and non-breast-fed infants. J Hosp Infect 2002;50:13-7. [ Links ]
23. Carrasco JL, Jover L. Métodos estadísticos para evaluar la concordancia. Med Clin (Barc) 2004;122(Supl. 1):28-34. [ Links ]
24. Altman DG. Practical statistics for medical research. Chapman & Hall/CRC; 1991. [ Links ]
25. Abraira V. Errores en las mediciones y clasificaciones clínicas: precisión y validez. (Internet). (Acceso: 29 octubre 2012). Disponible en: http://www.hrc.es/bioest/Intro_errores.html. [ Links ]
26. Zlamy M, Kofler S, Orth D, Würzner R, Heinz-Erian P, Streng A, et al. The impact of Rotavirus mass vaccination on hospitalization rates, nosocomial Rotavirus gastroenteritis and secondary blood stream infections. BMC Infect Dis 2013;13:112. [ Links ]
27. Pockett RD, Campbell D, Carroll S, Rajoriya F, Adlard N. Rotavirus, respiratory syncytial virus and non-rotaviral gastroenteritis analysis of hospital readmissions in England and Wales. Acta Paediatr 2013;102:e158-63. [ Links ]
28. Marc E, Biscardi S, Soulier M, Lebon P, Gendrel D. Nosocomial rotavirus infections in a pediatric unit: Surveillance during four successive winters. Med Mal Infect 2007;37:61-6. [ Links ]
29. Buettcher M, Heininger U. Prospective surveillance of nosocomial viral infections during and after hospitalization at a university children's hospital. Pediatr Infect Dis J 2010;29:950-6. [ Links ]
30. Borrows CL, Turner PC. Seasonal screening for viral gastroenteritis in young children and elderly hospitalized patients: Is it worthwhile? J Hosp Infect 2014;87:98-102. [ Links ]
31. Bruijning-Verhagen P, Quach C, Bonten M. Nosocomial rotavirus infections: A meta-analysis. Pediatrics 2012;129:e1011-9. [ Links ]
32. Goto M, Ohl ME, Schweizer ML, Perencevich EN. Accuracy of administrative code data for the surveillance of healthcare-associated infections: A systematic review and meta-analysis. Clin Infect Dis 2014;58:688-96. [ Links ]
33. Trybou J, Spaepen E, Vermeulen B, Porrez L, Annemans L. Hospital-acquired infections in Belgian acute-care hospitals: Financial burden of disease and potential cost savings. Acta Clin Belg 2013;68:199-205. [ Links ]
34. Márquez Cid M, Valera Niñirola I, Chirlaque López MD, Tortosa Martínez J, Párraga Sánchez E, Navarro Sánchez C. Validación de los códigos diagnósticos de cáncer de colon y recto del conjunto mínimo básico de datos. Gaceta Sanitaria 2006;20:266-72. [ Links ]
35. López Izquierdo R, Asensio Villahoz P, Vicente Vírseda JA, González Manzano I, Udaondo Cascante MA. Tuberculosis pathology attended in emergency through the analysis of the hospital discharges MBDS in the West Valladolid Area, Spain (2002-2006). Revista Española de Salud Pública 2009;83:279-90. [ Links ]
36. Merino Peralta A. Validez del conjunto mínimo básico de datos (CMBD) como fuente de información para detectar factores de riesgo y efectos adversos postoperatorios (Internet). (Acceso 23 noviembre 2012). Disponible en: http://academica-e.unavarra.es/handle/2454/6106. [ Links ]
37. Ramalle-Gomara E, Ruiz E, Serrano M, Bartulos M, Gonzalez MA, Matute B. Validity of discharge diagnoses in the surveillance of stroke. Neuroepid 2013;41:185-8. [ Links ]
38. Ribera A, Marsal JR, Ferreira-González I, Cascant P, Pons JMV, Mitjavila F, et al. Predicting in-hospital mortality with coronary bypass surgery using hospital discharge data: Comparison with a prospective observational study. Rev Esp Cardiol 2008;61:843-52. [ Links ]
39. Pérez Schael I. Aplicación universal de la vacuna de rotavirus: impacto en la mortalidad y hospitalizaciones por diarrea. Revista de la Sociedad Venezolana de Microbiología 2011;31:104-11. [ Links ]
40. Koch J, Wiese-Posselt M, Remschmidt C, Wichmann O, Bertelsmann H, Garbe E, et al. Background paper to the recommendation for routine rotavirus vaccination of infants in Germany. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2013;56:957-84. [ Links ]
41. Waisbourd-Zinman O, Ben-Ziony S, Solter E, Chodick G, Ashkenazi S, Livni G. The percentage of nosocomial-related out of total hospitalizations for rotavirus gastroenteritis and its association with hand hygiene compliance. Am J Infect Control 2011;39:166-8. [ Links ]











 text in
text in