My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.107 n.6 Madrid Jun. 2015
REVISIÓN
Neuropatía entérica asociada a diabetes mellitus
Enteric neuropathy associated to diabetes mellitus
José Antonio Uranga Ocio1,2, Sonia Bastús Díez1, Drissa Delkáder Palacios1, Noemí García Cristóbal1, Miguel Ángel Leal García1 y Raquel Abalo Delgado1,2,3
1Departamento de Ciencias Básicas de la Salud. Universidad Rey Juan Carlos. Alcorcón, Madrid.
2Unidad Asociada I+D+i. Instituto de Investigación en Ciencias de la Alimentación (CIAL). Consejo Superior de Investigaciones Científicas (CSIC). Madrid.
3Unidad Asociada I+D+i. Instituto de Química Médica. Consejo Superior de Investigaciones Científicas (CSIC). Madrid
Financiación del Ministerio de Educación y Ciencia (SAF2009-12422-C02-01; SAF2012-40075-C02-01), Comunidad de Madrid (S2010/BMD-2308) y Fundación Mapfre (Ayudas a la Investigación-Promoción de la Salud 2009: Alimentación y Ejercicio Físico).
Dirección para correspondencia
RESUMEN
La diabetes mellitus (DM) es un conjunto de enfermedades de gran prevalencia en la actualidad. Sus diferentes variantes se caracterizan por producir síntomas muy semejantes con complicaciones agudas y crónicas. Entre estas se encuentra la dismotilidad gastrointestinal (GI) asociada al desarrollo de neuropatía en el sistema nervioso entérico (SNE). El objetivo de este artículo es revisar los conocimientos sobre la dismotilidad GI y la neuropatía entérica asociada a diabetes mellitus.
Para ello se describen las diversas alteraciones funcionales y estructurales encontradas en el sistema digestivo tanto en el hombre como en diversos modelos animales de diabetes. Para finalizar, se hace un breve resumen de las estrategias de tratamiento y prevención de la neuropatía diabética entérica que se han considerado hasta la fecha.
En conclusión, entre las alteraciones descritas en la DM destaca especialmente la pérdida de inervación intrínseca inhibidora. Como posibles estrategias terapéuticas y/o preventivas se propone desde el uso de insulina, el factor de crecimiento nervioso y antioxidantes hasta el trasplante de neuronas mientéricas.
Palabras clave: Diabetes mellitus. Dismotilidad gastrointestinal. Gastroparesia. Neuropatía entérica. Plexo mientérico. Sistema nervioso entérico.
ABSTRACT
Diabetes mellitus (DM) is a group of diseases highly prevalent nowadays. Its different types produce very similar symptoms with acute and chronic complications. Amongst these, gastrointestinal (GI) dysmotility, associated with the development of neuropathy in the enteric nervous system (ENS) is recognized. The objective is to review the current knowledge on GI dysmotility and enteric neuropathy associated to diabetes mellitus. The different functional and structural alterations within the digestive tract in diabetic patients and animal models are described. Finally, the therapeutic and preventive strategies tested so far in the context of enteric diabetic neuropathy are briefly summarized.
In conclusion, amongst the alterations described in DM, the loss of inhibitory intrinsic innervation of the gut is most remarkable. Different therapeutic and/or preventive strategies, including the use of insulin, nerve growth factor or antioxidants, as well as myenteric neuron transplantation, are proposed.
Key words: Diabetes mellitus. Gastrointestinal dysmotility. Gastroparesia. Enteric neuropathy. Myenteric plexus. Enteric nervous system.
Abreviaturas
DM 1 y 2: diabetes mellitus 1 y 2.
GI: gastrointestinal.
SNE: sistema nervioso entérico.
STZ: estreptozotocina;
ZDF: Zucker diabetic fatty;
ICC: células intersticiales de Cajal;
ICC-MP: células intersticiales de Cajal del plexo mientético;
NOS: óxido nítrico sintasa;
NA: noradrenalina;
ASPA: aspartato ciclasa;
FNM: fibras nerviosas de la mucosa;
GDNF: factor de crecimiento derivado de células gliales.
Introducción
La diabetes mellitus (DM) es una de las enfermedades crónicas más prevalentes en occidente, extendiéndose rápidamente también a los países en desarrollo. En 2013, 382 millones de personas eran diabéticas en todo el mundo y se ha estimado que esta cifra alcanzará los 592 millones en 2035, por lo que la DM constituye un problema de salud pública de primer orden (1). Los tipos más habituales de la enfermedad son el 1 (DM 1) que conlleva la destrucción de las células β y una deficiencia absoluta de insulina, y el 2 (DM 2), caracterizado por déficits variables de insulina y resistencia a la misma (2). Los diferentes tipos de diabetes cursan con un estado hiperglucémico que a niveles elevados ocasiona poliuria, polifagia y polidipsia. Las complicaciones agudas (hipoglucemia, cetoacidosis, coma hiperosmolar no cetósico...) son consecuencia de un control inadecuado de la glucemia mientras que las crónicas (cardiovasculares, nefropatías, retinopatías, neuropatías...) se deben al mantenimiento a largo plazo del estado hiperglucémico (a niveles de glucemia de 200-250 mg/dl, que superan la reabsorción renal) y a los fenómenos oxidativos e inflamatorios por él generados (3). En definitiva, la DM induce alteraciones estructurales y funcionales de las células, tejidos y órganos de todo el cuerpo, incluyendo el tracto gastrointestinal (GI) y su inervación.
Objetivo
Revisar el conocimiento actual sobre las alteraciones que produce la diabetes en el tubo digestivo y, muy particularmente, en las neuronas entéricas responsables del control de sus funciones. Para ello, describiremos las alteraciones funcionales y estructurales/histológicas que se presentan en esta patología en el tubo digestivo, los modelos animales desarrollados para su estudio, y las posibles estrategias de tratamiento y prevención.
Control motor del tubo digestivo
El control de las funciones del tubo digestivo depende, fundamentalmente, de su inervación intrínseca y extrínseca. El sistema nervioso entérico (SNE) es una red nerviosa que se extiende desde el esófago hasta el esfínter anal interno y que incluye el plexo mientérico o de Auerbach (principal encargado de controlar la motilidad y situado entre las capas musculares) y el submucoso o de Meissner (que regula la microcirculación y la función epitelial). Las neuronas del SNE se acompañan de células gliales y pueden funcionar independientemente del control extrínseco, participando en la modulación de la peristalsis, secreción, percepción del dolor e inflamación (4).
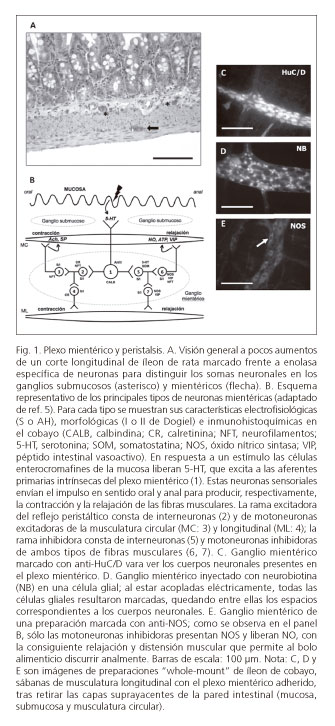
La unidad de la función motora del tracto GI es el reflejo peristáltico que se produce en el plexo mientérico en respuesta a los contenidos luminales (4). Presenta, entre otras, neuronas sensitivas, interneuronas y neuronas motoras excitadoras e inhibidoras de ambas capas musculares. Los estudios electrofisiológicos, morfológicos, inmunohistoquímicos y de marcaje retrógrado han establecido las diferencias entre las poblaciones neuronales (4,5) (Fig. 1). Además, las células intersticiales de Cajal (ICC), consideradas células marcapasos y situadas entre las neuronas mientéricas y las fibras musculares, coordinan las respuestas contráctiles (6).
El sistema nervioso extrínseco modula la función del SNE y está formado por las vías parasimpáticas del nervio vago y de los nervios sacros, que producen excitación de la musculatura e inhibición de los esfínteres, y por el sistema nervioso simpático toracolumbar, con efectos contrarios. El plexo mientérico del estómago y del duodeno proximal está densamente inervado por el nervio vago. Distalmente al duodeno, los ganglios mientéricos inervados por el vago disminuyen rápidamente, aunque la inervación parasimpática vuelve a ser importante en el ciego y el colon proximal (4). Así, tras la ingesta, la relajación del fundus por activación del vago permite la acomodación de la comida en el estómago. Las contracciones peristálticas del antro empujan el contenido gástrico hacia el píloro, que permite el paso de pequeñas cantidades al duodeno cuando está abierto. La llegada de nutrientes a la zona distal del intestino delgado retrasa el vaciado gástrico (reflejo enterogástrico), mientras que la distensión gástrica postprandial promueve el flujo de contenidos luminales al íleon y ciego (reflejo gastrocólico). Finalmente, las hormonas gastrointestinales también contribuyen a regular la motilidad del tubo digestivo ya sea favoreciendo la distensión gástrica (ghrelina), inhibiendo el vaciado (GLP-1, colecistoquinina y secretina) o favoreciendo la motilidad (gastrina, motilina). Por último es de reseñar que algunos de estos péptidos (GLP-1, colecistoquinina, gastrina y ghrelina) son conocidos mediadores del metabolismo de la glucosa al inducir efectos como la síntesis de insulina, la proliferación de células β o la liberación de glucagón (7).
Gastroenteropatía diabética: alteraciones funcionales
La DM se asocia, hasta en un 75% de los pacientes, a síntomas gastrointestinales como náuseas, distensión y dolor abdominal, diarrea, estreñimiento y enlentecimiento del vaciamiento gástrico. Además, las alteraciones de la motilidad provocan sobrecrecimiento de la flora bacteriana, lo que agrava el problema, pues puede ocasionar hinchazón, diarrea o dolor abdominal, así como malabsorción, e incluso alterar la estructura morfológica intestinal, tanto micro como macroscópica (8). De todas las alteraciones la mejor conocida es la gastroparesia (9). Se observa tanto en la DM 1 como en la DM 2, en pacientes con y sin complicaciones asociadas de la diabetes, y puede ocurrir hasta en el 50% de los enfermos (10).
La mejor prueba para la evaluación de pacientes con gastroparesia es la gammagrafía nuclear con alimento marcado con Tecnecio 99m. Sin embargo, tiene limitaciones como su alto coste, la exposición a la radiación y la necesidad de un equipo especializado, por lo que se han desarrollado nuevas tecnologías para mejorar el diagnóstico, como la cápsula endoscópica, ecografía 3D, MRI, SPECT o el test del aliento con Spiroulina platensis marcada con 13C (9). La evaluación física se limita a la valoración nutricional y de signos de neuropatía diabética (8).
La DM es la causa más común de neuropatía autonómica y contribuye a los síntomas GI, incluyendo la motilidad intestinal anormal (11,12). El diagnóstico de la neuropatía autonómica GI no es fácil pues puede afectar tanto a la inervación intrínseca (neuropatía entérica asociada a la DM), que es difícil de valorar (requiere muestras que incluyan los plexos entéricos), como extrínseca y, en este caso, las alteraciones cardiovasculares tienen poco valor en la predicción de trastornos motores del tracto GI (11). De hecho, gran parte de la información disponible sobre esta neuropatía se ha obtenido en modelos animales de diabetes, por lo que conviene repasar los estudios realizados en dichos modelos.
Modelos animales y estudios in vitro e in vivo
Se han desarrollado muchos modelos de neuropatía diabética, aunque no en todos se ha evaluado la afectación del SNE (13,14). Para la DM 1, aunque existen modelos genéticos como las ratas consanguíneas BB, el más frecuente es el inducido por administración de estreptozotocina (STZ), una toxina que destruye las células β-pancreáticas (15-17). La STZ a las dosis habituales puede ocasionar neurotoxicidad (18), lo que contribuiría a la neuropatía observada en estos modelos. En cambio, dosis más bajas pero repetidas no producen toxicidad en el plexo mientérico o en las ICC de ratones control, mientras que en ratones diabéticos transgénicos RIP-I/hIFNβ permitieron valorar los cambios en la motilidad digestiva debidos a la propia patología y los adaptativos a la polifagia, polidipsia, etc. (19).
La creciente prevalencia de la DM 2 en los últimos tiempos ha provocado un gran aumento de estudios en modelos de obesidad y diabetes inducidos por dietas hipercalóricas y/o hipergrasas, tanto en ratón (20,21), como en rata (22). También existen modelos genéticos de obesidad y DM 2 en los que se han valorado las alteraciones de la motilidad GI y/o la neuropatía entérica, como los ratones ob/ob, db/db, KK y KKAy (20-24), y las ratas Otsuka Long-Evans Tokushima Fatty (OLETF) y Zucker Diabetic (ZDF) (25,26).
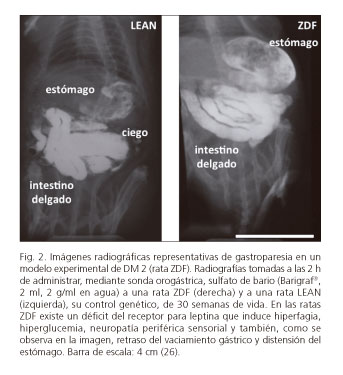
Los estudios in vitro realizados con estos modelos incluyen desde ensayos de contractilidad y respuestas farmacológicas en segmentos gastrointestinales aislados (19), hasta cultivos de líneas de neuronas entéricas o de ganglios mientéricos disecados mediante láser (22). En cuanto a los estudios in vivo, se han utilizado procedimientos invasivos: administración intragástrica de marcadores y análisis de su progresión por el tubo digestivo (19,21), electromiografía de la muscular externa tras inserción de electrodos en la serosa (27), y no invasivos. Estos últimos permiten valorar los cambios funcionales que se producen temporalmente durante el desarrollo de la patología. Así, se han empleado tests de aliento con ácido octanoico marcado con 13C para valorar la gastroparesia (28), y tests de expulsión de bolos fecales artificiales insertados en el colon para valorar la dismotilidad colónica (21). Destaca también el uso de marcadores radiopacos que permiten determinar las alteraciones en el tránsito y en la morfología de cada región GI (26) (Fig. 2).
Gastroenteropatía diabética: alteraciones estructurales
Tanto en ratas a las que se ha administrado STZ (29), o ratones diabéticos RIP-I/hIFNβ (19), se observa una mayor longitud del tracto GI. Alteraciones macroscópicas aparte, el daño que la DM produce en la pared del tracto GI y en las poblaciones específicas de neuronas entéricas, se ha analizado mediante histología convencional, inmunohistoquímica y microscopía electrónica, como analizamos a continuación.
Mucosa
En la diabetes, la mucosa del intestino delgado sufre cambios que alteran el paso del bolo alimenticio, la secreción de jugos entéricos y la absorción de los productos de la digestión (30). La hiperglucemia aguda en el yeyuno de las ratas no provocó alteraciones en el índice mitótico o en la morfometría de la mucosa intestinal. En cambio, la crónica cursa en la rata con hiperplasia e hipertrofia de la mucosa (30). El aumento en el índice mitótico puede estar relacionado con una adaptación de la capa mucosa a la patogenia crónica.
Por otra parte, se ha observado un aumento de células caliciformes en las vellosidades intestinales del intestino delgado de ratas con hiperglucemia aguda (31) y en las criptas del intestino delgado de ratones diabéticos (32). El mantenimiento de esta población celular permite la conservación de la túnica mucosa como adaptación morfo-funcional a la diabetes crónica (33).
Músculo liso
Las alteraciones en el grosor de las capas musculares depende de la región considerada y del momento en que se realiza el análisis a lo largo del desarrollo de la patología (33). La causa de estas diferencias regionales no está clara y, de hecho, su función intrínseca podría no estar afectada. Así, en los estudios en baño de órganos de preparaciones de musculatura longitudinal de íleon y circular de colon de ratones diabéticos RIP-I/hIFNβ, las respuestas contráctiles fueron semejantes a las de animales control, lo que sugiere que la función de las capas musculares podría adaptarse al daño asociado a la diabetes (19).
Células intersticiales de Cajal
La DM puede influir también en las células marcapasos del tracto GI. Se han observado cambios degenerativos y/o pérdida de ICC por todo el tracto digestivo de pacientes y modelos animales (34,35). Como en los ratones diabéticos, los sujetos con DM 2 con gastroparesia, tienen menos ICC en estómago (34). Además, las ICC pierden su asociación habitual con las neuronas entéricas, lo que se relaciona con una disminución de la actividad eléctrica muscular del antro (10).
La alteración de las ICC en el intestino es menos clara. Así, en ratones diabéticos RIP-I/hIFNβ, descendió la frecuencia de contracciones espontáneas en el delgado, pero la red de ICC del plexo mientérico (ICC-PM) estaba intacta. Por el contrario, en el colon la frecuencia de estas contracciones fue similar a los controles (19). No obstante, se encontraron áreas con escasez de ICC-MP en íleon y colon de ratones db/db (36) y en la capa muscular del colon de pacientes diabéticos (37).
Inervación extrínseca
Se ha considerado que una neuropatía visceral autónoma o cambios en la inervación vagal son los responsables de las alteraciones del control motor gástrico en la diabetes (38). En ratas diabéticas (BB) con alteraciones en la motilidad del yeyuno, no se demostró la presencia de neuropatía autonómica cardiaca (27). Sin embargo, la expresión de óxido nítrico sintetasa (NOS) neuronal en el yeyuno de ratas es independiente del nervio vago (39), por lo que la neuropatía vagal podría no ser la causa de las alteraciones de la motilidad más allá del duodeno. Tampoco parece que la hiperglucemia sea determinante en estos casos, ya que animales con distinto control de la glucemia mostraron cambios similares (27).
En lo que se refiere a la inervación simpática, los niveles de noradrenalina (NA) disminuyen en el íleon al mismo tiempo que aumentan en el colon proximal y permanecen inalterados en el distal. Además, el descenso de NA en el íleon de las ratas diabéticas coincide con la presencia de varicosidades inflamadas en las fibras nerviosas (40).
Inervación intrínseca: neuropatía entérica asociada a diabetes mellitus
Se han descrito cambios en el número de neuronas y en la expresión de neurotransmisores del plexo mientérico, así como pérdida de neuronas mientéricas en algunas áreas del tracto digestivo en roedores con DM (41), y alteraciones morfológicas en determinados subtipos de neuronas del estómago de pacientes con DM 2 (34,35).
Las distintas subpoblaciones de neuronas entéricas responden de diferente manera a la DM, y la magnitud de los cambios parece específica para el segmento de intestino, modelo y duración de la DM (17). Se ha demostrado la pérdida selectiva de poblaciones neuronales y neurodegeneración del plexo mientérico tanto en rata como ratón (18,41).
La estimulación eléctrica se emplea para generar respuestas musculares dependientes de la actividad neuronal. En estos estudios, la respuesta predominante normal del músculo longitudinal es excitadora, mediada por contracciones colinérgicas, y la incubación con atropina revela la presencia de cotramisión funcional inhibidora seguida de una contracción no colinérgica sensible a tetrodotoxina (TTX). Por el contrario, en el músculo circular la respuesta mayoritaria en condiciones de bloqueo adrenérgico y colinérgico es inhibidora, tanto en rata como en humano (42,43). En ratones diabéticos se observa un leve aumento de las contracciones colinérgicas, un fallo en la neurotrasmisión inhibidora en el íleon y un descenso de las contracciones no colinérgicas en el íleon y, más aún, en el colon. Estos resultados demuestran que ambos componentes, nitrérgico y purinérgico, de la relajación evocada por la estimulación eléctrica están inhibidos. Además, el daño de la inhibición nitrérgica en el colon se evidencia también por la disminución de la actividad contráctil en presencia de inhibidores de la NOS o de tetrodotoxina (19).
En cuanto a las causas de la neurodegeneración, se considera el efecto de la reacción inflamatoria provocada por la DM (27). Así, hay inflamación del estómago, intestino delgado y colon en ratas BB, y se acompaña de daño en los plexos mientérico y submucoso y limitación en la función motora (44). La causa del infiltrado inflamatorio no está clara; puede reflejar una alteración de la barrera intestinal (a lo que contribuye el sobrecrecimiento bacteriano), un descenso de la regulación de NOS neuronal (nNOS) por inducción de NOS inducible (iNOS), produciendo elevadas cantidades de NO (45) o muerte por apoptosis. Los cambios en la inmunorreactividad para nNOS persistieron tras la resolución de la inflamación (27). Otra posibilidad sería que la inflamación intestinal tenga un origen autoinmune (46). Estudios en humanos (47) parecen confirmar un comportamiento semejante al de la rata.
Estudios histopatológicos y experimentales in vivo han demostrado que la glía entérica desempeña un papel clave en las patologías asociadas a la disfunción de la barrera y alteraciones motoras del intestino, tales como estreñimiento, la aparición de divertículos y megacolon idiopático, la reducción de la motilidad intestinal y el enlentecimiento del vaciado (48). En este sentido, la actividad normal de la aspartato-ciclasa (ASPA) glial es notable para mantener las neuronas sanas al ser un importante agente inductor de neurodegeneración, estando elevada en el duodeno de ratones diabéticos. La hiperglucemia afecta por tanto a la actividad de la ASPA, pudiendo contribuir a la neuropatía observada en la DM 2 (49).
Por otra parte, se ha sugerido que también los cambios en la vascularización contribuyen a la neuropatía entérica asociada a la DM. La permeabilidad de los grandes vasos sanguíneos mesentéricos está alterada en la diabetes (50), pero el efecto en los capilares del interior de la pared intestinal no se conoce bien. El exceso de permeabilidad capilar puede resultar patológico para las neuronas entéricas y conducir a neuropatía en determinadas regiones intestinales (51). Así, las alteraciones de la pared capilar fueron pronunciadas en íleon y colon, pero no en duodeno. La recuperación de los niveles de insulina impidió las alteraciones estructurales en la pared capilar de íleon, pero no de colon. En el duodeno se observó una regulación al alza de caveolina-1 y NOS en las células endoteliales (eNOS). Esto concuerda con la hipótesis de que los microvasos adyacentes al plexo mientérico son dianas del daño de la DM (52).
La susceptibilidad de los microvasos a la hiperglucemia se relaciona con la prevalencia de bacterias en diferentes partes del tracto GI ya que inducen un estado anaerobio en el intestino distal (53). El daño estructural en el colon es irreversible, en el íleon puede revertirse con aporte de insulina, y en el duodeno el mecanismo que regula la permeabilidad vascular está activo. La hipoxia media la regulación al alza de lipooxigenasa, responsable del compromiso en el funcionamiento de la barrera de la membrana basal en la retinopatía diabética (54). En el colon determinaría un engrosamiento irreversible de la membrana basal tras el primer shock hiperglucémico. Estos estudios demuestran la necesidad de evaluar la participación de los sistemas antioxidantes, la composición de la microflora intestinal, y la regulación de la expresión de lipooxigenasa en los diferentes segmentos intestinales en la diabetes (52).
Inervación de la mucosa
Conviene mencionar los estudios sobre inervación de la mucosa debido a que los trabajos iniciales sobre el nervio vago en la DM son contradictorios (55,56), y porque, aunque los sujetos con DM 2 con gastroparesia tienen menos ICC en muestras de estómago y menos neuronas inhibitorias en el plexo mientérico (34), estas alteraciones no son observables mediante biopsia endoscópica convencional (57). Así, se ha confirmado histológicamente que la neuropatía autónoma afecta a los nervios de la mucosa gástrica de los pacientes con DM 1: ocurre una disminución de la densidad de las fibras nerviosas de la mucosa (FNM) además de una alteración en el patrón de inervación y en su morfología. La densidad de FNM se correlacionó en el antro de forma inversa con la duración de la diabetes y entre los síntomas de gastroparesia, la hinchazón abdominal tendió a asociarse con la densidad de FNM. Sin embargo, ninguna de las medidas de síntomas gástricos, ni los resultados de las pruebas neurológicas, o la densidad de fibras nerviosas cutáneas predijo la deficiencia en las FNM. La gravedad de las alteraciones encontradas en las pruebas de reflejo autónomo cardiorrespiratorio no se correlacionó tampoco con la gravedad de la pérdida de FNM (57). Por tanto, se ha propuesto la densidad de la inervación de la mucosa gástrica como biomarcador de neuropatía autonómica diabética (57).
Estrategias de tratamiento y prevención
El manejo óptimo del paciente diabético requiere una aproximación multidisciplinar y debería, primeramente, tratar de aliviar los síntomas gastrointestinales, así como mejorar el estado nutricional y el control de la glucemia, que puede mejorar la función motora gástrica per se (58,59). El vómito y las náuseas pueden generar pérdidas de peso, deshidrataciones y desregulaciones electrolíticas que no deben obviarse a pesar del posible sobrepeso inicial de algunos pacientes diabéticos. No existe una guía clara sobre la manera de actuar desde el punto de vista nutricional, si bien se considera que las comidas frecuentes y poco copiosas, disminuir la ingesta de grasas y fibra (que reducen el vaciamiento gástrico), así como ajustar la ingesta de carbohidratos en función de la medicación, mejoran los síntomas y el control glucémico (60). La presencia de dolor complica el problema en los casos en que ocurre ya que muchos analgésicos empeoran aún más la función motora GI. En algunos pacientes la gastroparesia puede incluso hacer necesario el tratamiento quirúrgico, ya sea mediante una yeyunostomía (para asegurar la adecuada nutrición del paciente), endoscopia para administrar toxina botulínica en el píloro (que relaja el esfínter y favorece el vaciamiento gástrico) o incluso la cirugía bariátrica (9,61-63).
La estrategia más común para mejorar los síntomas gastrointestinales de la DM es el empleo de fármacos procinéticos. Estos fármacos incrementan la motilidad digestiva favoreciendo el avance de los alimentos y las secreciones intestinales a través de los diferentes segmentos del tracto digestivo. En función de su mecanismo principal de acción, los procinéticos pueden dividirse en fármacos de acción predominantemente dopaminérgica, serotoninérgica, colinérgica o agonistas de la motilina (64). Los principales son la metoclopramida y la domperidona, ambos antagonistas dopaminérgicos del receptor D2, que además de mejorar el vaciamiento gástrico, reducen náuseas y vómitos, aunque la domperidona presenta menos efectos centrales y más efectos cardiovasculares (65). La cisaprida, agonista de receptores de serotonina tipo 5HT4, se empleó profusamente en el pasado, pero sus efectos proarritmogénicos han ocasionado su retirada del mercado hace ya algunos años (66). La eritromicina, un antibiótico macrólido, estimula al receptor de la motilina y con ello a las neuronas colinérgicas (65,67,68). La ghrelina y los agonistas de su receptor (TZP-101), también facilitan el vaciado gástrico (68), del mismo modo que la suplementación con tetrahidrobiopterina o su precursor sepiapterina (70). Los agentes duales como la levosulpirida (antagonista dopaminérgico D2 y agonista 5HT4) y la cinitaprida (agonista 5HT4 y antagonista 5HT2) también son útiles y seguros (64,69). El empleo de antieméticos es igualmente importante para evitar uno de los síntomas más debilitantes de estos pacientes. Además de los antagonistas dopaminérgicos mencionados anteriormente, los usados con mayor frecuencia son las fenotiazinas como la proclorperazina, que actúa sobre los receptores colinérgicos y dopaminérgicos, si bien puede presentar efectos secundarios como discinesia, y no necesariamente mejora el vaciamiento gástrico (63,65,67). Con el mismo fin se emplea la estimulación eléctrica (marcapasos gástrico), que ha demostrado mejorar la calidad de vida, aliviar los síntomas, las alteraciones nutricionales, e incluso el mal control de la diabetes, aunque se reserva a pacientes con síntomas refractarios, especialmente náusea y vómitos (65,67).
En relación con la pérdida de las ICC, y dado el alto estrés oxidativo generado en la diabetes, se ha podido comprobar que la hemina incrementa la expresión de NOS y mejora la gastroparesia diabética en ratones (35). Es de reseñar que la hemina también incrementa la actividad oxigenasa en humanos (67). Por último, la terapia regenerativa con células madre podría también ser útil para restaurar la población de ICC (71).
Entre los variados mecanismos de neuropatía entérica diabética se incluirían (13,14,52) los siguientes: disfunción endotelial y microcirculatoria; efectos celulares directos de la hiperglucemia (disfunción mitocondrial y estrés osmótico u oxidativo); metabolismo alterado de los ácidos grasos; cambios en los factores de crecimiento nervioso e interacciones cerebro-tracto GI alteradas; aumento en la apoptosis neuronal. En consecuencia, algunas de las estrategias ensayadas y dirigidas específicamente a preservar o restaurar la inervación del tracto digestivo y, con ello, impedir la neuropatía entérica, han sido:
- Insulina: en modelos animales de DM 1, como los generados tras tratamiento con STZ, es capaz de revertir la pérdida inicial (pero no la secundaria) de neuronas nitrérgicas (16) así como las células gliales (72).
- Factores de crecimiento nervioso: el GDNF (factor de crecimiento nervioso derivado de la glía) revirtió el daño neuronal funcional y morfológico inducido por la hiperglucemia (41).
- Antioxidantes, protegieron las neuronas entéricas y/o las células gliales:
• Ácido lipoico, aceite de onagra o la combinación de ambos (29); ácido oleico (22).
• Ácido ascórbico (73), que también es inhibidor de la aldosa reductasa (74).
• Vitamina E (33), extracto de Ginkgo biloba (75), quercetina (76).
• L-glutamina (77); glutatión reducido (78).
- Modular las señales nitrérgicas (modulación de la biodisponibilidad de S-nitrosotiol) (79).
Finalmente, otra posibilidad que se ha considerado es el trasplante de neuronas entéricas (13).
Conclusiones
Existen numerosos estudios, tanto en pacientes como en modelos animales, que demuestran el desarrollo de neuropatía en el sistema nervioso entérico con la progresión de la enfermedad diabética. Esta neuropatía, que afecta sobre todo a las neuronas inhibidoras nitrérgicas, subyace y contribuye a las complicaciones gastrointestinales de la diabetes que interfieren de manera importante con la calidad de vida de los pacientes. Aunque el diagnóstico de la dismotilidad GI es relativamente sencillo mediante pruebas funcionales, el de la neuropatía entérica asociada no lo es tanto y sólo recientemente se ha apuntado a la posibilidad de evaluar la densidad de fibras nerviosas de la mucosa en muestras biópsicas. Las estrategias de tratamiento y prevención de la dismotilidad GI y la neuropatía entérica subyacente pasan por un adecuado control de la glucemia, pero se proponen, además, medidas adicionales como el uso de antioxidantes o factores de crecimiento nervioso. Otras estrategias más sofisticadas, como el trasplante de neuronas mientéricas, podrían también ser adoptadas en el futuro.
Agradecimientos
Gema Vera y Pablo Antonio Cabezos han contribuido a la obtención de las preparaciones e imágenes de las figuras 1 y 2.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Raquel Abalo Delgado.
Departamento de Ciencias Básicas de la Salud
(Área Farmacología y Nutrición).
Facultad de Ciencias de la Salud.
Universidad Rey Juan Carlos.
Avda. de Atenas, s/n.
28922 Alcorcón, Madrid
e-mail: raquel.abalo@urjc.es
Recibido: 24/10/2014
Aceptado: 07/01/2015
Bibliografía
1. Guariguata L, Whiting DR, Hambleton I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035. Diabetes Res Clin Pract 2014;103:137-49. [ Links ]
2. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2014;37(Supl. 1):81-90. [ Links ]
3. Powers AC. Diabetes Mellitus. En: Longo, Fauci, Kasper Hauser, Jameson, Loscalzo, editores. Harrison Principios de Medicina Interna. McGraw-Hill Interamericana; 2012. [ Links ]
4. Furness JB. The enteric nervous system. Massachusetts: Blackwell; 2006. [ Links ]
5. Costa M, Brookes SJ, Steele PA, et al. Neurochemical classification of myenteric neurons in the guinea-pig ileum. Neuroscience 1996;75:949-67. [ Links ]
6. Al-Shboul OA. The importance of interstitial cells of Cajal in the gastrointestinal tract. Saudi J Gastroenterol 2013;19:3-15. [ Links ]
7. Drucker DJ. The role of gut hormones in glucose homeostasis. J Clin Invest 2007;117:24-32. [ Links ]
8. Kopacova M. Small intestinal bacterial overgrowth syndrome. World J Gastroenterol 2010;16:2978-90. [ Links ]
9. Gatopoulou A, Papanas N, Maltezos E. Diabetic gastrointestinal autonomic neuropathy: Current status and new achievements for everyday clinical practice. Eur J Intern Med 2012;23:499-505. [ Links ]
10. Smith D, Williams C, Ferris C. Diagnosis and treatment of chronic gastroparesis and chronic intestinal pseudo-obstruction. Gastroenterol Clin N Am 2003;32:619-58. [ Links ]
11. Samsom M, Smout AJ. Abnormal gastric and small intestinal motor function in diabetes mellitus. Dig Dis 1997;15:263-74. [ Links ]
12. Bruna J, Navarro X. Neuropatía autonómica en la diabetes mellitus. Rev Neurol 2005;40:102-10. [ Links ]
13. Chandrasekharan B, Srinivasan S. Diabetes and the enteric nervous system. Neurogastroenterol Motil 2007;19:951-60. [ Links ]
14. Bagyánszki M, Bódi N. Diabetes-related alterations in the enteric nervous system and its microenvironment. World J Diabetes 2012;3:80-93. [ Links ]
15. Lincoln J, Bokor JT, Crowe R, et al. Myenteric plexus in streptozotocin-treated rats. Neurochemical and histochemical evidence for diabetic neuropathy in the gut. Gastroenterology 1984;86:654-61. [ Links ]
16. Watkins CC, Sawa A, Jaffrey S, et al. Insulin restores neuronal nitric oxide synthase expression and function that is lost in diabetic gastropathy. J Clin Invest 2000;106:373-84. [ Links ]
17. LePard KJ. Choline acetyltransferase and inducible nitric oxide synthase are increased in myenteric plexus of diabetic guinea pig. Auton Neurosci 2005;118:12-24. [ Links ]
18. Guo C, Quobatari A, Shangguan Y, et al. Diabetic autonomic neuropathy: Evidence for apoptosis in situ in the rat. Neurogastroenterol Motil 2004;16:335-45. [ Links ]
19. Domènech A, Pasquinelli G, De Giorgio R, et al. Morphofunctional changes underlying intestinal dysmotility in diabetic RIP-I/hIFNB transgenic mice. Int J Exp Pathol 2011;92:400-12. [ Links ]
20. LePard KJ, Cellini J. Age-dependent slowing of enteric axonal transport in insulin-resistant mice. World J Gastroenterol 2013;19:482-91. [ Links ]
21. Nezami BG, Mwangi SM, Lee JE, et al. MicroRNA 375 Mediates Palmitate-Induced Enteric Neuronal Damage and High-Fat Diet-Induced Delayed Intestinal Transit in Mice. Gastroenterology 2014; 146:473-83. [ Links ]
22. Voss U, Sand E, Olde B, et al. Enteric neuropathy can be induced by high fat diet in vivo and palmitic acid exposure in vitro. PLoS One 2013;8:e81413. [ Links ]
23. Mizuno MS, Crisma AR, Borelli P, et al. Expression of the P2X receptor in different classes of ileum myenteric neurons in the female obese ob/ob mouse. World J Gastroenterol 2012;18:4693-703. [ Links ]
24. James AN, Ryan JP, Crowell MD, et al. Regional gastric contractility alterations in a diabetic gastroparesis mouse model: Effects of cholinergic and serotoninergic stimulation. Am J Physiol Gastrointest Liver Physiol 2004;287:612-9. [ Links ]
25. Yoneda S, Kadowaki M, Kuramoto H, et al. Enhanced colonic peristalsis by impairment of nitrergic enteric neurons in spontaneously diabetic rats. Auton Neurosci 2001;92:65-71. [ Links ]
26. Abalo R, Cabezos P, Vera G, et al. Radiographic analysis of gastrointestinal motor function in a model of type 2 diabetes, the Zucker Diabetic Fatty (ZDF) rat. J Diabetes 2009;1(Supl. 1):237-8. [ Links ]
27. Demedts I, Masaoka T, Kindt S, et al. Gastrointestinal motility changes and myenteric plexus alterations in spontaneously diabetic biobreeding rats. J Neurogastroenterol Motil 2013;19:161-70. [ Links ]
28. Creedon CT, Verhulst PJ, Choi KM, et al. Assessment of gastric emptying in non-obese diabetic mice using a (13C)-octanoic acid breath test. J Vis Exp 2013;73:e50301. [ Links ]
29. Shotton HR, Broadbent S, Lincoln J. Prevention and partial reversal of diabetes-induced changes in enteric nerves of the rat ileum by combined treatment with alpha-lipoic acid and evening primrose oil. Auton Neurosci 2004;111:57-65. [ Links ]
30. Zoubi SA, Williams MD, Mayhew TM, et al. Number and ultrastructure of epithelial cells in crypts and villi along the streptozotocin-diabetic small intestine: A quantitative study on the effects of insulin and aldose reductase inhibition. Virchows Arch 1995;427:187-93. [ Links ]
31. Mantle M, Thakore E, Atkins E, et al. Effects of streptozotocin-diabetes on rat intestinal mucin and goblet cells. Gastroenterology 1988;97:66-75. [ Links ]
32. Ettarh RR, Carr KE. A morphological study of the enteric mucosal epithelium in the streprozotocin-diabetic mouse. Life Sci 1997;61:1851-8. [ Links ]
33. Roldi LP, Pereira RV, Tronchini EA, et al. Vitamin E (alpha-tocopherol) supplementation in diabetic rats: Effects on the proximal colon. BMC Gastroenterol 2009;9:88. [ Links ]
34. Iwasaki H, Kajimura M, Osawa S, et al. A deficiency of gastric interstitial cells of Cajal accompanied by decreased expression of neuronal nitric oxide synthase and substance P in patients with type 2 diabetes mellitus. J Gastroenterol 2006;41:1076-87. [ Links ]
35. Choi KM, Gibbons SJ, Nguyen TV, et al. Heme oxygenase-1 protects interstitial cells of Cajal from oxidative stress and reverses diabetic gastroparesis. Gastroenterology 2008;135:2055-64. [ Links ]
36. Yamamoto T, Watabe K, Nakahara M, et al. Disturbed gastrointestinal motility and decreased interstitial cells of Cajal in diabetic db/db mice. J Gastroenterol Hepatol 2008;23:660-7. [ Links ]
37. Nakahara M, Isozaki K, Hirota S, et al. Deficiency of KIT positive cells in the colon of patients with diabetes mellitus. J. Gastroenterol Hepatol 2002;17:666-70. [ Links ]
38. Itoh H, Yoneda M, Tamori K, et al. Rapid gastric emptying and pathological changes of vagus nerve in the spontaneously diabetic Chinese hamster. Diabetes Res Clin Pract 1995;28:89-95. [ Links ]
39. Smits GJ, Lefebvre RA. Influence of age on cholinergic and inhibitory nonadrenergic noncholinergic responses in rat ileum. Eur J Pharmacol 1996;303:79-86. [ Links ]
40. Belai A, Lincoln J, Milner P, et al. Progressive changes in adrenergic, serotonergic, and peptidergic nerves in proximal colon of streptozotocin-diabetic rats. Gastroenterology 1988;95:1234-41. [ Links ]
41. Anitha M, Gondha C, Sutliff R, et al. GDNF rescues hyperglycemia- induced diabetic enteric neuropathy through activation of the PI3K/Akt pathway. J Clin Invest 2006;116:344-56. [ Links ]
42. Grasa L, Gil V, Gallego D, et al. P2Y(1) receptors mediate inhibitory neuromuscular transmission in the rat colon. Br J Pharmacol 2009;158:1641-52. [ Links ]
43. Gallego D, Gil V, Aleu J, et al. Pharmacological characterization of purinergic inhibitory neuromuscular transmission in the human colon. Neurogastroenterol Motil 2011;23:792-e338. [ Links ]
44. Meehan CJ, Fleming S, Smith W, et al. Idiopathic megacolon in the BB rat. Int J Exp Pathol 1994;75:37-42. [ Links ]
45. Zandecki M, Raeymaekers P, Janssens J, et al. The effect of nitric oxide donors on nitric oxide synthase-expressing myenteric neurones in culture. Neurogastroenterol Motil 2006;18:307-15. [ Links ]
46. Malaisse WJ, Courtois P, Scott FW. Insulin-dependent diabetes and gut dysfunction: The BB rat model. Horm Metab Res 2004;36:585-94. [ Links ]
47. He CL, Soffer EE, Ferris CD, et al. Loss of interstitial cells of Cajal and inhibitory innervations in insulin-dependent diabetes. Gastroenterology 2001;121:427-34. [ Links ]
48. Savidge T, Sofroniew M, Neunlist M. Starring roles for astroglia in barrier pathologies of gut and brain. Lab Invest 2007;87:731-36. [ Links ]
49. Surendran S, Matalon R, Trying SK. Upregulation of aspartoacylase activity in the duodenum of obesity induced diabetes mouse: Implications on diabetic neuropathy. Biochem Biophys Res Commun 2006;345:973-5. [ Links ]
50. Fortes ZB, Garcia Leme J, Scivoletto R. Vascular reactivity in diabetes mellitus: Role of the endothelial cell. Br J Pharmacol 1983;79:771-81. [ Links ]
51. Izbeki F, Wittman T, Rosztoczy A, et al. Immediate insulin treatment prevents gut motility alterations and loss of nitrergic neurons in the ileum and colon of rats with streptozotocin-induced diabetes. Diabetes Res Clin Pract 2008;80:192-8. [ Links ]
52. Bódi N, Talapka P, Hermesz E, et al. Gut region-specific diabetic damage to the capillary endothelium adjacent to the myenteric plexus. Microcirculation 2012;19:316-26. [ Links ]
53. Larsen N, Vogensen FK, van den Berg FW, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS One 2010;5:e9085. [ Links ]
54. Chronopoulos A, Tang A, Beglova E, et al. High glucose increases lysyl oxidase expression and activity in retinal endothelial cells: mechanism for compromised extracellular matrix barrier function. Diabetes 2010;59:3159-66. [ Links ]
55. Guy RJ, Dawson JL, Garrett JR, et al. Diabetic gastroparesis from autonomic neuropathy: Surgical considerations and changes in vagus nerve morphology. J Neurol Neurosurg Psychiatry 1984;47:686-91. [ Links ]
56. Yoshida MM, Schuffler MD, Sumi SM. There are no morphologic abnormalities of the gastric wall or abdominal vagus in patients with diabetic gastroparesis. Gastroenterology 1988;94:907-14. [ Links ]
57. Selim MM, Wendelschafer-Crabb G, Redmon JB, et al. Gastric mucosal nerve density: a biomarker for diabetic autonomic neuropathy? Neurology 2010;75:973-81. [ Links ]
58. Bytzer P, Talley NJ, Hammer J, et al. GI symptoms in diabetes mellitus are associated with both poor glycemic control and diabetic complications. Am J Gastroenterol 2002;97:604-11. [ Links ]
59. Bytzer P, Talley NJ, Leemon M, et al. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: a population-based survey of 15,000 adults. Arch Intern Med 2001;161:1989-96. [ Links ]
60. Sadiya A. Nutritional therapy for the management of diabetic gastroparesis: Clinical review. Diabetes Metab Syndr Obes 2012;5:329-35. [ Links ]
61. Hejazi RA, McCallum RW. Treatment of refractory gastroparesis: Gastric and jejunal tubes, botox, gastric electrical stimulation, and surgery. Gastrointest Endosc Clin N Am 2009;19:73-82. [ Links ]
62. Thomas MP, Wilson CH, Nayar M, et al. Endoscopic botulinum toxin injection for the treatment of diabetic gastropathy in pancreas and islet-cell transplant patients. Exp Clin Transplant 2012;10:168-71. [ Links ]
63. Szarka LA, Camilleri M. Stomach dysfunction in diabetes mellitus: Emerging technology and pharmacology. J Diabetes Sci Technol 2010;4:180-9. [ Links ]
64. Serra J. Levosulpiride in the management of functional dyspepsia and delayed gastric emptying. Gastroenterol Hepatol 2010;33:586-90. [ Links ]
65. Camilleri M, Parkman HP, Shafi MA, et al. Clinical guideline: Management of gastroparesis. Am J Gastroenterol 2013;108:18-37. [ Links ]
66. Quigley EM. Cisapride: What can we learn from the rise and fall of a prokinetic? J Dig Dis 2011;12:147-56. [ Links ]
67. Kashyap P, Farrugia G. Diabetic Gastroparesis: What we have learned and had to unlearn in the past 5 years. Gut 2010;59:1716-26. [ Links ]
68. Sanger GJ. Ghrelin and motilin receptor agonists: time to introduce bias into drug design. Neurogastroenterol Motil 2014;26:149-55. [ Links ]
69. Portincasa P, Mearin F, Robert M, et al. Eficacia y tolerabilidad de cinitaprida en el tratamiento de los pacientes con dispepsia funcional y vaciamiento gástrico enlentecido. Gastroenterol Hepatol 2009;32:669-76. [ Links ]
70. Gangula PR, Mukhopadhyay S, Pasricha PJ, et al. Sepiapterin reverses the changes in gastric nNOS dimerization and function in diabetic gastroparesis. Neurogastroenterol Motil 2010;22:1325-31. [ Links ]
71. Enweluzo C, Aziz F. Gastroparesis: a review of current and emerging treatment options. Clin Exp Gastroenterol 2013;6:161-5. [ Links ]
72. Coleman ES, Dennis JC, Braden TD, et al. Insulin treatment prevents diabetes-induced alterations in astrocyte glutamate uptake and GFAP content in rats at 4 and 8 weeks of diabetes duration. Brain Res 2010;1306:131-41. [ Links ]
73. De Freitas P, Natali MR, Pereira RV, et al. Myenteric neurons and intestinal mucosa of diabetic rats after ascorbic acid supplementation. World J Gastroenterol 2008;14:6518-24. [ Links ]
74. Nakamura T, Okano R, Uchiyama H, et al. Effectiveness of aldose reductase inhibitors for diabetic gastroenteropathy with constipation. Intern Med 1997;36:479-83. [ Links ]
75. da Silva GG, Zanoni JN, Buttow NC. Neuroprotective action of Ginkgo biloba on the enteric nervous system of diabetic rats. World J Gastroenterol 2011;17:898-905. [ Links ]
76. Ferreira PE, Lopes CR, Alves AM, et al. Diabetic neuropathy: An evaluation of the use of quercetin in the cecum of rats. World J Gastroenterol 2013;19:6416-26. [ Links ]
77. Pereira RV, Tronchini EA, Tashima CM, et al. L-glutamine supplementation prevents myenteric neuron loss and has gliatrophic effects in the ileum of diabetic rats. Dig Dis Sci 2011;56:3507-16. [ Links ]
78. Hermes-Uliana C, Panizzon CP, Trevizan AR, et al. Is L-glutathione more effective than l-glutamine in preventing enteric diabetic neuropathy? Dig Dis Sci 2014;59:937-48. [ Links ]
79. Savidge TC. S-nitrosothiol signals in the enteric nervous system: Lessons learnt from big brother. Front Neurosci 2011;5:31. [ Links ]











 text in
text in