My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.107 n.7 Madrid Jul. 2015
TRABAJOS ORIGINALES
Patología esofagogástrica en el obeso mórbido: diagnóstico preoperatorio e influencia en la selección de la técnica quirúrgica
Esophagogastric pathology in morbid obese patient: Preoperative diagnosis and influence in the selection of surgical technique
Sergio Estévez Fernández1, Raquel Sánchez Santos1, Esther Mariño Padín1, Sonia González Fernández1 y Juan Turnes Vázquez2
1Servicio de Cirugía General y del Aparato Digestivo y 2Servicio de Aparato Digestivo. Complejo Hospitalario Universitario de Pontevedra. Pontevedra
Dirección para correspondencia
RESUMEN
Introducción: la dificultad de acceso al estómago excluido tras el bypass gástrico (BG) y el empeoramiento del reflujo gastroesofágico tras la gastrectomía vertical (GV) justifican la fibrogastroscopia (FGS) preoperatoria. Se analiza la influencia de los hallazgos de FGS en la actitud terapéutica.
Pacientes y métodos: estudio retrospectivo de hallazgos de FGS previa a cirugía bariátrica desde 04/06 a 12/12. Influencia del resultado FGS en la selección de la técnica quirúrgica y en el tratamiento médico o endoscópico; y su relación con la fístula gástrica mediante regresión multivariada (factores de confusión: edad, índice de masa corporal, hipertensión arterial, diabetes mellitus, tratamiento antiagregante, técnica quirúrgica (bypass gástrico o gastrectomía vertical).
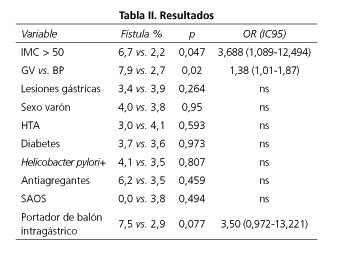
Resultados: se incluyen 331 pacientes: 32,6% biopsia de lesión gástrica; 27% gastritis. 18,1% de hernia de hiato; 3% metaplasia, 0,6% Barret, 2,1% esofagitis, 0,3% displasia, 0,3 anillo de Schalzsky, 1,5% de cardias incompetente, 2,4% de duodenitis, 0,3% erosiones gástricas, 0,6% xantoma gástrico, 1,8%, pólipos gástricos, 1,6%, úlcera duodenal, 0,6% gastritis papuloerosiva, 0,6% papiloma esofágico, 0,3% tumor submucoso. Helicobacter pylori+ 30,2% (triple terapia añadida en todos). Variación de técnica quirúrgica o tratamiento endoscópico debido a FGS 22,2%. Las lesiones gástricas no influyeron en el desarrollo de fístula gástrica. Factores pronósticos independientes de fístula: GV (7,9% vs. 2,7%; p = 0,02; OR: 1,38 IC95: 1,01-1,87) y el índice de masa corporal (IMC) > 50 kg/m2 (6,7% vs. 2,2%; p = 0,04; OR: 3,7 IC95: 1,12-12,4).
Conclusiones: el diagnóstico de patología esofagogástrica mediante FGS preoperatoria motivó variaciones en la actitud terapéutica del 52% de los procedimientos, por lo que consideramos imprescindible incluir la FGS en el preoperatorio de la cirugía bariátrica.
Palabras clave: Fibrogastroscopia. Preoperatorio. Obesidad. Cirugía. Bariátrica.
ABSTRACT
Introduction: Given the difficulty in accessing to the excluded stomach after gastric bypass and the increase in gastroesophageal reflux after sleeve gastrectomy, it is justified to perform a preoperative fibrogastroscopy.
The influence of the fibrogastroscopy (FGS) findings in the therapeutic approach is analyzed.
Patients and methods: A retrospective study of preoperative FGS findings is performed, from 04/06 to 12/12.
The influence of the FGS results on the surgical technique selection, in the endoscopic or medical treatment and its relation to gastric fistula is analyzed by means of multivariate regression (confounding factors: Age, body mass index, arterial hypertension, diabetes mellitus, antiplatelet therapy, surgical technique (bariatric surgery, sleeve gastrectomy).
Results: Three hundred thirty one patients are included: 32.6% biopsy of gastric lesion; 27% gastritis; 18.1% hiatal hernia; 3% metaplasia; 0.6% Barrett esophagus; 2.1% esophagitis; 0.3% dysplasia; 0.3 Schatzky's ring; 1.5% incompetent cardia; 2.4% duodenitis; 0.3% gastric erosions; 0.6% gastric xanthoma; 1.8%, gastric polyp; 1.6% duodenal ulcer; 0.6% papulo-erosive gastritis; 0.6% esophageal papilloma; 0.3% submucosal tumor. Helicobacter pylori+ 30.2% (triple therapy eradication in all patients). The FGS findings led to a variation in the surgical technique or to the completion of endoscopic treatment in 22.2% of cases.
The gastric lesions did not influence the development of gastric fistula. Independent prognostic factors of fistula: Sleeve gastrectomy (7.9% vs. 2.7%; p = 0.02; OR: 1.38 IC95: 1.01-1.87) and the body mass index > 50 kg/m2) (6.7% vs. 2.2%; p = 0.04; OR: 3.7 IC95: 1.12-12.4).
Conclusions: The diagnosis of gastroesophageal disease through preoperative FGS motivated variations in the therapeutic approach in 52% of patients, so we consider essential to include the preoperative FGS in bariatric surgery.
Key words: Fibrogastroscopy. Preoperative. Obesity. Bariatric surgery.
Introducción
Los obesos mórbidos tienen mayor riesgo de padecer patologías gastrointestinales (1,2). La dificultad de acceso al remanente gástrico excluido tras el bypass gástrico (BG) refuerza la necesidad de descartar la existencia de patologías gástricas en el estudio preoperatorio que pudieran degenerar en lesiones malignas en el futuro (3-6). La identificación mediante FGS de pólipos, nódulos o lesiones submucosas gástricas o esofágicas permite su resección endoscópica o al menos la realización de biopsia para diagnóstico anatomopatológico. Dependiendo del resultado de dicha biopsia y de si se ha realizado o no una exéresis completa de la lesión puede ser necesario realizar una exéresis quirúrgica de la zona afectada de forma simultánea a la técnica de cirugía bariátrica (CB) o adaptar dicha técnica con el fin de extirpar la lesión (7,8). Por otra parte, algunos síntomas digestivos, como el reflujo gastroesofágico (RGE) pueden empeorar tras la gastrectomía vertical (GV) o la banda gástrica (LBGA) por lo que es conveniente conocer su existencia antes de decidir la técnica quirúrgica a realizar (9). La presencia de Helicobacter pylori (HP) en el estómago a seccionar, puede ser también relevante dada la influencia de esta bacteria en el desarrollo de lesiones gástricas premalignas y ulcerosas; puede ser especialmente peligroso si queda activa dentro de un remanente gástrico excluido que no podrá ser explorado con facilidad, además de aumentar el riesgo de úlceras de anastomosis (10). Sin embargo, todavía no existe consenso respecto a la necesidad de incluir la FGS en el estudio preoperatorio de la CB. Varias publicaciones demuestran elevados porcentajes de hallazgos patológicos en la FGS previa a CB (11); sin embargo, las guías clínicas todavía no recogen una recomendación firme (6,8,12). Algunos autores recomiendan la realización de la FGS a todos los pacientes sin excepción (13-15), otros la recomiendan sólo en el caso de pacientes con sospecha de lesión gástrica o que vayan a ser sometidos a una técnica que suponga la exclusión de parte del estómago (16), mientras que un tercer grupo de autores recomiendan la realización de la FGS únicamente a los pacientes que presenten sintomatología o clínica sospechosa de lesión gástrica (dispepsia, pirosis, dolor epigástrico...) (17,18).
El objeto de la FGS preoperatoria sería diagnosticar y/o tratar lesiones que potencialmente podrían afectar al tipo de cirugía planificada; causar complicaciones en el postoperatorio inmediato o provocar síntomas intolerables tras la CB. El objetivo del presente estudio es valorar la prevalencia de lesiones esófagogástricas en el paciente candidato a CB, la influencia de dichas lesiones en el manejo terapéutico del paciente obeso mórbido y el valor de los resultados de la FGS en el algoritmo para la selección de la técnica quirúrgica.
Pacientes y métodos
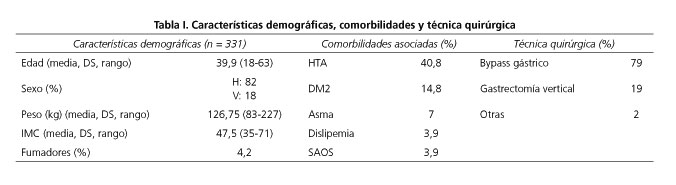
Se realiza una revisión retrospectiva de una base de datos recogida prospectivamente de pacientes remitidos de forma consecutiva para CB en el Complejo Hospitalario Universitario de Pontevedra (CHOP). Se realizó FGS preoperatoria a todos los pacientes. En los pacientes en los que fue posible, las lesiones se extirparon endoscópicamente, en los pacientes en los que se encontró patología esofagogástrica macroscópica se realizó biopsia. En todos los casos se determinó la presencia de HP mediante test de ureasa. El BG fue la técnica de elección en la mayoría de los casos. Se ofreció GV cuando el paciente presentaba IMC por debajo de 45 o mayor de 55 con comorbilidades severas. A los pacientes con IMC > 50 se les ofreció el balón intragástrico (BIG) para pérdida de peso preoperatoria durante 6 meses. En todos los casos la selección de la técnica se realizó de forma consensuada con el paciente tras exponerle los pros y contras de cada opción terapéutica. La existencia de lesiones esofágicas o gástricas en la endoscopia fue valorada antes de decidir la técnica definitiva, cuando fue necesario se extirpó quirúrgicamente la zona gástrica afectada por la lesión diagnosticada en la FGS. En la base de datos se registraron los cambios de la técnica quirúrgica o en el tratamiento farmacológico debidos a los hallazgos de la FGS. Otras variables registradas fueron: edad, sexo, IMC, comorbilidades previas -hipertensión arterial (HTA), síndrome de apnea obstructiva del sueño (SAOS), diabetes mellitus (DM)...-, estancia postoperatoria, complicaciones mayores postoperatorias (neumonía, fístula gástrica, fístula yeyunal, hemorragia digestiva, hemoperitoneo, atelectasia, estenosis, absceso intraabdominal) y mortalidad (Tabla I).
Se realiza un análisis descriptivo de las variables recogidas de forma prospectiva en la base de datos y se evalúan las lesiones esofagogástricas encontradas en la FGS preoperatoria y los cambios en la estrategia terapéutica que conllevaron.
Como análisis secundario, mediante regresión logística multivariada, se determina la posible relación de las lesiones gástricas con la fístula gástrica postoperatoria, definida como la fuga de material gastrointestinal a través de las suturas mecánicas o manuales que se utilizan para la confección del remanente, y evidenciándola por la extravasación de contraste en un estudio radiológico y/o la identificación de fuga de azul de metileno o material gastrointestinal en la reexploración. Se incluyen como posibles factores de confusión edad, sexo, IMC, técnica quirúrgica, comorbilidades, tratamiento antiagregante, tabaquismo, HP+ y portador previo de BIB.
El análisis estadístico se realizó con el paquete estadístico SPSS 20.0.
Resultados (Tabla II)
Descriptivo
Se incluyen 331 pacientes a los que se realiza CB en el CHOP entre abril de 2006 y diciembre de 2012. Un 82% de los pacientes eran mujeres, con una edad media de 39,9 años (rango 18-63). Un 32% de los pacientes eran superobesos; siendo el IMC medio de toda la serie 47,5 (rango 35-71). En cuanto a las comorbilidades asociadas, un 40,8% eran hipertensos, un 14,8% eran diabéticos y un 3,6% estaban diagnosticados de SAOS. Un 4,9% de los pacientes tomaba tratamiento antiagregante.
Resultados FGS preoperatoria
Se realizó FGS preoperatoria en los 331 pacientes. En 108 (32,6%) pacientes se realizó biopsia de lesiones macroscópicas. Un 18,1% tenían hernia de hiato. Un 27% de pacientes fueron diagnosticados de gastritis en la biopsia. Otras lesiones diagnosticadas de menor frecuencia fueron: 3% metaplasia, 0,6% Barrett, 2,1% esofagitis, 0,3% displasia, 0,3 anillo de Schatzky, 1,5% de cardias incompetente, 2,4% de duodenitis, 0,3% erosiones gástricas, 0,6% xantoma gástrico, 1,8%, pólipos gástricos, 1,6%, úlcera duodenal, 0,6% gastritis papuloerosiva, 0,6% papiloma esofágico y 0,3% tumor submucoso. En los casos de xantomas, papilomas y pólipos se realizó resección endoscópica (supone un 4,2% del total de los pacientes).
El HP fue positivo en un 30% de los pacientes, todos ellos recibieron triple terapia para su erradicación (claritromicina 500 mg/12 h v.o. + amoxicilina 1 g/12 h v.o. durante 1 semana y omeprazol 20 mg/12 h v.o. durante 1 mes). Un mes después de terminar el tratamiento se realizó determinación de Ag de HP en heces siendo el test positivo en 4,2%, administrándose en esos casos una segunda línea de tratamiento con levofloxacino 500 mg/12 h v.o. + amoxicilina 1 g/12 h v.o. + omeprazol 20 mg/12 h v.o. durante 14 días. Se repitió el test de Ag de HP en heces y fue negativo en todos los casos.
Cincuenta y tres pacientes (16%) aceptaron la colocación de BIG para la pérdida de peso preoperatorio. Un 96% lo mantuvieron durante 6 meses y en 2 casos se tuvo que retirar antes por intolerancia.
Se realizaron 260 bypass gástricos (79%), 63 gastrectomías verticales (19%) y otras técnicas en 2,1% de pacientes.
La mortalidad postoperatoria fue del 0%. Un 9% de pacientes presentaron alguna complicación en el postoperatorio (en algún caso más de una). Las complicaciones fueron: 1 absceso intraabdominal, 3 hemorragias digestivas altas, 2 hemoperitoneos, 10 fístulas gástricas y 2 fístulas de pie de asa, 2 neumonías y 15 atelectasias.
La estancia mediana fue de 5 días (media 6,9 ± 9,3).
Influencia de los resultados de la gastroscopia en la actitud terapéutica
En un 22,6% de los pacientes se realizó una variación en la actitud quirúrgica/terapéutica debida a los resultados de la FGS; en un 4,2%, resección endoscópica de lesiones potencialmente premalignas (pólipos esofágicos y gástricos, papilomas, xantomas). En un 3,3%, cambio del tipo de técnica quirúrgica para resecar lesiones, realizando BPG asociando gastrectomía o GV. En un 15,1%, cambio de técnica quirúrgica por reflujo gastroesofágico, realizando BPG en lugar de GV.
En un 30% de los pacientes se añadió un tratamiento farmacológico (tratamiento para erradicar el HP).
En global la determinación de lesiones esofagogástricas en el estudio preoperatorio motivó variaciones en la actitud terapéutica del 52,6% de los procedimientos.
En un 4,2% de paciente se retrasó la intervención quirúrgica dos meses para completar la segunda línea de tratamiento del HP y comprobar su erradicación.
Influencia de las lesiones gástricas como factor pronóstico de fístula postoperatoria
Las lesiones esofagogástricas (gastritis, esofagitis, hernia de hiato) no mostraron relación estadísticamente significativa con la fístula postoperatoria en el estudio multivariado incluyendo como posibles factores de confusión la edad, el sexo, el IMC, comorbilidad (DM, HTA, dislipemia, SAOS, tabaquismo), tratamiento antiagregante, el tipo de técnica quirúrgica o haber sido portador de un balón gástrico.
Los únicos factores independientes que mostraron relación estadísticamente significativa con la fístula postoperatoria fueron el tipo de cirugía, siendo más frecuente en la gastrectomía vertical (p = 0,02; OR: 1,38 IC95: 1,01-1,87), y la superobesidad (IMC > 50 kg/m2 = 0,04; OR: 3,7 IC95: 1,12-12,4).
Discusión
La selección de la técnica quirúrgica más adecuada para cada obeso mórbido en centros con amplia experiencia suele variar dependiendo de las características demográficas del paciente, sus hábitos alimentarios o sus preferencias; sin embargo, hay pocos datos referentes a la influencia que tiene la FGS preoperatoria en la decisión. En nuestro estudio, la realización de una FGS preoperatoria a los 331 pacientes candidatos a cirugía bariátrica modificó en alguna medida el tratamiento médico de los pacientes en un 30%, e influyó en la selección de la técnica quirúrgica en un 22,6%. Este elevado porcentaje justifica, en nuestra opinión, la realización sistemática de una FGS a todos los candidatos a la cirugía bariátrica, incluso a los que no presentan síntomas digestivos; esta opinión la comparten algunos autores y se recoge en diversas guías clínicas, pero no existe todavía consenso sobre su inclusión en el estudio preoperatorio de la cirugía bariátrica (2,12,19). Los detractores de la FGS sistemática afirman que supone un coste añadido y que es una técnica invasiva que causa disconfort al paciente, e incluso puede existir riesgo de broncoaspiración; sin embargo, no existen estudios con suficiente evidencia científica que soporten la no realización de la FGS y la mayoría de las guías se basan en recomendaciones con un nivel de evidencia 2 o 3, como en el caso de la EAES (European Association of Endoscopic Surgery) que recomienda con un nivel C la realización de un estudio baritado o FGS en los candidatos a cirugía bariátrica (19). La detección de HP, por otra parte, también es un tema de controversia en la actualidad; algunas guías incluso le dan más importancia que la propia FGS, como es el caso de la guía europea interdisciplinar para la cirugía de la obesidad mórbida severa, que recomienda la detección de H. pylori sistemática pero no considera necesaria la FGS sistemática (20). En nuestra serie se detectaron un 30% de casos de HP+ y se erradicó en todos los casos siendo necesario un único ciclo de tratamiento en el 94% de los casos, lo que nos indica que en nuestra área la tasa de resistencias es baja. Esta prevalencia resulta algo menor que la estimada de HP en nuestro país situada en torno a un 40% siendo variable dependiendo de la región estudiada (21). Una posible explicación para las diferencias en la prevalencia podría ser la prueba diagnóstica empleada. La detección del HP en nuestro estudio se realizó mediante test de ureasa y biopsia gástrica y desconocemos si pudiera existir una variación en la prevalencia diagnosticada si se hubiese utilizado otra técnica diagnóstica como la detección del antígeno de HP en heces.
La erradicación del HP parece más importante en el caso de dejar el estómago excluido como sucede en el bypass gástrico.
En nuestra serie, con un 79% de bypass gástrico, la detección y erradicación del HP se consideró imprescindible desde el inicio del estudio; más aún cuando los hallazgos endoscópicos como la hernia de hiato o el reflujo nos hicieron cambiar la técnica y un 15,1% de pacientes a los que se indicó inicialmente una GV, que finalmente fueron sometidos a un bypass gástrico. La Sociedad Americana de Cirujanos Gastrointestinales y Laparoscopia (SAGES) recomienda en su guía clínica realizar FGS sólo a los pacientes sintomáticos y tratar a los pacientes con HP positivo; sin embargo, no especifica que sea necesario determinar el HP en todos los pacientes (22). En nuestra opinión, un elevado número de pacientes quedarían sin diagnosticar ya que casi la mitad de nuestros pacientes no referían síntomas digestivos y, siguiendo esta indicación no se les hubiera hecho la FGS ni la detección de HP; por otra parte, el hallazgo de patología en la FGS no siempre coincidió en pacientes con síntomas; esto mismo ha sido reportado por otros autores que mostraban que los pacientes asintomáticos tenían el mismo porcentaje de lesiones gástricas que los sintomáticos (8,23).
Por otra parte, consideramos que cada centro debe tener en cuenta las características demográficas de la población que atiende y la prevalencia de HP en su zona, así como la tasa de cepas resistentes.
Respecto a las lesiones gástricas detectadas en las FGS existen diversos estudios que demuestran porcentajes muy variables de lesiones detectadas en pacientes obesos mórbidos oscilando entre el 5 y el 90% de los pacientes estudiados (2,18,24). Destaca el caso de la serie de Verset (14)en la que se modificó la actitud terapéutica en un 42% de pacientes debido a los hallazgos encontrados en la FGS preoperatoria; un 63% de los pacientes presentaba hernia hiatal o incompetencia de cardias siendo un 70% asintomáticos; un 31% presentaban esofagitis (50% asintomáticos); gastritis en 17%, úlcera gástrica en 15% (70% asintomáticos); y úlcera duodenal 5%, siendo todos asintomáticos.
Otros autores modificaron la actitud terapéutica en un porcentaje menor (4,9% reportado por Schirmer y cols.) pero consideran la FGS como una buena herramienta para el estudio del candidato a cirugía bariátrica tanto en el preoperatorio como en el postoperatorio o en el seguimiento (15,25). En general las lesiones más frecuentes descritas son la hernia hiatal (20-40%), la gastritis (20-30%) y la esofagitis (1-15%) (7,18,26,27).
La FGS también es de gran importancia en el diagnóstico preoperatorio de reflujo gastroesofágico para la selección de la técnica y definir realmente cuáles son los pacientes que presentan esta patología (28), ya que la decisión de la técnica quirúrgica ha variado en los últimos años en función de la presencia o no de reflujo. La prevalencia del reflujo en la población de obesos mórbidos es variable y oscila entre 50-70% de pacientes (11). La prevalencia de hernia de hiato también es variable y se han publicado cifras que oscilan entre el 10-40% en los candidatos a cirugía bariátrica (11,26). Cuando se describió la técnica de GV por Gagner en el año 2002 (29) no se consideraba el reflujo como una contraindicación para este tipo de técnica; sin embargo, publicaciones posteriores resaltaron una incidencia llamativa de reflujo gastroesofágico en el seguimiento de los pacientes sometidos a esta técnica, así como mostraron un empeoramiento de los síntomas de reflujo en pacientes que presentaban reflujo previamente (26,30-32), por lo que a partir del año 2009 se inicia una tendencia de opinión en la que el reflujo esofágico se consideraba una contraindicación para la realización de una GV, al igual que en el caso de la BGA. En nuestro Centro se habían realizado 10 GV en pacientes con hernia de hiato o reflujo gastroesofágico hasta esa fecha; 4 de estos 10 pacientes desarrollaron síntomas severos de reflujo durante el seguimiento; uno de ellos pudo ser controlado con fármacos pero en tres casos resultaba invalidante a pesar del tratamiento y se decidió convertirlos a bypass gástrico obteniendo una remisión completa de la sintomatología posteriormente. A partir del año 2009 se evitó la realización de GV en los pacientes con síntomas de reflujo preoperatorio o con hernia de hiato de moderado-gran tamaño en la FGS preoperatoria y en todos esos casos se realizó un bypass gástrico (53 pacientes). En ninguno de los pacientes con reflujo preoperatorio o hernia de hiato que fueron sometidos a bypass gástrico se evidenciaron síntomas de reflujo en el seguimiento. Por este motivo, nuestra actitud en la actualidad sigue siendo la contraindicación de la GV en los pacientes con reflujo o hernia de hiato. Sin embargo, los resultados de otros grupos publicados en años recientes son contradictorios. En una revisión de la literatura publicada en 2011 por Chiau y cols. (33), se recogen publicaciones con resultados muy diversos, así como en múltiples trabajos científicos, pero ninguna de ellas proporciona una evidencia científica suficiente para establecer una recomendación clara (9,34-35).
Conclusión
La realización de la fibrogastroscopia preoperatoria diagnosticó lesiones esofagogástricas macroscópicas en un 32,6% de pacientes, en 18,1% se diagnosticó enfermedad por reflujo o hernia de hiato y en un 30% se evidenció la presencia de HP. Los hallazgos endoscópicos motivaron cambios en la actitud terapéutica en un 52,6% de procedimientos, dado que en 22,6% se cambió la indicación de la técnica quirúrgica o se realizó resección endoscópica de lesiones y en un 30% fue necesario administrar un tratamiento farmacológico previo a la cirugía y comprobar su efectividad.
En nuestro estudio la fibrogastroscopia ha sido esencial en el algoritmo terapéutico de los candidatos a cirugía bariátrica del Área de Pontevedra Salnés por lo que consideramos imprescindible su inclusión sistemática en el protocolo de estudio preoperatorio de los candidatos a cirugía bariátrica.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Sergio Estévez-Fernández.
Servicio de Cirugía General y Digestiva.
Hospital Montecelo.
Complejo Hospitalario de Pontevedra.
Carretera Mourente, s/n.
36071 Pontevedra
e-mail:
sestevezf@gmail.com
Recibido: 06-09-2014
Aceptado: 01-04-2015
Bibliografía
1. Fysekidis M, Bouchoucha M, Bihan H, et al. Prevalence and co-occurrence of upper and lower functional gastrointestinal symptoms in patients eligible for bariatric surgery. Obes Surg 2012;22:403-10. DOI: 10.1007/s11695-011-0396-z. [ Links ]
2. Sharaf RN, Weinshel EH, Bini EJ, et al. Endoscopy plays an important preoperative role in bariatric surgery. Obes Surg 2004;14:1367-72. DOI: 10.1381/0960892042583806. [ Links ]
3. Kuruba R, Koche LS, Murr MM. Preoperative assessment and perioperative care of patients undergoing bariatric surgery. Med Clin North Am 2007;91:339-51, ix. DOI: 10.1016/j.mcna.2007.01.010. [ Links ]
4. Trincado MT, del Olmo JC, García Castaño J, et al. Gastric pouch carcinoma after gastric bypass for morbid obesity. Obes Surg 2005;15:1215-7. DOI: 10.1381/0960892055002383. [ Links ]
5. Khitin L, Roses RE, Birkett DH. Cancer in the gastric remnant after gastric bypass: A case report. Curr Surg 2003; 60:521-3. DOI: 10.1016/S0149-7944(03)00052-7. [ Links ]
6. Muñoz R, Ibáñez L, Salinas J, et al. Importance of routine preoperative upper GI endoscopy: Why all patients should be evaluated? Obes Surg 2009;19:427-31. [ Links ]
7. Dietz J, Ulbrich-kulcynski JM, Elisabete K, et al. Endoscopy and gastric histopathology findings in morbidly obese patients. Arq Gastroenterol 2012;49:52-5. [ Links ]
8. Zeni TM, Frantzides CT, Mahr C, et al. Value of preoperative upper endoscopy in patients undergoing laparoscopic gastric bypass. Obes Surg 2006;16:142-6. DOI: 10.1381/096089206775565177. [ Links ]
9. Carter PR, LeBlanc K, Hausmann MG, et al. Association between gastroesophageal reflux disease and laparoscopic sleeve gastrectomy. Surg Obes Relat Dis 2011;7:569-72. DOI: 10.1016/j.soard.2011.01.040. [ Links ]
10. Rawlins L, Rawlins MP, Brown CC, et al. Effect of Helicobacter pylori on marginal ulcer and stomal stenosis after Roux-en-Y gastric bypass. Surg Obes Relat Dis 2013;9:760-4. DOI: 10.1016/j.soard.2012.06.012. [ Links ]
11. Soricelli E, Casella G, Rizzello M, et al. Initial experience with laparoscopic crural closure in the management of hiatal hernia in obese patients undergoing sleeve gastrectomy. Obes Surg 2010;20:1149-53. DOI: 10.1007/s11695-009-0056-8. [ Links ]
12. Korenkov M, Sauerland S, Shah S, et al. Is routine preoperative upper endoscopy in gastric banding patients really necessary? Obes Surg 2006;16:45-7. [ Links ]
13. Küper M a, Kratt T, Kramer KM, et al. Effort, safety, and findings of routine preoperative endoscopic evaluation of morbidly obese patients undergoing bariatric surgery. Surg Endosc 2010;24:1996-2001. DOI: 10.1007/s00464-010-0893-5. [ Links ]
14. Verset D, Houben JJ, Gay F, et al. The place of upper gastrointestinal tract endoscopy before and after vertical banded gastroplasty for morbid obesity. Dig Dis Sci 1997;42:2333-7. DOI: 10.1023/A:1018835205458. [ Links ]
15. Schirmer B, Erenoglu C, Miller A. Flexible endoscopy in the management of patients undergoing Roux-en-Y gastric bypass. Obes Surg 2002;12:634-8. DOI: 10.1381/096089202321019594. [ Links ]
16. Anderson M, Gan SI, Fanelli RD, et al. Role of endoscopy in the bariatric surgery patient. Gastrointest Endosc 2008;68:1-10. DOI: 10.1016/j.gie.2008.01.028. [ Links ]
17. Nguyen NT, Morton JM, Wolfe BM, et al. The SAGES bariatric surgery outcome initiative. Surg Endosc 2005;19:1429-38. DOI: 10.1007/s00464-005-0301-8. [ Links ]
18. Loewen M, Giovanni J, Barba C. Screening endoscopy before bariatric surgery: a series of 448 patients. Surg Obes Relat Dis 2008;4:709-12. DOI: 10.1016/j.soard.2008.02.009. [ Links ]
19. Sauerland S, Angrisani L, Belachew M, et al. Obesity surgery: evidence-based guidelines of the European Association for Endoscopic Surgery (EAES). Surg Endosc 2005;19:200-21. DOI: 10.1007/s00464-004-9194-1. [ Links ]
20. Fried M, Hainer V, Basdevant A, et al. Interdisciplinary European guidelines for surgery for severe (morbid) obesity. Obes Surg 2007;17:260-70. DOI: 10.1007/s11695-007-9025-2. [ Links ]
21. Hartin CW, ReMine DS, Lucktong T. Preoperative bariatric screening and treatment of Helicobacter pylori. Surg Endosc (Internet) 2009;23:2531-4. DOI: 10.1007/s00464-009-0449-8. [ Links ]
22. SAGES Guidelines Committee. SAGES guideline for clinical application of laparoscopic bariatric surgery. Surg Endosc 2008;22:2281-300. DOI: 10.1007/s00464-008-9913-0. [ Links ]
23. Mong C, Van Dam J, Morton J, et al. Preoperative endoscopic screening for laparoscopic Roux-en-Y gastric bypass has a low yield for anatomic findings. Obes Surg 2008;18:1067-73. DOI: 10.1007/s11695-008-9600-1. [ Links ]
24. Greenwald D. Preoperative gastrointestinal assessment before bariatric surgery. Gastroenterol Clin North Am 2010;39:81-6. DOI: 10.1016/j.gtc.2009.12.012. [ Links ]
25. Schreiner MA, Fennerty MB. Endoscopy in the obese patient endoscopy obese bariatric surgery gastrointestinal. Gastroenterol Clin NA 2010;39:87-97. DOI: 10.1016/j.gtc.2009.12.009. [ Links ]
26. Angrisani L, Iovino P, Lorenzo M, et al. Treatment of morbid obesity and gastroesophageal reflux with hiatal hernia by Lap-Band. Obes Surg 1999;9:396-8. DOI: 10.1381/096089299765553007. [ Links ]
27. Fornari F, Gurski RR, Navarini D, et al. Clinical utility of endoscopy and barium swallow X-ray in the diagnosis of sliding hiatal hernia in morbidly obese patients: A study before and after gastric bypass. Obes Surg 2010;20:702-8. DOI: 10.1007/s11695-009-9971-y. [ Links ]
28. Pérez-Holanda S, Urdiales GL, Fernández JA, et al. Preoperative workup to assess indication for laparoscopic treatment in gastroesophageal reflux disease. Rev Esp Enferm Dig 2008;100:405-10. DOI: 10.4321/S1130-01082008000700005. [ Links ]
29. Regan JP, Inabnet WB, Gagner M, et al. Early experience with two-stage laparoscopic Roux-en-Y gastric bypass as an alternative in the super-super obese patient. Obes Surg 2003;13:861-4. DOI: 10.1381/096089203322618669. [ Links ]
30. Wilson LJ, Ma W, Hirschowitz BI. Association of obesity with hiatal hernia and esophagitis. Am J Gastroenterol 1999;94:2840-4. DOI: 10.1111/j.1572-0241.1999.01426.x. [ Links ]
31. Sabaté JM, Jouët P, Merrouche M, et al. Gastroesophageal reflux in patients with morbid obesity: A role of obstructive sleep apnea syndrome? Obes Surg 2008;18:1479-84. [ Links ]
32. Fisichella PM, Patti MG. Gastroesophageal reflux disease and morbid obesity: Is there a relation? World J Surg 2009;33:2034-8. DOI: 10.1007/s00268-009-0045-z. [ Links ]
33. Chiu S, Birch DW, Shi X, et al. Effect of sleeve gastrectomy on gastroesophageal reflux disease: A systematic review. Surg Obes Relat Dis 2011;7:510-5. DOI: 10.1016/j.soard.2010.09.011. [ Links ]
34. Howard DD, Caban AM, Cendan JC, et al. Gastroesophageal reflux after sleeve gastrectomy in morbidly obese patients. Surg Obes Relat Dis 2011;7:709-13 DOI: 10.1016/j.soard.2011.08.003. [ Links ]
35. Deitel M. Third International Summit: Current status of sleeve gastrectomy. Surg Obes Relat Dis 2011;7:749-59. DOI: 10.1016/j.soard.2011.07.017. [ Links ]











 text in
text in