My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.108 n.1 Madrid Jan. 2016
REVISIÓN
Neoplasia intraepitelial anal: una revisión de conjunto
Anal intraepitelial neoplasia: A narrative review
Garazi Elorza, Yolanda Saralegui, Jose María Enríquez-Navascués, Carlos Placer y Leyre Velaz
Servicio de Cirugía General y Digestiva. Hospital Universitario Donostia. Donostia, Guipúzcoa
Dirección para correspondencia
RESUMEN
La neoplasia intraepitelial anal (AIN) constituye un importante problema de salud en ciertos grupos de riesgo como los pacientes con inmunodepresión de diverso origen, varones que mantienen relaciones sexuales con otros hombres, y mujeres con antecedentes de alteraciones en la citología cervical y/o vaginal. Está bien demostrada su relación con la infección del virus del papiloma humano (HPV), sin embargo se desconocen muchos de los factores implicados en la progresión y regresión de la infección viral a la displasia y al carcinoma anal. La pruebas diagnósticas de elección son la citología del canal anal y la anuscopia de alta resolución con biopsias dirigidas, aunque existe controversia sobre la necesidad de realización de la misma en poblaciones de riesgo. El tratamiento del AIN depende de los factores de riesgo y la necesidad de tratamiento local es controvertida debido a la alta tasa de recurrencia y morbilidad de las técnicas utilizadas. La biopsia quirúrgica está justificada sólo ante lesiones macroscópicas sugestivas de progresión. La vacunación frente al HPV para una prevención primaria en pacientes de alto riesgo ha sido debatida entre diferentes grupos, sin embargo no existe consenso sobre su implantación ni tampoco sobre la realización de un cribado en esta población.
Palabras clave: Neoplasia intraepitelial anal. Anuscopia de alta resolución. Carcinoma anal. Vacuna del virus del papiloma humano.
ABSTRACT
Anal intraepitelial neoplasia (AIN) constitutes a major health problem in certain risk groups, such as patients with immunosuppression of varied origin, males who have sexual relations with other males, and females with a previous history of vaginal or cervical abnormalities in cytology. Its relationship with the human papillomavirus (HPV) infection has been well documented; however, many of the factors involved in the progression and regression of the viral infection to dysplasia and anal carcinoma are unknown. AIN can be diagnosed through cytology of the anal canal or biopsy guided by high-resolution anoscopy. However, the need for these techniques in high-risk groups remains controversial. Treatment depends on the risk factors and given the high morbidity and high recurrence rates the utility of the different local treatments is still a subject of debate.
Surgical biopsy is justified only in the case of progression suggesting lesions. The role of the vaccination in high-risk patients as primary prevention has been debated by different groups. However, there is no general consensus on its use or on the need for screening this population.
Key words: Anal intraepithelial neoplasia. High-resolution anoscopy. Anal carcinoma. Human papillomavirus vaccine.
Introducción
La neoplasia intraepitelial anal (AIN, por sus siglas en inglés) es una lesión precancerosa que puede evolucionar hacia un cáncer escamoso de margen y/o canal anal de cuya historia natural se desconocen muchos aspectos. Se ha demostrado que al igual que en la neoplasia intraepitelial de cérvix (CIN) y en la neoplasia intraepitelial vulvar (VIN) se relaciona con la infección del virus del papiloma humano (HPV) (1) en más del 90% de los casos, sobre todo con los serotipos 16 (85%) y 18 (7%) (2). La presencia de HPV en el canal anal es casi universal en los pacientes VIH positivos (3).
La incidencia del AIN ha aumentado en la última década. Se han identificado como grupos de mayor riesgo los hombres que tienen sexo con hombres (HSH), pacientes con inmunodepresión de diverso origen, pacientes con antecedentes de condilomas anogenitales y mujeres con displasia cervical, vaginal o vulvar.
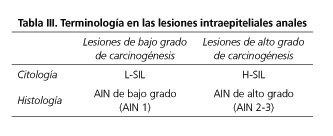
El AIN se clasifica histológicamente como AIN I (displasia de bajo grado) y AIN II-III (displasia de alto grado) dependiendo de la profundidad del epitelio afectado y citológicamente como SIL (squamous intraepitelial lesion) de bajo o alto grado, siguiendo la clasificación de Bethesda.
En la literatura se recoge que la citología del canal anal y la anuscopia de alta resolución son hoy en día el "gold standard" para el diagnóstico de la AIN, sin embargo, a día de hoy, los métodos utilizados para su diagnóstico y cribado, así como sus formas de tratamiento, continúan generando controversia. Es importante reconocer estas lesiones, ya que la mayoría de ellas presentarán una clínica inespecífica y poco característica. Sólo una exploración minuciosa unida a un elevado índice de sospecha impedirá el retraso en el diagnóstico.
La importancia de esta entidad radica en seleccionar a aquellos pacientes de riesgo que se vayan a beneficiar de un programa de screening de diagnóstico precoz , así como entre los pacientes que una vez hayan desarrollado una lesión de alto grado, identificar aquellos que vayan a beneficiarse de un tratamiento u otro.
Métodos
Se ha realizado una revisión narrativa de la literatura existente desde enero de 2005 hasta enero de 2015 sobre el diagnóstico, tratamiento y prevención de la neoplasia intraepitelial anal. Se escogieron revisiones sistemáticas, metaanálisis, estudios de cohortes, ensayos clínicos aleatorizados, y guías y recomendaciones gubernamentales y de asociaciones científicas relacionadas con el tema. Se seleccionaron los artículos más relevantes según consenso de los autores. Se ha realizado la búsqueda en bases de datos como Medline, Ovid, EMBASE y Cochrane. Se han utilizado palabras clave como "anal intraepithelial neoplasia", "high-resolution anuscopy" "papillomavirus", "screening", "vaccine".
Epidemiología
A pesar de su escasa longitud, el canal anal produce una gran variedad de tumores, reflejando una estructura anatómica e histológica muy compleja. Unido a su baja incidencia, que supone un 2% de los cánceres gastrointestinales (4), hace que las recomendaciones basadas en la evidencia científica existente sean escasas y confusas.
El cáncer de ano es una entidad relativamente poco frecuente, aunque su incidencia está aumentando sobre todo en poblaciones de riesgo como son los HSH, inmunodeprimidos (VIH, pacientes trasplantados) y mujeres con antecedentes de displasia cervical, vulvar o vaginal.
Está bien demostrada la asociación que existe entre la infección del HPV anal con el desarrollo del AIN. El HPV es la infección de transmisión sexual más frecuente en el mundo. La infección del HPV cervical es muy frecuente en mujeres sexualmente activas (5), pero la incidencia del HPV anal varía según los factores de riesgo de cada sujeto. En las mujeres no infectadas por VIH, la tasa de infección por HPV anal aumenta en aquellas con antecedentes de displasia cervical. En mujeres sin historia de displasia cervical, la prevalencia del HPV anal es del 6%, y aumenta hasta un 55% en mujeres con antecedentes de carcinoma microinvasor de cérvix (6).
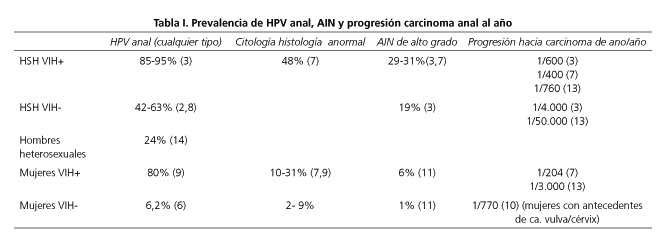
En la tabla I se presentan los datos relativos a la prevalencia de las infecciones por HPV, SIL, AIN II-III y carcinoma anal en varones heterosexuales, HSH, y en mujeres, con o sin infección por VIH. Podemos observar que el riesgo de tener una infección por HPV anal aumenta en HSH e infectados por VIH. La prevalencia de HPV anal en varones heterosexuales HIV- es del 24% y del 6,2 en las mujeres VIH-. La prevalencia de HPV anal en HSH es del 42-63% en los VIH- y esta cifra asciende hasta el 80-95% en los pacientes VIH+.
Así, los pacientes infectados por VIH tienen un mayor riesgo de tener un AIN o de desarrollar un carcinoma escamoso de ano, independientemente de sus prácticas sexuales, y este riesgo aumenta en pacientes con un contaje de CD4 < 200. Sin embargo, se ha observado que las relaciones anorreceptivas aumentan el grado de displasia (7). Se podría pensar que en la época en la que el tratamiento antirretroviral es agresivo la prevalencia del AIN hubiera disminuido pero los estudios recogen que en contra de esta teoría está aumentando. Se cree que esto puede deberse al aumento de supervivencia de los pacientes VIH positivos con la terapia antirretroviral, por lo que disponen de más tiempo para que la AIN desarrolle un carcinoma invasor (9). Según un metaanálisis publicado por Machalek (3), el 93% de los HSH infectados por VIH tiene un HPV anal, de los cuales un 29% presenta también un AIN de alto grado. Entre los HSH no infectados por VIH, el 63% tiene infección por HPV anal, 21% de los cuales tiene una AIN de alto grado.
Las mujeres portadoras de HPV vulvar, vaginal o cervical, o que hayan tenido alteraciones en la citología, también tienen un riesgo más elevado de cáncer de ano, sobre todo las mujeres con antecedentes de carcinoma in situ vulvar (10). En la tabla II se presenta la prevalencia de HPV anal y carcinoma anal en relación a la coexistencia o no de displasia intraepitelial cervical y su grado. Considerando que la prevalencia del AIN de alto grado en mujeres no infectadas por VIH es del 1%, estos datos nos indican que la AIN en la mujer se relaciona estrechamente con la existencia síncrona de CIN y/o VIN en ausencia de infección por VIH.
Por otra parte, según el estudio de Hessol y cols. realizado en 655 mujeres donde se compara la prevalencia del AIN en mujeres infectadas por VIH y mujeres no infectadas por VIH, las mujeres infectadas por VIH presentaron mayor riesgo de tener anomalías en la histología o la citología, independientemente de sus prácticas sexuales (31% y 9%, respectivamente). Aunque en este estudio la proporción de relaciones sexuales anales en ambos grupos fue alta (47% y 46%, respectivamente), se observó que el riesgo de tener un AIN de alto grado era 3,8 veces mayor en mujeres con historia de relaciones anorreceptivas respecto a mujeres que nunca habían mantenido tales relaciones, independientemente de su estado inmune (11).
Al igual que ocurre con el CIN y VIN, el AIN se ha relacionado con el tabaco, la promiscuidad (8,12) y con el no estar circuncidado (15).
Patogenia
No se conoce con exactitud la historia natural del cáncer de ano, aunque se acepta que la evolución es similar a la del cáncer de cérvix. Se ha demostrado la asociación con el HPV y la predilección que este tiene por la unión escamo-columnar. La mayoría de estas lesiones se localizan en la línea de transición anal, aunque se trata de una enfermedad multifocal que puede afectar tanto al canal anal como a la piel perianal. Sin embargo, la historia natural del CIN y del AIN es diferente y el motivo de esta diferencia puede ser debido a las diferencias anatómicas, fisiológicas (actividad hormonal) e inmunológicas entre ambas localizaciones (16).
El HPV infecta los queratinocitos de la capa basal a través de zonas discontinuas en la capa superior del epitelio (lesiones, micro-heridas o microabrasiones). Estas micro-heridas proporcionan el contacto entre los receptores presentes en la células basales y los viriones, que entran así por endocitosis (17). Cuando el HPV se asocia a lesiones benignas como condilomas, la replicación del genoma viral es extracromosomal, mientras que para que se produzca una lesión maligna el DNA viral se integra en el cromosoma del huésped. La integración del HPV es también obligatoria para la progresión hacia AIN III a tumor invasivo, y es el paso principal en la transición del AIN I/II al III, siendo el origen de la multiplicación de células monoclonales (18).
Una acumulación secuencial de cambios moleculares y la integración del DNA del HPV y consiguiente inestabilidad cromosómica, caracteriza la evolución de una mucosa anormal a un carcinoma invasor. La inestabilidad de los cromosomas inicia la secuencia de mutación de carcinogénesis causando un desequilibrio en el número de cromosomas y un aumento de la tasa de pérdida de heterozigosidad, lo cual es un importante mecanismo de inactivación de genes supresores de tumores (19). La progresión hacia carcinoma invasor requiere además pérdidas en los cromosomas de genes supresores de tumores como el APC (5q), 17p (p53) y 18 q (DDC) (20).
Historia Natural Del AIN
Existen pocos estudios acerca de la persistencia, progresión y/o regresión del HPV anal hacia AIN y/o hacia cáncer invasor. La tasa de progresión de un AIN hacia carcinoma invasor es escaso, sin embargo poco se sabe sobre su historia natural, y más que de cifras reales se puede hablar de estimaciones. Además, la mayoría de los estudios sobre AIN se basan en estudios realizados en varones, en concreto HSH.
Según un estudio realizado en varones VIH-, la regresión del HPV 16 anal fue del 66% a los 12 meses y del 90% a los 24 meses sin seguir ningún tipo de tratamiento (12) . La tasa de regresión fue considerablemente menor cuanto mayor era el número de parejas sexuales. También observaron una menor tasa de regresión en el HPV 16, comparando con otros tipos de HPV no oncogénicos (12,21).
Por otro lado, se calcula que la progresión del AIN hacia carcinoma escamoso de ano pueda ser entorno 1/156-600 (3,13) , por año en HSH infectados por VIH y 1/4.000 al año en HSH no infectados por VIH (3). La progresión del AIN hacia carcinoma escamoso en mujeres con antecedentes de displasia cervical o vulvar es de 1/700 (13) y 1/200-625 (7,13) en mujeres infectadas por VIH, y si esto lo comparamos con la tasa de progresión del CIN hacia carcinoma escamoso de cérvix, que se calcula que es de 1/80 (22), se demuestra que hay importantes diferencias en la carcinogénesis y en la historia natural del HPV anal y cervical. Esto se puede deber a las diferencias en el microambiente considerando que el medio anal es más hostil para la persistencia del HPV, que la respuesta inmune es diferente y que además las diferencias hormonales entre ambas localizaciones pueden ayudar a frenar la carcinogénesis (2).
Diagnóstico
La infección por HPV anal es asintomática, aunque en ocasiones se pueden observar lesiones exofíticas, y palpables o pequeñas áreas hiper o hipopigmentadas, por lo general no pruriginosas. El diagnóstico del AIN puede ser también incidental, en hemorroidectomías o extirpación "colgajos anales" y desde luego en resecciones de condilomas anales.
El objetivo del diagnóstico es detectar las lesiones de alto riesgo de carcinogénesis, bien mediante citología o mediante histología. Cada muestra citológica o histológica es en realidad, una representación estadística de la verdadera biología de la lesión, que más precisa será cuantas más muestras o datos tengamos.
Para las lesiones escamosas no invasivas relacionadas con el HPV se recomienda la terminología dicotómica (alto o bajo grado), por ser biológicamente más relevante, tanto para muestras citológicas (nomenclatura SIL), como para las lesiones histológicas (nomenclatura AIN) (23) (Tabla III).
Citología
La citología se realiza tanto en el canal anal como en el margen anal. En el canal anal mediante un cepillo exfoliativo que se introduce unos 3 cm mediante movimientos circulares, tras lo cual se procesa para el análisis citopatológico. Esta muestra será analizada con el microscopio, similar a una citología cervical convencional (24).
Los pacientes programados para realizar una citología anal no deberían tener relaciones receptivas anales ni aplicarse enemas en las 24 horas previas al examen para optimizar la celularidad de la muestra (25). Se debe tomar la muestra antes de realizar la anuscopia de alta resolución o del tacto rectal, ya que el ácido acético o el lubricante pueden influir en la interpretación.
La nomenclatura de Bethesda define los hallazgos citológicos que diferenciaría entre SIL de bajo grado o SIL de alto grado, similar al cérvix (26).
Según una revisión sistemática de Chiao y cols. (27), la citología anal muestra una sensibilidad del 69-93% y una especificidad del 32-59% en la era de los antirretrovirales. Dada su baja especificidad (28), muchos pacientes serían sometidos a una anuscopia de alta resolución, con el gasto y consecuencias psicológicas que esto conllevaría. Por otra parte diversos trabajos señalan que la alteración citológica se correlaciona pobremente con la alteración histológica (7), existiendo varios estudios que constatan que la citología infradiagnostica la enfermedad (3,11) y que quizás una citología a ciegas resultaría insuficiente. La diferencia entre una lesión premaligna y maligna es la integridad de la membrana basal y para ello precisamos de una biopsia con cortes histológicos y por ello las lesiones sospechosas deben tener un diagnóstico histológico y no citológico.
Los pacientes con anomalías en la citología deben ser sometidos a una biopsia dirigida, bien por inspección simple o si es posible mediante anuscopia de alta resolución.
Anuscopia de alta resolución
La anuscopia de alta resolución ha resultado ser muy eficaz en el diagnóstico del AIN y en la literatura se recoge como técnica de elección para despistaje para este tipo de lesiones (29). No obstante a pesar de facilitar la identificación de pacientes con AIN, su utilización seriada, para valorar la progresión de AIN a carcinoma anal, no parece ofrecer ventaja alguna respecto a la inspección simple y observación (29). Debido a que la progresión de AIN a carcinoma es poco frecuente es probable que sea más importante la vigilancia y control periódico de las lesiones sospechosas que el método empleado para el seguimiento.
Para la anuscopia de alta resolución se requiere un microscopio similar al colposcopio. Se debe aplicar ácido acético al 3% durante dos minutos y después se puede aplicar lugol. Las lesiones del AIN en contacto con el ácido acético suelen adquirir una coloración blanquecina (zonas acetoblancas), y son estas zonas las que deberemos biopsiar (las zonas acetoblancas, ulceradas o con patrón vascular irregular). Estas zonas no captarán lugol, a diferencia de las zonas sanas que sí lo captarán. Tanto la colposcopia como la anuscopia de alta resolución son operador dependiente, precisando una curva de aprendizaje larga. En nuestra práctica la realización de anuscopia de alta resolución nos ha parecido compleja por diferentes motivos: interpretar bien la línea pectínea como normal o patológica por zonas acetoblancas es difícil; realizar biopsias dirigidas en el canal anal es técnicamente complejo y cualquier biopsia en la zona anal es muy dolorosa para realizarla en la consulta sin apoyo de ningún tipo de anestesia. Aun reconociendo las dificultades antes escritas, hemos encontrado de utilidad de la aplicación "app-lupa" al objetivo de la cámara de los "smartphones" conectado a un anuscopio convencional para realizar el seguimiento de los pacientes con AIN.
Prevención primaria: vacunación
Desde la introducción de programas de cribado, la incidencia de cáncer de cérvix ha disminuido, pero en la última década ha aumentado la incidencia del cáncer de ano. Dado que el carcinoma de ano se relaciona con la infección del HPV, la vacuna frente al virus en poblaciones de riesgo ha sido un tema de controversia (30).
La vacuna tetravalente del HPV es una proteína recombinante de la cápside mayor (proteína L1) del HPV 6, 11, 16 y 18, y ha demostrado su eficacia en la prevención de lesiones anogenitales relacionados con el HPV. Es una vacuna sintética, de partículas estructuralmente análogas a la cápside viral. Fue aprobado por la Food and Drug Administration (FDA) para la prevención del cáncer cervical en mujeres entre 9 y 26 años. Protege frente al HPV 6 y 11, de bajo riesgo de carcinogénesis y responsables del 90% de condilomas, y frente al HPV 16 y 18, responsables de la mayoría de los cánceres anogenitales.
En la población de HSH infectados por el VIH hay una alta prevalencia de AIN de alto grado (30%) (31), lo cual indica que esta población se beneficiaría de una vacuna antes de ser expuestos al HPV. La vacuna tetravalente en estos pacientes aporta una seroconversión del 95%, incluso en pacientes en los que previamente tenían anticuerpos contra el HPV se observa un aumento en el recuento de anticuerpos (32).
En un ensayo clínico aleatorizado de Guiliano y cols. (33), en el cual participaron 4.065 varones de entre 16 y 26 años, sanos, sin antecedentes de condilomas anales y siendo la mayoría heterosexuales, compararon la vacuna tetravalente con el placebo. Observaron una reducción significativa en el número de lesiones anales externas relacionadas con el HPV 6 (60%) y HPV 11 (76%). En el análisis por intención de tratar la vacuna se relacionó con una reducción no significativa de las lesiones anales relacionadas con el HPV 16 (70% de eficacia) y el HPV 18 (33% de eficacia). Se observó una mayor eficacia global de la vacuna en varones heterosexuales (92% de eficacia) que en HSH (79% de eficacia).
En el ensayo clínico aleatorizado realizado por Palefsky y cols. (34), en el cual participaron 602 HSH, se comparó la vacuna tetravalente frente a placebo. Observaron una eficacia global del 50% y una reducción significativa del AIN de bajo y de alto grado.
Swedish y cols. (35) en el estudio observacional que realizan, analizaron a HSH mayores de 18 años con una media de edad de 40 años, con historia de AIN de alto grado previamente tratada. Compararon pacientes a los que se les administró la vacuna tetravalente frente a los que no se vacunaron y observaron una disminución del riesgo de recurrencia del AIN de alto grado. La incidencia del AIN de alto grado recurrente fue de 15/100 personas/ año en vacunados y 28/100 personas/año en no vacunados.
A pesar de existir múltiples estudios que demuestran una protección frente a la infección del HPV en varones con la vacuna, los análisis de coste efectividad observan que no es coste-efectivo en la población general (36). Sin embargo, el análisis en varones de alto riesgo como los HSH o infectados por VIH demuestra que la vacuna tetravalente es coste efectiva para la prevención de lesiones anogenitales y cáncer de ano y es además segura y eficaz en estos pacientes (37).
La infección por HPV ocurre poco tiempo después de la primera experiencia sexual (38). El problema de prevenir una infección en poblaciones de riesgo, radica en que es difícil conocer la población de HSH entre la población preadolescente y en que la mayoría de los infectados por VIH son mayores de 26 años. Además, la administración de la vacuna en mujeres preadolescentes no cubriría la transmisión a esta población, ya que se infectan de otros varones.
Así, el US Centers for Disease Control and Prevention (CDC) recomienda la vacuna de HPV para todos los pacientes infectados por VIH menores de 26 años (independientemente del número de CD4) y HSH menores de 26 años (39).
A pesar de los estudios mencionados, en España hoy en día la vacuna tetravalente del HPV no está en el calendario vacunal de los varones ni de los grupos de alto riesgo.
Prevención secundaria: cribado
Se ha propuesto realizar un cribado de poblaciones de alto riesgo (24), sin embargo, en estos momentos no hay evidencia de su efectividad.
El European AIDS Clinical Society (40) recomienda el cribado con citología en HSH cada 1-3 años y anuscopia en caso de que existan anomalías, aunque reconocen que la evidencia es incierta.
El New York State Department of Health AIDS Institute (41) recomienda una citología anal en HSH infectados por VIH, pacientes con historia de condilomas anogenitales y en mujeres con alteraciones histológicas vulvares o cervicales.
El Centers for Disease Control and Prevention y la VIH Medicine Association of the Infectious Diseases Society of America (42) no recomiendan el cribado para la prevención del cáncer de ano, aunque mencionan que sería útil la citología en pacientes de alto riesgo como los HSH o mujeres con historia de cáncer de cérvix, realizando una anuscopia de alta resolución en caso de observar alteraciones.
Las guías británicas de manejo de la salud sexual y reproductiva tampoco recomiendan el cribado de rutina (43).
Tratamiento
El riesgo de carcinoma escamoso de ano en los pacientes con historia de AIN depende de sus factores de riesgo, pero en general su progresión hacia carcinoma es escasa y lenta (44), por lo que debemos elegir el tratamiento menos agresivo. El tratamiento del AIN genera controversia, por un lado los tratamientos que se describen se asocian a una alta tasa de efectos secundarios (15% de estenosis o incontinencia fecal) y por otro lado tienen una alta tasa de recurrencias (sobre todo en VIH+) (45) y de lesiones metácronas.
Hoy en día no hay evidencia de que un programa de cribado en la población general pueda disminuir la morbimortalidad relacionada con el cáncer de ano, aunque sí puede disminuir la progresión en grupos de riesgo (29). Existen pocos estudios y la mayoría son series de pocos casos existiendo sólo dos ensayos clínicos comparando diferentes tratamientos.
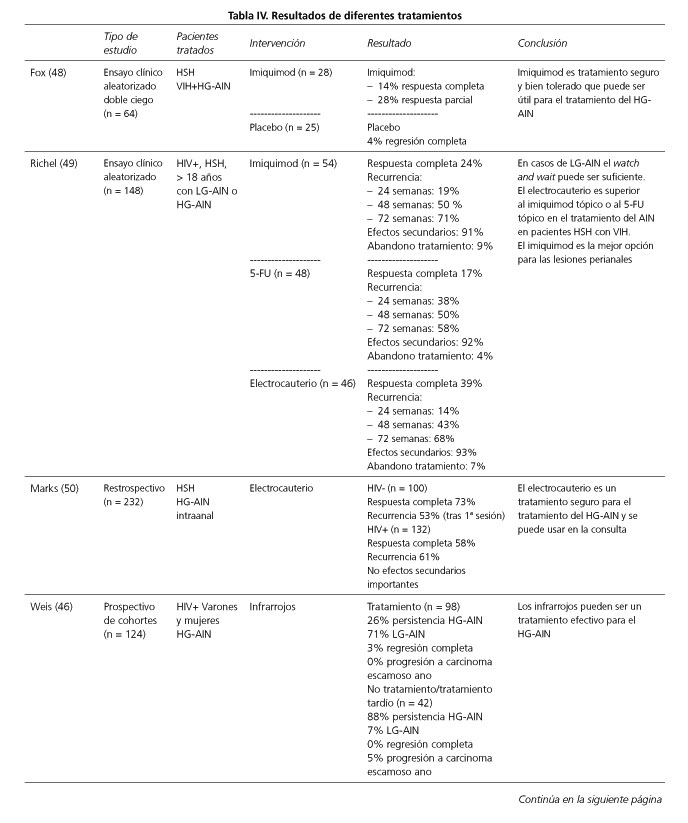
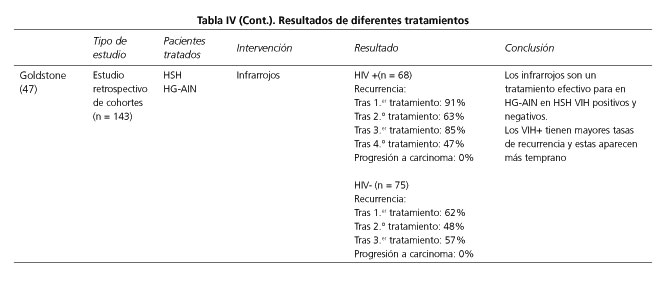
Se han empleado múltiples tratamientos como el láser de CO2, el electrocauterio, los infrarrojos (46,47), la crioterapia o los agentes tópicos como el imiquimod, el ácido tricloroacético o el 5-fluorouracilo (5-FU). En la tabla IV se exponen los resultados obtenidos en los estudios más relevantes o con un mayor número de pacientes incluidos, utilizando diversas técnicas de tratamiento.
En el ensayo clínico comparativo aleatorizado de la utilidad del imiquimod (Aldara®) frente a placebo, Fox y cols. (48) observaron una respuesta completa en el 14% de los pacientes y una disminución en el grado de displasia en el 28%, comparado con el 4% de regresión completa en el grupo placebo. En el ensayo clínico aleatorizado comparando el electrocuterio, la crema de imiquimod y 5-FU tópico, con controles de anuscopia de alta resolución, Richel y cols. (49) concluyen que un seguimiento es suficiente y que el electrocauterio es superior al imiquimod y al 5-FU tópicos para el tratamiento del AIN intra-anal en HSH infectados por HIV, y recomiendan la crema de imiquimod para el tratamiento del AIN perianal. Por otra parte todos los tratamientos tienen una alta tasa de recurrencia (67%) a los 5 años. El electrocauterio fue también analizado por Marks y cols. (50) en un estudio de cohortes retrospectivo, observando unas tasas de curación del 73% en HSH VIH negativos y del 58% en VIH positivos, pero con una tasa de recurrencia del 53% y del 61% respectivamente.
La Sociedad Americana de Cirujanos Colorrectales (51) recomienda tratar los pacientes con AIN de bajo o alto grado con crema de imiquimod al 5%, sobre todo las lesiones del margen anal, o con crema tópica de 5-FU al 5%, con un grado de recomendación 1C. Considera también una terapia opcional la escisión local o bien realizar un "watch and wait", con un grado de recomendación 2C.
Por lo tanto, tal y como se describe en los trabajos la recidiva está por encima del 60% a los 6 meses, independientemente del tipo de tratamiento administrado. Teniendo en cuenta que la tasa de progresión de las lesiones de alto grado hacia lesiones invasivas de carcinoma escamoso es de únicamente 1/400-600 en HSH infectados por VIH y 4.000 en HSH no infectados por VIH, consideramos que es más prudente mantener una actitud expectante con exploraciones anales en consulta y anuscopias ordinarias antes de plantearnos realizar anuscopias de alta resolución de forma rutinaria.
Conclusiones
La historia natural de la enfermedad anal por la infección del HPV sigue indeterminada debido a que aún no se conocen bien los factores de regresión y/o progresión de la enfermedad hacia cánceres invasores. Todos los pacientes con AIN deben tener un seguimiento y control periódico de las lesiones sospechosas, bien por inspección simple y biopsia de las lesiones sospechosas o bien mediante anuscopia de alta resolución en centros con experiencia. La realización de anuscopias de alta resolución es compleja y requiere una larga curva de aprendizaje.
No creemos que sea oportuna realizar tratamientos locales de forma rutinaria dada la alta tasa de recurrencia, así como la escasa tasa de progresión hacia cánceres invasores. Consideramos que la biopsia quirúrgica sólo se debería de realizar ante lesiones macroscópicas sugestivas de progresión.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Garazi Elorza.
Servicio de Cirugía General y Digestiva.
Hospital Universitario Donostia.
Begiristain Doktorea Pasealekua, 117.
20080 Donostia, Gipuzkoa
e-mail: garazielorza@gmail.com
Recibido: 24-03-2015
Aceptado: 24-05-2015
Bibliografía
1. Palefsky JM, Holly EA, Gonzales J, et al. Detection of human papillomavirus DNA in anal intraepithelial neoplasia and anal cancer. Cancer Res 1991;51:1014-9. [ Links ]
2. Tong WWY, Hillman RJ, Kelleher AD, et al. Anal Intraepithelial neoplasia and squamous cell carcinoma in HIV-infected adults. HIV Medicine 2014;15:65-76 DOI: 10.1111/hiv.12080. [ Links ]
3. Machalek DA, Poynten M, Jin F, et al. Anal human papillomavirus infection and associated neoplastic lesions in men who have sex with men: A systematic review and meta-analysis. Lancet Oncol 2012;13:487-500 DOI: 10.1016/S1470-2045(12)70080-3. [ Links ]
4. Siegel R; Naishadham D, Jemal A. Cancer statistics 2012. CA Cancer J Clin 2012;62:10-29 DOI: 10.3322/caac.20138. [ Links ]
5. Moscicki A, Schiffman M, Burchel A, et al. Updating the natural history of human papillomavirus and anogenital cancer. Vaccine 2012;30:F24-F33. DOI: 10.1016/j.vaccine.2012.05.089. [ Links ]
6. Sehnal B, Dusek L, Cibula D, et al. The relationship between cervical and anal HPV infection in women with cervical intraepithelial neoplasia. J Clin Virol 2014;59:18-23. DOI: 10.1016/j.jcv.2013.11.004. [ Links ]
7. Weis SE, Vecino I, Pogoda JM, et al. Prevalence of anal intraepitelial neoplasia defined by anal cytology screening and high resolution anoscopy in a primary care population of HIV-infected men and women. Dis Colon Rectum 2011;54:433-41. DOI: 10.1007/DCR.0b013e318207039a. [ Links ]
8. Goldstone S, Palefsky JM, Guiliano AR, et al. Prevalence of and risk factors for human papillomavirus (HPV) infection among HIV-seronegative men who have sex with men. J Infect Dis 2011;203:66-74. DOI: 10.1093/infdis/jiq016. [ Links ]
9. D'Souza G, Wiley DJ, Li X, et al. Incidence and epidemiology of anal cancer in the multicenter AIDS cohort study. J Acquir Immune Defic Syndr 2008;48:491-9. DOI: 10.1097/QAI.0b013e31817aebfe. [ Links ]
10. Saleem AM, Paulus JK, Shapter AP, et al. Risk of anal cancer in a cohort with human papillomavirus-related gynecologic neoplasm. Obstet Gynecol 2011;117:643-9. DOI: 10.1097/AOG.0b013e31820bfb16. [ Links ]
11. Hessol NA, Holly EA, Effird JT, et al. Anal intraepithelial neoplasia in a multisite study of HIV-infected and high-risk HIV-uninfected women. AIDS 2009;23:59-70. DOI: 10.1097/QAD.0b013e32831cc101. [ Links ]
12. Giuliano AR, Lee J, Fulp W, et al. Incidence and clearance of genital papillomavirus infection in men (HIM): A cohort study. Lancet 2011;377:932-40. DOI: 10.1016/S0140-6736(10)62342-2. [ Links ]
13. Silverberg MJ, Lau B, Justice AC, et al. Risk of anal cancer in HIV-infected and HIV-uninfected individuals in North America. Clin Infect Dis 2012;54:1026-34. DOI: 10.1093/cid/cir1012. [ Links ]
14. Nielson CM, Flores R, Harris RB, et al. Human Papillomavirus prevalence and type distribution in male anogenital sites and semen. Cancer Epidemiol Biomarkers Prev 2007;16:1107-14. DOI: 10.1158/1055-9965.EPI-06-0997. [ Links ]
15. Albero G, Castellsagué X, Giuliano A, et al. Male circumcision and genital human papillomavirus: A systematic review and meta-analysis. Sex Transm Dis 2012;39:104-11. DOI: 10.1097/OLQ.0b013e3182387abd. [ Links ]
16. Doorbar J, Quint W, Banks L, et al. The biology and life-cycle of human papillomaviruses. Vaccine 2012;30(Supl):F55-F70. DOI: 10.1016/j.vaccine.2012.06.083. [ Links ]
17. Evander M, Fraser IH, Payne E, et al. Identification of the alpha 6 integrin as a candidate receptor for papillomaviruses. J Virol 1997;71:2449-56. [ Links ]
18. Narisawa-Saito M, Kiyono T. Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: Roles of E6 and E7 proteins. Cancer Sci 2007;98:1505-11. DOI: 10.1111/j.1349-7006.2007.00546.x. [ Links ]
19. Wentzensen N, Vinokurova S, von Knebel Doeberitz M. Systematic review of genomic integration sites of human papillomavirus genomes in epithelial dysplasia and invasive cancer of the female lower genital tract. Cancer Res 2004;64:3878-84. DOI: 10.1158/0008-5472.CAN-04-0009. [ Links ]
20. de Freitas AC, Coimbra EC, Leitão MC. Molecular targets of HPV oncoproteins: Potential biomarkers for cervical carcinogenesis. Biochim Biophys Acta 2014;1845:91-103. DOI: 10.1016/j.bbcan.2013.12.004. [ Links ]
21. Pokomandy A, Rouleau D, Ghattas G, et al. Prevalence, clearance, and incidence of anal human papillomavirus infection in HIV-infected men: The HIPVIRG Cohort Study. J Infect Dis 2009;199:9965-73. DOI: 10.1086/597207. [ Links ]
22. McCredie MR, Sharples KJ, Paul C, et al. Natural History of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: A retrospective cohort study. Lancet Oncol 2008;9:425-34. DOI: 10.1016/S1470-2045(08)70103-7. [ Links ]
23. Darragh TM, Colgan TJ, Cox T, et al. The lower anogenital squamous terminology standardization project for HPV-associated lesions: Background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. Arch Pathol Lab Med 2012;136:1266-97. DOI: 10.5858/arpa.LGT200570. [ Links ]
24. Smyaczek, Singh AE, Romanowski B. Anal intraepithelial neoplasia: Review and recommendations for screening and management. Int J STD AIDS 2013;24:843-51. DOI: 10.1177/0956462413481527. [ Links ]
25. Berry JM, Palefsky JM, Welton ML. Anal cancer and its precursors in HIV-positive patients: Perspectives and management. Surg Oncol Clin N Am 2004;13:355-73. DOI: 10.1016/j.soc.2003.12.003. [ Links ]
26. Solomon D, Davey D, Kurman R, et al. The 2001 Bethesda System: Terminology for reporting results of cervical cytology. JAMA 2002;287:2114-9. DOI: 10.1001/jama.287.16.2114. [ Links ]
27. Chiao EY, Giordano TP, Palefsky JM, et al. Screening HIV-infected individuals for anal cancer precursor lesions: A systematic review. Clin Infect Dis 2006;43:223-3. DOI: 10.1086/505219. [ Links ]
28. Panther LA, Wagner K, Proper J, et al. High resolution anoscopy findings for men who have sex with men: Inaccuracy of anal cytology as a predictor of histologic high-grade anal intraepithelial neoplasia and the impact of HIV serostatus. Clin Infect Dis 2004;38:1490-2. DOI: 10.1086/383574. [ Links ]
29. Crawshaw BP, Russ AJ, Stein SL, et al. High resolution anoscopy or expectant management for anal intraepithelial neoplasia for the prevention of anal cancer: Is there really a difference? Dis Colon Rectum 2015;58:53-5. [ Links ]
30. Deshmukh AA, Chiao EY, Das P, et al. Clinical effectiveness and cost-effectiveness of quadrivalent human papillomavirus vaccination in HIV-negative men who have sex with men to prevent recurrent high-grade anal intraepithelial neoplasia. Vaccine 2014;32:6941-7. DOI: 10.1016/j.vaccine.2014.10.052. [ Links ]
31. Wilkin T, Lee JY, Lensing SY, et al. High-grade anal intraepithelial neoplasia among HIV-1-infected men screening for a Multicenter Clinical Trial of a Human Papillomavirus Vaccine. HIV Clin Trials 2013;14:75-9. DOI: 10.1310/hct1402-75. [ Links ]
32. Wilkin T, Lee JY, Lensing SY, et al. Safety and Immunogenicity of the quadrivalent human papillomavirus vaccine in HIV-1-infected men. J Infect Dis 2010;202:1246-53. DOI: 10.1086/656320. [ Links ]
33. Guiliano AR, Palefsky JM, Goldstone S, et al. Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med 2011;364:401-11. DOI: 10.1056/NEJMoa0909537. [ Links ]
34. Palefsky JM, Guiliano AR, Goldstone S, et al. HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J Med 2011;365:1576-85 DOI: 10.1056/NEJMoa1010971. [ Links ]
35. Swedish KA, Factor SH, Goldstone SE. Prevention of recurrent high-grade anal neoplasia with quadrivalent human papillomavirus vaccination of men who have sex with men: A non-concurrent cohort study. Clin Infect Dis 2012;54:891-8. DOI: 10.1093/cid/cir1036. [ Links ]
36. Kim JJ, Goldie SJ. Cost effectiveness analysis of including boys in a human papillomavirus vaccination programme in the United States. BMJ 2009;339:b3884. DOI: 10.1136/bmj.b3884. [ Links ]
37. Kim JJ. Targeted human papillomavirus vaccination of men who have sex with men in the USA: A cost-effectiveness modelling analysis. Lancet Infect Dis 2010;10:845-52. DOI: 10.1016/S1473-3099(10)70219-X. [ Links ]
38. Zou H, Tabrizi SN, Grulich AE, et al. Site-specific human papillomavirus infection in adolescent men who have sex with men (HYPER): An observational cohort study. Lancet Infect Dis 2015;15:65-73. DOI: 10.1016/S1473-3099(14)70994-6. [ Links ]
39. Recommended Adult Immunization Schedule- United States- 2014. www.cdc.gov/vaccines/schedules. [ Links ]
40. The European AIDS Clinical Society Guidelines (Version 6.1). Available at: http://www.europeanaidsclinicalsociety.org/images/stories/EACS-pdf/EacsGuidelines-v6.1-2edition.pdf (2012). [ Links ]
41. New York AIDS Department of Health AIDS Institute. Anal Dysplasia and Cancer. Available at: http://www.hiv-guidelines.org/clinical-guidelines/adults/anal-dysplasia-and-cancer/ (2007). [ Links ]
42. Kaplan JE, Benson C, Holmes KH, et al. Guidelines for prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: Recommendations from CDC, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. MMWR Recomm Rep 2009;58:1-207. [ Links ]
43. UK guidelines for the management of sexual and reproductive health of people living with HIV infection. 2008. [ Links ]
44. Cotter MB, Kelly ME, O'Connell PR, et al. Anal intraepithelial neoplasia: A single centre 19 year review. Colorectal Dis 2014;16:777-82. DOI: 10.1111/codi.12679. [ Links ]
45. Goldstone SE, Johnstone BA, Moshier EL. Long-term outcome of ablation of anal high-grade squamous intraepithelial lesions: Recurrence and incidence of cancer. Dis Colon Rectum 2014;57:316-23. DOI: 10.1097/DCR.0000000000000058. [ Links ]
46. Weis SE, Vecino I, Pogoda JM, et al. Treatment of high-grade anal intraepithelial neoplasia with infrared coagulation in a primary care population of HIV-infected men and women. Dis Colon Rectum 2012;55:1236-43. DOI: 10.1097/DCR.0b013e31826d5cb5. [ Links ]
47. Goldstone RN, Goldstone AB, Russ J, et al. Long-term follow-up of infrared coagulator ablation of anal high-grade dysplasia in men who have sex with men. Dis Colon Rectum 2011;54:1284-92. DOI: 10.1097/DCR.0b013e318227833e. [ Links ]
48. Fox PA, Nathan M, Francis N, et al. A double blind, randomized controlled trial of the use of imiquimod cream for the treatment of anal canal high-grade anal intraepithelial neoplasia in HIV-positive MSM on HAART, with long term follow-up data including the use of open-label imiquimod. AIDS 2010;24:2331-5. DOI: 10.1097/QAD.0b013e32833d466c. [ Links ]
49. Richel O, de Vries H, Van Noesel C, et al. Comparison of Imiquimod, topical fluorouracil, and electrocautery for the treatment of anal intraepithelial neoplasia in HIV positive men who have sex with men: An open-label, randomised controlled trial. Lancet Oncol 2013;14:346-53. DOI: 10.1016/S1470-2045(13)70067-6. [ Links ]
50. Marks DK, Goldstone SE. Electrocautery ablation of high-grade anal squamous intraepithelial lesions in HIV-negative and HIV-positive men who have sex with men. J Acquir Immune Defic Syndr 2012;59:259-65. DOI: 10.1097/QAI.0b013e3182437469. [ Links ]
51. Steele SR, Varma MG, Melton GB, et al. Practice parameters for anal squamous neoplasms. Dis Colon Rectum 2012;55:735-49. DOI: 10.1097/DCR.0b013e318255815e. [ Links ]











 text in
text in