My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Enfermedades Digestivas
Print version ISSN 1130-0108
Rev. esp. enferm. dig. vol.109 n.9 Madrid Sep. 2017
https://dx.doi.org/10.17235/reed.2017.4693/2016
Coste-efectividad de una estrategia de cribado del virus de la hepatitis B para prevenir la reactivación en pacientes con neoplasia hematológica
Cost-effectiveness of a hepatitis B virus screening strategy to prevent reactivation in patients with hematologic neoplasms
Javier Crespo1, Rafael Esteban2, Covadonga Torres3, Itziar Oyagüez3, Miguel Ángel Casado3 y María Buti2
1Hospital Universitario Marqués de Valdecilla. Santander.
2Hospital Universitari Vall d'Hebrón. Barcelona.
3Pharmacoeconomics & Outcomes Research Iberia (PORIB). Madrid
Dirección para correspondencia
RESUMEN
Introducción: se analizó la efectividad de una estrategia de cribado de la infección por el virus de la hepatitis B (VHB) con consiguiente profilaxis en pacientes con neoplasia hematológica para evitar la reactivación del VHB.
Material y métodos: se utilizó un árbol de decisión para comparar costes y eficacia (reactivaciones evitadas), en 18 meses, de una estrategia con cribado previo a quimioterapia con R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona) versus una estrategia sin cribado. Los pacientes HBsAg+ (antígeno de superficie de la hepatitis B) y/o antiHBc+ (anticuerpos del núcleo de la hepatitis B) y ADN-VHB+ recibieron profilaxis antiviral con tenofovir disoproxil desde el inicio de la quimioterapia hasta un año después de su finalización. Los pacientes sin cribado recibieron tenofovir en caso de reactivación. Las probabilidades del modelo se obtuvieron de la literatura. El coste total (€, 2015) incluyó: profilaxis antiviral, R-CHOP, pruebas de cribado (HBsAg, antiHBc y ADN-VHB) y función hepática. El coste farmacológico se calculó con el precio de venta al laboratorio aplicando la deducción obligatoria.
Resultados: en una cohorte hipotética de 1.000 pacientes, el cribado evitó 7,36 reactivaciones frente a la estrategia sin cribado (14,9 versus 22,3). El coste total/paciente (incluyendo 8.282 € de coste de R-CHOP) fue de 8.584 € para la estrategia con cribado y 8.449 € para la estrategia sin cribado. La relación coste-efectividad incremental del cribado versus la estrategia sin cribado fue de 18.376 €/reactivación evitada.
Conclusión: el cribado de la infección por el VHB permite implementar una profilaxis antiviral en pacientes con alto riesgo de reactivación, disminuyendo la frecuencia de dichas reactivaciones en pacientes con neoplasias hematológicas en tratamiento quimioterapia, con un coste incremental aceptable.
Palabras clave: Cribado. Hepatitis B. Reactivación. Neoplasia. Coste-efectividad.
ABSTRACT
Introduction: The effectiveness of a screening strategy for the detection of a hepatitis B virus (HBV) infection followed by prophylaxis in order to prevent HBV reactivation was assessed in patients with hematologic neoplasms.
Material and methods: A decision tree was developed to compare the cost and effectiveness (prevented reactivations) over an 18 month period of a screening strategy prior to chemotherapy with R-CHOP (rituximab, cyclophosphamide, doxorubicin, vincristine and prednisone) with a non-screening approach. HBsAg+ (hepatitis B surface antigen) and/or anti-HBc+ (antibodies to hepatitis B core antigen) and HBV-DNA+ patients received oral antiviral prophylaxis with tenofovir disoproxil (245 mg once daily) from chemotherapy baseline until one year after chemotherapy completion. Non-screened patients received tenofovir in case of a reactivation. Model probabilities were obtained from the literature. The total cost (€, 2015) included: antiviral prophylaxis, R-CHOP, screening tests (HBsAg, anti-HBc, HBV-DNA) and liver function tests. Drug therapy costs were estimated using ex-factory prices with mandatory deductions. The incremental cost-effectiveness ratio (ICER) was calculated in order to assess the cost-effectiveness of this intervention in terms of cost per reactivation averted versus no screening.
Results: In a hypothetical cohort of 1,000 patients, screening prevented 7.36 reactivations when compared to the non-screening approach (14.9 versus 22.3). Total cost/patient (including €8,282 for R-CHOP) was €8,584 for the screening strategy and €8,449 for the non-screening approach. The ICER for screening versus non-screening was €18,376/prevented reactivation.
Conclusion: HBV screening followed by oral antiviral prophylaxis yielded more health benefits than non-screening, reducing HBV reactivation in patients with hematologic neoplasms on chemotherapy.
Key words: Screening. Hepatitis B virus. Reactivation. Neoplasm. Cost-effectiveness.
Introducción
La infección por el VHB constituye un problema de salud pública mundial, estimándose en cerca de 240 millones el número de personas crónicamente infectadas (1).
La reactivación del VHB se define por la reaparición o el incremento (> 1 log o > 20.000 UI/ml) del ADN-VHB en un paciente con una infección actual o pasada por VHB. La reactivación del VHB abarca un amplio espectro de manifestaciones clínicas, desde una hepatitis leve, transitoria y silente hasta formas fulminantes potencialmente mortales. La notable heterogeneidad evolutiva de la hepatitis por VHB depende básicamente de la interacción entre el sistema inmunológico del huésped y la capacidad del VHB para burlar estos mecanismos (2). La reactivación del VHB se describió por primera vez hace más de 35 años (3), siendo este riesgo más elevado en pacientes del ámbito de la onco-hematología que en otros tipos de neoplasias, aunque también se ha descrito en sujetos tratados con inmunomoduladores y/o tratamientos biológicos, individuos sometidos a inmunosupresión por trasplante de órganos sólidos e incluso en pacientes con un hepatocarcinoma a los cuales se les practica una quimioembolización hepática. Desde entonces, se han publicado múltiples trabajos que demuestran la reactivación del VHB en diferentes situaciones clínicas. En los últimos años y como consecuencia de la incorporación de nuevos fármacos con una elevada capacidad inmunosupresora como rituximab, el tema ha adquirido una especial relevancia (4,5). En el metaanálisis de Kazt y cols. en el que se incluyen 21 estudios, se reporta que entre un 24-100% de los pacientes que reactivan el VHB desarrollan una hepatitis aguda, con una mortalidad relacionada con el VHB muy variable, entre un 0 y un 50% (6). Además, otra consecuencia de la reactivación del VHB se relaciona con la necesidad de retrasar o incluso suspender el tratamiento quimioterápico o inmunosupresor, con el impacto clínico negativo que puede suponer en la supervivencia total (7). En este mismo metaanálisis, entre un 10-19% de los pacientes vieron interrumpido su tratamiento.
En los pacientes trasplantados, la reactivación del VHB incrementa la mortalidad y el riesgo de pérdida del injerto. El riesgo es más alto cuando se administran corticoides y es máximo en regímenes que combinan corticoides y rituximab, tal y como ha puesto de manifiesto otro metaanálisis que incluye nueve estudios y 971 pacientes (8), sobre todo en el caso de sujetos sometidos a trasplante de progenitores hematopoyéticos y de aquellos que reciben quimioterapia por linfomas, en especial no hodgkiniano (5,7,9-14). Además, la supervivencia de los pacientes oncológicos que son capaces de recuperarse de reactivación del VHB puede verse afectada debido a las alteraciones en el tratamiento de quimioterapia inicialmente previsto (15).
Se han efectuado tres ensayos clínicos controlados y aleatorizados (13,16,17) con lamivudina como terapia profiláctica en pacientes asiáticos HBsAg+ que iban a recibir quimioterapia por linfoma o hepatocarcinoma. Los tres demostraron que el uso profiláctico de lamivudina se asoció con una incidencia de reactivación del VHB mucho más baja que los pacientes controles. En España, un estudio multicéntrico afirmaba que el uso profiláctico de tenofovir reduce de forma significativa la incidencia y la gravedad de la reactivación del VHB asociada a la quimioterapia con rituximab (18).
Dado que la infección crónica suele ser asintomática y, con frecuencia, asociada a niveles normales de ALT, las personas infectadas solo pueden ser identificadas de forma fiable mediante la detección del antígeno de superficie de la hepatitis B (HBsAg) y del anti-HBc. Es recomendable, por tanto, que antes de recibir terapia inmunosupresora se realice un examen de marcadores de infección por VHB (1). Sin embargo, un estudio realizado en Estados Unidos, encontró que solo el 14% de los oncólogos cribaba regularmente a sus pacientes (19). Del mismo modo, solo al 14% de los pacientes en un hospital de Toronto se les realizaba la prueba de HBsAg antes de recibir la quimioterapia (20).
Por otra parte, algunas publicaciones recientes concluyen que no hay pruebas suficientes para determinar los beneficios o los riesgos del cribado rutinario de la infección crónica por el VHB en individuos con cáncer que van a recibir terapia inmunosupresora (21). Aunque se ha demostrado que la terapia antiviral preventiva en pacientes HBsAg positivos es económicamente aceptable, hay poca información sobre el coste y la efectividad del cribado del VHB (15), y no existen datos en nuestro país. Por ello, el objetivo de este estudio fue estimar la relación coste-efectividad del cribado del VHB en pacientes con neoplasia hematológica previamente al inicio del tratamiento con quimioterapia basada en rituximab, desde la perspectiva del Sistema Nacional de Salud.
Métodos
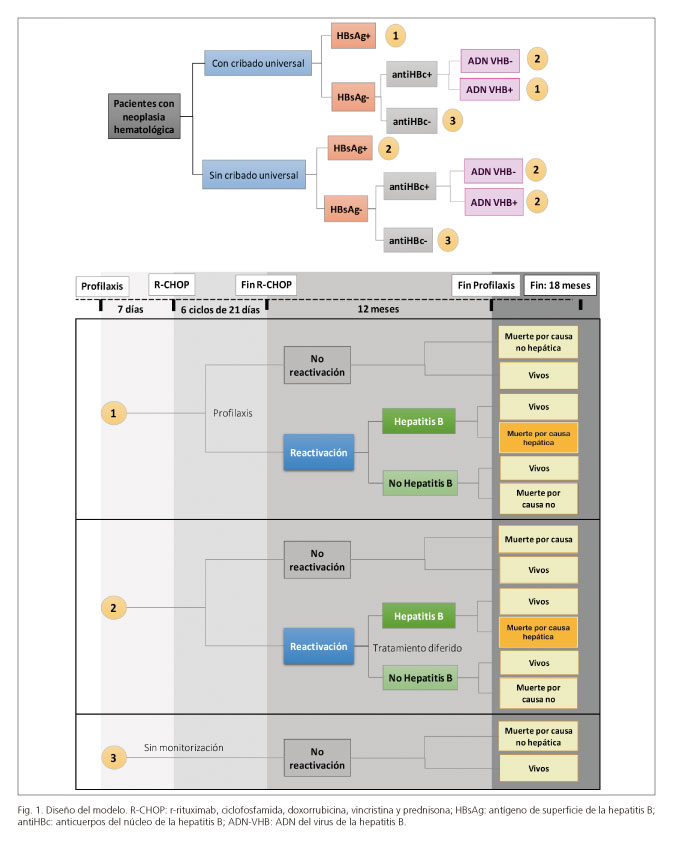
Se diseñó un modelo analítico en Excel, con estructura de árbol de decisión, para estimar la eficacia y los costes de dos posibles estrategias, cribado del VHB y profilaxis con tenofovir disoproxil versus no cribado, en una cohorte hipotética de 1.000 pacientes con neoplasia hematológica en el inicio de un tratamiento de quimioterapia con R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona). El análisis se realizó desde la perspectiva del Sistema Nacional de Salud, con un horizonte temporal de 18 meses (Fig. 1).
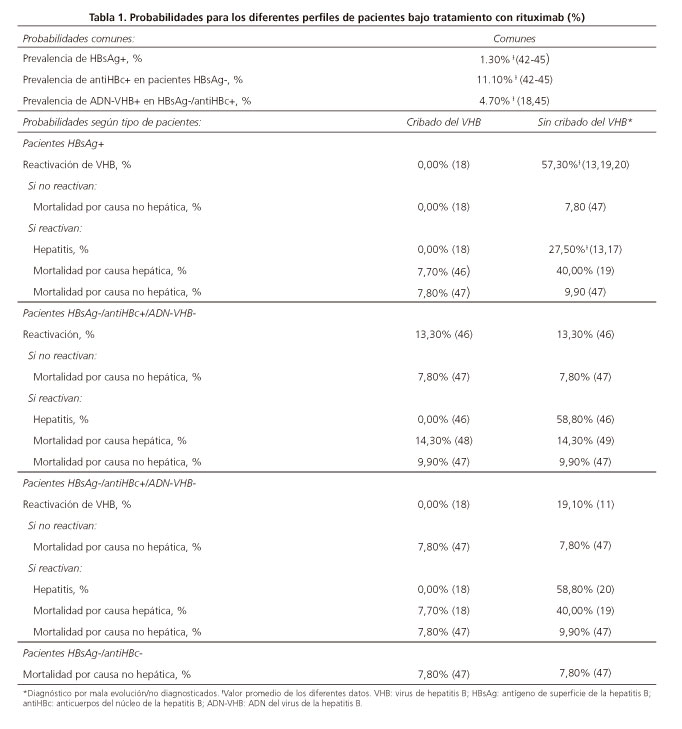
La evaluación de la eficacia consideró el número de reactivaciones evitadas con la estrategia de cribado frente al no cribado. Las diferentes probabilidades de cada estrategia (reactivaciones, hepatitis y muerte) para cada una de las situaciones reflejaron la mejor evidencia científica disponible, tras una revisión exhaustiva de la literatura. La prevalencia estimada de HBsAg+ fue del 1,3% y la prevalencia de anti-HBc+ en pacientes HBsAg-, del 11,1%. En la tabla 1 se detallan todas las probabilidades empleadas en el modelo, incluyendo sus referencias.
Para el análisis coste-efectividad (objetivo principal de este estudio) se ha utilizado un indicador numérico conocido como ratio coste-efectividad incremental (RCEI). Los resultados se expresan como coste extra por unidad de beneficio adicional conseguido con la estrategia de cribado respecto a la estrategia de no cribado. Como variable de eficacia se ha utilizado el número de pacientes que se necesita cribar para evitar la reactivación. Por lo tanto, el resultado de este cociente se deberá interpretar como el coste adicional que supondría la estrategia de cribado para evitar una reactivación.
En el grupo de pacientes sometidos a cribado se determinaron las pruebas de HBsAg y anti-HBc antes de la quimioterapia. En los casos con HBsAg y/o antiHBc positivo se evaluó el ADN del virus de la hepatitis B (ADN-VHB), cada dos meses en caso de no existir reactivación y cada mes en caso que esta se produzca. En los pacientes con alto riesgo de reactivación (HBsAg positivo y/o antiHBc positivo + ADN-VHB positivo) se administró profilaxis con tenofovir disoproxil desde una semana previa al inicio de la quimioterapia hasta un año después de la finalización de la misma.
En el grupo no sometido a cribado solo se consideraba el tratamiento antiviral diferido, es decir, en el momento en el que se identifica una reactivación. Desde un punto de vista cronológico, la reactivación puede producirse tras las primeras dosis del fármaco inmunosupresor y/o quimioterápico o bien puede tener lugar meses después de finalizada la terapia inmunosupresora, cuando el sistema inmunitario recupera su reactividad y detecta el aumento de la replicación viral que ha tenido lugar durante la fase de inmunosupresión. En base a la evidencia disponible, se asumió que la reactivación de VHB en pacientes con neoplasia hematológica se produce con máxima frecuencia a los cuatro meses de inicio de la quimioterapia con R-CHOP (20,22,23).
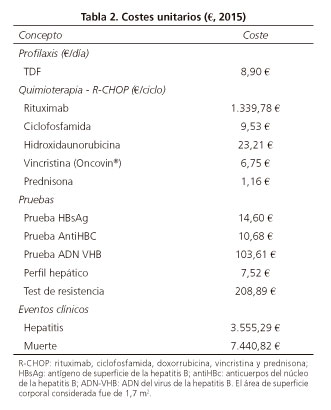
La estimación del coste total de cada estrategia incluyó el coste farmacológico de la quimioterapia y el tratamiento antiviral, el coste del cribado, el coste de monitorización de la función hepática y el coste de los eventos clínicos (hepatitis y muerte). El coste farmacológico se calculó partir del precio de venta laboratorio (PVL) obtenido del Catálogo de Medicamentos del Consejo General de Colegios Oficiales de Farmacéuticos (24), aplicando, en los medicamentos afectados, la deducción obligatoria establecida por el Real Decreto 8/2010 (25). Para la terapia antiviral se consideró administración oral de un comprimido de 245 mg diarios de tenofovir disoproxil fumarato (TDF) (26). El coste de la quimioterapia con R-CHOP se estimó considerando 6 ciclos de 21 días, con la posología habitual: rituximab - 375 mg/m2 el día primero del ciclo (27); ciclofosfamida - 750 mg/m2 el día primero del ciclo (28); hidroxidaunorubicina - 50 mg/m2 el día primero del ciclo (29); Oncovin® - 1,4 mg/m2 (máximo 2 mg) el día primero del ciclo (30); y prednisona - 100 mg los días primero y quinto del ciclo (31). El área de superficie corporal considerado fue de 1,7 m2 (32,33).
Las pruebas de función hepática que incluyeron valores de transaminasas y bilirrubina se realizaron cada dos meses. En los casos de reactivación del VHB, se asumió una monitorización mensual. Los costes unitarios de las determinaciones para el cribado y la monitorización de la función hepática se obtuvieron de una base de datos de costes nacionales (34). Para el coste de manejo de hepatitis se consideró el promedio de los costes estimados en 2014 por el Ministerio de Sanidad, Servicios Sociales e Igualdad, correspondientes al registro de altas del Conjunto Mínimo Básico de Datos (CMBD) de 2012 (35) para los siguientes códigos CIE-9: 070 (hepatitis vírica), 070.30 (hepatitis viral B sin coma hepático agudo o inespecífica sin hepatitis delta), 070.32 (hepatitis viral B sin coma hepático, crónica sin hepatitis delta), 573.3 (hepatitis sin especificar), 571.40 (hepatitis crónica no especificada) y 571.49 (otras hepatitis crónicas), junto con el coste del manejo de la hepatitis B estimado en un estudio en diferentes países europeos entre los que se aportan datos de España (36).
El coste de la muerte por causa hepática se obtuvo de la literatura (37), actualizándose con la correspondiente variación interanual del IPC publicada por el Instituto Nacional de Estadística (38).
Para evaluar la incertidumbre de los resultados, se realizaron diversos análisis de sensibilidad determinísticos, creando nuevos escenarios y modificando los siguientes parámetros: el tiempo en el que se produce la reactivación tras el inicio de la quimioterapia con R-CHOP, de cuatro a cinco meses (AS1); el número de ciclos de quimioterapia con R-CHOP considerados, de seis a ocho ciclos (pauta también utilizada en la práctica clínica habitual) (AS2); el porcentaje de sujetos HBsAg-, modificando la prevalencia de 1,3% a un 0,7% (prevalencia en población general) (AS3); el porcentaje de sujetos antiHBc+, disminuyendo su valor un 25%, es decir, de una prevalencia de 11,10% a 8,32% (AS4); la probabilidad de mortalidad por causa no hepática en pacientes HBsAg+ que no reactivan en la rama de cribado, igualando su valor a la probabilidad en la rama de no cribado, es decir, de un valor de 0,0% a 7,8% (AS5).
Todos los costes se expresan en euros (€) con valores de 2015 (Tabla 2).
Resultados
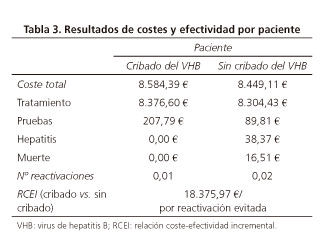
En una cohorte hipotética de 1.000 pacientes con neoplasia hematológica tratados con R-CHOP, una estrategia de cribado del VHB previamente al inicio de la quimioterapia evitaría un total de 7,36 reactivaciones frente a la estrategia sin cribado en un periodo de 18 meses (Tabla 3).
El coste total estimado por paciente fue de 8.584 € para la estrategia de cribado, con una contribución del 97,6% del coste farmacológico de la terapia con R-CHOP. Este coste total por paciente resultó de 8.449 € para la alternativa de no cribado, siendo en este caso de un 98,3% la contribución del coste farmacológico. Es decir, la estrategia de cribado supone un coste incremental de 135 € por paciente, lo que representa un 1,6% adicional, frente a la estrategia sin cribado. Además, la contribución del coste de los eventos clínicos (hepatitis y muerte) en la estrategia de cribado fue del 0,0%, sin embargo, en la estrategia sin cribado esta contribución ascendió al 0,6%.
La RCEI resultante fue 18.376 € por reactivación del VHB evitada con una estrategia de cribado frente a no cribado, en un periodo de 18 meses (Tabla 3).
Tras realizar los diferentes análisis de sensibilidad determinísticos se obtuvieron los siguientes resultados: en relación al número de reactivaciones evitadas, no hubo cambios con respecto al valor obtenido en el caso base excepto para los análisis de sensibilidad en los que se modificó el porcentaje de sujetos HBsAg- (AS3) y el porcentaje de sujetos antiHBc+ (AS4), disminuyendo las 7,36 reactivaciones evitadas del caso base a 4,28 y 7,19 para el AS3 y el AS4, respectivamente. Con respecto al RCEI (18.376 € por reactivación evitada con la estrategia de cribado frente a no cribado en el cwaso base), el valor varía entre 16.078,07 € para el análisis de sensibilidad en el que se modificó el porcentaje de sujetos antiHBc+ (AS4) y 27.155,06 € para el análisis de sensibilidad en el que se modificó el porcentaje de sujetos HBsAg- (AS3).
Discusión
El estudio PRESCRIB ha evaluado la relación coste-efectividad del cribado del VHB en pacientes con neoplasia hematológica antes del inicio del tratamiento con quimioterapia, siendo uno de los pocos estudios que evalúan la efectividad en quimioterapia con R-CHOP y el único estudio que analiza el coste-efectividad en España. Además, es el primer estudio que evalúa la efectividad, en función del parámetro clínico comúnmente utilizado en práctica clínica habitual, definido como reactivación evitada.
Según los resultados obtenidos, el cribado y la monitorización de la función hepática asociada a la estrategia con cribado suponen un coste adicional de 135 € por paciente en 18 meses, con una tasa de reactivaciones evitadas de 7,36 por cada 1.000 pacientes.
Por ello, se puede concluir que la profilaxis antiviral tras el cribado del VHB disminuye la frecuencia de reactivación y reduce la mortalidad en pacientes con neoplasias hematológicas con quimioterapia. Aunque el coste de la estrategia de cribado es levemente más alto que el de la estrategia de no cribado, el beneficio del cribado es la reducción de reactivaciones que pueden originar eventos clínicos, como hepatitis, carcinoma hepatocelular, trasplante hepático y muertes por causa hepática (39). Además, existe un factor adicional difícil de cuantificar pero que indudablemente afecta negativamente al paciente: la imposibilidad o el retraso en la administración de quimioterapia en los pacientes con una reactivación.
Un estudio recientemente realizado en España (18) comparó la eficacia de la profilaxis con TDF versus observación en pacientes anti-HBc positivo y AgHBs negativo, tratados con rituximab por neoplasia hematológica. Sus resultados estaban en línea con los descritos en el presente estudio, mostrando que la administración de TDF previene la reactivación del VHB.
Otro estudio (15) evaluó el coste-efectividad de tres estrategias de cribado (cribado en todos los pacientes, cribado en pacientes de alto riesgo y no cribado) en pacientes con linfoma en un horizonte temporal de 12 meses. El estudio indicaba que la estrategia de cribado en todos los pacientes, aunque con pequeñas diferencias, era coste-efectiva frente a las otras dos estrategias descritas. Sin embargo, dicho estudio solo desagregó los diferentes perfiles clínicos de los pacientes en función de la determinación inicial de HBsAg.
El estudio de Day y cols. (40) también realizó un análisis coste efectividad comparando la estrategia de cribado frente a la de no cribado en pacientes con tumores sólidos en Australia. Sus conclusiones afirmaban que la estrategia de cribado es coste-efectiva en determinadas subpoblaciones de pacientes y/o simplificando las estrategias de cribado.
Cabe destacar que los dos únicos estudios publicados de coste-efectividad descritos con anterioridad utilizaron la misma metodología que el presente estudio, analizando los resultados mediante un modelo basado en un árbol de decisión.
Entre las limitaciones asociadas al presente estudio, destaca el reducido horizonte temporal empleado en el análisis, cuya elección estuvo condicionada por la evidencia disponible sobre reactivaciones en este perfil de pacientes. Un horizonte temporal más extenso permitiría, de manera más adecuada, captar todas las diferencias significativas en los costes y en los resultados entre las alternativas evaluadas, lo que aportaría mayor validez a los resultados. En este sentido, la historia natural de la enfermedad y cómo puede ser modificada mediante los tratamientos evaluados son elementos a tener muy en cuenta. Otro punto a mencionar es que el modelo está asumiendo que el cribado no supone ningún retraso en la quimioterapia. Sin embargo, sería conveniente asegurar que esta situación no ocurre en la práctica clínica habitual. Además, la estrategia profiláctica descrita (tenofovir) podría no ser adecuada en todos los perfiles de pacientes, pudiéndose utilizar en su lugar lamivudina. Por último, la principal dificultad en la interpretación de los datos obtenidos se asocia a la ausencia de umbral específico de disponibilidad a pagar por cada unidad de eficacia conseguida, en este caso por cada reactivación evitada.
Ante la situación actual de los sistemas sanitarios públicos, que se enfrenta a una escasez de recursos y a una demanda creciente de recursos y servicios, debería plantearse un debate sobre el interés sanitario y social de implementación de programas y estrategias (como los nuevos marcadores para diagnóstico de reactivación [41]) con un perfil más profiláctico que terapéutico que presenten un adecuado perfil de eficiencia a la vez que se asocien a beneficios adicionales. Sin embargo, los presentes resultados sí permiten concluir que el cribado del VHB en población con neoplasia hematológica que va a recibir quimioterapia con rituximab identifica pacientes susceptibles de beneficiarse de una profilaxis antiviral, que supone un coste adicional de 135 € por paciente en 18 meses con respecto a la estrategia de no cribado y que evita 7,36 reactivaciones por cada 1.000 pacientes.
Agradecimientos
Los autores agradecen a Cándido Hernández, empleado de Gilead Sciences, su colaboración en el proceso de búsqueda bibliográfica, que permitió identificar los trabajos más relevantes.
Los autores también agradecen a los revisores de la Revista Española de Enfermedades Digestivas los comentarios y las propuestas aportadas durante el proceso de revisión del manuscrito, que han permitido mejorar la calidad del mismo.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Itziar Oyagüez.
Pharmacoeoconomics & Outcomes Research Iberia (PORIB).
Paseo Joaquín Rodrigo 4o I.
28224 Pozuelo de Alarcón, Madrid. Spain
e-mail: ioyaguez@porib.com
Recibido: 29-10-2016
Aceptado: 11-04-2017
Bibliografía
1. World Health Organization. Media Centre: Hepatitis B. July 2015. Disponible en: http://www.who.int/mediacentre/factsheets/fs204/en/. [ Links ]
2. Yim HJ, Lok AS. Natural history of chronic hepatitis B virus infection: What we knew in 1981 and what we know in 2005. Hepatol 2006;43(2 Supl 1):S173-81. DOI: 10.1002/hep.20956. [ Links ]
3. Wands JR, Chura CM, Roll FJ, et al. Serial studies of hepatitis-associated antigen and antibody in patients receiving antitumor chemotherapy for myeloproliferative and lymphoproliferative disorders. Gastroenterol 1975;68:105-12. [ Links ]
4. Hui CK, Cheung WW, Zhang HY, et al. Kinetics and risk of de novo hepatitis B infection in HBsAg-negative patients undergoing cytotoxic chemotherapy. Gastroenterol 2006;131:59-68. DOI: 10.1053/j.gastro.2006.04.015. [ Links ]
5. Yeo W, Chan TC, Leung NW, et al. Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab. J Clin Oncol 2009;27:605-11. DOI: 10.1200/JCO.2008.18.0182. [ Links ]
6. Katz LH, Fraser A, Gafter-Gvili A, et al. Lamivudine prevents reactivation of hepatitis B and reduces mortality in immunosuppressed patients: Systematic review and meta-analysis. J Viral Hepat 2008; 15:89-102. [ Links ]
7. Francisci D, Falcinelli F, Schiaroli E, et al. Management of hepatitis B virus reactivation in patients with hematological malignancies treated with chemotherapy. Infection 2010;38:58-61. DOI: 10.1007/s15010-009-9019-1. [ Links ]
8. Dong HJ, Ni LN, Sheng GF, et al. Risk of hepatitis B virus (HBV) reactivation in non-Hodgkin lymphoma patients receiving rituximab-chemotherapy: A meta-analysis. J Clin Virol 2013;57:209-14. DOI: 10.1016/j.jcv.2013.03.010. [ Links ]
9. Marzano A, Angelucci E, Andreone P, et al. Prophylaxis and treatment of hepatitis B in immunocompromised patients. Dig Liver Dis 2007;39(5):397-408. DOI: 10.1016/j.dld.2006.12.017. [ Links ]
10. Raimondo G, Navarra G, Mondello S, et al. Occult hepatitis B virus in liver tissue of individuals without hepatic disease. J Hepatol 2008;48(5):743-6. DOI: 10.1016/j.jhep.2008.01.023. [ Links ]
11. Kusumoto S, Tanaka Y, Ueda R, et al. Reactivation of hepatitis B virusfollowing rituximab-plus-steroid combination chemotherapy. J Gastroenterol 2011;46(1):9-16. DOI: 10.1007/s00535-010-0331-4. [ Links ]
12. Matsue K, Kimura S, Takanashi Y, et al. Reactivation of hepatitis B virus after rituximab-containing treatment in patients with CD20-positive B-cell lymphoma. Cancer 2010;116(20):4769-76. DOI: 10.1002/cncr.25253. [ Links ]
13. Lau GK, Yiu HH, Fong DY, et al. Early is superior to deferred preemptive lamivudine therapy for hepatitis B patients undergoing hemotherapy. Gastroenterol 2003;125(6):1742-9. DOI: 10.1053/j.gastro.2003.09.026. [ Links ]
14. Evens AM, Jovanovic BD, Su YC, et al. Rituximab-associated hepatitis B virus (HBV) reactivation in lymphoproliferative diseases: Meta-analysis and examination of FDA safety reports. Ann Oncol 2011;22(5):1170-80. DOI: 10.1093/annonc/mdq583. [ Links ]
15. Zurawska U, Hicks LK, Woo G, et al. Hepatitis B virus screening before chemotherapy for lymphoma: A cost-effectiveness analysis. J Clin Oncol 2012;30(26):3167-73. DOI: 10.1200/JCO.2011.40.7510. [ Links ]
16. Jang JW, Choi JY, Bae SH, et al. A randomized controlled study of preemptive lamivudine in patients receiving transarterial chemo-lipiodolization. Hepatol 2006;43(2):233-40. DOI: 10.1002/hep.21024. [ Links ]
17. Hsu C, Hsiung CA, Su IJ, et al. A revisit of prophylactic lamivudine for chemotherapy-associated hepatitis B reactivation in non-Hodgkin's lymphoma: A randomized trial. Hepatol 2008;47(3):844-53. DOI: 10.1002/hep.22106. [ Links ]
18. Buti M, Morillas R, Manzano ML, et al. Tenofovir for the prophylaxis of HBV reactivation in anti-HBc-positive patients with hematologic malignancies treated with rituximab - Preliminary results of a randomized study (PREBLIN study). J Hepatol 2014;60(1):S421(P1040). DOI: 10.1016/S0168-8278(14)61200-9. [ Links ]
19. Viganò M, Serra G, Casella G, et al. Reactivation of hepatitis B virus during targeted therapies for cancer and immune-mediated disorders. Expert Opin Biol Ther 2016;16(7):917-26. DOI: 10.1080/14712598.2016.1177017. [ Links ]
20. Pei SN, Chen CH, Lee CM, et al. Reactivation of hepatitis B virus following rituximab-based regimens: A serious complication in both HBsAg-positive and HBsAg-negative patients. Ann Hematol 2010;89(3):255-62. DOI: 10.1007/s00277-009-0806-7. [ Links ]
21. Artz AS, Somerfield MR, Feld JJ, et al. American Society of Clinical Oncology provisional clinical opinion: Chronic hepatitis B virus infection screening in patients receiving cytotoxic chemotherapy for treatment of malignant diseases. J Clin Oncol 2010;28(19):3199-202. DOI: 10.1200/JCO.2010.30.0673. [ Links ]
22. Kim SJ, Hsu C, Song YQ, et al. Hepatitis B virus reactivation in B-cell lymphoma patients treated with rituximab: Analysis from the Asia Lymphoma Study Group. Eur J Cancer 2013;49(16):3486-96. DOI: 10.1016/j.ejca.2013.07.006. [ Links ]
23. Li HR, Huang JJ, Guo HQ, et al. Comparison of entecavir and lamivudine in preventing hepatitis B reactivation in lymphoma patients during chemotherapy. J Viral Hepat 2011;18(12):877-83. DOI: 10.1111/j.1365-2893.2010.01386.x. [ Links ]
24. Base de Datos de Medicamentos del Consejo General de Colegios Farmacéuticos. BotPlus. Disponible en: https://botplusweb.portalfarma.com/. [ Links ]
25. Real Decreto Ley 8/2010 - BOE. Disponible en: www.boe.es/boe/dias/2010/05/24/pdfs/BOE-A-2010-8228.pdf DOI: 10.1016/j.janxdis.2010.02.003. [ Links ]
26. Ficha técnica de tenofovir. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000419/WC500051737.pdf. [ Links ]
27. Ficha técnica de rituximab. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000165/WC500025821.pdf. [ Links ]
28. Ficha técnica de ciclofosfamida. Disponible en: https://www.aemps.gob.es/cima/pdfs/es/ft/79065/FichaTecnica_79065.html.pdf. [ Links ]
29. Ficha técnica de hidroxidaunorubicina. Disponible en URL: https://www.aemps.gob.es/cima/pdfs/es/ft/62177/FT_62177.pdf. [ Links ]
30. Ficha técnica de Oncovin. Disponible en: https://www.aemps.gob.es/cima/pdfs/es/ft/71117/FichaTecnica_71117.html.pdf. [ Links ]
31. Ficha técnica de prednisona. Disponible en: https://www.aemps.gob.es/cima/pdfs/es/ft/29724/29724_ft.pdf. [ Links ]
32. Mosteller RD. Simplified calculation of body-surface area. N Engl J Med 1987;317:1098. PMID 3657876. [ Links ]
33. Haycock GB, Schwartz GJ, Wisotsky DH. Geometric method for measuring body surface area: A height-weight formula validated in infants, children and adults. J Pediatr 1978;93:62-6. [ Links ]
34. Oblikue consulting. eSalud. Disponible en: http://oblikue.com. [ Links ]
35. Ministerio de Sanidad, Servicios Sociales e Igualdad. Instituto de Información Sanitaria. (2014). Registro de altas. CIE9 MC-CMBD 2012. Disponible en: http://pestadistico.inteligenciadegestion.msssi.es/. [ Links ]
36. Brown RE, De Cock E, Colin X, et al. Hepatitis B management costs in France, Italy, Spain, and the United Kingdom. J Clin Gastroenterol 2004;38(10 Supl 3):S169-74. DOI: 10.1097/00004836-200411003-00009. [ Links ]
37. Buti M, Brosa M, Casado MA, et al. Modeling the cost-effectiveness of different oral antiviral therapies in patients with chronic hepatitis B. J Hepatol 2009;51(4):640-6. DOI: 10.1016/j.jhep.2009.04.013. [ Links ]
38. Instituto Nacional de Estadística. Cálculo de variaciones del Índice de Precios de Consumo. Disponible en: http://www.ine.es. [ Links ]
39. Hay AE, Meyer RM. Hepatitis B, rituximab, screening, and prophylaxis: Effectiveness and cost effectiveness. J Clin Oncol 2012;30(26):3155-7. DOI: 10.1200/JCO.2012.43.7509. [ Links ]
40. Day FL, Karnon J, Rischin D. Cost-effectiveness of universal hepatitis B virus screening in patients beginning chemotherapy for solid tumors. J Clin Oncol 2011;29(24):3270-7. DOI: 10.1200/JCO.2011.35.1635. [ Links ]
41. Seto WK, Wong DH, Chan TY, et al. Association of hepatitis B core-related antigen with hepatitis B virus reactivation in occult viral carriers undergoing high-risk immunosuppressive therapy. Am J Gastroenterol 2016;111(12):1788-95. DOI: 10.1038/ajg.2016.436. [ Links ]
42. Álvarez Suárez B, De la Revilla Negro J, Ruiz-Antoran B, et al. Reactivación de la hepatitis B y su impacto clínico actual. Rev Esp Enferm Dig 2010;102(9):542-52. [ Links ]
43. Gutiérrez García ML, Alonso López S, Martín Ríos MD, et al. Hepatitis B virus reactivation in rituximab-treated patients: Incidence and risk factors. Gastroenterol Hepatol 2015;38(1):1-6. DOI: 10.1016/j.gastrohep.2014.05.008. [ Links ]
44. Yeguas A, Turcu V, Núñez J, et al. Profilaxis y reactivación de la hepatitis en la era del rituximab. Experiencia clínica en el Hospital Universitario de Getafe. LIV Reunión de la Sociedad Española de Hematología y Hemoterapia. Salamanca, 18-20 oct 2012. Póster P-008. Disponible en: http://www.sehh.es/images/stories/recursos/2013/comunicaciones_cientificas/2012/LIV_Congreso_SEHH_2012.pdf. [ Links ]
45. Sampedro B, Hernández-López C, Ferrándiz JR, et al. Computerized physician order entry-based system to prevent HBV reactivation in patients treated with biologic agents: The PRESCRIB project. Hepatol 2014;60(1):106-13. DOI: 10.1002/hep.27103. [ Links ]
46. Hsu C, Tsou HH, Lin SJ, et al. Chemotherapy-induced hepatitis B reactivation in lymphoma patients with resolved HBV infection: A prospective study. Hepatol 2014;59(6):2092-100. DOI: 10.1002/hep.26718. [ Links ]
47. Saab S, Dong MH, Joseph TA, et al. Hepatitis B prophylaxis in patients undergoing chemotherapy for lymphoma: A decision analysis model. Hepatol 2007;46(4):1049-56. DOI: 10.1002/hep.21783. [ Links ]
48. Papadopoulos N, Deutsch M, Manolakopoulos S, et al. Is antiviral prophylactic treatment necessaray in HBsAg(-), antiHBc(+) and antiHBs(+) onco-hematologic patients with high or moderate risk for HBV reactivation. European Association for the Study of the Liver. EASL Special conference. Optimal Management of Hepatitis B Virus Infection. Atenas, 25-27 sept 2014. [ Links ]
49. Papadopoulos N, Deutsch M, Manolakopoulos S, et al. Is antiviral prophylactic treatment necessaray in HBsAg(-), antiHBc(+) and antiHBs(+) onco-hematologic patients with high or moderate risk for HBV reactivation. European Association for the Study of the Liver. EASL Special conference. Optimal Management of Hepatitis B Virus Infection. Atenas, 25-27 sept 2014. [ Links ]











 text in
text in