My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.40 n.5 Toledo Sep./Oct. 2016
https://dx.doi.org/10.7399/fh.2016.40.5.10429
ORIGINALES
Análisis de minimización de costes del tratamiento de la espasticidad en niños con parálisis cerebral con toxina botulínica tipo A: un estudio observacional, longitudinal, retrospectivo
Cost-minimization analysis in the treatment of spasticity in children with cerebral palsy with botulinum toxin type A: an observational, longitudinal, retrospective study
Gloria Tapias1, Mar García-Romero2, Carlos Crespo3,4, Maribel Cuesta3, Carles Forné3 y Samuel Ignacio Pascual-Pascual2
1Ipsen Pharma S.A., Barcelona.
2Paediatric Neurology Unit, Hospital Universitario Materno Infantil La Paz, Madrid.
3Department of Health Economics and Outcomes Research, Oblikue Consulting S.L., Barcelona.
4Department of Statistics, Universitat de Barcelona, Barcelona. Spain.
Este estudio ha sido financiado por Ipsen Pharma.
Dirección para correspondencia
RESUMEN
Objetivo: Estudio de minimización de costes de onabotulinumtoxinA y de abobotulinumtoxinA, teniendo en cuenta la dosis real administrada, en niños con espasticidad asociada con la deformidad dinámica del pie equino debida a parálisis cerebral.
Método: Estudio unicéntrico, observacional, longitudinal y retrospectivo que incluyó pacientes pediátricos espásticos entre 2 y 18 años tratados con onabotulinumtoxinA o abobotulinumtoxinA, entre diciembre del 1995 y octubre del 2012, en el Servicio de Neurología Pediátrica de un hospital español de primer nivel. Se realizó un análisis longitudinal de la gravedad de la espasticidad para confirmar la similar efectividad de ambos tratamientos y proceder al análisis de minimización de costes que contempló las dosis infiltradas y los costes directos (costes farmacológicos y de visitas) desde la perspectiva del Sistema Nacional de Salud (euros 2016).
Resultados: Se analizaron 895 pacientes con espasticidad infantil, 543 fueron tratados únicamente con onabotulinumtoxinA, 292 con abobotulinumtoxinA y 60 con ambos tratamientos. Las dosis medias infiltradas obtenidas fueron de 5,44 U/kg (DE = 2,17) para las infiltraciones con onabotulinumtoxinA y de 14,73 U/kg (5,26) para las infiltraciones con abobotulinumtoxinA. El coste directo anual total (farmacológico y visitas) fue de 839,56 € para onabotulinumtoxinA y de 631,23 € para abobotulinumtoxinA, lo que supone una diferencia de 208,34 € al año a favor del tratamiento con abobotulinumtoxinA.
Conclusiones: Se ha mostrado que en práctica clínica real el coste por paciente y año del tratamiento de la espasticidad infantil resulta más económico con la utilización de abobotulinumtoxinA.
Palabras clave: Toxinas botulínicas; Espasticidad infantil; Dosis práctica clínica; Pie equino; España.
ABSTRACT
Objective: Cost-minimization analysis of onabotulinumtoxinA and abobotulinumtoxinA, taking into account the real dose administered to children with spasticity associated with dynamic equinus foot deformity due to cerebral palsy.
Method: A single centre, observational, longitudinal, and retrospective study which included spastic paediatric patients aged 2-to-18-years and treated with onabotulinumtoxinA or abobotulinumtoxinA from December 1995 to October 2012, in the Paediatric Neurology Unit of a first-level Spanish hospital. A longitudinal analysis of spasticity severity was made to confirm the similar effectiveness of both treatments. Cost minimization was analyzed using the dose administered and the direct costs (pharmacological and medical visits costs) from the perspective of the National Health System (in 2016 euros).
Results: We analyzed 895 patients with paediatric spasticity: 543 were treated only with onabotulinumtoxinA, 292 only with abobotulinumtoxinA, and 60 with both treatments. The mean doses administered were 5.44 U/kg (SD = 2.17) for onabotulinumtoxinA, and 14.73 U/kg (5.26) for abobotulinumtoxinA. The total annual direct cost (pharmacological and medical visits) was € 839.56 for onabotulinumtoxinA and € 631.23 for abobotulinumtoxinA, which represents a difference of € 208.34 per year in favour of treatment with abobotulinum-toxinA.
Conclusions: It has been shown that in real clinical practice, the cost per patient and year for treatment of paediatric spasticity was lower when abobotulinumtoxinA was used.
Key words: Botulinum toxins; Paediatric spasticity; Clinical practice dose; Equinus foot; Spain.
Aportación a la literatura científica
La principal aportación de este estudio es que los resultados corresponden a la práctica clínica real del tratamiento de la espasticidad infantil con toxina botulínica tipo A en pacientes españoles.
El tratamiento de la espasticidad infantil con Dysport® supone un ahorro potencial en el coste farmacológico por paciente, respecto al tratamiento con Botox®.
Introducción
La espasticidad es un trastorno motor, caracterizado por un aumento dependiente de la velocidad en el reflejo de estiramiento tónico que podría causar dolor y discapacidad debido a un daño o lesión de una parte del sistema nervioso central que controla el movimiento voluntario1. Este daño interrumpe importantes señales entre el sistema nervioso y los músculos, creando un desequilibrio que aumenta la actividad muscular y/o produce espasmos. La espasticidad puede dificultar los movimientos, la postura y el equilibrio. Puede afectar a la capacidad de mover uno o varios miembros o un lado del cuerpo. Además, a veces la espasticidad es tan severa que afecta a las actividades diarias, a los patrones de sueño y a los cuidados de los menores.
El principal objetivo del tratamiento es la mejora de la función motora, la disminución del dolor y la prevención de complicaciones, con la finalidad primordial de mejorar la calidad de vida relacionada con la salud del paciente2.
Junto con la rehabilitación motora, la toxina botulínica tipo A (TBA) es considerada uno de los principales tratamiento de elección de los síndromes espásticos y distónicos focales, independientemente de las causas2-4. Desde hace más de una década, la TBA se emplea en adultos y en niños con enfermedades neurológicas que cursan con espasmo, hipertonía y/o distonía muscular.
Datos procedentes de ensayos clínicos demuestran que las diferentes especialidades farmacéuticas de TBA cuentan con un perfil similar, tanto de eficacia como de seguridad5.
En España se dispone actualmente de 3 presentaciones de TBA con similar perfil de eficacia y seguridad: Dysport®abobotulinumtoxinA (Ipsen Pharma), Botox®onabotulinumtoxinA (Allergan) y Xeomin®incobotulinumtoxinA (Merz Pharma)6. Cada formulación tiene recomendaciones clínicas específicas que se han formulado sobre la base de la información científica disponible, poseen diferentes perfiles bioquímicos7, las unidades son específicas de cada preparado y no son intercambiables con otros preparados de toxina botulínica8-10. Hasta la fecha existen dos estudios en España que analizan los costes del uso de TBA. Sin embargo, estas evaluaciones se realizaron asumiendo la posología recomendada para cada indicación según ficha técnica de los productos11,12. Ahora bien, se desconocen las dosis reales en la práctica clínica de TBA utilizadas en nuestro país y como consecuencia se hace imposible la cuantificación real de los costes de los diferentes tratamientos de TBA comercializados.
El objetivo de este estudio fue comparar los costes y la efectividad de Botox® y de Dysport®, teniendo en cuenta la dosis real administrada en niños con espasticidad asociada con la deformidad dinámica del pie equino debido a parálisis cerebral (se excluyó Xeomin®, dado que no está autorizado para el tratamiento de la espasticidad infantil). Para ello, se realizó un análisis longitudinal de la gravedad de la espasticidad para confirmar la efectividad similar de ambos tratamientos y proceder al análisis de minimización de costes.
Material y Métodos
Diseño y población de estudio
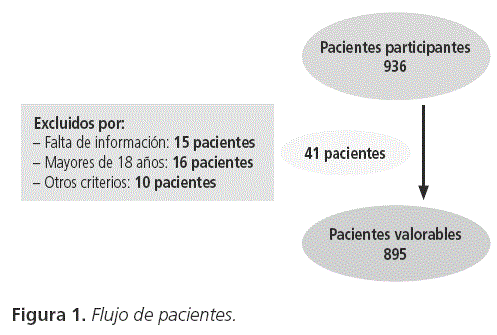
Se realizó un estudio observacional, longitudinal y retrospectivo en una cohorte de 936 pacientes con espasticidad infantil tratados con Botox® o Dysport®, entre diciembre del 1995 y octubre del 2012, en el Servicio de Neurología Pediátrica de un hospital español de primer nivel. Del total de pacientes registrados, 895 fueron pacientes valorables según los criterios de selección (Figura 1): pacientes espásticos menores de 18 años en tratamiento con TBA que tuvieran registradas las principales variables del estudio (fechas de nacimiento, fechas de visita, dosis infiltrada y peso).
Músculos analizados
El análisis se centró en cuatro grupos musculares (proadores redondos, aductores, semitendinosos y tríceps surales) puesto que, además de ser los músculos más frecuentemente infiltrados, la espasticidad de los mismos afecta a la autonomía del paciente, y por lo tanto a su calidad de vida así como la calidad de vida de los cuidadores.
Gravedad de la espasticidad
La gravedad de la espasticidad se recogió en la escala de Ashworth13, escala ordinal con 5 categorías (desde 0: espasticidad nula, hasta 4: espasticidad severa). La espasticidad de cada uno de los músculos analizados se determinó tomando el máximo de la espasticidad de los músculos bilaterales.
Como medida asociada a la gravedad de la espasticidad, y por indicación de los clínicos del estudio, se analizó también el apoyo del pie equino varo medido en una escala ordinal con 5 categorías (desde 1: apoyo equino completo, hasta 5: apoyo inicial del talón).
Dosis infiltradas
Las dosis infiltradas fueron determinadas por el máximo de las dosis infiltradas en los músculos izquierdo y derecho (considerando una dosis=0 si no se realizó infiltración en el músculo lateral). Una vez determinada la dosis, esta se dividió por el peso del paciente en la correspondiente visita, obteniendo la dosis por kilogramo (U/kg) inyectada por paciente.
Costes
El análisis se realizó desde la perspectiva del Sistema Nacional de Salud (SNS) considerando únicamente los costes directos: costes farmacológicos (PVL)14 y costes de visitas15 en euros del año 2016. Los costes unitarios de Botox® y Dysport® corresponden a una media de las diferentes presentaciones (Tabla 1).
Los costes farmacológicos totales anuales de cada TBA según las dosis de práctica clínica real se obtuvieron multiplicando las dosis por kilogramo medias por el coste unitario de las correspondientes presentaciones de la TBA. Al cálculo resultante se le multiplicó el peso medio de los pacientes y el número medio de visitas al año según el tratamiento.
Para el cálculo de los costes anuales por visitas se consideró el número esperado de visitas en un año (de infiltración y de seguimiento) de un paciente. Se aplicó un coste específico para la primera visita, y otro coste para las visitas de seguimiento según los costes de recursos sanitarios publicados15.
Caso base del análisis de minimización de costes
El análisis del caso base se realizó considerando el perfil del paciente cuyo coste fue calculado a partir de las dosis registradas para cada músculo así como los pesos de los pacientes registrados a lo largo del seguimiento. Se realizó un análisis por subgrupos en función del grupo muscular afectado.
Análisis de sensibilidad
Para valorar la influencia de la incertidumbre de las estimaciones obtenidas sobre los resultados del estudio, y evaluar así la robustez de los mismos, se realizaron diversos análisis de sensibilidad modificando las variables principales:
- Se consideró la combinación de viales que más reduce el coste total por dosis administrada.
- Se realizó un análisis de sensibilidad de extremos, asumiendo el escenario con la menor dosis de Botox® y la dosis máxima de Dysport® (Escenario A). Por otro lado, se ha valorado también el escenario considerando la mayor dosis de Botox® y la menor dosis de Dysport® (Escenario B).
- Finalmente se asumió un escenario hipotético con el perfil de un paciente "tipo" cuyo coste fue calculado considerando un peso medio de 22kg y cuatro visitas al año (dos de ellas con infiltración) para los dos grupos de pacientes, y asumiendo infiltración en cada uno de los cuatro grupos musculares con la dosis media observada en la muestra.
Análisis estadístico
Se realizó un análisis descriptivo en el que las variables cuantitativas se analizaron mediante medias y desviaciones estándar (DE), medianas y rangos intercuartílicos (RI), y para las variables categóricas se usaron tablas de frecuencia.
La comparación de los grupos se realizó mediante técnicas no paramétricas (prueba U de Mann-Whitney) para las variables continuas y la prueba chi cuadrado para las variables categóricas.
Para comprobar la efectividad de los tratamientos se llevó a cabo un análisis longitudinal de la gravedad de la espasticidad creándose variables dicotómicas: 1 si la espasticidad del músculo mejoró durante el periodo de tratamiento, 0 en caso contrario. Se ajustaron modelos de regresión logística donde la variable respuesta fue la mejora en la espasticidad, y como variable independiente el tratamiento (Botox®/Dysport®), ajustando por espasticidad inicial y tiempo de seguimiento. La calibración de los modelos se evaluó con el estadístico C de Hosmer-Lemeshow16. En los resultados se muestran las odds-ratio (OR) ajustadas y los respectivos intervalos de confianza (IC).
El nivel de significación estadística se estableció en 0,05 para todos los análisis. Se utilizó la versión 3.2.3 del paquete estadístico R17.
Resultados
Características de los pacientes y visitas
En el presente estudio se analizaron un total de 895 pacientes con espasticidad infantil, 543 fueron tratados únicamente con Botox®, 292 con Dysport® y 60 con ambos tratamientos (en las visitas de infiltración iniciales se trataron con Botox® y al final del seguimiento con Dysport®). Las infiltraciones de los pacientes que recibieron ambos tratamientos se distribuyeron en función del mismo. No se observaron diferencias en la media de edad en la primera visita ni en la media del peso (Tabla 2).
En cuanto al tiempo transcurrido entre visitas se observaron diferencias estadísticamente significativas entre los dos grupos de pacientes, siendo los pacientes tratados con Botox® los que acudieron más a menudo a la consulta (p<0,001). Se siguieron observando diferencias en la frecuencia de visitas entre los pacientes tratados con Dysport® y Botox® cuando se consideraron únicamente las visitas con infiltración (p<0,01) (Tabla 2).
No se observaron diferencias en la espasticidad inicial de los pacientes de ambos grupos en ningún músculo, excepto para los tríceps surales (test chi cuadrado, valor p = 0,01). Tampoco se observaron diferencias en la gravedad del pie equino.
Efectividad de los tratamientos
El análisis longitudinal con las medidas inicial y final de espasticidad mostró una tendencia no significativa a favor de Dysport® frente a Botox®. También se observó una tendencia no significativa a favor de Dysport® en el pie equino (Tabla 2).
Dosis infiltradas
Se calcularon las dosis medias infiltradas a los pacientes del estudio para los cuatro músculos analizados y por TBA (Tabla 3). Debemos entender estas dosis medias como dosis administradas en cada infiltración, y no por visita. Para el análisis de costes del caso base resultó conveniente disponer de las dosis medias infiltradas en cada visita en cualquiera de los músculos. En ese caso las medias obtenidas fueron de 5,44 U/kg (2,17) para las infiltraciones con Botox® y de 14,73 U/kg (5,26) para las infiltraciones con Dysport® (Tabla 3).
Costes
El coste farmacológico medio por paciente y año fue de 480,00€ para Botox® y de 287,36€ para Dysport®, lo que supone un ahorro anual a favor de Dysport® de 192,64€ en el coste farmacológico, en el supuesto que no se desaprovecha ninguna fracción de los viales de TBA (Tabla 3). El coste anual por visitas de un paciente fue de 359,56€ para Botox® y de 343,87€ para Dysport®. El coste directo anual total que se obtuvo fue de 839,56€ para Botox® y de 631,23€ para Dysport®, lo que supone una diferencia de 208,34€ al año a favor del tratamiento con Dysport® (Figura 2).
El análisis estratificado por grupo muscular reveló que el ahorro farmacológico anual se mantiene a favor de Dysport® para los cuatro músculos: desde 58,03€ en el caso de infiltraciones en los pronadores redondos, hasta 164,15€ si los músculos infiltrados fuesen los tríceps surales (Tabla 3). Este resultado muestra que el tratamiento para cualquier combinación de los cuatro grupos musculares siempre será más económico con Dysport®.
Análisis de sensibilidad
Si se tiene en cuenta que la parte no infiltrada del contenido de los viales se desecha, el ahorro anual farmacológico a favor de Dysport® sería de 59,60€ (Tabla 3). Al tener en cuenta tanto el coste farmacológico como el coste del seguimiento de paciente, el ahorro anual seguiría siendo a favor de Dysport® en 75,29€.
En el análisis del escenario A (favorable a Botox®) se obtuvo un ahorro farmacológico potencial de 158,29€ por paciente y año a favor de Dysport®. En el escenario B (favorable a Dysport®) el ahorro farmacológico se elevó hasta 227,60€ por paciente y año a favor de Dysport® (Tabla 3). En vista que los resultados en ambos escenarios no cambian las conclusiones del análisis principal, no fue necesario realizar un análisis de sensibilidad probabilístico.
Finalmente, si se considera el perfil de paciente "tipo", el ahorro potencial farmacológico con Dysport® sería de 295,15€ por paciente y año (Tabla 3 y Figura 2) y el coste directo anual sería 1.015,88€ para Botox® y de 720,73€ para Dysport®.
Discusión
Este estudio ha utilizado registros de pacientes en la vida real, tratados de espasticidad infantil en el Servicio de Neuropediatría de un hospital español de primer nivel, para realizar un análisis de minimización de costes desde la perspectiva del SNS. Se ha estimado que el ahorro potencial por paciente y año que se puede alcanzar sería de 208,34€, si el tratamiento de la espasticidad infantil se llevase a cabo en su totalidad con Dysport®en lugar de tratar con Botox®. Además, se ha mostrado que el tratamiento con Dysport® de la espasticidad de cualquier combinación de los grupos musculares estudiados supondría un ahorro para el pagador. Los análisis de sensibilidad han mostrado que, aun variando los parámetros de entrada del análisis, la diferencia en costes seguiría siendo favorable a Dysport®.
Tapias et al. realizaron un análisis de impacto presupuestario basado en datos de prevalencia extrapolados con un horizonte temporal de 3 años (2012-2014) para analizar la repercusión en el presupuesto del SNS de un incremento en la utilización de Dysport® frente a Botox®y Xeomin®11. Sin embargo, esta evaluación se realizó asumiendo la posología recomendada para cada indicación según ficha técnica de los productos. En otro estudio, los autores estimaron el coste del tratamiento por paciente con TBA en las indicaciones que presentan en común los tres medicamentos disponibles en España12. Para la espasticidad infantil, para la que sólo están indicados Botox® y Dysport®, los autores concluyeron que el uso de Botox® supondría un ahorro anual por paciente del 10%-40% basándose en las dosis infiltradas recomendadas en las fichas técnicas12. El presente estudio, con dosis observadas en práctica clínica real, muestra que tales ahorros no los proporcionaría el uso de Botox®, sino el de Dysport®, alcanzando ahorros por paciente y año del 40% en el coste farmacológico, y del 25% en los costes directos totales por paciente y año. En el escenario de no aprovechamiento del vial, los ahorros se reducen -debido a la mayor diversidad en las presentaciones de Botox®- pero siguen siendo a favor del uso de Dysport®: 11% de ahorro en el coste farmacológico por paciente y año; 8% de ahorro en los costes directos totales por paciente y año. Tales resultados ponen de manifiesto la utilidad que supone disponer de información real del tratamiento en práctica clínica, ya que las dosis recomendadas en fichas técnicas distan notablemente de las realmente administradas en la práctica clínica habitual. Así pues, dentro del paradigma clínico habitual en la clínica asistencial, las dosis aplicadas en cada músculo inicialmente fueron las recomendadas en las guías y consensos. La siguiente dosis aplicada en cada musculo se ajustó en función del resultado observado en la infiltración anterior y de si hubo o no efectos adversos, siempre sin exceder las dosis totales recomendadas1,3.
Hay diversos estudios en los que se muestra que ambos tratamientos son muy similares en efectividad y seguridad18-23 siempre que se administren de manera apropiada23-26. Ahora bien, debido a que la concentración de TBA no es la misma en ambas presentaciones27, las toxinas no son comparables. Además, las técnicas de dilución e inyección alteran aún más estas desigualdades. Las dosis también varían considerablemente dependiendo de la preparación particular utilizada, el músculo inyectado, la gravedad de la enfermedad, y la duración del tratamiento28.
La principal aportación del presente estudio es que la fuente de datos es un registro real de pacientes españoles con espasticidad infantil. Por tanto, los resultados corresponden a la práctica clínica real del tratamiento de la espasticidad con TBA.
El análisis de costes realizado presenta limitaciones. Una de ellas es la falta de validez externa de los resultados. Precisamente por el hecho que los pacientes corresponden a aquellos que han sido tratados y seguidos en el Servicio de Neuropediatría de un único centro, estos pueden no ser representativos de la población infantil afectada por espasticidad. Para superar esta limitación es necesario realizar estudios controlados más amplios (multicéntricos internacionales). Sin embargo, tanto los supuestos conservadores, como todos los análisis de sensibilidad realizados señalan que la utilización de Dysport® es beneficiosa al SNS a igualdad de efectividad.
Otra limitación es consecuencia del propio protocolo de tratamiento de la espasticidad con TBA. Las dosis administradas dependen no sólo de la gravedad de la espasticidad, sino también de la evolución de la misma y de las dosis administradas anteriormente. Aunque no se han observado diferencias en la efectividad durante todo el periodo de seguimiento, podría ser que la espasticidad presentara diferentes patrones de evolución desde el primer al último registro. Un análisis longitudinal más profundo, en el que se tuviesen en cuenta todas las medidas de espasticidad, sería conveniente para describir los diferentes perfiles de evolución de la gravedad de la espasticidad y de las dosis de TBA administradas.
Si bien el diseño retrospectivo pudiera implicar un riesgo de selección de uno u otro producto, las indicaciones del tratamiento y la elección de la toxina botulínica han sido las mismas para ambos productos comerciales para cualquier indicación de espasticidad, sin preferencia por una u otra por razones de gravedad de espasticidad o de localización de la misma. El mayor número de casos tratados con Botox® se debe a que se comercializó en España años antes que Dysport®. Pensamos que el gran número de infiltraciones de uno y otro producto disminuye el peso del posible sesgo que, de haberlo, sería involuntario.
Vale la pena clarificar que no se tuvo en cuenta medicación concomitante puesto que muy pocos pacientes recibieron medicación oral antiespástica. En la infancia se emplean sólo en tetraplejias espásticas graves, a dosis bajas, ya que produce habitualmente efectos adversos -especialmente sedación- que limitan la escalada de dosis. Por este motivo no se registró este dato que no modifica el análisis.
Una cuarta limitación que presentan los datos es la escala de gravedad espástica registrada. La escala de Ashworth se puede utilizar como una medida de nivel ordinal de la resistencia al movimiento pasivo, pero presenta ciertas limitaciones como escala de medida de la espasticidad29. Como se apunta en el estudio de Bakheit et al.30, por regla general, los clínicos están destinados a evaluar la efectividad del tratamiento con escalas del nivel de deterioro, y las medidas de respuesta funcional raramente se utilizan en la práctica clínica. Concluye que debe fomentarse el uso de esas medidas para evaluar si la reducción del tono muscular se traduce en un beneficio funcional para los pacientes y sus cuidadores30.
Una quinta limitación podría surgir por el hecho de haber asumido que no hay pérdida de TBA durante las sesiones de tratamiento. Debido a la variabilidad en las dosis y a que las presentaciones de TBA están fijadas, aunque haya disponibilidad de varias presentaciones, es lógico pensar que hay que desechar parte del contenido del vial. Además, la TBA sólo debe utilizarse para el tratamiento de un solo paciente, durante una sola sesión, y cualquier cantidad de producto restante no utilizado debe ser inactivado8,9. Para poder tener en cuenta la posible merma de TBA durante la práctica clínica se deberían tener registrados los viales que se han utilizado durante el periodo de estudio, pero no se dispone de esa información. Para superar esta limitación, se ha llevado a cabo un análisis en el escenario de merma de TBA.
Este estudio proporciona los primeros datos de la práctica clínica real en los patrones de tratamiento y consumo de recursos en pacientes con espasticidad infantil en un centro de España. Se ha mostrado que el coste del tratamiento con Dysport® por paciente y año resulta más económico. El ahorro potencial en el coste farmacológico anual es de aproximadamente 193€ por paciente. Los resultados pertenecen a las dosis en práctica clínica de un centro hospitalario y en pacientes pediátricos, por lo tanto deben tomarse con cautela en posibles extrapolaciones al conjunto de la población. Es necesario realizar estudios controlados más amplios para comparar la efectividad de los diferentes tratamientos con TBA y otros tratamientos focales, con especial atención a la evaluación individual, los beneficios funcionales, así como su duración, posibles cotratamientos y post-tratamientos, los efectos secundarios y el coste-efectividad.
Contribución de los autores
Gloria Tapias desarrolló la idea del proyecto que incluye este estudio. El Dr. Pascual-Pascual facilitó el registro de los datos anonimizado que posibilitó el análisis de las dosis. Carlos Crespo, Maribel Cuesta y Carles Forné realizaron el análisis estadístico y de costes. La Dra. García-Romero participó en la redacción del manuscrito. Todos los autores leyeron y aprobaron la versión final del manuscrito.
Agradecimientos
Los autores agradecen a Gemma Lairisa, Lina Ruiz y Eduardo Belenguer de Ipsen Pharma su contribución en la revisión del manuscrito.
Conflicto de intereses
El Dr. Pascual-Pascual ha recibido honorarios de Allergan y de Ipsen Pharma por conferencias y cursos de formación. La Dra. García-Romero declara no tener conflicto de interés en relación con este artículo. Gloria Tapias trabaja para Ipsen Pharma que es la empresa promotora del estudio. Carles Forné y Maribel Cuesta trabajan para la consultora Oblikue Consulting, que recibió una subvención de Ipsen Pharma para la realización del estudio. Carlos Crespo trabajó en Oblikue Consulting en el momento de ejecución del análisis estadístico y de costes.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: gloria.tapias@ipsen.com
(Gloria Tapias).
Recibido el 4 de diciembre de 2015;
aceptado el 10 de mayo de 2016.
Bibliografía
1. Pascual-Pascual SI, Herrera-Galante A, Póo P, García-Aymerich V, Aguilar-Barberá M, Bori-Fortuny I, et al. Guía terapéutica de la espasticidad infantil con toxina botulínica. Rev Neurol. 2007;44(5):303-9. [ Links ]
2. Merello M. Fisiopatología, clínica y tratamiento de la espasticidad. Arch Neurol Neuroc Neuropsiq. 2008;7(2):29-62. [ Links ]
3. Heinen F, Desloovere K, Schroeder AS, Berweck S, Borggraefe I, van Campenhout A, et al. The updated European Consensus 2009 on the use of Botulinum toxin for children with cerebral palsy. Eur J Paediatr Neurol. 2010;14(1):45-66. [ Links ]
4. Strobl W, Theologis T, Brunner R, Kocer S, Viehweger E, Pascual-Pascual I, et al. Best clinical practice in botulinum toxin treatment for children with cerebral palsy. Toxins (Basel). 2015;7(5):1629-48. [ Links ]
5. Rosales RL, Chua-Yap AS. Evidence-based systematic review on the efficacy and safety of botulinum toxinA therapy in post-stroke spasticity. J Neural Transm. 2008;115(4):617-23. [ Links ]
6. Mense S. Neurobiological basis for the use of botulinum toxin in pain therapy. J Neurol. 2004;251 Suppl 1:I1-7. [ Links ]
7. Peng Chen Z, Morris JG, Rodriguez RL, Shukla AW, Tapia-Núñez J, Okun MS. Emerging Opportunities for Serotypes of Botulinum Neurotoxins. Toxins (Basel). 2012;4:1196-1222. [ Links ]
8. Ficha Técnica de Dysport®. Ministerio de Sanidad, Servicios Sociales e Igualdad. Agencia española de medicamentos y productos sanitarios (Internet). Disponible en: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=buscar (Acceso en febrero de 2014). [ Links ]
9. Ficha técnica de Botox®. Ministerio de Sanidad, Servicios Sociales e Igualdad. Agencia española de Medicamentos y productos sanitarios (Internet).Disponible en: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=buscar (Acceso en febrero de 2014). [ Links ]
10. Ficha Técnica de Xeomin®. Ministerio de Sanidad, Servicios Sociales e Igualdad. Agencia española De medicamentos y productos sanitarios (Internet). Disponible en: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=buscar (Acceso en febrero de 2014). [ Links ]
11. Tapias G, Ilgrande A, Espinós B. Análisis de impacto presupuestario del uso de la toxina botulínica tipo A (TBA) en el Sistema Nacional de Salud en España. Pharmacoecon Span Res Artic. 2013;10(4):119-129. [ Links ]
12. de Andrés-Nogales F, Morell A, Aracil J, Torres C, Oyagüez I, Casado MA. Análisis de costes del uso de toxina botulínica A en España. Farm Hosp. 2014;38(3):193-201. [ Links ]
13. Ashworth B. Preliminary trial of carisoprodal in multiple sclerosis. Practitioner. 1964 Apr;192:540-2. [ Links ]
14. Consejo General del Colegio Oficial de Farmacéuticos. Base de datos del medicamento (Base de Datos en Internet). www.botplusweb.portalfarma.com. 2014. Disponible en: https://botplusweb.portalfarma.com/ (Acceso en marzo de 2016). [ Links ]
15. Gisbert R, Brosa M. Base de datos de costes sanitarios Español: eSalud. (Base de datos en Internet). Disponible en: http://www.oblikue.com/bddcostes/ (Acceso en marzo de 2016). [ Links ]
16. Hosmer DW, Lemeshow S. Applied logistic regression (2nd ed). Wiley, New York, NY, 2000. [ Links ]
17. R Core Team. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing. Vienna, Austria. 2015. Disponible en: http://www.R-project.org/. [ Links ]
18. Pascual-Pascual SI, Pascual-Castroviejo I. Safety of botulinum toxin type A in children younger than 2 years. Eur J Paediatr Neurol. 2009;13(6):511-5. [ Links ]
19. Gaber TA, Basu B, Shakespeare D, Singh R, Salam S, McFarlane J. Botulinum Toxin in the management of hitchhiker's toe. NeuroRehabilitation. 2011;28(4):395-9. [ Links ]
20. Mohammadi B, Balouch SA, Dengler R, Kollewe K. Long-term treatment of spasticity with botulinum toxin type A: an analysis of 1221 treatments in 137 patients. Neurol Res. 2010;32(3):309-13. [ Links ]
21. Sobolewski P. The application of botulinum toxin type A in the treatment of spastic paraparesis. Przegl Lek. 2007;64 Suppl 2:3-7. [ Links ]
22. Sheean G. Botulinum toxin treatment of adult spasticity: a benefit-risk assessment. Drug Saf. 2006;29(1):31-48. [ Links ]
23. Slawek J, Bogucki A, Reclawowicz D. Botulinum toxin type A for upper limb spasticity following stroke: an open-label study with individualised, flexible injection regimens. Neurol Sci. 2005;26(1):32-9. [ Links ]
24. Ravenni R, De Grandis D, Mazza A. Conversion ratio between Dysport and Botox in clinical practice: an overview of available evidence. Neurol Sci. 2013; 34(7):1043-8. [ Links ]
25. Wissel J, Entner T. Botulinum toxin treatment of hip adductor spasticity in multiple sclerosis. Wien Klin Wochenschr. 2001;113 Suppl 4:20-4. [ Links ]
26. Stawek J, Car H, Bonikowski M, Bogucki A, Koziorowski D, Potulska-Chromik A, et al. Are botulinum toxin type A preparations really the same medication? A comparison of three botulinum toxin A for variations in labelled neurological indications. Neurol Neurochir Pol. 2010;44(1):43-64. [ Links ]
27. Frevert J. Content of Botulinum Neurotoxin in Botox®/Vistabel®, Dysport®/Azzalure®, and Xeomin®/Bocouture®. Drugs R D. 2010;10(2):67-73. [ Links ]
28. Baba Y, Osborne MD, Wszolek ZK, Kwolek A, Druzbicki M. Treatment of spasticity with botulinum toxin. Ortop Traumatol Rehabil. 2004;6(5):665-72. [ Links ]
29. Pandyan AD, Johnson GR, Price CI, Curless RH, Barnes MP, Rodgers H. A review of the properties and limitations of the Ashworth and modified Ashworth Scales as measures of spasticity. Clin Rehabil. 1999;13(5):373-83. [ Links ]
30. Bakheit AM, Zakine B, Maisonobe P, Aymard C, Fhedoroff K, Hefter H, et al. The profile of patients and current practice of treatment of upper limb muscle spasticity with botulinum toxin type A: an international survey. Int J Rehabil Res. 2010;33(3):199-204. [ Links ]











 text in
text in