My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.41 n.3 Toledo May./Jun. 2017
https://dx.doi.org/10.7399/fh.2017.41.3.10691
Originales
Utilización de medicamentos fuera de ficha técnica y sin licencia en una Unidad de Cuidados Intensivos Neonatales española
1Pharmacy Department. Hospital Clínico Universitario Virgen de la Arrixaca, Murcia. Spain.
Aportación a la literatura científica
Aunque el uso de fármacos fuera de ficha técnica y sin licencia es muy habitual en pediatría en general, y en las unidades de cuidados intensivos neonatales en particular, se presenta el primer trabajo que recoge por separado la realidad en una Unidad de Cuidados Intensivos Neonatales española desde el cambio de legislación en 2009.
Nuestros resultados confirman los obtenidos en otros países de nuestro entorno, y evidencian la necesidad de que las Comisiones de Farmacia y Terapéutica protocolicen el uso de este tipo de fármacos en estas unidades en las que su uso es urgente y forman parte de la práctica habitual.
Introducción
Los niños hospitalizados están expuestos a muchos tipos de medicamentos1. Sin embargo, muchos de éstos se utilizan frecuentemente en condiciones diferentes a las autorizadas en la ficha técnica (FT) o incluso no disponen de ella2,3,4. Ya en 1998, Turner definió el uso Fuera de Ficha Técnica (FFT) como la utilización de los medicamentos autorizados fuera de los términos de su licencia del producto o de la autorización de comercialización en lo que respecta a la dosis, la indicación, la edad y la vía de administración, y los fármacos sin licencia como los medicamentos sin autorización de comercialización5. La prescripción FFT no fue una preocupación seria en Pediatría hasta que la evidencia comenzó a demostrar que la respuesta fisiológica de los niños a muchos fármacos difiere significativamente de la de los adultos. Actualmente, la información específica en la población pediátrica acerca de la dosis óptima, la farmacocinética, y las posibles reacciones adversas de muchos fármacos sigue siendo insuficiente. Éste es, probablemente, el resultado de la falta de ensayos clínicos controlados en la población pediátrica y la consiguiente escasez de datos cuantitativos y cualitativos. Además, hay varias razones subyacentes: los problemas éticos, la desconfianza de los padres, el bajo interés de la industria farmacéutica (bajos beneficios y dificultades en el desarrollo de las formulaciones pediátricas) y la escasa financiación de las autoridades gubernamentales6. En ausencia de datos específicos extraídos de ensayos clínicos en niños, los pediatras sólo pueden basarse en los resultados de estudios realizados en adultos, a pesar de que los niños tienen un metabolismo diferente. Esto implica, que la respuesta a los fármacos es casi siempre impredecible7. Este problema se ve incrementado por la falta de fórmulas comercializadas (jarabes, soluciones o suspensiones), que permitan la dosificación fraccionada adecuada al amplio intervalo de dosificación propio de esta población, especialmente de los neonatos, que es el subgrupo que más se ve afectado por la falta de información técnica y de formulaciones adecuadas8. Esto representa un dilema ético para el clínico, que tiene que prescribir un medicamento sin suficientes datos de seguridad o incluso evitar su uso, privando al niño de los posibles beneficios terapéuticos que a veces pueden ser vitales para tratar su patología. Los riesgos se incrementan en los recién nacidos debido a su inmadurez fisiológica, siendo mayores en las Unidades de Cuidados Intensivos Neonatales (UCIN) por varias razones: múltiples prescripciones, enfermedades graves en prematuros muy inmaduros, bajo peso al nacer y avances tecnológicos que han permitido la supervivencia de bebés muy prematuros, con semanas de gestación anteriormente incompatibles con la vida.
En España, el proceso de autorización de medicamentos en condiciones FFT debe seguir las directrices del RD 1015/2009 de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales9 y del RD 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones10. Este último RD traslada la responsabilidad para autorizar la prescripción de un medicamento para su utilización en condiciones diferentes a las establecidas en su ficha técnica a la Comisión responsable de los protocolos terapéuticos u órgano colegiado equivalente de cada Comunidad Autónoma11. Sin embargo, lo anteriormente expuesto resulta inviable en pacientes ingresados en unidades como las UCIN, en las que la administración de medicamentos es urgente y la prescripción FFT forma parte de la práctica habitual.
El objetivo de este estudio fue describir el perfil de utilización de medicamentos FFT y sin licencia en los recién nacidos en la UCIN de un hospital español de tercer nivel.
Métodos
Se diseñó un estudio observacional, descriptivo y retrospectivo de tres meses de duración que se llevó a cabo en la UCIN de un hospital público de tercer nivel. Se incluyeron en este estudio todos los pacientes ingresados en esta unidad entre el 9 de noviembre de 2015 y el 9 de febrero de 2016 que recibieron algún tratamiento médico. Se excluyeron del análisis las prescripciones de sueros cristaloides, los sueros expansores del plasma (excepto albúmina), la nutrición parenteral, los antisépticos y las heparinas utilizadas para evitar la obstrucción del catéter. Los recién nacidos se dividieron en dos grupos: prematuros (edad gestacional < 37 semanas) y recién nacidos a término (edad gestacional ≥ 37 semanas). De cada niño se registraron la edad cronológica, la edad gestacional, el peso y todas las prescripciones realizadas durante su ingreso en la UCIN. De cada tratamiento se registró el fármaco prescrito, la presentación, la vía de administración, la dosis, la frecuencia, la duración y la indicación de la prescripción. Se analizaron todas las prescripciones tomando como referencia la FT oficial de cada medicamento aprobada por la Agencia Española de Medicamentos y Productos Sanitarios, clasificándose éstas en tres grupos siguiendo los criterios publicados por Turner5: prescripciones según FT, prescripciones FFT y prescripciones sin licencia. Como prescripciones sin licencia se consideraron las de los medicamentos no autorizados por la Dirección General de Farmacia y Productos Sanitarios, que incluyen las de los medicamentos extranjeros y las de las fórmulas magistrales, bien elaboradas en el Servicio de Farmacia o adquiridas de empresas externas. Además, las prescripciones FFT se clasificaron según la razón por la que no se ajustaban a la FT en cuatro grupos: dosis diferente a la aprobada, frecuencia diferente a la descrita, edad diferente a la aprobada o contraindicada, e indicación diferente a la aprobada. Los fármacos prescritos también se analizaron según el Sistema de Clasificación Anatómica, Terapéutica y Química (ATC) establecido por la Organización Mundial de la Salud12.
Durante el transcurso del estudio todos los documentos relacionados con el mismo estuvieron custodiados de manera segura y confidencial, siguiendo la Ley de protección de datos. Al tratarse de un estudio observacional y retrospectivo, y no existir ningún tipo de intervención sobre el paciente, no se consideró necesario solicitar el consentimiento informado ni su evaluación por el Comité Ético de Investigación Clínica.
Resultados
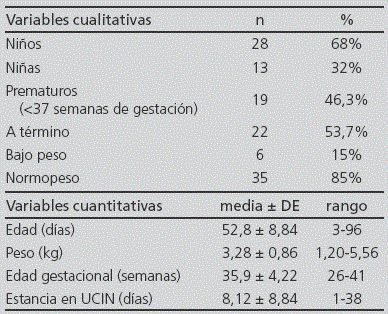
Durante los tres meses del estudio se incluyeron 41 recién nacidos, el 46,3% de ellos prematuros (Tabla 1). Se realizaron 273 prescripciones (media de 6,65 ± 3,28 por paciente) de 48 fármacos diferentes. De ellas, el 53,1% (145) se prescribieron según FT, el 41,4% (113) se prescribieron FFT y el 5,5% (15) fueron prescripciones de medicamentos sin licencia en España (Figura 1). El 90,2% de los pacientes (37/41) recibió al menos un tratamiento FFT, con una media de 3 prescripciones FFT por paciente (rango 1-7). En el 42,5% de los casos la razón por la cual se consideró el fármaco FFT fue la edad de los pacientes, en el 31,0% fue la dosis prescrita, en el 16,8% la frecuencia, en el 8,8% dosis y frecuencia y sólo en el 0,9% el motivo de prescripción FFT fue la indicación. Los fármacos con más prescripciones FFT fueron ampicilina (18,6%) y gentamicina (16,8%) (Tabla 2). El grupo terapéutico según el código ATC con más prescripciones FFT fue el J (Antiinfecciosos para uso sistémico) con más del 50% de las prescripciones de este tipo (ver Figura 2). No se encontraron diferencias estadísticamente significativas en la tasa de prescripción FFT entre los recién nacidos a término y los prematuros.
En cuanto a las prescripciones de fármacos sin licencia, la que más se repitió fue la de cafeína citrato para el tratamiento del síndrome apneico del prematuro (Tabla 3). Todos los medicamentos sin licencia fueron fórmulas magistrales, no registrándose ningún medicamento extranjero durante el periodo de estudio.
Discusión
A pesar de la limitación de ser un estudio unicéntrico, el nuestro es el único realizado exclusivamente en una UCIN española en los últimos 10 años, y el primero desde el cambio de legislación de 2009. Se dispone de otro estudio similar realizado en el Hospital Vall d´Hebron13 en 2003 y de una reciente publicación que incluyó pacientes ingresados en las UCI neonatales y pediátricas del Hospital Universitario San Cecilio de Granada14. Otro estudio piloto realizado en el Hospital Gregorio Marañón (GM), incluyó pacientes ingresados únicamente en la UCI pediátrica15. Además, se han publicado varias series en UCIN y unidades de neonatología de otros países. En nuestro estudio el 41,4% de las prescripciones se consideraron FFT. Este porcentaje es ligeramente inferior al registrado en otras series de pacientes ingresados en UCI neonatales, como el 65% publicado en Estonia16, el 62% en Francia17, el 55% en Reino Unido6, el 50% en Italia3 o el 47% en Australia18. El estudio realizado en Vall d`Hebron en 2003, muestra una tasa de prescripción FFT del 50%, similar al de los estudios de los Hospitales San Cecilio y GM, ambos publicados en 2016, con tasas del 52% y 53,9% respectivamente y al de nuestro propio estudio (41,4%), por lo que parece que la situación ha cambiado muy poco en la última década. En el estudio del Hospital San Cecilio, que incluyó niños de hasta 14 años, la razón principal para que las prescripciones se consideraran FFT fue la dosis prescrita y en el realizado en el Hospital GM (donde el rango de edad llegaba hasta los 18 años) el principal motivo de uso FFT fue la indicación. En nuestro caso, al incluir únicamente pacientes recién nacidos, fue la edad la principal razón por la cual las prescripciones se consideraron FFT. Estos resultados coinciden con los trabajos publicados en Francia, Italia y Turquía en los que sólo se incluyeron pacientes de UCIN.
En nuestro estudio el grupo terapéutico con más prescripciones FFT fue el de los antiinfecciosos para uso sistémico. La ampicilina, que fue el antibiótico más prescrito FFT, sólo tiene indicación aprobada para mayores de un año. Sin embargo, las guías de práctica clínica pediátrica recomiendan su utilización en recién nacidos, tanto en profilaxis como en tratamiento19. Diferente es el caso de la gentamicina que, aunque si presenta indicación aprobada en recién nacidos, debe ser administrada según su FT con un intervalo de ocho horas; sin embargo en nuestro hospital se administró cada 24 horas en recién nacidos a término, cada 36 horas en prematuros entre 32-36 semanas de gestación y cada 48 horas en los pacientes muy prematuros (<32 semanas), con control farmacocinético en algunos de estos casos. Estos cambios de frecuencia también están avalados y protocolizados en las guías de práctica clínica pediátricas20. En los estudios realizados en otros centros, los antiinfecciosos también son los fármacos más prescritos FFT, aunque existen diferencias en los antibióticos empleados (bencilpenicilina, amikacina, tobramicina, meropenem, piperacilina/ tazobactam, cefotaxima y vancomicina)3,6,13,21,22. Esta heterogenicidad en el uso de los antibióticos indica que los tratamientos empíricos con estos fármacos varían entre países e incluso entre las UCIN de una misma nación. Este hallazgo no sorprende, puesto que no existe consenso basado en ensayos clínicos a favor de un tratamiento antibiótico particular para la profilaxis y el tratamiento de la sepsis neonatal. Consecuentemente, la elección de los antibióticos depende de la experiencia de los diferentes facultativos y de la política antibiótica hospitalaria, más que de los estudios clínicos comparativos.
En cuanto a los fármacos sin licencia, éstos son necesarios cuando no existen formulaciones adecuadas para la administración de una dosis neonatal o pediátrica. Una de las formas de conseguir estas formulaciones es a través de las fórmulas magistrales. Estas preparaciones pueden ser elaboradas en los Servicios de Farmacia de los Hospitales o encargadas a empresas externas acreditadas para ello. En nuestro estudio, el fármaco sin licencia más frecuentemente prescrito fue el citrato de cafeína que, aunque ya se encuentra comercializado en España, se sigue utilizando como fórmula magistral en nuestro hospital por razones de eficiencia. Su principal indicación en neonatos es aliviar el síndrome de la apnea del prematuro. A la cafeína se le ha atribuido un efecto antagonista de los receptores de la adenosina, con efectos estimulantes del Sistema Nervioso Central, y específicamente se le atribuyen propiedades de estimulación del centro respiratorio, aumento de la ventilación, disminución del umbral hasta la hipercapnia, aumento de la respuesta a la hipercapnia, aumento del tono del músculo esquelético, descenso de la fatiga del diafragma, aumento del metabolismo y elevación del consumo de oxígeno. El uso del citrato de cafeína como fórmula magistral, ha sido habitual durante muchos años, y se ha mantenido por razones de eficiencia, a pesar de la comercialización de una especialidad farmacéutica registrada. En nuestro estudio también ha resultado inferior el porcentaje de fármacos sin licencia (5,5%) en relación al publicado en otras series: 10% en Reino Unido6 y en Francia17, 11% en Australia18, 12% en Italia3 y 22% en Estonia16. Estos porcentajes están influenciados también por la tradición de cada país en la elaboración de fórmulas magistrales. Así, en un estudio holandés de 2001 se registró una tasa del 41% de tratamientos sin licencia elaborados por la farmacia del hospital para pacientes de la UCIN7. En el Hospital Vall d´Hebron la tasa de prescripción sin licencia también fue superior a la nuestra, registrando un 13%. En cambio, en los estudios más recientes, las tasas registradas han sido ligeramente inferiores. Así, encontramos porcentajes del 8,6% en el estudio llevado a cabo en el Hospital GM y del 5% en el trabajo del Hospital San Cecilio, tasa similar a la nuestra. Este descenso en la frecuencia de uso de fármacos sin licencia desde 2003 puede ser indicativo de que ha aumentado la cantidad de presentaciones comerciales disponibles adaptadas a las dosis pediátricas.
Por otro lado, desde el punto de vista legal, en España el uso de medicamentos en condiciones FFT precisa de una autorización previa por las Comisiones de Farmacia y Terapéutica de las Comunidades Autónomas. Sin embargo, como se demuestra en nuestro estudio, la prescripción FFT en las UCIN es muy habitual y casi siempre urgente, ya que se trata de pacientes críticos, lo que hace inviable su autorización previa de manera individualizada. Por ello, sería conveniente tratar de protocolizar el uso FFT en las situaciones que se repiten con más asiduidad, como por ejemplo el tratamiento y la profilaxis antibiótica de la sepsis del recién nacido.
A nivel mundial, tanto la Agencia Europea de Medicamentos (EMA) como la Agencia Americana (FDA) han impulsado diversas medidas para incentivar la realización de ensayos clínicos en pediatría aunque, de momento, los resultados de estas iniciativas no parecen haberse reflejado en la actualización de las fichas técnicas y su adecuación a los pacientes críticos recién nacidos.
References
Kumar , Praveen et al. Medication Use in the Neonatal Intensive Care Unit: Current Patterns and Off-Label Use of Parenteral Medications. The Journal of Pediatrics. 2008;152(3): 412-5. [ Links ]
Lindell-Osuagwu L, Korhonen MJ, Saano S, Helin-Tanninen M, Naaranlahti T, Kokki H. Off-label and unlicensed drug prescribing in three paediatric wards in Finland and review of the international literature. J Clin Pharm Ther. 2009; 34(3): 277-87. [ Links ]
Dell’Aera M, Gasbarro AR, Padovano M, Laforgia N, Capodiferro D, Solarino B, et al. Unlicensed and off-label use of medicines at a neonatology clinic in Italy. Pharm World Sci. 2007; 29(4): 361-7. [ Links ]
Dessi A,Salemi C,Fanos V,Cuzzolin L. Drug treatments in a neonatal setting: focus on the off-label use in the first month of life. Pharm World Sci. 2010; 32: 120-4. [ Links ]
Turner S, Longworth A, Nunn AJ, Choonara I. Unlicensed and off-label drug use in paediatric wards: prospective study. BMJ. 1998; 316: 343-5. [ Links ]
Conroy S, McIntyre J, Choonara I. Unlicensed and off-label drug use in neonates. Arch Dis Child Fetal Neonatal. 1999; 80: F142-5. [ Links ]
‘t Jong GW, Vulto AG, de Hoog M, Schimmel KJ, Tibboel D, van den Anker JN. A survey of the use of off-label and unlicensed drugs in a Dutch children’s hospital. Pediatrics. 2001; 108: 1089-93. [ Links ]
Nahata MC. Lack of pediatricdrugformulations. Pediatrics. 1999; 104: 607-9. [ Links ]
Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. Boletin Oficial del Estado, no 174, (20 de julio de 2009). [ Links ]
Real Decreto-Ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones. Boletin Oficial del Estado, no 98 (24 de abril de 2012). [ Links ]
Arocas Casan V, Mateo Carmona J, Garcia Molina O, Fernandez de Palencia Espinosa MA, Blazquez Alvarez MJ, De la Rubia Nieto MA, et al. Prescripcion hospitalaria de medicamentos fuera de ficha tecnica. FarmHosp. 2016; 40(2): 63-78. [ Links ]
WHO Collaborating Centre forDrugStatisticsMethodology. ATC/DDD Index 2016.Oslo: Norwegian Institute of Public Health; (16/12/2015; 26/8/2016). Disponibleen: http://www.whocc.no/atcddd/ [ Links ]
Lopez Martinez R, Cabanas Poy MJ, Oliveras Arenas M, Clemente Bautista S. Utilizacion de medicamentos en una UCI neonatal: estudio prospectivo. FarmHosp. 2005; 29(1): 26-9. [ Links ]
Blanco-Reina E, Medina-Claros AF, Vega-Jimenez MA, Ocana-Riola R, Marquez-Romero EI y Ruiz-Extremera A. Utilizacion de fármacos en ninos en cuidados intensivos: estudio de las prescripciones off-label. Med Intensiva. 2016; 40(1): 1-8. [ Links ]
Garcia Lopez I, Fuentes-Rios JE, Manrique-Rodriguez S, M. Fernandez-Llamazares C. Utilizacion de medicamentos en condiciones off label y unlicensed: resultados de un estudio piloto realizado en una unidad de cuidados intensivos pediatricos. Anpediatr (Barc). 2017; 86(1): 28-36. [ Links ]
Lass J, Kaar R, Jogi K, Varendi H, Metsvanht T, Lutsar I. Drugutilizationpattern and off-label use of medicines in Estonian neonatal units. Eur J ClinPharmacol. 2011; 67: 1263-71. [ Links ]
Avenel S, Bomkratz A, Dassieu G, Janaud JC, Danan C. The incidence of prescriptions without marketing product license in a neonatal intensive care unit. Arch Pediatr. 2000; 7: 143-7. [ Links ]
O’Donnell CP, Stone RJ, Morley CJ. Unlicensed and off-label drug use in an Australian neonatal intensive care unit. Pediatrics 2002;110: e52. [ Links ]
Taketomo CK, Hodding JH, Kraus DM. Manuel de prescripcionPediatrica. 15a Ed. Mexico: Intersistemas S.A.; 2008. [ Links ]
Rylance G. British National Formulary for chidren. BMJ Publising Group Ltd; 2006. [ Links ]
Neubert A, Lukas K, Leis T, Dormann H, Brune K, Rascher W. Drug utilization on a preterm and neonatal intensive care unit in Germany: a prospective, cohort-based analysis. Eur J ClinPharmacol. 2010; 66: 87-95. [ Links ]
Kieran EA, O’Callaghan N, O’Donnell C. Unlicensed and off-label drug use in a Irish neonatal intensive care unit: a prospective cohort study. Acta Paediatrica. 2014; 103: 139-42. [ Links ]
Recibido: 24 de Octubre de 2016; Aprobado: 23 de Diciembre de 2016











 text in
text in