My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.42 n.4 Toledo Jul./Aug. 2018
https://dx.doi.org/10.7399/fh.10935
Articles
Estudio multicéntrico de contaminación por fármacos peligrosos en superficies de áreas de elaboración de Servicios de Farmacia
1Instituto de Investigación Sanitaria La Fe, Valencia. Spain.
2Servicio de Farmacia Hospitalaria, Hospital Universitario y Politécnico La Fe, Valencia. Spain.
Introducción
La manipulación de los denominados fármacos peligrosos (FP), puede suponer riesgos para la salud de los trabajadores si no se realiza de manera adecuada.
El término FP fue utilizado por primera vez en los años noventa por la American Society of Hospital Pharmacists1, y adoptado posteriormente por el National Institute of Occupational Safety and Health americano (NIOSH) en 20042, que considera como tales a todos aquellos fármacos que muestren en estudios en animales o humanos una o más de las siguientes características:
Carcinogenicidad.
Teratogenicidad u otra toxicidad para el desarrollo.
Toxicidad reproductiva.
Toxicidad en órganos a dosis bajas.
Genotoxicidad.
Fármacos con estructura o perfiles de toxicidad que sean similares a otros fármacos existentes considerados peligrosos.
La bibliografía refleja que la exposición laboral a FP puede inducir la aparición de efectos adversos agudos o crónicos (erupciones, trastornos reproductivos o posibles alteraciones cromosómicas)3-6. Los efectos mencionados son considerados efectos estocásticos, para los que existe una probabilidad determinada de que aparezcan, pero no lo hacen necesariamente. Establecer la relación causal directa entre la exposición a estos fármacos y el desarrollo de neoplasias u otros efectos nocivos resulta muy difícil debido al carácter multifactorial de ese tipo de procesos patológicos. A esto se une la inexistencia de biomarcadores diagnósticos o pronósticos adecuados. Ante esta circunstancia, el criterio de prudencia aconseja seguir el principio denominado ALARA7 (As Low As Reasonably Achievable) en lo que a exposición a FP se refiere.
A nivel nacional, la manipulación de FP se trata de manera extensa en la legislación. Así, existen una serie de leyes y reales decretos que estandarizan y regulan su manipulación y que son de obligado cumplimiento: Ley 31/1995, de 8 de noviembre, de Prevención de Riesgos Laborales8; Real Decreto 773/1997, de 30 de mayo, sobre disposiciones mínimas de seguridad y salud relativas a la utilización por los trabajadores de equipos de protección individual9; y Real Decreto 665/1997 sobre protección de los trabajadores contra los riesgos relacionados con la exposición laboral a cancerígenos10. Recientemente, el Instituto de Seguridad e Higiene en el Trabajo publicó el Documento técnico 87.1:16. Medicamentos Peligrosos: medidas de prevención para su preparación y administración11.
Está claro y es generalmente asumido que la manipulación de FP debe llevarse a cabo de manera centralizada en los Servicios de Farmacia (SF), aplicando las medidas de protección colectivas e individuales necesarias y recomendadas por las principales sociedades científicas y por la legislación12-17.
La presencia de FP, concretamente citostáticos, en el entorno laboral sanitario ha sido demostrada en múltiples estudios de ámbito internacional18-23, tanto europeo como americano. En nuestro país, actualmente apenas existen experiencias de este tipo24, pero parece demostrado que la exposición laboral a FP es una realidad, y la probabilidad de contacto del personal sanitario con los mismos, si no se toman precauciones, alta.
El objetivo principal del presente estudio es evaluar la presencia de FP en las superficies de trabajo de las áreas de elaboración de los SF Hospitalaria en España. Los objetivos secundarios incluyen: cuantificar la cantidad (ng/m2) existente de los FP analizados en las superficies de trabajo muestreadas, comparar los niveles de contaminación (ng/m2) en función del tipo de superficie muestreada para determinar posibles zonas de trabajo tendentes al acúmulo de FP y comparar los niveles de contaminación entre hospitales participantes. Asimismo, se pretende evaluar la posible asociación entre los niveles de FP presentes y diversas variables: número de preparaciones elaboradas, uso de sistemas cerrados de transferencia de fármacos, procesos de descontaminación periódicos.
Métodos
Se diseñó un estudio observacional, prospectivo, multicéntrico y transversal de medición de niveles de FP (citostáticos) en las áreas de elaboración de los SF de diez hospitales en España.
Se seleccionaron para la muestra diez hospitales que preferiblemente deberían tener más de 700 camas, con preparación centralizada de FP en el SF.
Se seleccionaron ciclofosfamida (CIC), ifosfamida (IFO) y 5-fluorouracilo (5FU) como fármacos a determinar, considerándose marcadores subrogados de contaminación química. Esta elección se llevó a cabo por las características específicas de los fármacos y especialidades (CIC e IFO requieren de reconstitución previa a su uso, con el consiguiente aumento en el número de manipulaciones necesarias y el riesgo que ello supone), por la frecuencia de uso y por las considerables cantidades que se manipulan habitualmente.
Se estableció que en los SF participantes en el estudio se manipularían los FP según los procedimientos normalizados de trabajo vigentes en los mismos. Se aplicarían los protocolos de limpieza del área y de derrames de manera habitual. Dichos procedimientos se recopilarían y analizarían para facilitar la interpretación de los resultados.
Las muestras fueron tomadas por una persona designada por cada centro utilizando un kit de muestreo (CYTO WIPE KIT®) de un laboratorio independiente responsable del análisis y cuantificación de los medicamentos estudiados en las muestras (Exposure Control, Sweden AB). Los límites de detección de las técnicas utilizadas para la cuantificación de CIC, IFO y 5FU fueron de 0,1 ng/ mL, 0,1 ng/mL y 1 ng/mL respectivamente. Se asumió un nivel de recuperación del 100% en las muestras.
El procedimiento de toma de muestras se especificó en el protocolo del estudio. Se elaboró un vídeo demostrativo donde se explicaba de manera práctica la metodología de muestreo, que fue enviado a los centros participantes para estandarizar y unificar la toma de muestras. Para las superficies discontinuas, debido a la dificultad de calcular la superficie muestreada, se determinó una superficie ficticia como si fuera continua. A su vez, se diseñó un listado de verificación que permitiera el seguimiento y registro de la correcta toma de muestras por parte de un observador externo del proceso. Dicho listado fue enviado al coordinador del estudio al finalizar el procedimiento.
La toma de muestras se realizó en todos los centros el 26 de octubre de 2016, al finalizar la jornada laboral, antes de los procedimientos habituales de limpieza y/o descontaminación, y sin previo conocimiento de los trabajadores, para no modificar las pautas de trabajo.
Cada centro definió sus puntos de muestreo, con un máximo de 30, asegurándose de que las siguientes localizaciones fueran analizadas.
Todas las cabinas de seguridad biológica en uso para la manipulación de FP. En cada cabina: superficie central de trabajo, pared frontal, vidrio protector por la cara interior, sumidero de aire más cercano al operario y suelo frente a la cabina.
En la antesala: en la bancada donde se preparan los materiales de partida, en la bancada donde se revisan los productos finales, en la superficie externa de un vial de CIC, de un vial de 5FU y de un vial de IFO.
En aquellos centros que utilizaran talla para cubrir la zona central de elaboración, se debería enviar dicho paño como si de una muestra más se tratara, especificando la superficie del mismo.
Se adecuó la toma de muestras de manera que las superficies muestreadas fueran lo más comparables posible entre sí.
Los centros registraron de forma sistemática los incidentes relacionados con la manipulación (derrames, rotura de contenedores o viales, etc.) que se produjeron la semana previa a la toma de muestras y recogieron una serie de datos referidos a la política de limpieza y/o descontaminación, el sistema de transferencia de fármacos utilizado y el número de mezclas elaboradas.
A efectos del análisis estadístico, se consideró que el centro desarrollaba un proceso de descontaminación si especificaba el uso de detergentes alcalinos y/o soluciones alcalinas (NaOH), independientemente de la frecuencia del mismo. No se consideraron procesos de descontaminación específicos los procedimientos de limpieza o desinfección en los que se utilizaban detergentes (sin especificar alcalinidad) o alcohol 70º.
Para el análisis descriptivo de los resultados se calculó la media, desviación estándar, mediana y el primer y tercer cuartil en el caso de las variables cuantitativas continuas, así como la frecuencia absoluta y relativa en el caso de las variables categóricas. Por otro lado, se realizó un modelo de regresión de percentiles con la finalidad de estudiar la posible asociación entre el nivel de contaminación y el hecho de llevar a cabo un proceso de descontaminación, así como con el número de preparaciones diarias o anuales. Dado que es más probable que las muestras recogidas en lugares comparables sean parecidas entre sí, se añadió la variable “Lugar de muestreo” como variable de efectos aleatorios en el modelo de regresión de percentiles con el objetivo de corregir la no independencia de las observaciones, así como la variable “Hospital”.
Para comparar los niveles de contaminación en superficie (mediana) entre los diferentes centros participantes y los diferentes lugares de muestreo, se representó la variabilidad de las variables consideradas como efecto aleatorio del modelo (hospital y lugar de muestreo) para cada fármaco.
Los análisis se realizaron con el software estadístico R (versión 3.3.3) y el paquete brms (versión 1.5.1). Para simular la circunstancia más desfavorable, se asignó a los resultados negativos (por debajo del límite de detección) el valor máximo no detectable que existiría en la superficie muestreada.
Resultados
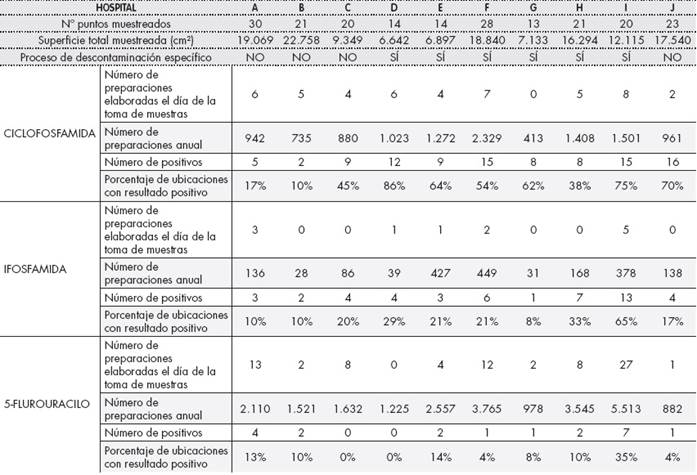
El número total de localizaciones muestreadas fue de 204, variando entre 14 y 30 por centro. Se muestrearon 136.367,48 cm2, con un total de superficie muestreada por centro de 6.642 a 22.758 cm2. Las características de muestreo, actividad y procedimientos analizados de los hospitales participantes se recogen en la Tabla 1.
Se evidenció la presencia de FP en todos los centros, con un porcentaje de muestras positivas del 49% para CIC (99/204), del 23% para IFO (47/204) y del 10% para 5FU (20/204). CIC e IFO estaban presentes en todos los hospitales participantes, con al menos un resultado positivo. Ocho centros presentaron al menos un resultado positivo para 5FU (Tabla 1).
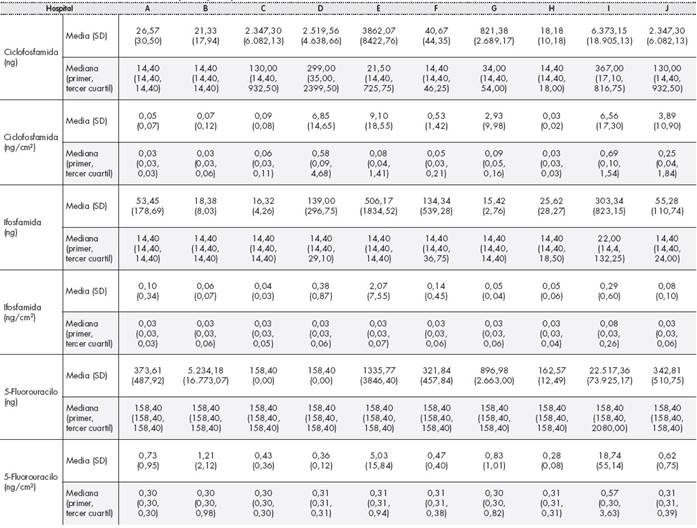
La mediana (primer-tercer cuartil) de niveles de contaminación por superficie para CIC, IFO y 5FU fue de 0,05 ng/cm2 (0,03-0,23), 0,03 ng/ cm2 (0,03-0,06) y 0,31 ng/cm2 (0,3-0,59) respectivamente. Los resultados medios (SD) y medianos (primer-tercer cuartil) por centro se recogen en la Tabla 2.
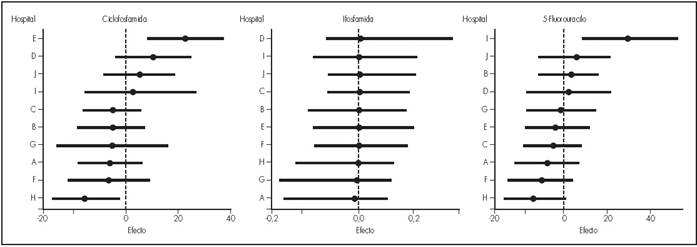
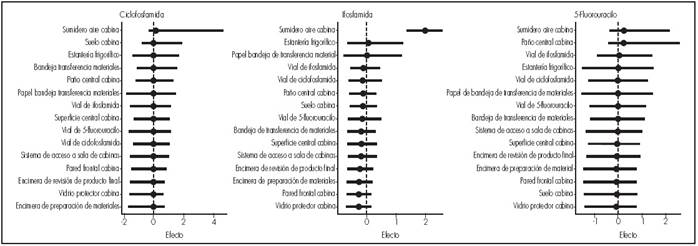
El modelo estadístico corroboró la existencia de variabilidad significativa en los niveles de contaminación entre los diferentes centros (para CIC 13,251. IC 95% 7,630-22,324; para IFO 0,077. IC 95% 0,002-0,303; para 5FU 15,027. IC 95% 8,768-25,562) y entre los diferentes lugares de muestreo (para CIC 0,505. IC 95% 0,011-2,192; para IFO: 0,666. IC 95% 0,418-1,036; para 5FU 0,547. IC 95% 0,017-1,564) (Figura 1yFigura 2).
Se observó que las localizaciones con niveles de contaminación más altos fueron los sumideros de aire de las cabinas. Las superficies muestreadas con un mayor número de positivos fueron los suelos frente a las cabinas y los sumideros de aire de las mismas, para las que todos los centros presentaron algún positivo para, al menos, uno de los FP.
El modelo de regresión de percentiles no reveló ninguna asociación entre el número de preparaciones anuales para cada uno de los fármacos y los niveles de contaminación presentes en las superficies muestreadas para ninguno de los FP (CIC 1,731. IC 95%-13,617-17,723; IFO-0,015. IC 95%-0,180-0,110; 5FU 4,213. IC 95%-11,288-20,217). Tampoco existía relación entre el número de mezclas elaboradas el día de muestreo y los niveles de contaminación en las superficies (CIC 1,309. IC 95%-11,920-15,015; IFO 0,067. IC 95%-0,105-0,309; 5FU 5,502. IC 95%-5,488-16,170).
Asimismo no reveló ninguna relación significativa entre descontaminar el área o no y los niveles de contaminación en superficie para ninguno de los fármacos muestreados (CIC 9,610. IC 95%-5,142-23,349; IFO 0,127. IC 95%-0,051-0,372; 5FU 5,944. IC 95%-8,030-19,293).
Respecto a los sistemas de transferencia de fármacos, en tres de los centros participantes se utilizaba aguja de manera aislada en la preparación. Todos los centros utilizaban sistemas de punzón con o sin filtro de venteo, no clasificados con código ONB. En ningún caso se utilizaban sistemas cerrados de transferencia de fármaco con clasificación ONB, por lo que no se pudo estudiar la posible asociación entre niveles de contaminación en superficie y el dispositivo de transferencia utilizado.
Discusión
Nuestro estudio evidenció la presencia de CIC, IFO y 5FU en las áreas de elaboración de los SF de los hospitales españoles analizados, ya que todos los centros presentaron al menos un positivo para alguno de los FP evaluados.
El número de positivos respecto al total de puntos muestreados fue similar para CIC19 que en otros estudios publicados, pero mucho menor para 5FU24, que los reflejados en estudios previos. Este hecho cabe atribuirlo a que el límite de detección de la técnica de cuantificación de 5FU fue diez veces superior al de IFO y CIC. Además, el hecho de que el vial no requiera reconstitución previa reduce la probabilidad de exposición. A esto debemos añadir la menor volatilidad que presenta respecto a ciclofosfamida e ifosfamida, lo que reduce su capacidad de propagación en caso de que se produzca algún derrame.
Los niveles de contaminación en lo que se refiere a cantidad de fármaco por cm2 de superficie son bajos, comparables con algunos estudios publicados18, pero superiores a otros20,21,23, donde en algunos de ellos, el rango de detección está en pg/cm2, mil veces menor que el usado en este estudio Esto demuestra el margen de mejora existente en nuestro entorno asistencial.
Debe tenerse en cuenta que las muestras fueron tomadas antes de llevar a cabo los protocolos de limpieza, de la misma forma que estudios previos19, lo que asegura que los resultados reflejan los niveles máximos de exposición a los que pueden verse expuestos los profesionales sanitarios. La comparación con otros estudios en los que las muestras se tomaron tras llevar a cabo la limpieza23, puede no resultar adecuada.
La elección de CIC, IFO y 5FU atendió a razones explicadas anteriormente. Asimismo, la bibliografía existente referenciaba con frecuencia el análisis de estos FP, lo que facilitaba la comparación de resultados con estudios ya publicados. En otros estudios se valora la presencia de metotrexato, gemcitabina, doxorrubicina y derivados del platino19,21,23-28, aspecto que debería valorarse en futuros muestreos.
La variabilidad significativa en niveles de contaminación entre los hospitales participantes evidencia la necesidad de un análisis profundo de los procedimientos que puedan contribuir a la misma en futuros estudios.
Respecto al estudio de los niveles de contaminación en función del área muestreada, al igual que en otras publicaciones18,27, los lugares que con más frecuencia presentaron contaminación fueron los sumideros de aire de las cabinas y los suelos frente a las mismas. En nuestra opinión, la presencia de FP en los sumideros es debida al propio mecanismo de funcionamiento de las cabinas y a la dificultad de limpiar adecuadamente las superficies no continuas. Por su parte, la presencia de contaminación en los suelos pone de manifiesto los problemas de coordinación en las tareas de limpieza y descontaminación de las superficies de trabajo cuando en estas actividades participan diferentes colectivos (personal de enfermería, personal de limpieza), que no siempre aplican los mismos protocolos. Este aspecto debería analizarse en futuros estudios.
La ausencia de influencia en los niveles de contaminación del número de preparaciones elaboradas el día de muestreo o anualmente, sugiere la influencia de otros factores que podrían afectar a la presencia de FP en las superficies de trabajo. Otros estudios publicados19 evidencian la relación positiva entre el número de preparaciones anuales elaboradas y el grado de contaminación, lo que demuestra la necesidad de llevar a cabo monitorizaciones continuas que confirmen o desmientan esta asociación en nuestro entorno asistencial.
El hecho de que no existiera relación entre los niveles de contaminación y que se lleve a cabo un protocolo de descontaminación específico o no, pone de manifiesto la necesidad de estudios específicos que evalúen este aspecto. La heterogeneidad en las metodologías de limpieza y/o descontaminación utilizadas entre los centros, así como la dificultad de establecer qué procedimientos se consideran descontaminación o mera limpieza del área, hace necesario el desarrollo de estudios futuros que cuantifiquen el efecto que un procedimiento u otro aporta a los niveles de contaminación.
Nuestro estudio tiene como principales fortalezas el elevado número de centros participantes y de muestras evaluadas, así como la independencia de los análisis realizados. Además, ofrece la visión de la situación actual de los SF españoles respecto a niveles de contaminación en superficie.
Como principales debilidades, destacar la heterogeneidad de procedimientos entre los centros participantes, así como el carácter transversal del mismo, ya que los resultados pueden haberse visto afectados por las circunstancias puntuales del día de muestreo.
Añadir que puede existir un sesgo de procedimiento en la toma de muestras, efectuada por personas diferentes en cada hospital. Asimismo, el bajo límite de detección de 5FU puede a su vez condicionar los resultados observados. En otros estudios se ha evidenciado la influencia de la cantidad de fármaco manipulada con los niveles de contaminación en superficie19, aspecto que no se cuantificó en nuestro estudio y que debería ser tenido en cuenta en futuros análisis.
Otros aspectos que pueden influir en los niveles de contaminación observados y que deberían ser analizados en posteriores estudios son: las instalaciones disponibles, el mantenimiento de las mismas, los protocolos de manipulación de FP y el uso de sistemas cerrados, ya que, en nuestro estudio, ningún hospital los utilizaba de manera rutinaria.
Además, que se trate de un estudio transversal hace necesaria la corroboración de los resultados obtenidos con posteriores muestreos, ya que las condiciones del área de elaboración del SF pueden cambiar sustancialmente en función del día. A su vez, la posible incorporación de otros centros participantes a futuros análisis debería aumentar la solidez de los resultados.
Como conclusión, el presente estudio pone de manifiesto la presencia de FP en las áreas de elaboración de antineoplásicos en SF en España, la variabilidad de los niveles de contaminación entre centros y en función del lugar muestreado. Este estudio abre nuevas líneas de investigación que permitan evaluar y mejorar los resultados observados. La variabilidad existente entre los centros participantes pone de manifiesto la necesidad de aumentar el grado de estandarización de los procesos de manipulación de FP.
Bibliography
American Society of Hospital Pharmacists. ASHP technical assistance bulletin on handling cytotoxic and hazardous drugs. Am J Hosp Pharm. 1990;47:1033-49. [ Links ]
Burroughs G, Connor T, McDiarmid M. NIOSH alert: preventing occupational exposures to antineoplastic and other hazardous drugs in health care settings. DHHS (NIOSH) Publ No. 2004-165 (consultado marzo de 2016). Disponible en: http://www.cdc.gov/niosh/docs/2004-165/pdfs/2004-165.pdf [ Links ]
Valanis BG, Vollmer WM, Labuhn KT, Glass AG. Association of antineoplastic drug handling with acute adverse effects in pharmacy personnel. Am J Hosp Pharm. 1993;50:455-62. [ Links ]
McDiarmid M, Egan T. Acute occupational exposure to antineoplastic agents. J Occup Med. 1988;30(12):984-7. [ Links ]
Valanis B, Vollmer WM, Steele P. Occupational exposure to antineoplastic agents: self-reported miscarriages and stillbirths among nurses and pharmacists. J Occup Environ Med. 1999;41(8):632-8. [ Links ]
McDiarmid MA, Oliver MS, Roth TS, Rogers B, Escalante C. Chromosome 5 and 7 abnormalities in oncology personnel handling anticancer drugs. J Occup Environ Med. 2010;52(10):1028-34. DOI: 10.1097/JOM.0b013e3181f73ae6 [ Links ]
USP General Chapter <800> Hazardous Drugs-Handling in Healthcare Settings. United States Pharmacopeia. USP 2016. Disponible en: http://www.usp.org/usp-nf/notices/general-Chapter-hazardous-drugs-handling-healthcare-settings [ Links ]
Ley 31/1995, de 8 de noviembre, de Prevención de Riesgos Laborales. BOE nº 269, 10/11/1995. [ Links ]
Real Decreto 773/1997, de 30 de mayo, sobre disposiciones mínimas de seguridad y salud relativas a la utilización por los trabajadores de equipos de protección individual. BOE nº 140, 12/6/1997. [ Links ]
Real Decreto 665/1997 sobreprotección de los trabajadores contra los riesgos relacionados con la exposición laboral a cancerígenos, modificado por el RD 1124/2000, de 16 de junio, es el resultado de la transposición de las Directivas 90/394/CEE de 28 de junio, 97/42/CE, de 27 de junio y 1999/38/CE, de 29 de abril. [ Links ]
Documento técnico 87.1:16. Medicamentos peligrosos. Medidas de prevención para su preparación y administración. Instituto de Seguridad e Higiene en el trabajo (consultado septiembre 2017). Disponible en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/FICHAS%20DE%20PUBLICACIONES/EN%20CATALOGO /Higiene/2016%20medicamentos%20peligrosos/Medicamentos%20peligrosos.pdf [ Links ]
Guía de buenas prácticas de preparación de medicamentos en servicios de farmacia hospitalaria. Dirección General de Cartera Básica de Servicios del SNS y Farmacia. Subdirección General de Calidad de Medicamentos y Productos Sanitarios. Junio 2014. [ Links ]
Guía de buenas prácticas para trabajadores profesionalmente expuestos a agentes citostáticos. Instituto de Salud Carlos III. Madrid. Febrero 2014 (consultado enero 2016). Disponible en: http://gesdoc.isciii.es/gesdoccontroller?action=download&id=26/03/2014-199edf956b [ Links ]
NTP 1051: Exposición laboral a compuestos citostáticos: sistemas seguros para su preparación. Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT) (consultado septiembre 2017). Disponible en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/NTP/NTP/Ficheros/1043a1054/ntp-1051w.pdf [ Links ]
ISOPP standards of practice. Safe handling of cytotoxics. J Oncol Pharm Pract. 2007;13(Suppl):1-81. [ Links ]
Estándares de calidad de los Servicios de Farmacia Oncológica. (QuapoS 4 (consultado septiembre 2017). Disponible en: http://www.esop.li/downloads/library/quapos4_english.pdf [ Links ]
NIOSH (2016). NIOSH list of antineoplastic and other hazardous drugs in healthcare settings, 2016. By Connor TH, MacKenzie BA, DeBord DG, Trout DB, O’Callaghan JP. Cincinnati, OH: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication Number 2016-161 (Supersedes 2014-138). [ Links ]
Sessink PJ, Trahan J, Coyne JW. Reduction in Surface Contamination With Cyclophosphamide in 30 US Hospital Pharmacies Following Implementation of a Closed-System Drug Transfer Device. Hosp Pharm. 2013;48(3):204-12. DOI: 10.1310/hpj4803-204 [ Links ]
Roland C, Caron N, Bussières JF. Multicenter study of environmental contamination with cyclophosphamide, ifosfamide, and methotrexate in 66 Canadian hospitals: A 2016 follow-up study. J Occup Environ Hyg. 2017;14(8):661-9. DOI: 10.1080/15459624.2017.1316389 [ Links ]
Crul M, Simons-Sanders K. Carry-over of antineoplastic drug contamination in Dutch hospital pharmacies. J Oncol Pharm Pract. 2017;1:1078155217704990. DOI: 10.1177/1078155217704990 [ Links ]
Redic KA, Fang K, Christen C, Chaffee BW. Surface contamination of hazardous drug pharmacy storage bins and pharmacy distributor shipping containers. J Oncol Pharm Pract. 2018;24(2):91-97. DOI: 10.1177/1078155216679027 [ Links ]
Viegas S, Pádua M, Veiga AC, Carolino E, Gomes M. Antineoplastic drugs contamination of workplace surfaces in two Portuguese hospitals. Environ Monit Assess. 2014;186(11):7807-18. DOI: 10.1007/s10661-014-3969-1 [ Links ]
Sottani C, Grignani E, Oddone E, Dezza B, Negri S, Villani S, et al. Monitoring Surface Contamination by Antineoplastic Drugs in Italian Hospitals: Performance-Based Hygienic Guidance Values (HGVs) Project. Ann Work Expo Health. 2017;61(8):994-1002. DOI: 10.1093/annweh/wxx065 [ Links ]
González Álvarez A, López-Montenegro Soria MA, Albert Marí A, Martínez Gómez MA, Porta Oltra B, Jiménez Torres NV. Exposición a fármacos citotóxicos en el personal sanitario. Farm Hosp. 2012;36(5):368-73. DOI: 10.1016/j.farma.2011.10.007 [ Links ]
Yoshida J, Koda S, Nishida S, Nakano H, Tei G, Kumagai S. Association between occupational exposure and control measures for antineoplastic drugs in a pharmacy of a hospital. Ann Occup Hyg. 2013;57(2):251-60. DOI: 10.1093/annhyg/mes061 [ Links ]
Odraska P, Dolezalova L, Kuta J, Oravec M, Piler P, Blaha L. Evaluation of the efficacy of additional measures introduced for the protection of healthcare personnel handling antineoplastic drugs. Ann Occup Hyg. 2013;57(2):240-50. DOI: 10.1093/annhyg/mes057 [ Links ]
Janes A, Tanguay C, Caron NJ, Bussières JF. Environmental Contamination with Cyclophosphamide, Ifosfamide, and Methotrexate: A Study of 51 Canadian Centres. Can J Hosp Pharm. 2015;68(4):279-89. [ Links ]
Viegas S, Pádua M, Veiga AC, Carolino E, Gomes M. Antineoplastic drugs contamination of workplace surfaces in two Portuguese hospitals. Environ Monit Assess. 2014;186(11):7807-18. DOI: 10.1007/s10661-014-3969-1 [ Links ]
Recibido: 13 de Noviembre de 2017; Aprobado: 03 de Febrero de 2018











 text in
text in