My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.42 n.5 Toledo Sep./Oct. 2018
https://dx.doi.org/10.7399/fh.10917
ARTÍCULOS ESPECIALES
Evaluación económica del informe GENESIS-SEFH de olaratumab con doxorrubicina en el sarcoma de tejidos blandos en estadios avanzados
1Servicio de Farmacia, Hospital Regional Universitario de Málaga, Málaga. Spain.
2Hospital Duran I Reynals, Institut Catalá D´Oncología, Hospitalet, Barcelona. Spain.
3Servicio de Farmacia, Complejo Hospitalario Mancha Centro, Alcázar de San Juan, Ciudad Real. Spain.
Introducción
El sarcoma de partes blandas (SPB) consiste en una proliferación descontrolada y anárquica de las células que forman el tejido mesenquimal, conectivo o soporte del organismo, localizándose en las partes blandas de este (grasa, músculo, tendones, vasos sanguíneos, nervios y tejidos profundos de la piel; es decir, excluyendo hueso y cartílago)1. El SPB abarca un amplio grupo de neoplasias, con más de 50 subgrupos histológicos distintos1,2,3.
La incidencia de los tumores de partes blandas se estima en unos 300 casos/100.000 personas/año, aunque prácticamente la totalidad de estos son benignos. Alrededor de un 1% se clasifica como SPB por su malignidad, representando una forma rara de cáncer, ya que la incidencia anual de este tipo de tumores se estima en unos 4-5 nuevos casos por cada 100.000 personas al año en Europa, constituyendo alrededor de un 1% del total de tumores malignos y siendo responsables de en torno a un 2% de la mortalidad debida a cáncer.
Los SPB son un 20% más frecuentes en hombres que en mujeres, y pueden aparecer a todas las edades, incluso en adolescentes y niños, donde pueden llegar a representar el 21% de los tumores sólidos diagnosticados1,2,4,5,6.
El tratamiento de la enfermedad avanzada consiste en cirugía y quimioterapia. Los fármacos clásicos, cuyo uso ya se describía por Benjamín et al.7 (1975), siguen siendo los más utilizados en la actualidad. La doxorrubicina (adriamicina)5 y la ifosfamida son los tratamientos de primera línea desde hace casi cincuenta años. Pueden ser administrados en combinación o, secuencialmente, primero la doxorrubicina y cuando esta deja de funcionar o bien está contraindicada, la ifosfamida.
En los últimos años, se han incorporado nuevos agentes quimioterápicos activos al tratamiento de los SPB. Estos nuevos tratamientos se administran tras los anteriores, cuando la enfermedad se hace resistente y progresa de nuevo: trabectedina, combinación de gemcitabina + dacarbacina o docetaxel, pazopanib o eribulina entre otros8.
De todos modos, son necesarios estudios con nuevos fármacos que permitan identificar nuevos agentes activos. La participación en estudios clínicos con nuevos fármacos es una alternativa válida para los pacientes con SPB resistente a los tratamientos disponibles.
El olaratumab ha sido autorizado por la European Medicines Agency (EMA)9 y la Agencia Española de Medicamentos y Productos sSanitarios (AEMyPS)10 en combinación con la doxorrubicina para el tratamiento de pacientes adultos con sarcoma de tejidos blandos en estadio avanzado que no son susceptibles de tratamiento curativo con cirugía o radioterapia y que no han sido tratados previamente con doxorrubicina. El olaratumab ha sido designado medicamento huérfano y ha tenido una aprobación condicional11.
El olaratumab es un anticuerpo monoclonal inmunoglobulina G subclase 1 (IgG1), dirigido, recombinante, completamente humano que se une específicamente al receptor del factor de crecimiento derivado de plaquetas (PDGFR-α), bloqueando la unión de los ligandos PDGF AA, -BB y -CC al receptor y su consecuente activación.10
En el presente artículo desarrollamos la evaluación económica del fármaco olaratumab en el tratamiento del sarcoma de partes blandas (SPB), utilizando el programa MADRE del modelo de informe GENESIS-SEFH12.
Métodos
En fecha 25 de febrero de 2017 se realizó una búsqueda bibliográfica en Medline-Pubmed Clinical Queries: (therapy/narrow (filter)) and (olaratumab) and (sarcoma). Se obtuvo un único resultado que se corresponde con el ensayo clínico pivotal13 de los informes EPAR de la EMA9.
Para la evaluación económica, en fecha 1 de noviembre de 2017 se realizó una búsqueda bibliográfica en Medline-Pubmed con los descriptores “olaratumab” AND “incremental cost-effectivenes”. Se obtuvo un artículo publicado por Tikhonova, IA et al. (2017)14.
Los datos se analizaron siguiendo las recomendaciones contenidas en la Guía de evaluación económica e impacto presupuestario en los informes de evaluación de medicamentos. Guía práctica asociada al programa MADRE 4.0. Noviembre 201612.
Resultados
Eficacia
El ensayo que ha llevado a la aprobación condicional del olaratumab es un ensayo clínico fase Ib/II en pacientes con SPB13. Se trata de un estudio de superioridad, multicéntrico, abierto donde se compara olaratumab + doxorrubicina (OlaDox) vs. doxorrubicina en monoterapia (Dox) (tratamiento actual de referencia). En el grupo intervención se administró olaratumab a dosis de 15 mg/kg los días uno y ocho de cada ciclo de 21 días junto con doxorrubicina a dosis de 75 mg/m2 el día uno de cada ciclo, máximo ocho ciclos. En el grupo control se administró doxorrubicina a dosis de 75 mg/m2 el día uo de cada ciclo, también máximo ocho ciclos.
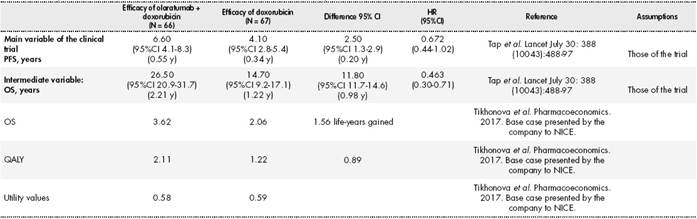
La ganancia en supervivencia libre de progresión (SLP, variable principal) en términos absolutos fue de 2,5 meses con un Hazard ratio (HR) de 0,672 IC95% (0,442-1,021). La ganancia absoluta en supervivencia global (SG) (variable secundaria) fue de 11,8 meses con un HR de 0,463 IC 95% (0,301-0,710). Ver los principales resultados de eficacia en la Tabla 1.
Tabla 1 Resultados de eficacia del ensayo clínico pivotal13 y resultados de SG, AVAC y utilidad del artículo de Tikhonova IA et al.14
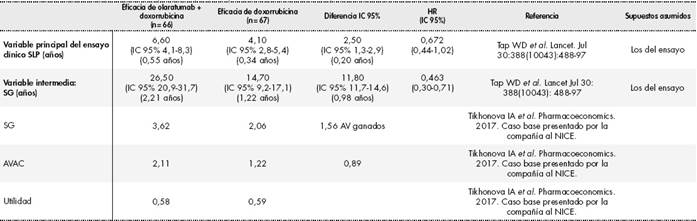
SLP: Supervivencia libre de progresión se define como el tiempo desde la fecha de la aleatorización hasta la fecha más temprana del tumor documentado, progresión o muerte por cualquier causa, lo que sea primero. La evaluación del tumor se basa en los criterios RECIST 1.1 según la evaluación del investigador; SG: Supervivencia global se define como el tiempo desde la fecha de la aleatorización hasta la fecha de la muerte por cualquier causa; AVAC: años de vida ajustado por calidad; HR: Hazard ratio; IC: intervalo de confianza
Los pacientes podían haber recibido líneas previas de tratamiento para su enfermedad avanzada siempre y cuando no fueran doxorrubicina, daunorrubicina, idarrubicina, y/u otras antraciclinas y antraquinonas o terapia previa con cualquier agente dirigido a la vía PDGF/PDGFR. Esto podría comprometer la interpretación de los resultados del ensayo clínico al haber recibido los pacientes líneas previas de tratamiento para el estadio avanzado de su enfermedad.
Seguridad
Un total de 485 pacientes han recibido olaratumab en nueve ensayos clínicos fase I y II.
En el brazo de OlaDox, las reacciones adversas a medicamentos (RAM) graves (grado ≥ 3), que se observaron más frecuentemente fueron neutropenia (54,7%) y dolor musculo-esquelético (7,8%). Las RAM que aparecieron más frecuentemente en cualquier grado fueron náuseas (73,4%), dolor musculo-esquelético (64,1%), neutropenia (59,4%) y mucositis (53,1%)9.
Es un fármaco que presenta como inconveniente la administración en el hospital de día al igual que la doxorrubicina. Puede producir reacciones de infusión en los pacientes, por este motivo es necesario realizar un estricto seguimiento de la premedicación. En concreto, se notificaron reacciones relacionadas con la infusión (IRR) en el 12,5% de los pacientes y se manifestaron principalmente como escalofríos, fiebre o disnea. Se notificaron IRR graves, también incluyendo un caso mortal en el 3,1% de los pacientes y se presentaron principalmente como dificultad para respirar, pérdida del conocimiento e hipotensión. Todas las IRR graves se produjeron durante la primera administración del olaratumab o inmediatamente después9.
Evaluación económica
Se realizó una evaluación económica siguiendo las recomendaciones contenidas en la Guía de evaluación económica e impacto presupuestario en los informes de evaluación de medicamentos. Guía práctica asociada al programa MADRE 4.0. Noviembre 201612.
Se tuvieron en cuenta las siguientes premisas a la hora de realizar la evaluación económica:
A fecha 01/11/2017 se autoriza la comercialización del olaratumab en España. El precio se consultó en BOT PLUS15. Se aplicó la deducción del Real Decreto Ley 8/201016 así como el 4% de IVA, de tal manera que los precios aplicados para hacer la evaluación económica se quedaron: Precio de venta del laboratorio (PVL) notificado de un vial de olaratumab de 500 mg/50 ml = 1.531,15 euros y de un vial de 190 mg/19 ml = 581,84 euros. PVL de doxorrubicina 50 mg/25ml consultado: 14,20 euros.
El coste por ciclo se ha calculado en único supuesto:
Sin aprovechamiento de viales, entendiéndose que no es posible agrupar a pacientes en espacio y tiempo y por tanto hay que desechar restos de viales. Los resultados de este análisis son los que se han tenido en cuenta para cálculos posteriores.
El coste total del tratamiento se calculó siguiendo la misma metodología que en el punto anterior, teniendo en cuenta la diferencia en la media de ciclos recibidos con OlaDox y Dox en monoterapia en el ensayo clínico pivotal.
Para realizar la evaluación económica se han tenido en cuenta las medias de ciclos correspondientes en cada fármaco y grupo según el European Public Assessment Report (EPAR) de la EMA9. Se indican las cantidades calculadas para cada ítem.
Costes directos asociados:
Dexrazoxano: se ha utilizado a partir del quinto ciclo de doxorrubicina como preventivo de la cardiotoxicidad crónica acumulativa asociado al empleo de esta antraciclina. Coste vial de dexrazosano15: 74,47 euros. PVL-deducción Real Decreto Ley 8/2010 (15%) + 4% de IVA.
Cálculo del coste de la utilización de hospital de día: 292,86 euros, precio consultado en la página web www.esalud.oblikue.com17.
Cálculo del coste de tratamiento de la neutropenia inducida por fármacos, teniendo en cuenta que la combinación OlaDox producía neutropenia en el 59,40% de los pacientes y Dox sola un 35,4%. Coste del tratamiento de la neutropenia: 4.383,16 euros. Coste consultado en la página web www.esalud.oblikue.com17.Para el grupo de tratamiento con OlaDox 2.603,6 euros. Para el grupo de Dox, 1.551,63 euros.
Cálculo de coste de tratamiento de la mucositis: en el grupo de pacientes en el brazo de tratamiento, el 53,10% desarrolló mucositis y en el grupo control el 35,40%. Coste de tratamiento de mucositis: 3.429,05 euros. Coste consultado en la página web www.esalud. oblikue.com17. Coste para el grupo de OlaDox: 1.820,83 euros. Para el grupo de Dox: 1.213,88 euros.
Para el cálculo de dosis se tuvo en cuenta una superficie corporal de 1,7 m2 y un peso de 70 kg12.
Los autores advierten que, según los decimales que se consideren, la reproducción de estos cálculos podría variar.
La combinación OlaDox supondría un coste de 81.581,12 euros, valor muy superior a la alternativa terapéutica existente actualmente. El coste incremental OlaDox vs. Dox se situaría en 79.974,40 euros (Tabla 2).
Tabla 2 Comparación de costes del tratamiento “OlaDox” vs. “Dox”
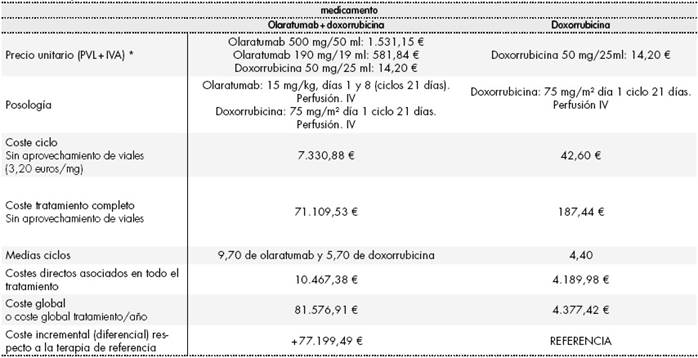
*Se aplica la deducción del Real Decreto Ley 8/2010 además del 4% de IVA para todos los medicamentos implicados en el análisis. PVL: precio de venta del laboratorio; IVA: impuesto del valor añadido.
La evaluación económica que se seleccionó fue el análisis coste-efectividad ya que únicamente disponíamos de los datos de eficacia del estudio pivotal. Posteriormente, se ha publicado un análisis coste-utilidad que comentaremos más adelante. Se descartó el análisis de minimización de costes, ya que en los resultados del ensayo clínico la eficacia del olaratumab fue superior al comparador.
Análisis coste-efectividad
A continuación se muestran los datos de coste-efectividad con los datos de eficacia del ensayo clínico pivotal17 de la Tabla 1 y los costes de Ola-Dox y Dox de la Tabla 2.
Se describen dos escenarios:
ESCENARIO 1: calculamos el coste-efectividad incremental en base a los costes de adquisición de los medicamentos SIN aprovechamiento de viales y los datos de eficacia del ensayo clínico pivotal. Según los datos de eficacia del ensayo clínico y la diferencia de costes entre los tratamientos, si se trata a los pacientes con OlaDox en lugar de con Dox sola tendríamos un ratio coste-efectividad incremental (RCEI) de 28.443,81 euros/mes de libre de progresión ganado y de 72.560,74 euros/año de vida ganado (AVG).
ESCENARIO 2: calculamos el coste efectividad incremental en base a los costes de adquisición de los medicamentos SIN aprovechamiento de viales y con todos los costes directos asociados (visitas a hospital de día, mucositis, neutropenia y utilización de dexrazoxano) y los datos de eficacia del ensayo clínico pivotal. Según los datos de eficacia del ensayo clínico y la diferencia de costes entre los tratamientos, si se trata a los pacientes con OlaDox en lugar de con Dox sola tendríamos un RCEI de 30.879,79 euros/mes libre de progresión ganado y de 78.774,99 euros/AVG.
Análisis coste utilidad publicado
Recientemente, se ha publicado por Tikhonova, IA et al. (2017)14 la revisión crítica del Evidence Review Group (ERG) sobre el análisis presentado por el fabricante (Lilly) al National Institute for Health and Care Excellence (NICE) respecto a la evaluación económica. El NICE invitó a la compañía farmacéutica Lilly a entregar una revisión de la evidencia y un análisis coste-efectividad de olaratumab en combinación con doxorrubicina para el tratamiento del SPB de aquellos pacientes no susceptibles de cirugía o radioterapia. La compañía Lilly examinó la efectividad clínica y económica del tratamiento combinado de OlaDox, en comparación con tratamientos con Dox solamente e ifosfamida más doxorrubicina (IfoDox). IfoDox, rara vez se usa para tratar SPB en el Reino Unido, por lo que el Comité de Evaluación del NICE concluyó que el comparador más relevante para Ola-Dox era la doxorrubicina en monoterapia y no consideró IfoDox como un comparador en la evaluación final.
Según la documentación entregada finalmente por el fabricante, el olaratumab sería considerado como una alternativa a la doxorrubicina, fármaco que se ha utilizado como tratamiento de primera línea para el SPB avanzado durante más de tres décadas. La compañía argumentó que dado que la dosis acumulada máxima de por vida de la doxorrubicina permitida en la práctica clínica del Reino Unido es de 450 mg/m2 (igual a seis ciclos de tratamiento a una dosis de 75 mg/m2), aquellos pacientes que ya hayan recibido doxorrubicina en primera línea, no podrían tener como tratamiento OlaDox en posteriores líneas.
En este análisis coste-utilidad, se tuvieron en cuenta las siguientes premisas:
Los costes totales fueron expresados en libras esterlinas (año 2015).
Se incluyeron los costes de adquisición del medicamento, costes de administración, manejo de la enfermedad, costes de tratar efectos adversos y costes de monitorización cardiaca. Los factores estimulantes de colonias se administraron en función del peso del paciente mientras que otros fármacos se administraron en función de la superficie corporal. Se asumió un peso de 77,3 kg y una superficie corporalde 1,91 m2.
Debido a que en la práctica clínica de Reino Unido no se administra una dosis acumulada de antraciclinas superior a 450 mg/m2 por el potencial riesgo de cardiotoxicidad, la compañía presentó un análisis del escenario en Reino Unido con un máximo de seis ciclos en vez de ocho ciclos de OlaDox.
Se asumió disponibilidad de dos presentaciones de olaratumab vial: de 500 mg y 190 mg y no se asumió en aprovechamiento de viales.
Los costes de administración de los fármacos (con premedicación incluida) asumidos fueron de dos horas en el caso de OlaDox y de sesenta minutos en el caso de Dox.
En el ensayo pivotal17, los pacientes con SPB avanzado recibieron hasta cuatro líneas de terapia sistémica contra el cáncer después de los tratamientos experimentales a estudio. En el caso base, la compañía asumió que el costo total del tratamiento en la enfermedad en progresión es independiente de la supervivencia posprogresión; es decir, el coste del tratamiento posprogresión era igual en ambas ramas de tratamiento.
En el análisis del caso base, el coste de tratar eventos adversos de grado 3 o superior se calcularon combinando la proporción de eventos que probablemente requieran hospitalización basándose en los datos del ensayo pivotal13, con las estimaciones de los costes por evento extraídos de los costes de referencia del NHS. Los costes de manejar eventos adversos fueron contabilizados en el primer año del modelo presentado.
Respecto a la utilidad en el ensayo pivotal13 no se recogieron ni analizaron datos de calidad de vida, así que la compañía realizó una búsqueda bibliográfica para identificar datos publicados relativos a la calidad de vida. Se tomaron los datos de 0,72 y 0,56 de Reichardt et al.18.
En cuanto al análisis coste-utilidad presentado por la compañía al NICE, lo podemos ver resumido en la Tabla 3.
Tabla 3 Análisis coste-utilidad presentado por el fabricante y revisado por ERG del NICE
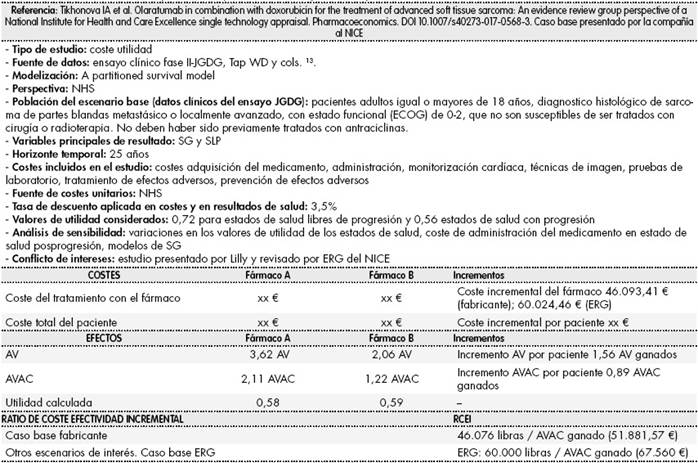
Cambio utilizado en la tabla, 1 Libra = 1,126 € (noviembre 2017). AV: año de vida ganado; AVAC: año de vida ajustado por calidad de vida; SG: supervivencia global; SLP: supervivencia libre de progresión; ERG: European Regulatory Group; NICE: National Institute for Health and Care Excellence.
Análisis coste utilidad de elaboración propia
Hemos realizado un análisis coste-utilidad de elaboración propia, considerando por un lado los datos de años de vida ajustados por calidad de vida AVAC , obtenidos con los tratamientos OlaDox vs. Dox (Tikhonova, IA et al.)14 y la diferencia de costes entre ellos según el precio notificado en España, de tal manera que si se trata a los pacientes con OlaDox en vez de con Dox cada AVAC adicional que ganan los pacientes costará 86.449,59 euros/AVAC (Tabla 4).
Tabla 4 Análisis coste-utilidad de elaboración propia utilizando datos de AVAC del estudio Tikhonova IA et al.14 y coste incremental obtenido en nuestro estudio

AVAC: años de vida ajustados por calidad; A: esquema Oladox; B: esquema Dox; RCEI: ratio o razón coste-eficacia incremental; SLP: supervivencia libre de progresión; SG: supervivencia global.
Si tomamos los AVAC calculados con la mediana de SLP y SG y los valores de utilidades 0,72 para SLP y 0,56 para SG de Reichardt et al.18 obtenemos que cada AVAC adicional costará 132.198,11 euros/AVAC.
Análisis de sensibilidad
Se realizaron cuatro análisis de sensibilidad, teniendo en cuenta los siguientes supuestos (Tabla 5):
Tabla 5 Razón coste-eficacia Incremental (RCEI). Análisis de sensibilidad con supuestos distintos a las condiciones basales de uso
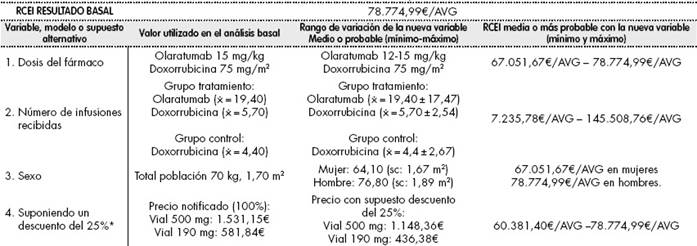
*Se aplica la deducción del Real Decreto Ley 8/2010 además del 4% de IVA para todos los medicamentos implicados en el análisis. En todos los supuestos se mantuvo la condición de NO aprovechamiento de viales, como en el caso basal. ⨰: media aritmética; AVG: años de vida ganados; RCEI: ratio coste-eficacia incremental.
ANÁLISIS 1: Se planteó la necesidad de realizar un análisis de sensibilidad ya que el olaratumab es un fármaco que puede producir reacciones adversas de grado 3 a nivel gastrointestinal y musculo-esquelético, además de las que origina a nivel hematológico, y en estos casos la dosis de olaratumab debe suspenderse hasta que la toxicidad sea ≤ grado 1 o se haya vuelto al estado basal previo al tratamiento. Para perfusiones posteriores, la dosis se debe reducir a 12 mg/kg en caso de toxicidades graves Grado 3. Por tanto, planteamos un análisis de sensibilidad con dosis de olaratumab a 12 mg/kg. No consideramos reducción de dosis en el caso de doxorrubicina. El RCEI máximo se estimó considerando los costes de neutropenia, mucositis, etc. Estimamos un RCEI que podía oscilar entre 67.051,67 euros/ AVG-78.774,99 euros/AVG (RCEI basal).
ANÁLISIS 2: Como existe una desviación posible en el número de ciclos de olaratumab recibidos (el rango varía entre 1-83); consideramos necesario realizar otro análisis en función de la media y desviación estándar de infusiones recibidos de olaratumab ( = 19,4 ± 17,47), así como de doxorrubicina ( = 5,7 ± 2,54), contando en este caso que el máximo es de ocho infusiones). Se realizó el análisis tomando los límites inferior y superior de las infusiones recibidas de doxorrubicina y olaratumab, y del uso en consecuencia del hospital de día. Se realizó el mismo procedimiento para las infusiones de doxorrubicina en el grupo control ( = 4,4 ± 2,67), para comparar y obtener el RCEI. Se eliminó el coste del dexrazosano en los límites inferiores ya que no se alcanzaron ciclos de doxorrubicina suficientes para ser requerido. El resto de variables permanecieron constantes. En este caso, y dada la gran desviación en el número de infusiones, el RCEI varía entre 7.235,78 euros/AVG y 145.508,76 euros/AVG.
ANÁLISIS 3: Dado que el olaratumab se dosifica por peso, se esperan diferencias en el RCEI entre hombres y mujeres, ya que según el Instituto Nacional de Estadística (INE)19 las mujeres españolas tienen un peso de 64,1 kg (SC = 1,675 m2) y los hombres 76,8 Kg (SC = 1,89 m2). Con estas consideraciones, y teniendo en cuenta constantes el resto de las variables, incluida la eficacia (HR = 0,55 en hombres vs. 0,53 mujeres), el RCEI oscila entre 67.051,67 euros/AVG en mujeres, y 78.774,99 euros/AVG (RCEI basal) en hombres, coincidiendo con la hipótesis del análisis 1. Consideramos relevante esta distinción por haber un 60% de pacientes hombres con SPB.
ANÁLISIS 4: Dado que pueden existir diferencias entre el precio notificado de los viales y el coste real de los mismos, suponemos un descuento aleatorio del 25% sobre el precio notificado (únicamente en los viales de olaratumab). En este caso, el RCEI oscilaría entre 60.381,4euros/AVG y 78.774,99 euros/AVG (RCEI basal).
No se han identificado subgrupos en particular en los que el tratamiento pudiera tener resultados estadísticamente significativos, por lo que no se realizó análisis de sensibilidad por subgrupos.
Estimación del impacto presupuestario y de los beneficios esperados en salud
La población española según censo de INE19 es de 46.528.966 habitantes y la población española ≥ 18 años es de 38.400.583 (01/01/2017). Teniendo en cuenta cifras de incidencia de 8 por 100.000 y año; la presentación como metastásico en el 20% y el riesgo de recidiva metastásica del 35% en SPB20, estimamos que la población de pacientes metastásico/año con SPB en nuestro país sería de 1.800 casos
Si consideramos restricciones de edad, morbilidad e indicación, (referidas sobre todo a la toxicidad cardiaca producida por la doxorrubicina), la cifra de potenciales candidatos para la administración del olaratumab se reduciría hasta entre 800 y 1.200 por año.
Dada la media de ciclos de tratamiento recibidos (9,7), consideramos el tratamiento de duración limitada (< 1 año).
Estimación de la población diana en tratamientos de duración limitada (Tabla 6)
Tabla 6 Estimación de la población diana susceptible de recibir tratamiento. Datos obtenidos del Informe Olaratumab SEOM20
Observaciones: la población diana de este apartado ha sido extraída íntegramente del informe de evaluación de la SEOM20. Referencias: Informe de Evaluación SEOM de Olaratumab (Lartruvo®) en combinación con doxorubicina doxorubicina en sarcomas de partes blandas avanzados del adulto (consultado enero 2017).20 SEOM: Sociedad Española de Oncología Médica.
La población diana anual de candidatos a tratamiento con olaratumab, en pacientes con SPB metastásico, en primera línea de tratamiento y en las condiciones de uso establecidas, se estima que sería de 800 a 1.200 pacientes en el ámbito del estado español.
No consideramos razones para esperar cambios en la evolución natural de la enfermedad, ni variaciones mayores en la incidencia y prevalencia de la patología.
Se realizaron análisis de sensibilidad donde los dos principales aspectos del análisis de sensibilidad a valorar serán las posibles alternativas de coste de adquisición del medicamento y las variaciones en la cuantificación de la población diana en función de los diferentes escenarios plausibles.
Análisis de sensibilidad en función de los costes de adquisición del medicamento evaluado
ESCENARIO 1. El coste incremental por paciente sería de 79.974,40 euros según el precio consultado en BOT-PLUS web15. Se aplicó el descuento del Real Decreto Ley 8/201016 así como el 4% de IVA. PVL notificado de un vial de olaratumab de 500 mg/50 ml es de 1.531,15 euros y de un vial de 190 mg/19 ml es de 581,84 euros.
ESCENARIO 2. Si tenemos en cuenta disponibilidad a pagar de 21.000 euros/AVAC, el coste de un vial de 500 mg de olaratumab debería ser de: 314,87 euros/vial de 500 mg y 121,45 euros vial de 190 mg si consideramos SG.
ESCENARIO 3. Si tenemos en cuenta 30.000 euros/AVAC, el coste de un vial de 500 mg de olaratumab debería ser 506,54 euros/vial y el coste de un vial de 190 mg 195,37 euros si consideramos SG.
La población diana en España ya hemos calculado que se situaría entre 800-1.200 pacientes. El impacto a nivel estatal, por tanto, se situaría en torno a 61.759.592 euros y 92.639.388 euros; 166,66-250 años de vida libre de progresión ganados, 784-1.176 años de supervivencia global ganados y 714,4-1.071,6 AVAC ganados (datos de AVAC de Tikhonova et al. 2017)14.
Andalucía cuenta con una población aproximada de 6.766.814 habitantes mayores de 18 años en 2016; si extrapolamos los datos de España a Andalucía tenemos que en Andalucía se producirán aproximadamente 141-212 nuevos casos/año de SPB susceptibles de tratamiento con olaratumab. A nivel autonómico, el impacto económico se situaría entre 10.885.128 euros y 16.366.291 euros; 29,38 -44,16 años de vida libre de progresión ganados, 138,18-207,76 años de supervivencia global ganados y 125,91-189,32 AVAC ganados (datos de AVAC de Tikhonova et al. 2017)14.
De acuerdo a la relación coste-efectividad incremental e impacto presupuestario este fármaco se situaría en el cuadrante de medicamentos con relación coste-efectividad claramente por encima del umbral y de impacto presupuestario alto.
Con el análisis efectuado, tomando como supuestos el precio notificado y como supuestos teóricos los 21.000 y 30.000 euros/AVAC, observamos que el RCEI del medicamento, así como el impacto presupuestario estimado están muy por encima de los óptimos.
Al no haber detectado ningún subgrupo en el estudio de Tap, WD et al. (2016)13 de pacientes en el que el tratamiento combinado de olaratumab y doxorrubicina sea más eficaz, solo podemos recomendar un descenso significativo del precio notificado, hasta los 314,87 euros/vial de 500 mg y 121,45 euros/vial de 190 mg.
Si consideramos el umbral 21.000 euros/AVAC, el coste de un vial de 500 mg de olaratumab debería ser: 314,87 euros/vial de 500 mg y 121,45 euros/vial de 190 mg, (consideramos SG). El coste incremental total para 0,98 años ganados sería de 20.580 euros. De acuerdo con estos criterios, el impacto presupuestario estatal, si consideramos entre 800-1.200, pacientes se situaría entre 16.464.000 euros y 24.696.000 euros.
Si consideramos el umbral 30.000 euros/AVAC, el coste de un vial de 500 mg de olaratumab debería ser 506,54 euros/vial, y el precio de la presentación de 190 mg/19ml de 195,37 euros (consideramos SG). El coste incremental para 0,98 años de ganancia sería de 29.400 euros. De acuerdo con estos criterios, el impacto presupuestario estatal, si consideramos entre 800-1.200 pacientes, se situaría entre 23.520.000 euros y 35.280.000 euros.
Si consideramos el umbral 11.000 euros/AVAC, el coste de un vial de 500 mg de olaratumab debería ser 101,91 euros/vial y el precio de la presentación de 190 mg/19ml de 39,31euros (consideramos SG). El coste incremental para 0,98 años de ganancia sería de 10.780 euros. De acuerdo con estos criterios, el impacto presupuestario estatal, si consideramos entre 800-1.200 pacientes, se situaría entre 8.624.000 euros y 12.936.000 euros.
Discusión
La cantidad de ciclos de doxorrubicina recibidos podría suponer un punto de conflicto con la aplicabilidad del ensayo clínico en un hospital, ya que en el brazo de estudio, la doxorrubicina se administra durante un máximo de ocho ciclos a 75 mg/m2 (dosis total acumulada de 600 mg/m2), de igual forma al brazo control, lo cual en la práctica clínica habitual, debido a la toxicidad de las antraciclinas, no suele llegar a alcanzarse, limitando la dosis acumulativa recibida de manera general a unos 450-500 mg/m2 y una mediana de cuatro ciclos21,22. Este hecho hace más relevante aún la inclusión del dexrazoxano como agente modulador de la toxicidad de los ciclos quinto al octavo, que además incrementaría el coste total del tratamiento de manera relevante.
También es importante comentar que los pacientes podían haber recibido líneas previas para su enfermedad avanzada siempre y cuando no fueran doxorrubicina, daunorrubicina, idarrubicina, y/u otras antraciclinas y antraquinonas o terapia previa con cualquier agente dirigido a la vía PDGF/PDGFR. Esto podría comprometer la interpretación de los resultados del ensayo clínico al haber recibido los pacientes líneas previas de tratamiento para el estadio avanzado de su enfermedad.
Debemos tener también en cuenta que en el ensayo pivotal no se incluyeron pacientes con valor de la escala Eastern Cooperative Oncology Group (ECOG) mayor de dos, y que tan solo un 27,3% (n = 18) de los pacientes del grupo de tratamiento eran mayores de 65 años, lo que arroja dudas sobre los resultados de la combinación OlaDox en estos pacientes9.
Llama la atención la gran variabilidad existente entre la SLP (2,5 meses) y la SG (11,8 meses). Esta diferencia, no justificada por el curso natural de la enfermedad, es un punto de discusión en algunos artículos de opinión23, que dejan en el aire la posibilidad de un efecto inmunológico del olaratumab, ya que su respuesta recuerda a algunos anticuerpos utilizados en inmunoterapia como el ipilimumab en melanoma, si bien esta suposición, meramente especulativa, debe contrastarse en los estudios posteriores de fase III.
La mayor tasa de SG obtenida en el grupo experimental está asociada con un retraso modesto en la progresión del tumor. Tampoco se observa diferencia entre los pacientes con PDGFR-α‘ positivo o negativo, por lo que no se puede explicar la correlación entre este receptor y la mejora o no en SG. Queda por resolver la incógnita entre la base biológica de la enfermedad y los buenos resultados obtenidos en SG, aunque si bien hay que destacar que el brazo experimental pasaba a olaratumab en monoterapia y que en el grupo control se permitió el cruce a olaratumab en monoterapia tras progresión. La N de los pacientes que llegan a recibir olaratumab en monoterapia es muy pequeña en ambos brazos, unos 30 aproximadamente en cada rama de tratamiento9.
Se realizó un análisis por subgrupos utilizando la calculadora META-SURV24, calculando la p de interacción entre subgrupos para cada uno de los mismos detallados en el ensayo pivotal. No hay ningún subgrupo que se beneficie del tratamiento. Dado que la diana terapéutica del olaratumab es el PDGFR, es llamativo que su expresión no sea relevante en la eficacia del tratamiento, más aún cuando (aunque sin diferencias estadísticamente significativas), el HR es menor en el grupo que NO expresa la diana. Hasta el momento no se dispone de ningún biomarcador predictivo. La expresión proteínica con el anticuerpo testado para PDGFR-α‘ no mostró valor predictivo para el olaratumab.
En noviembre de 2017 se ha publicado el Informe de posicionamiento terapéutico (IPT) del olaratumab25 en la página web de la Agencia Española de Medicamentos y Productos Sanitarios con la siguiente conclusión: la combinación del olaratumab con la doxorrubicina seguida de mantenimiento de olaratumab se posiciona como opción preferente frente a la doxorrubicina sola en pacientes con SPB avanzado que no sean candidatos para tratamiento con cirugía o radioterapia y que no hayan sido tratados previamente con antraciclinas, en primera y sucesivas líneas, según los resultados preliminares del estudio pivotal JGDG13. Por último, debe tenerse en cuenta que este medicamento ha sido autorizado en base a la alta relevancia clínica de los resultados, si bien se trata de una aprobación condicional y habrá que esperar a la confirmación de los resultados definitivos del ensayo fase III.
A la vista de los resultados de eficacia y seguridad del ensayo fase Ib/II y teniendo en cuenta la conveniencia y el coste considerado para hacer los análisis económicos, los autores del informe concluyeron que el olaratumab es un fármaco que aporta un beneficio significativo en SG, no así en SLP.
Dado que los pacientes podían haber recibido líneas previas para su enfermedad avanzada siempre y cuando no fueran doxorrubicina, daunorrubicina, idarrubicina, y/u otras antraciclinas y antraquinonas o terapia previa con cualquier agente dirigido a la vía PDGF/PDGFR, no queda clara la utilidad en primera línea de tratamiento. Los datos disponibles en pacientes ≥ 65 y con ECOG ≥ 2 son muy limitados.
Para poder utilizarse en SPB y que resultase coste-efectivo el coste de adquisición del vial de 500 mg debería situarse entre 101,91 euros y 506,54 euros y el del vial de 190 mg entre 39,31 euros y 195,37 euros. Además, habría que realizar una nueva evaluación y posicionamiento del fármaco cuando se presentasen los datos del ensayo clínico fase III.
Bibliography
Sociedad Española de Oncología Médica. Información sobre tipos de cáncer (página Web). Madrid: SEOM; 2017 (actualizado 22/02/2017; consultado 21/11/2017). Disponible en: https://www.seom.org/es/info-sobre-el-cancer/sarcomas-partes-blandas?showall = 1 [ Links ]
Trojani M, Contesso G, Coindre JM, Rouesse J, Bui NB, de Mascarel A, et al. Soft-tissue sarcomas of adults: study of pathological prognostic variables and definition of a histopathological grading system. Int J Cancer. 1984;33(1):37- 42. DOI: 10.1002/ijc.2910330108 [ Links ]
Fletcher CDM, Bridge JA, Hogendoorn PCW, Mertens F. WHO Classification of Tumours of Soft Tissue and Bone. Pathology and Genetics of Tumours of Soft Tissue and Bone. 4ª ed. Lyon: IARC Press; 2013. [ Links ]
Stiller CA, Trama A, Serraino D, Rossi S, Navarro C, Chirlaque MD, et al. Descriptive epidemiology of sarcomas in Europe: report from the RARE CARE project. Eur J Cancer. 2013;49(3):684-95. DOI: 10.1016/j.ejca.2012.09.011 [ Links ]
Wibmer C, Leithner A, Zielonke N, Sperl M, Windhager R. Increasing incidence rates of soft tissue sarcomas? A population-based epidemiologic study and literature review. Ann Oncol. 2010;21(5):1106-11. DOI: 10.1093/annonc/mdp415 [ Links ]
Surveillance, Epidemiology, and End Results (SEER) Program (página web). USA: National Cancer Institute; 2017 (actualizado 15/12/2017; consultado 01/2017). Disponible en: http://www.seer.cancer.gov [ Links ]
Benjamin RS, Wiernik PH, Bachur NR. Adriamycin: a new effective agent in the therapy of disseminated sarcomas. Med Pediatr Oncol. 1975;1(1):63-76. [ Links ]
García del Muro X, de Álava E, Artigas V, Bagué S, Braña A, Cubedo A, et al. Clinical practice guidelines for the diagnosis and treatment of patients with soft tissue sarcoma by the Spanish group for research in sarcomas (GEIS). Cancer Chemother Pharmacol. 2016;77:133-46. DOI: 10.1007/s00280-015-2809-5 [ Links ]
Comité de Medicamentos de Uso Humano de la Agencia Europea del Medicamento. European Public Assessment Report (EPAR): Lartruvo® (página web). Londres: Agencia Europea del Medicamento; 2016 (consultado 11/2017). Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_Public_assessment_report/human/004216/WC5002 16871.pdf [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Centro información online de medicamentos (CIMA). Ficha técnica del medicamento: Lartruvo® (página web). Madrid: Agencia Española de Medicamentos y Productos Sanitarios; 2016 (consultado 11/2017). Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1161143001/FT_1161143001.pdf [ Links ]
European Medicine Agency. Detalles autorización olaratumab (página web). Londres: 2016 (consultado 11/2017). Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl = pages/medicines/human/medicines/004216/human_med_002036.jsp&mid = WC0b01ac058001d124 [ Links ]
Ortega Eslava A, Marín Gil R, Fraga Fuentes MD, López-Briz E, Puigventós Latorre F (GENESIS-SEFH). Guía de evaluación económica e impacto presupuestario en los informes de evaluación de medicamentos. (Monografía en internet). Guía práctica asociada al programa MADRE v 4.0. Madrid: SEFH (ed.); 2016 (consultado 11/2017). Disponible en: http://gruposdetrabajo.sefh.es/genesis [ Links ]
Tap WD, Jones RL, Van Tine BA, Chmielowski B, Elias AD, Adkins D, et al. Olaratumab and doxorubicin versus doxorubicin alone for treatment of softtissue sarcoma: an open-label phase 1b and randomised phase 2 trial. Lancet. 2016;388(10043):488-97. DOI: 10.1016/S0140-6736(16)30587-6 [ Links ]
Tikhonova IA, Jones-Hughes T, Dunham J, Warren FC, Robinson S, Stephens P, et al. Olaratumab in Combination with Doxorubicin for the Treatment of Advanced Soft Tissue Sarcoma: An Evidence Review Group Perspective of a National Institute for Health and Care Excellence Single Technology Appraisal. Pharmacoeconomics. 2018;36(1):39-49. DOI: 10.1007/s40273-017-0568-3 [ Links ]
Consejo General de Colegios Oficiales de Farmacéuticos. Bot Plus Web (Base de datos en internet). Madrid: Consejo General de Colegios Oficiales de Farmacéuticos 2002 (consultado: 11/2017). Disponible en https://botplusweb.portalfarma.com [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad. Listado de medicamentos afectados por el Real Decreto Ley 8/2010 a Noviembre de 2017 (consultado 11/2017). Disponible en: http://www.msssi.gob.es/profesionales/farmacia/pdf/DeduccionesNoviembre2017.pdf [ Links ]
OblikueConsulting, S. L. Base de datos de costes sanitarios españoles: eSalud (Base de datos en Internet). Barcelona: OblikueConsulting, S.L.; 2007 (consultado 11/2017). Disponible en: http://www.oblikue.com/bddcostes/ [ Links ]
Reichardt P, Leahy M, García del Muro X, Ferrari S, Martin J, Gelderblon H. Quality of Life and Utility in Patients with Metastatic Soft Tissue and Bone Sarcoma: The Sarcoma Treatment and Burden of Illness in North America and Europe (SABINE) Study. Sarcoma. 2012;2012:740279. DOI: 10.1155/2012/740279 [ Links ]
INE base/Demografía y población/Cifras de población y censos demográficos/Cifras de Población (Base de datos en Internet). Madrid: Instituto Nacional de Estadística; 1946 (consultado 11/2017). Disponible en: http://www.ine.es/dyngs/INEbase/es/operacion.htm?c = Estadistica_C&cid = 1254736176951&menu = ultiDatos&idp = 1254735572981 [ Links ]
Informe de Evaluación SEOM de olaratumab (Lartruvo®) en combinación con doxorrubicina en sarcomas de partes blandas avanzados del adulto (página web). Madrid: Sociedad Española de Oncología Médica; 2017 (consultado 23/01/2017). Disponible en http://seom.org/seomcms/images/stories/Informes_SEOM/IPT_Olaratumab.pdf [ Links ]
Karavasilis V, Seddon BM, Ashley S, Al-Muderis O, Fisher C, Judson I. Significant clinical benefit of first-line palliative chemotherapy in advanced soft-tissue sarcoma: retrospective analysis and identification of prognostic factors in 488 patients. Cancer. 2008;112(7):1585-91. DOI: 10.1002/cncr.23332 [ Links ]
Floyd JD, Nguyen DT, Lobins RL, Bashir Q, Doll DC, Perry MC. Cardiotoxicity of cancer therapy. J Clin Oncol. 2005;23(30):7685-96. DOI: 10.1200/JCO.2005.08.789 [ Links ]
Judson I, Van der Graaf WT. Sarcoma: Olaratumab-really a breakthrough for soft-tissue sarcomas? Nat Rev Clin Oncol. 2016;13(9):534-6. DOI: 10.1038/nrclinonc.2016.123 [ Links ]
Primo J, Escrig J. MetaSurv: calculadora Excel para metaanálisis de supervivencia. Programa de habilidades en lectura crítica en español (página web). Alicante: 2008 (consultado 03/2017). Disponible en: http://www.redcaspe.org/herramientas/descargas/MetaSurv.xls [ Links ]
Informe de posicionamiento terapéutico de olaratumab (Lartruvo®) para el tratamiento de primera línea de sarcomas de partes blandas avanzados (página web). Madrid: Agencia Española de Medicamentos y Productos Sanitarios; 2017 (consultado 11/2017). Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-olaratumab-Lartruvo-sarcoma-TBA.pdf [ Links ]
Recibido: 13 de Octubre de 2017; Aprobado: 22 de Enero de 2018











 text in
text in 


