My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.42 n.6 Toledo Nov./Dec. 2018 Epub Nov 09, 2020
https://dx.doi.org/10.7399/fh.11016
ORIGINALES
Análisis de impacto presupuestario del implante intravítreo de dexametasona para el tratamiento del edema macular diabético
1Servicio de Oftalmología, Consorci Hospital General Universitari de Valencia, Valencia. Spain.
2Pharmacoeconomics & Outcomes Research Iberia (PORIB), Pozuelo de Alarcón, Madrid. Spain.
3Servicio de Oftalmología, Hospital Universitario La Paz, Madrid. Spain.
4Servicio de Oftalmología, Hospital Universitari de Bellvitge, Hospitalet de Llobregat, Barcelona. Spain.
5Pricing and Market Access, Allergan S.A.U., Tres Cantos, Madrid. Spain.
Objetivo:
Determinar el impacto económico tras la inclusión del implante intravítreo de dexametasona para el tratamiento del edema macular diabético en un área sanitaria en España.
Método:
Se diseñó un modelo de impacto presupuestario a tres años para estimar los costes directos en pacientes adultos con edema macular diabético, desde la perspectiva del Sistema Nacional de Salud, considerando terapias intravítreas actualmente utilizadas (aflibercept/ranibizumab/dexametasona). La población diana se obtuvo a partir de la prevalencia (6,41%) e incidencia (0,82%) del edema macular diabético publicadas para una población de 25.000 pacientes adultos. Se asumió un 20%, 30% y 40% anual de pacientes tratados con dexametasona, respectivamente. El coste total incluyó: coste farmacológico (precio de venta del laboratorio con deducción obligatoria y fraccionamiento de viales, según frecuencia de inyecciones necesarias cada año de tratamiento), administración intravítrea, seguimiento de pacientes y manejo de eventos oculares (cataratas, hipertensión ocular, endoftalmitis, hemorragia intravítrea y desprendimiento de retina) y cardiovasculares. El consumo de recursos según la práctica habitual fue estimado por expertos en retina y vítreo. Los costes unitarios (€, 2016) se obtuvieron de la literatura y de bases de datos nacionales. Los análisis de sensibilidad evaluaron la robustez del modelo.
Resultados:
La inclusión del implante intravítreo de dexametasona supondría reducciones de 35.030 € (-4,2%), 10.743 € (-1,8%) y 5.051 € (-0,9%) cada año, respectivamente, disminuyendo principalmente por el menor número anual de inyecciones requeridas con dexametasona. La reducción anual promedio supondría 350 €, 96 € y 41 € por paciente.
Conclusiones:
La inclusión del implante intravítreo de dexametasona para el tratamiento del edema macular diabético supone ahorros para el área sanitaria considerada, fundamentalmente por la reducción de costes de administración.
PALABRAS CLAVE: Presupuestos; Costes y análisis de costes; Dexametasona; Inyección intravítrea; Edema macular; España
Introducción
El edema macular diabético (EMD) es una enfermedad ocular de elevado impacto en pacientes con diabetes mellitus debido a que es la principal causa del deterioro visual en la retinopatía diabética y, por consiguiente, de ceguera en esta población1.
Este trastorno inflamatorio es consecuencia de los cambios metabólicos secundarios a la hiperglucemia provocados por la retinopatía diabética en la mácula. Cambios vasogénicos que inducen la ruptura de la barrera hematorretiniana junto con una activación inflamatoria conllevan un daño retinal grave y cambios maculares crónicos2.
Los objetivos clínicos en el abordaje terapéutico del EMD son reducir el nivel de edema y prevenir la afectación de la visión3. El tratamiento, basado en un buen control metabólico (glucemia, hipertensión, perfil lipídico, función renal), requiere medidas adicionales para evitar la pérdida de visión, como la fotocoagulación láser y el tratamiento farmacológico4. Entre las terapias autorizadas para el EMD se encuentran dos grupos de fármacos, administrados mediante inyección intravítrea: los agentes inhibidores del factor de crecimiento endotelial vascular (anti-VEGF), como ranibizumab y aflibercept, y los corticosteroides, como dexametasona en implante estéril de liberación prolongada. De posología variable, el mantenimiento de la respuesta al tratamiento determinará la frecuencia de administración de las inyecciones. Estas terapias han demostrado su eficacia en diversos ensayos clínicos5 6-7, estando todas indicadas en pacientes con EMD, sin perjuicio de la existencia de recomendaciones o protocolos que establezcan algoritmos específicos de tratamiento.
La ceguera, la retinopatía diabética y el EMD son muy frecuentes en pacientes diabéticos. En estos pacientes, la prevalencia de ceguera oscila entre el 4% y el 11%, la prevalencia de retinopatía diabética se sitúa en torno al 40% y la de EMD oscila entre el 1,4% y el 7,9%8. La presencia de EMD y la pérdida de agudeza visual condicionan negativamente la calidad de vida relacionada con la salud de los pacientes y repercuten también en la capacidad de realizar actividades de la vida diaria, incluyendo el autocontrol de la diabetes9,10.
El EMD y la retinopatía diabética presentan un elevado impacto económico debido tanto a los costes directos como indirectos por una disminución de ingresos y una mayor necesidad de atención social al empeorar la visión11. Se estima que el consumo anual de recursos y el coste sanitario directo por paciente con EMD podría ser aproximadamente el doble que en pacientes sin EMD12. La afectación bilateral del EMD presentaría un mayor impacto en los costes directos sanitarios con mayores costes indirectos por afectación de la vida laboral13.
El objetivo del presente trabajo consiste en determinar el impacto económico sobre el presupuesto del Sistema Nacional de Salud (SNS) que implica la inclusión de un implante intravítreo de dexametasona para el tratamiento del EMD en un área sanitaria en España.
Métodos
Se realizó un análisis de impacto presupuestario basado en recomendaciones nacionales e internacionales14,15. Este análisis se desarrolló en Microsoft Excel, recurriendo a la asesoría de un panel de expertos, compuesto por tres oftalmólogos especialistas en retina y vítreo, con objeto de validar los valores de los parámetros obtenidos de la literatura médica y consensuar el consumo de recursos según la práctica clínica habitual. Este análisis evaluó el impacto incremental presupuestario asignado al EMD debido a la incorporación de una nueva alternativa terapéutica: el implante intravítreo de dexametasona.
Alternativas terapéuticas y escenarios considerados
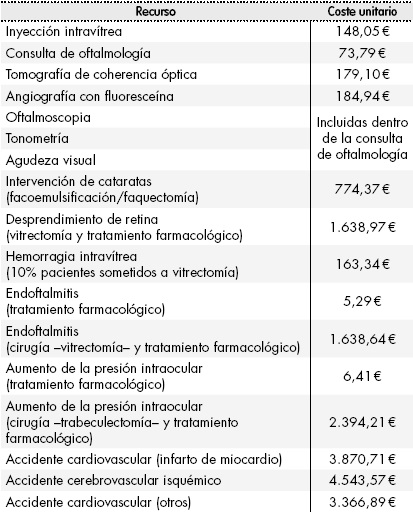
En este análisis se consideraron las alternativas terapéuticas financiadas con indicación actualmente en uso en el tratamiento del EMD: aflibercept 40 mg/ml solución inyectable y ranibizumab 10 mg/ml solución inyectable e implante intravítreo de dexametasona 700 µg en aplicador. Se compararon dos escenarios diferenciados: un escenario en el que el implante intravítreo de dexametasona no se encuentra disponible (solo se dispone de aflibercept y ranibizumab) y otro en el que el implante intravítreo de dexametasona se incorpora al arsenal terapéutico del EMD. Para cada escenario, se calcularon los costes asociados al manejo del EMD con cada una de las alternativas disponibles en ese escenario. Los costes obtenidos se ponderaron según el porcentaje de utilización de cada uno de los medicamentos seleccionados para obtener los costes totales de cada escenario. El impacto presupuestario derivado de la inclusión de la nueva alternativa se calculó mediante la comparación de los costes totales generados entre ambos escenarios (escenario CON versus escenario SIN implante intravítreo de dexametasona). En laTabla 1se detalla el porcentaje de utilización definido para cada uno de los medicamentos en cada escenario (estimación interna (caso base) y según panel de expertos (análisis alternativo)).
Tabla 1. Número de inyecciones anuales, porcentaje de utilización y precio unitario de las alternativas terapéuticas
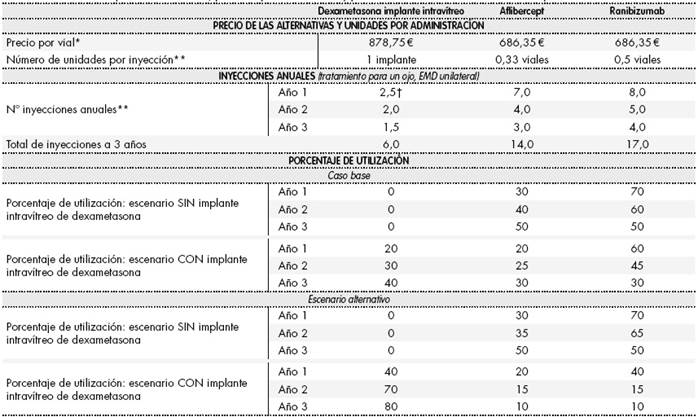
*PVL notificado con deducción del Real Decreto-Ley 8/2010. **Determinadas por panel de expertos según práctica clínica real. †En la práctica clínica real se establece un intervalo de tratamiento de 5 meses en pacientes naive (2-3 administraciones en el año).
Población diana
La población diana candidata a tratamiento consiste en pacientes diabéticos con edema macular en tratamiento con terapias oftalmológicas intravítreas. Se determinó considerando un área de población de 25.000 habitantes adultos a partir de datos epidemiológicos. Se consideraron la prevalencia anual de diabetes mellitus diagnosticada (7,8%)16y de EMD (5,73% en diabetes tipo 1 y 6,44% en diabetes tipo 2)17y la incidencia de EMD (6,36% a 8 años en pacientes diabéticos)18para todo el periodo de análisis. La proporción de pacientes diagnosticados con EMD que reciben tratamiento (80%) y la proporción de pacientes con afectación de ambos ojos (EMD bilateral) (60%) fue determinada por el panel de expertos en función de la práctica clínica habitual.
Perspectiva, horizonte temporal y tasa de descuento
La perspectiva considerada en este análisis fue la del SNS, por lo que sólo se han considerado costes sanitarios directos. No se ha aplicado tasa de descuento al no realizarse comparación interanual entre costes. El horizonte temporal analizado correspondió a un periodo de 3 años.
Recursos y costes considerados
Los costes considerados según la perspectiva seleccionada fueron: costes farmacológicos, costes de administración, costes de monitorización/ seguimiento (incluyendo pruebas realizadas y visitas de seguimiento) y costes del manejo de acontecimientos adversos. El coste de los recursos se estableció mediante el consumo estimado de cada uno de los recursos y sus costes unitarios.
Para estimar el coste farmacológico se consideró el precio de venta del laboratorio (PVL), que corresponde con el precio oficial notificado19, aplicando en cada caso las deducciones establecidas por el Real Decreto-Ley 8/2010. El coste farmacológico de cada una de las alternativas consideradas se estimó en función de las inyecciones anuales necesarias y del número de viales de cada medicamento utilizado en cada inyección. Como reflejo de la práctica clínica habitual, se consideró la división del contenido de los viales de aflibercept (para tres inyecciones intravítreas) y de ranibizumab (para dos inyecciones intravítreas), sin considerar el coste adicional del Servicio de Farmacia asociado al proceso de fraccionamiento de viales. El coste de administración de cada medicamento seleccionado se estimó a partir del número de inyecciones intravítreas anuales requeridas por cada alternativa terapéutica y según la afectación del EMD (unilateral o bilateral), determinado por el panel de expertos (Tabla 1).
El coste de monitorización de los pacientes se determinó a partir del número total de visitas de seguimiento necesarias (con o sin administración de inyección intravítrea) y de las pruebas diagnósticas realizadas en estas visitas. Las posibles pruebas realizadas durante las visitas de seguimiento incluyeron tomografía de coherencia óptica, oftalmoscopia, tonometría y test de agudeza visual y, en algunos casos, angiografía con fluoresceína. En el caso de los pacientes que requieren tratamiento bilateral del EMD, se asumió que el 100% de los pacientes tratados con dexametasona realizaría dos visitas separadas para tratar ambos ojos, mientras que para el tratamiento con aflibercept o ranibizumab, el 80% de los pacientes requeriría el doble de visitas con inyección intravítrea para el tratamiento bilateral del EMD. El número anual de visitas de seguimiento y pruebas diagnósticas se recoge en laTabla 2.
Tabla 2. Visitas de seguimiento, pruebas diagnósticas anuales y proporción de acontecimientos adversos por paciente
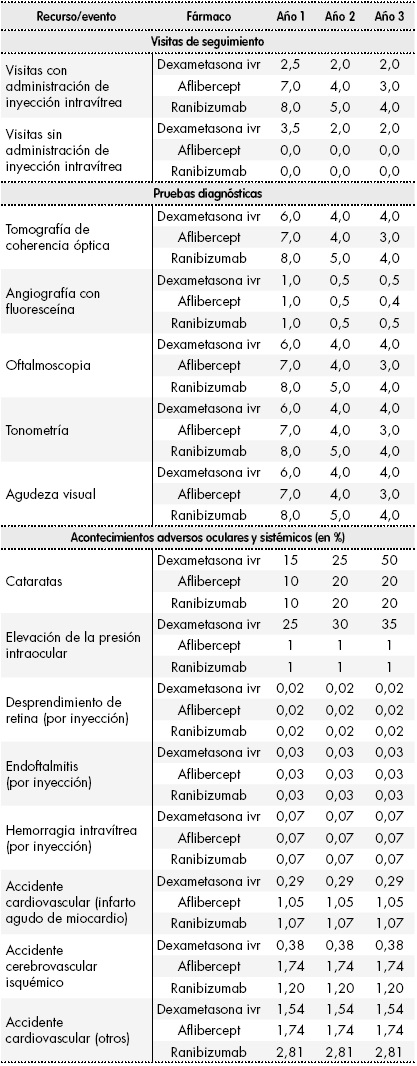
ivr: implante intravítreo.
El modelo considera el manejo de acontecimientos adversos oculares (cataratas, elevación de la presión intraocular, desprendimiento de retina, endoftalmitis y hemorragia intravítrea) o cardiovasculares (infarto agudo de miocardio, accidente cerebrovascular isquémico y otros accidentes cardio-vasculares) ocurridos durante el tratamiento de los pacientes con EMD. El manejo de la endoftalmitis y de la elevación de la presión intraocular puede realizarse mediante tratamiento farmacológico y cirugía o sólo farmacológico. El 70% de los pacientes con endoftalmitis reciben únicamente tratamiento farmacológico, independientemente del tratamiento recibido para el EMD, mientras que el 100% de los pacientes con elevación de la presión intraocular se tratan farmacológicamente. El modelo no consideró la cirugía como tratamiento de la elevación de la presión intraocular. La proporción de pacientes con acontecimientos adversos según el tratamiento recibido se encuentra recogida en laTabla 2.
La incidencia de acontecimientos adversos oculares y el consumo de recursos debido a su manejo fueron determinados según la práctica clínica por el panel de expertos, mientras que los eventos cardiovasculares se establecieron según los datos disponibles de los ensayos clínicos pivotales de las alternativas terapéuticas5 6-7.
Todos los costes se expresaron en euros de 2016. En laTabla 3se detallan los costes unitarios de los recursos sanitarios incluidos en el análisis,
que fueron obtenidos de la literatura médica y de bases de datos de costes nacionales19 20 21-22.
Análisis de sensibilidad y escenarios alternativos
Se realizaron varios análisis de sensibilidad univariantes y multivariantes, modificando individualmente los valores de diferentes parámetros con el objetivo de incorporar la incertidumbre en el análisis y observar el efecto de esta modificación en los resultados. Los parámetros incluidos en este análisis de sensibilidad fueron la proporción de pacientes diagnosticados con EMD que reciben tratamiento, los costes unitarios, el coste de inyección intravítrea, el número de inyecciones anuales del implante de dexametasona, el coste de manejo de acontecimientos adversos cardiovasculares, la incidencia de cataratas con fármacos antiangiogénicos y el precio de las alternativas terapéuticas (PVL con/sin la aplicación de la deducción estipulada en el Real Decreto-Ley 8/2010). Además, se modificó el porcentaje de utilización del implante intravítreo de dexametasona y del resto de alternativas terapéuticas (Tabla 1). Adicionalmente, se consideraron varios escenarios alternativos para valorar áreas sanitarias con poblaciones mayores a la considerada: 100.000, 250.000 y 500.000 adultos.
Resultados
Considerando los datos epidemiológicos del EMD en España aplicados a un área sanitaria de 25.000 habitantes adultos, se estimó que la población susceptible de recibir tratamiento con alguna de las terapias analizadas sería de 100, 112 y 124 pacientes en cada uno de los 3 años considerados en el análisis, respectivamente.
El impacto del tratamiento del EMD en estos pacientes, en un escenario sin disponibilidad de implante intravítreo de dexametasona con los parámetros considerados en el análisis, supondría un coste anual total de 835.197 € (año 1), 606.004 € (año 2) y 555.227 € (año 3). En el escenario con disponibilidad del implante intravítreo de dexametasona, el coste anual total resultaría en 800.167 €, 595.262 € y 550.176 € para los tres primeros años, respectivamente, por lo que su incorporación al arsenal terapéutico para el EMD generaría una reducción del presupuesto del 4,2% para el primer año, seguido de disminuciones del 1,8% y del 0,9% en los años posteriores (reducción de 35.030 €, 10.743 € y 5.051 €, respectivamente) (Tabla 4). Considerando el coste individual por paciente, el coste anual de tratamiento presentaría una disminución de 350,31 €, 95,97 € y 40,80 € para los años 1, 2 y 3 del análisis.
Tabla 4. Resultados del análisis de impacto presupuestario (caso base y análisis de sensibilidad)
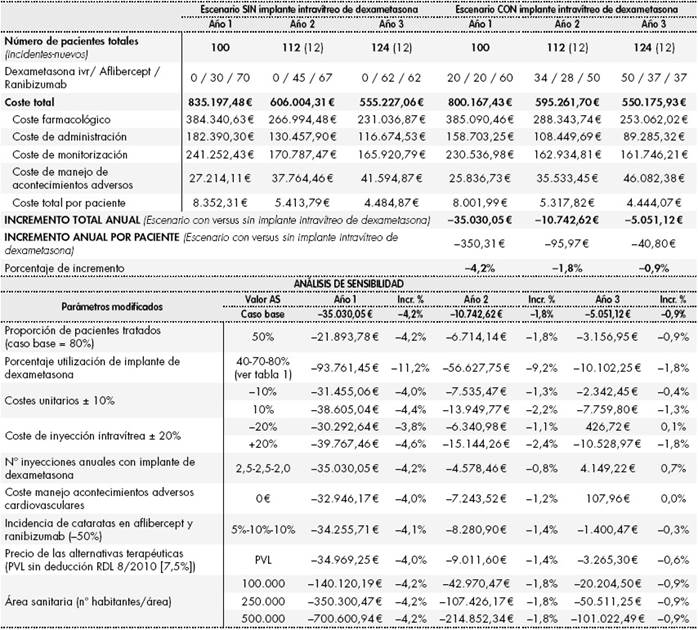
AS: análisis de sensibilidad; Incr. %: incremento porcentual entre el escenario con implante intravítreo de dexametasona versus el escenario sin implante intravítreo de dexametasona; ivr: implante intravítreo; PVL: precio de venta del laboratorio; RDL: Real Decreto-Ley.
El coste farmacológico entre el escenario sin la incorporación del implante intravítreo de dexametasona frente al escenario con la incorporación de esta nueva alternativa terapéutica supondría un incremento del 5% global para los 3 años del análisis (0,2%, 8% y 9,5%, respectivamente). Los costes de administración y monitorización son las partidas que más contribuyen a la disminución del coste total. Los costes de administración presentan una reducción de entre el 13% y el 23,5%, mientras que los costes de monitorización presentan reducciones entre el 2,5% y el 4,6%. Esto supone una reducción global del 17,01% en los costes de administración y de un 3,93% de los costes de monitorización entre ambos escenarios.
En los análisis de sensibilidad se observó que un aumento en la utilización de dexametasona en implante intravítreo generó mayores reducciones del coste anual con respecto al escenario en el que este implante no está disponible para el tratamiento del EMD. El resto de análisis determinó que un incremento en los costes unitarios de los recursos sanitarios, excluyendo el farmacológico, incrementaría los costes totales en el escenario sin dexametasona (administración y seguimiento), que presenta mayor consumo de recursos, y por tanto, incrementaría los ahorros generados por la introducción de dexametasona intravítrea. Adicionalmente, una reducción de estos costes unitarios, no considerar el coste del manejo de acontecimientos adversos sistémicos, una reducción de la incidencia de cataratas en las terapias con angiogénicos o aumentar el número de inyecciones anuales de dexametasona intravítrea reduciría la capacidad de generar ahorros por la introducción en el sistema el implante de dexametasona intravítrea (Tabla 4).
Al considerar una población de 100.000 adultos (400 pacientes prevalentes), los costes totales alcanzarían los 3,3, 2,4 y 2,2 millones de euros para los 3 años del análisis, respectivamente, en un escenario sin implante intravítreo de dexametasona, frente a los 3,2, 2,4 y 2,2 millones de euros en el nuevo escenario con disponibilidad del implante. En un área sanitaria mediana de 250.000 adultos de población (1.000 pacientes prevalentes), los costes del EMD supondrían un total de 8,4, 6,1 y 5,6 millones de euros en los 3 años del escenario sin implante de dexametasona. El escenario con disponibilidad de la nueva alternativa conllevaría reducciones de 350.300 €, 107.426 € y 50.511 € cada uno de esos años, respectivamente. En un análisis realizado para una población de 500.000 adultos, en comparación con los 16,7 (año 1), 12,1 (año 2) y 11,1 (año 3) millones de euros generados en el manejo del EMD sin dexametasona intravítrea, la incorporación de esta opción terapéutica supondría ahorros de 700.601 €, 214.852 € y 101.022 €, respectivamente.
Discusión
La diabetes mellitus es una patología con una amplia prevalencia, que seguirá aumentando en los próximos años. Un mal control glucémico y la consiguiente aparición de complicaciones derivadas de la enfermedad, entre las que se encuentran la retinopatía diabética y el EMD, supondrá una gran carga económica para el SNS debido al manejo requerido por este creciente número de pacientes.
Según la reciente evidencia económica sobre el EMD en España, se estableció en 6.271 € el coste directo anual por paciente con EMD (excluyendo el coste farmacológico)13, mientras que el coste anual de tratamiento con antiangiogénicos se estimó en 7.154 €, con unos costes de seguimiento de 474 €23. Adicionalmente, el EMD supone grandes limitaciones para los pacientes diabéticos debido a la discapacidad producida por la pérdida parcial de visión o la ceguera, que conllevaría un incremento adicional de los costes indirectos, con un coste anual por paciente debido a incapacidad laboral permanente de 7.051 €, siendo especialmente relevante en pacientes con EMD bilateral (11.712 € versus 4.284 €)13. Según el Informe de la Ceguera en España24, los costes de la ceguera por discapacitado en España se aproximan a los 5.100 € anuales, con un coste total cercano a los 360 millones de euros. Existirían además costes adicionales soportados por las personas con ceguera (25.914 €) o baja visión (11.032 €)25. Además del adecuado control de los pacientes diabéticos, la selección de tratamientos eficaces para reducir la aparición de una mayor discapacidad en los pacientes con EMD permitiría disminuir la carga económica generada por estos pacientes para el SNS.
Según el presente análisis, la incorporación del implante intravítreo de dexametasona al arsenal terapéutico para el tratamiento del EMD supondría ahorros de 35.030 €, 10.743 € y 5.051 € en los 3 años evaluados, respectivamente. Estos ahorros se deben fundamentalmente a una menor frecuencia del tratamiento con implante intravítreo de dexametasona que se asocia a la reducción de costes de administración y seguimiento de los pacientes, estableciéndose un ahorro anual por paciente de entre 41 y 350 €. Estos ahorros se confirman en el escenario alternativo en el que un aumento del porcentaje de utilización del implante intravítreo de dexametasona provocaría mayores ahorros en el manejo de esta enfermedad en el periodo del análisis.
En conocimiento de los autores, el presente análisis es el primer estudio que evalúa la repercusión económica en el presupuesto sanitario de los tratamientos actualmente disponibles para el tratamiento del EMD en España, incluyendo el implante intravítreo de dexametasona. En una revisión de la literatura, se encontraron publicaciones recientes sobre evaluaciones económicas que analizaban la eficiencia entre diversas terapias anti-VEGF a nivel internacional26 27-28. Sin embargo, los trabajos que incorporan el implante intravítreo de dexametasona son mucho más limitados25,29. Un análisis coste-efectividad realizado en España concluyó que el implante intravítreo de dexametasona era una opción eficiente, con un coste de 2.050 € por línea de agudeza visual ganada25.
El presente análisis no está exento de limitaciones. La principal de ellas es la relacionada con la estimación de la población diana. La robustez de los datos está directamente relacionada con la fiabilidad de la evidencia epidemiológica disponible del EMD, siendo estudios realizados con tamaño de población de referencia limitado17,18. Los porcentajes de utilización de las diferentes alternativas terapéuticas pretenden representar la posible tendencia de uso de estos medicamentos en los años futuros. Los resultados obtenidos podrían variar si los valores de utilización de fármacos estimados no suponen un reflejo cercano de la evolución del mercado. La escasez de información robusta sobre el manejo real de pacientes con EMD condicionó que algunos parámetros tuvieran que ser proporcionados por el panel de expertos. Por ello, la estimación del número de inyecciones intravítreas y de visitas anuales necesarias para el tratamiento de los pacientes con las diferentes alternativas, así como el consumo de recursos en el manejo de acontecimientos adversos y seguimiento de los pacientes, puede no ser fielmente representativa de la práctica clínica diaria de todos los centros españoles.
El desarrollo de evaluaciones económicas completas, como los análisis coste-efectividad y/o coste-utilidad, permiten determinar la eficiencia comparativa de las alternativas disponibles para el tratamiento de una patología. Los análisis de impacto presupuestario, como el presente trabajo, suponen evaluaciones económicas parciales, complementarias al resto de evaluaciones, que analizan la repercusión de las diferentes terapias en términos financieros sin valorar su eficacia o efectividad. Este tipo de evaluaciones deben entenderse como herramientas útiles para la toma de decisiones en materia sanitaria, especialmente en contextos o entornos donde se requiera una priorización del control del gasto sanitario, sin menoscabo del futuro desarrollo de otro tipo de estudios que complementen la información aquí expuesta, permitiendo reafirmar la decisión que finalmente se adopte.
En conclusión, en el contexto actual la inclusión del implante intravítreo de dexametasona para el tratamiento del EMD en el contexto actual supondría ahorros en el presupuesto del área sanitaria, debido fundamentalmente a la reducción de costes en la administración del tratamiento y en el seguimiento de los pacientes.
REFERENCIAS
Romero-Aroca P. Targeting the pathophysiology of diabetic macular edema. Diabetes Care. 2010;33(11):2484-85. DOI: 10.2337/dc10-1580 [ Links ]
Romero-Aroca P, Baget-Bernaldiz M, Pareja-Rios A, Lopez-Galvez M, Navarro-Gil R, Verges R. Diabetic Macular Edema Pathophysiology: Vasogenic versus Inflammatory. J Diabetes Res. 2016;2016:2156273. DOI: 10.1155/2016/2156273 [ Links ]
Cheung N, Mitchell P, Wong TY. Diabetic retinopathy. Lancet. 2010;376(9735):124-36. DOI: 10.1016/S0140-6736(09)62124-3 [ Links ]
Corcostegui B, Duran S, Gonzalez-Albarran MO, Hernandez C, Ruiz-Moreno JM, Salvador J, et al. Update on Diagnosis and Treatment of Diabetic Retinopathy: A Consensus Guideline of the Working Group of Ocular Health (Spanish Society of Diabetes and Spanish Vitreous and Retina Society). J Ophthalmol. 2017;2017:8234186. DOI: 10.1155/2017/8234186 [ Links ]
Korobelnik JF, Do DV, Schmidt-Erfurth U, Boyer DS, Holz FG, Heier JS, et al. Intravitreal aflibercept for diabetic macular edema. Ophthalmology. 2014;121(11):2247-54. DOI: 10.1016/j.ophtha.2014.05.006 [ Links ]
Boyer DS, Yoon YH, Belfort R Jr, Bandello F, Maturi RK, Augustin AJ, et al. Threeyear, randomized, sham- controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology. 2014;121(10):1904-14. DOI: 10.1016/j.ophtha.2014.04.024 [ Links ]
Brown DM, Nguyen QD, Marcus DM, Boyer DS, Patel S, Feiner L, et al.; RISE and RIDE Research Group. Long-term outcomes of ranibizumab therapy for diabetic macular edema: the 36-month results from two phase III trials: RISE and RIDE. Ophthalmology. 2013;120(10):2013-22. DOI: 10.1016/j.ophtha.2013.02.034 [ Links ]
Vila L, Viguera J, Aleman R. Diabetic retinopathy and blindness in Spain: epidemiology and prevention. Endocrinol Nutr. 2008;55(10):459-75. DOI: 10.1016/S1575-0922(08)75843-1 [ Links ]
Gonder JR, Walker VM, Barbeau M, Zaour N, Zachau BH, Hartje JR, et al. Costs and Quality of Life in Diabetic Macular Edema: Canadian Burden of Diabetic Macular Edema Observational Study (C-REALITY). J Ophthalmol. 2014;2014:939315. DOI: 10.1155/2014/939315 [ Links ]
Peters CM, James AI, Tran I, Kambarian J, Colman S, Apte RS, et al. The impact of diabetic macular edema on the daily lives of diabetic adults - a qualitative study. IOVS. 2012;53:5449. DOI: 10.1167/iovs.12-10148 [ Links ]
Lafuma A, Brezin A, Lopatriello S, Hieke K, Hutchinson J, Mimaud V, et al. Evaluation of non-medical costs associated with visual impairment in four European countries: France, Italy, Germany and the UK. Pharmacoeconomics. 2006;24(2):193-205. DOI: 10.2165/00019053-200624020-00007 [ Links ]
Wallick CJ. The economic burden of diabetic macular edema in a working age and commercially insured population (tesis de master) (Internet). Washington: Department of Pharmacy, University of Washington; 2013 (consultado 5/9/2014). Disponible en: https://digital.lib.washington.edu/dspace/bitstream/handle/1773/23543/Wallick_washington_0250O_11859.pdf?sequence=1 [ Links ]
Abraldes MJ, Pareja A, Roura M; en representacion del grupo del estudio OBSERVAR. Analysis of costs associated with the management and morbidity of diabetic macular oedema and macular oedema secondary to retinal vein occlusion. Arch Soc Esp Oftalmol. 2016;91(6):273-80. DOI: 10.1016/j.oftal.2015.11.019 [ Links ]
Brosa M, Gisbert R, Rodriguez JM, Soto J. Principios, metodos y aplicaciones del analisis del impacto presupuestario en el sector sanitario. Pharmacoeconomics Spa Res Art. 2005;2(2):65-78. DOI: 10.1007/bf03320900 [ Links ]
Sullivan SD, Mauskopf JA, Augustovski F, Caro J, Lee KM, Minchin M, et al. Budget impact analysis-principles of good practice: report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value Health. 2014;17(1):5-14. DOI: 10.1016/j.jval.2013.08.2291 [ Links ]
Soriguer F, Goday A, Bosch-Comas A, Bordiu E, Calle-Pascual A, Carmena R, et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: the Di@bet.es Study. Diabetologia. 2012;55(1):88-93. DOI: 10.1007/s00125-011-2336-9 [ Links ]
Romero-Aroca P, Sagarra-Alamo R, Baget-Bernaldiz M, Fernandez-Ballart J, Mendez-Marin I. Prevalence and relationship between diabetic retinopathy and nephropathy, and its risk factors in the North-East of Spain, a population-based study. Ophthalmic Epidemiol. 2010;17(4):251-65. DOI: 10.3109/09286586.2010.498661 [ Links ]
Romero-Aroca P, de la Riva-Fernandez S, Valls-Mateu A, Sagarra-Alamo R, Moreno-Ribas A, Soler N. Changes observed in diabetic retinopathy: eight-year follow-up of a Spanish population. Br J Ophthamol. 2016;100(10):1366-71. DOI: 10.1136/bjophthalmol-2015-307689 [ Links ]
Consejo General de Colegios Oficiales de Farmaceuticos. Base de datos del Conocimiento Sanitario-Bot Plus 2.0 (Internet). Madrid: Consejo General de Colegios Oficiales de Farmaceuticos; 2016 (consultado 8/6/2016). Disponible en: https://botplusweb.portalfarma.com/ [ Links ]
Oblikue Consulting. Base de datos de costes sanitarios eSalud (Internet). Barcelona: Oblikue Consulting; 2016 (consultado 26/5/2016). Disponible en: http://www.oblikue.com/bddcostes/ [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad, Instituto de informacion sanitaria. Registro de altas. CIE9 MC-CMBD 2013. En: Portal estadistico del Ministerio de Sanidad, Servicios Sociales e Igualdad (Internet). Madrid: Ministerio de Sanidad, Servicios Sociales e Igualdad; 2015 (consultado 20/2/2015). Disponible en: http://pestadistico.msc.es [ Links ]
Lozano Lopez V, Serrano Garcia M, Mantolan Sarmiento C, Pareja Rios A, Losada Castillo MJ, Cordoves Dorta L, et al. Resultados coste-efectividad del implante de dexametasona en edema macular. Arch Soc Esp Oftalmol. 2015; 90(1):14-21. DOI: 10.1016/j.oftal.2013.10.007 [ Links ]
Romero-Aroca P, de la Riva-Fernandez S, Valls-Mateu A, Sagarra-Alamo R, Moreno-Ribas A, Soler N, et al. Cost of diabetic retinopathy and macular oedema in a population, an eight year follow up. BMC Ophthalmol. 2016;16:136. DOI: 10.1186/s12886-016-0318-x [ Links ]
Retinaplus+. Informe sobre la ceguera en Espana (Internet). Madrid: Ernst & Young, SL.; 2012 (consultado 4/8/2016). Disponible en: http://www.fundacionretinaplus.es/images/documentos/Informe_Ceguera.pdf [ Links ]
Instituto Municipal de Personas con Discapacidad. El agravio comparativo económico de las personas con discapacidad en la ciudad de Barcelona (Internet). Barcelona: Ajuntament de Barcelona; 2006 (consultado 4/8/2016). Disponible en: http://w110.bcn.cat/portal/site/ObservatoriSocialBarcelona/ [ Links ]
Regnier SA, Malcolm W, Haig J, Xue W. Cost-effectiveness of ranibizumab versus aflibercept in the treatment of visual impairment due to diabetic macular edema: a UK healthcare perspective. Clinicoecon Outcomes Res. 2015;7:235-47. DOI: 10.2147/ceor.s82556 [ Links ]
Ross EL, Hutton DW, Stein JD, Bressler NM, Jampol LM, Glassman AR; Diabetic Retinopathy Clinical Research Network. Cost-effectiveness of Aflibercept, Bevacizumab, and Ranibizumab for Diabetic Macular Edema Treatment: Analysis From the Diabetic Retinopathy Clinical Research Network Comparative Effectiveness Trial. JAMA Ophthalmol. 2016;134(8):888-96. DOI: 10.1001/jamaophthalmol.2016.1669 [ Links ]
Kourlaba G, Relakis J, Mahon R, Kalogeropoulou M, Pantelopoulou G, Kousidou O, et al. Cost-utility of ranibizumab versus aflibercept for treating Greek patients with visual impairment due to diabetic macular edema. Cost Eff Resour Alloc. 2016;14:7. DOI: 10.1186/s12962-016-0056-1 [ Links ]
Cavusoglu Sezen S, Dokuyucu O, Saylan M, Burke C, Mahon R, Keskinaslan A. Cost-effectiveness of Ranibizumab Vs Dexamethasone Implant In Diabetic Macular Edema. Value Health. 2015;18(7):A422. DOI: 10.1016/j.jval.2015.09.565 [ Links ]
FinanciaciónEl presente proyecto se ha realizado con financiación no condicionada de Allergan, S.A.U.
Cómo citar este artículo:Cervera E, de Andrés-Nogales F, Armadá F, Arias L, Oyagüez I, Martínez C. Budget impact analysis of dexamethasone intravitreal implant for the treatment of diabetic macular oedema. Farm Hosp. 2018;42(6):244-250.
Aportación a la literatura científicaEl trabajo evalúa la implicación para el sistema sanitario de la inclusión del implante intravítreo de dexametasona como terapia del EMD. Los resultados obtenidos son útiles en la toma de decisiones en oftalmología, un área relevante a nivel presupuestario por la reciente incorporación de nuevas terapias intravítreas.
Recibido: 13 de Marzo de 2018; Aprobado: 19 de Julio de 2018











 text in
text in