My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.43 n.5 Toledo Sep./Oct. 2019 Epub Oct 14, 2019
https://dx.doi.org/10.7399/fh.11161
ORIGINALES BREVES
Perfil de seguridad de capecitabina formulación innovadora y formulación genérica en adyuvancia del cáncer colorrectal no metastásico
1Servicio de Farmacia, Hospital Virgen de la Luz, Cuenca. España.
2Departamento de Farmacia y Tecnología Alimentaria, Universidad Complutense de Madrid, Madrid. España.
3Instituto de Farmacia Industrial, Universidad Complutense de Madrid, Madrid. España.
Objetivo
Analizar las reacciones adversas en pacientes con cáncer colorrectal no metastásico debidas al tratamiento con capecitabina innovadora o genérica, y/o al régimen quimioterápico empleado, capecitabina en monoterapia o en combinación con oxaliplatino (XELOX).
Método
Estudio descriptivo retrospectivo llevado a cabo en un hospital de segundo nivel en dos periodos de estudio (noviembre de 2013-abril de 2014 y agosto de 2016 -mayo de 2017). Las variables recogidas fueron variables de exposición (esquema quimioterápico y/o medicamento recibido), variables de control (datos demográficos, de enfermedad y de tratamiento) y variables de respuesta (reacciones adversas). El análisis estadístico de los datos se efectuó con el programa SPSS® 15.0.
Resultados
Se incluyeron 50 pacientes. Según el esquema quimioterápico administrado, se encontraron diferencias estadísticamente significativas en la aparición de eritrodisestesia palmo-plantar, más frecuente con monoterapia (p < 0,05), y neurotoxicidad, trombopenia y neutropenia, más frecuentes con XELOX (p < 0,05). Según el medicamento de capecitabina administrado, no se observaron diferencias estadísticamente significativas en las reacciones adversas estudiadas.
Conclusiones
El perfil de seguridad de dos formulaciones de capecitabina, innovadora y genérica, parece estar asociado al esquema quimioterápico empleado, y no al medicamento en cuestión. La mayor eritro-disestesia palmo-plantar para monoterapia se debe probablemente a la mayor dosis de capecitabina empleada en dicho esquema, y la mayor neurotoxicidad, trombopenia y neutropenia para XELOX se debe probablemente a la toxicidad acumulada de dos fármacos antineoplásicos.
PALABRAS CLAVE: Seguridad; Capecitabina; Fármaco genérico; Cáncer colorrectal
Introducción
Capecitabina es una fluoropirimidina carbamato oral para el tratamiento adyuvante del cáncer colorrectal no metastásico (CCRnm), en monoterapia o combinada con oxaliplatino (esquema XELOX)1. Sus reacciones adversas más frecuentes son: alteraciones gastrointestinales, mucositis, eritrodisestesia palmo-plantar (EPP), fatiga, astenia, anorexia, neurotoxicidad y hepatotoxicidad1. Además, existen otros factores que pueden potenciar dicha toxicidad, dependientes del paciente (escala ECOG (Eastern Cooperative Oncology Group), edad, patologías concomitantes) y del fármaco (número de ciclos, esquema quimioterápico administrado)2.
En España, capecitabina se comercializó por primera vez en 2001 y a partir de 2012 comenzaron las presentaciones genéricas. En el caso de fármacos antineoplásicos intravenosos, se han realizado estudios donde se compara la toxicidad de formulaciones genéricas e innovadoras, pero no existen respecto al tratamiento citotóxico oral3 4-5. Este dato resulta importante, pues cada vez es mayor el número de moléculas citotóxicas adaptadas a la vía oral, lo que permite mayor autonomía del paciente, evitando pinchazos y riesgos asociados a catéteres6.
Los medicamentos genéricos presentan los mismos principios activos, la misma dosis, la misma forma farmacéutica y la misma biodisponibilidad que el medicamento innovador. Para su comercialización se exigen ensayos de bioequivalencia con el medicamento innovador: si los dos medicamentos son bioequivalentes, presentan la misma seguridad y eficacia7.
Para la mayoría de las terapias, los límites de aceptación del ensayo de bioequivalencia no conllevan diferencias clínicamente relevantes en la actividad del principio activo administrado en el medicamento innovador o genérico. Sin embargo, en algunos campos, como la oncología, donde los fármacos presentan elevada toxicidad, este intervalo permitido entre genérico e innovador podría resultar excesivamente amplio, máxime si tenemos en cuenta que con frecuencia la dosis terapéutica de los fármacos antineoplásicos viene dictada por el límite de toxicidad. Este problema es de especial relevancia cuando se emplea la vía oral, ya que pueden existir variaciones en la liberación y absorción del principio activo, variaciones que no existen en la vía intravenosa, donde las concentraciones plasmáticas dependerán de la velocidad de infusión.
Por tanto, el objetivo del presente estudio es analizar la frecuencia y severidad de las reacciones adversas en pacientes diagnosticados de CCRnm debidas al tratamiento adyuvante con dos formulaciones de capecitabina, innovadora y genérica, y/o al régimen quimioterápico empleado, capecitabina en monoterapia o esquema XELOX.
Métodos
Estudio observacional descriptivo retrospectivo de pacientes diagnosticados de CCRnm en tratamiento adyuvante con capecitabina, medicamento innovador (Xeloda®) o genérico (Capecitabina EFG®). Ambos medicamentos con los mismos excipientes, tanto a nivel del núcleo del comprimido como del recubrimiento.
El estudio fue llevado a cabo en un hospital de segundo nivel durante dos periodos: noviembre de 2013-abril de 2014, donde coexistieron ambas formulaciones, y agosto de 2016-mayo de 2017, donde sólo estaba disponible la formulación genérica. Ambos periodos surgen por el pequeño número de pacientes tratados con formulación genérica en el primero. El estudio fue autorizado por el Comité Ético de Investigación Clínica del centro, incluyendo todos los pacientes que recibieron tratamiento adyuvante para CCRnm. Se excluyeron aquellos que sólo recibieron un ciclo de quimioterapia.
Se evaluó la relevancia del esquema quimioterápico empleado en la aparición y severidad de eventos adversos; capecitabina en monoterapia o esquema XELOX; y la relevancia del medicamento de capecitabina administrado. Para esta última evaluación, se dividió a los pacientes en tres grupos (1: pacientes tratados con medicamento innovador, 2: pacientes tratados con medicamento genérico, y 3: pacientes tratados con combinación de medicamento innovador más medicamento genérico).
Se revisaron las historias clínicas informatizadas (Mambrino XXI®) y las historias farmacoterapéuticas (Farmatools-Dominion® y Farhos-Oncología® v.5.0). Se recogieron variables de exposición (esquema quimioterápico y medicamento administrado), de control (edad, sexo, estadio de la enfermedad, escala ECOG, dosis de inicio, reducción de dosis, suspensión del tratamiento y número de ciclos recibidos) y de respuesta (perfil de seguridad y gravedad; establecido según los Common Terminology Criteria for Adverse Events, CTCAE v. 4.03)8.
El análisis estadístico de datos se efectuó con el programa SPSS 15.0 (versión para Windows®). Se realizó un análisis descriptivo de las variables continuas o numéricas utilizando medidas de tendencia central y dispersión. En el análisis bivariante, la relación entre las diferentes variables independientes categóricas nominales y la variable dependiente se estudió mediante la prueba de la χ2. Para el análisis de medias se empleó la prueba T para muestras independientes. Se consideró estadísticamente significativa la p < 0,05.
Resultados
Se analizaron 50 pacientes con mediana de edad de 68 años (rango: 47-88) y predominio masculino (34 pacientes; 68%). Todos los pacientes presentaban ECOG menor o igual a 2 al inicio del tratamiento y el régimen quimioterápico más frecuente fue monoterapia (27 pacientes; 54%). En cuanto al medicamento administrado, 22 (44%) pacientes recibieron medicamento innovador, 15 (30%) genérico y 13 (26%) combinación innovador más genérico.
Las dosis de inicio fueron todas acordes a ficha técnica a excepción de 5 (10%) pacientes que iniciaron con dosis reducidas por mal estado general. Durante el tratamiento, 32 (64%) pacientes tuvieron que reducir la dosis debido al perfil de seguridad del fármaco, principalmente: EPP (17 pacientes; 34%), toxicidad hematológica (7 pacientes; 14%), neurotoxicidad (6 pacientes; 12%) y diarrea (5 pacientes; 10%). Además, 12 (24%) pacientes suspendieron el tratamiento, 3 (25%) por progresión, 4 (33%) por efecto adverso (cardiopatía hipertrófica hipertensiva, trombopenia, enteritis y desnutrición, EPP y neurotoxicidad), 2 (17%) por decisión familiar y del paciente y 3 (25%) por otras causas (operación, ictus cerebral reciente y biopsia endometrial).
La mediana de ciclos administrados fue de 7 (rango: 2-8) y todos los pacientes presentaron alguna reacción adversa, a excepción de uno (98%).
Respecto al esquema quimioterápico administrado, las características de los pacientes quedan recogidas en la Tabla 1, sin encontrarse diferencias estadísticamente significativas. El perfil de seguridad también queda recogido en la Tabla 1 y se encontraron diferencias estadísticamente significativas en la frecuencia de EPP y alteración de la bilirrubina total (más frecuente con monoterapia) y en la frecuencia de neurotoxicidad, trombopenia, neutropenia y alteración de gamma-glutamil transpeptidasa (GGT) (más frecuente con XELOX). Los efectos adversos más habituales para ambos grupos de pacientes fueron diarrea y/o estreñimiento, EPP, anemia y linfopenia, y las menos frecuentes náuseas y/o vómitos, mucositis y aumento de la bilirrubina total, las transaminasas y la GGT.
Tabla 3. Características de los pacientes en función del esquema quimioterápico recibido y reacciones adversas presentadas

*p < 0,05.
**p ≤ 0,005.
GOT: glutamato-oxalacetato transaminasa; GPT: glutamato-piruvato transaminasas; GGT: gamma-glutamil transpeptidasa.
En cuanto al medicamento de capecitabina administrado, las características de los pacientes y el perfil de seguridad quedan recogidos en la Tabla 2, sin encontrarse diferencias estadísticamente significativas en ninguno de los ítems. Las reacciones adversas más frecuentes para ambos grupos de pacientes fueron diarrea y/o estreñimiento, EPP, trombopenia y linfopenia, y las menos habituales náuseas y/o vómitos, mucositis y alteración de la GGT.
Tabla 4. Características de los pacientes en función del medicamento administrado y reacciones adversas presentadas*
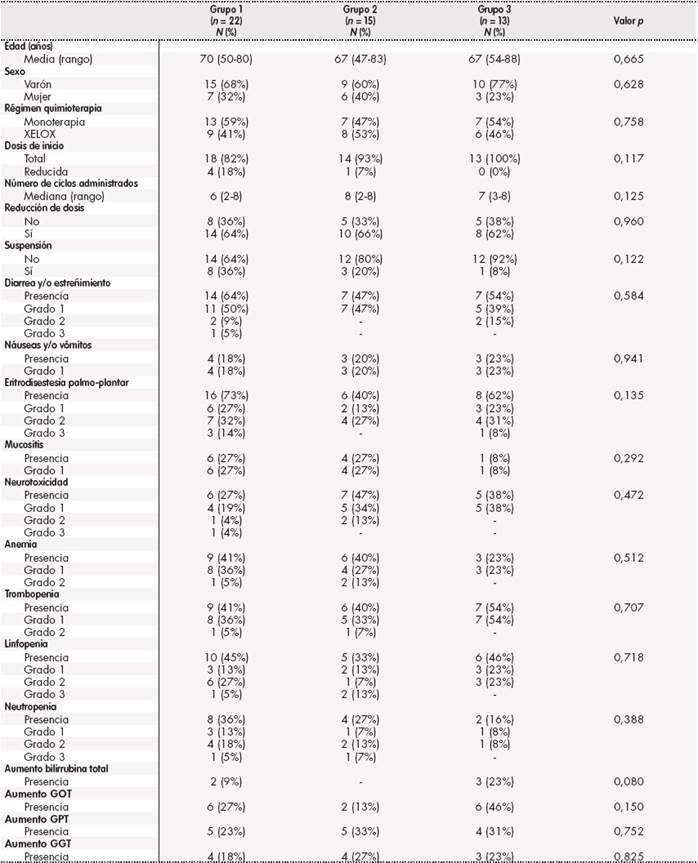
*Grupo 1: pacientes tratados con medicamento innovador; Grupo 2: pacientes tratados con medicamento genérico; Grupo 3: pacientes tratados con combinación de medicamento innovador más medicamento genérico.
GOT: glutamato-oxalacetato transaminasa; GPT: glutamato-piruvato transaminasas; GGT: gamma-glutamil transpeptidasa.
Discusión
En la comparación entre capecitabina en monoterapia y capecitabina en combinación con oxaliplatino, existe mayor EPP y un aumento de la bilirrubina total con capecitabina en monoterapia, y mayor neurotoxicidad, trombopenia, neutropenia y aumento de la GGT con XELOX. Estos datos son acordes con la bibliografía, donde se observa mayor neurotoxicidad y toxicidad hematológica con XELOX versus capecitabina en monoterapia9. En nuestro estudio, el efecto adverso más frecuente es EPP de cualquier grado (74%), siendo en estudios anteriores semejante (62%), y en cuanto a la hiperbilirrubinemia, en nuestro estudio la tasa se sitúa en 19%, mientras que se establece en 20% en estudios previos10. Respecto a la severidad de las reacciones adversas, en nuestro estudio se observan menos efectos adversos grado 3-4, probablemente porque en la práctica clínica se reducen las dosis cuando aparecen reacciones adversas leves, sin permitir que se produzcan eventos adversos graves. En concreto, en estudios previos aparece EPP grado 3-4 en un 3-4% (no aparece en nuestro estudio) y neurotoxicidad grado 3-4 en un 17% (4% en nuestro estudio)11,12.
Estos datos hallados no resultan llamativos, pues la EPP es una reacción adversa muy frecuente propia de la capecitabina, y la neurotoxicidad es un evento adverso muy frecuente y propio del oxaliplatino1. La mayor EPP con capecitabina en monoterapia probablemente se deba a las dosis empleadas, pues en dicho esquema se usa aproximadamente un 20% más de dosis de capecitabina12,13.
En cuanto a la mayor trombopenia y neutropenia con la combinación, éstas se atribuyen al acúmulo de toxicidad producida por la administración conjunta de dos fármacos antineoplásicos. La neutropenia se presenta en nuestro estudio en un 48% y la trombopenia en un 70% versus porcentajes de 20-30% reportados en otros trabajos12 13 14-15. En cambio, al analizar la severidad de estos efectos adversos, los datos son semejantes para neutropenia grado 3-4 (9% en nuestro estudio versus 7-9% en la bibliografía) y favorables para trombopenia grado 3-4 (0% en nuestro estudio versus 2-6% en la bibliografía)12 13 14-15. Estas diferencias, principalmente en los efectos adversos grado 1-2, pueden deberse a los valores marcados como estándares según los distintos laboratorios donde se analizan las muestras biológicas, pues el CTCAE v.4.03 no establece un intervalo concreto para reacciones adversas hematológicas grado 1.
Respecto a los efectos adversos en los que no se encuentran diferencias estadísticamente significativas, cabe resaltar que existe una tendencia de mayor diarrea y/o estreñimiento, náuseas y/o vómitos, anemia y linfopenia con XELOX, muy probablemente debido a la administración conjunta de dos fármacos citotóxicos.
En el análisis comparativo entre capecitabina medicamento innovador y capecitabina medicamento genérico, se observa que ambos medicamentos se presentan en la misma forma farmacéutica y composición cualitativa de excipientes, sin apreciarse diferencias estadísticamente significativas en las reacciones adversas presentadas. Sólo se observa una tendencia de mayor EPP con formulación innovadora y mayor neurotoxicidad con formulación genérica. Estas tendencias podrían justificarse porque la formulación innovadora se emplea mayormente como capecitabina en monoterapia (esquema asociado a EPP) y formulación genérica como XELOX (esquema asociado a neurotoxicidad). Por tanto, el perfil de seguridad de dos formulaciones de capecitabina, innovadora y genérica, parece estar asociado al esquema quimioterápico empleado, y no al medicamento administrado en cuestión.
Finalmente, la principal limitación del estudio es el tamaño muestral, hecho que limita el poder sacar conclusiones más potentes. Un mayor estudio aleatorizado podría realizarse para confirmar estos resultados. Además, la escasez de estudios que comparen perfiles de seguridad de formulaciones innovadoras y genéricas de fármacos citotóxicos orales hace necesaria la realización de más trabajos de este estilo.
Aportación a la literatura científica:
El cáncer colorrectal es la neoplasia más frecuente del aparato digestivo y su tratamiento quimioterápico cada vez aporta más beneficios con menor toxicidad. Además, son cada vez más las moléculas que se adaptan a presentaciones orales, aportando mayor comodidad y autonomía a los pacientes. Capecitabina es un medicamento oral que se usa en la práctica clínica como formulación innovadora y/o genérica. El presente estudio trata de comparar la seguridad de ambas formulaciones, pues en el área de oncología se han realizado diversos estudios que comparan dicha seguridad, pero siempre implicando medicamentos de administración intravenosa, no medicamentos de administración oral.
Puesto que cada vez son más los medicamentos adaptados a formas farmacéuticas de administración oral, es importante conocer la seguridad de las formulaciones innovadoras frente a las genéricas. Es un tema muy debatido en todas las áreas médicas y especialmente importante en los medicamentos antineoplásicos de administración oral, pues, a diferencia de los medicamentos de administración intravenosa, donde la concentración plasmática depende exclusivamente de la velocidad de infusión, en las formulaciones orales las concentraciones plasmáticas dependen de la velocidad de liberación del principio activo y de su velocidad de absorción, con su consiguiente variabilidad interindividual.
REFERENCIAS
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Capecitabina. Centro de información de medicamentos (CIMA) (web page). Madrid. Agencia Española de Medicamentos y Productos Sanitarios (accessed 15/7/2018). Available at: https://www.aemps.gob.es/cima/inicial.do [ Links ]
Ferreiro J, García JL, Barceló R, Rubio I. Quimioterapia: efectos secundarios. Gac Méd Bilbao. 2003;100(2): 69-74. [ Links ]
Sekine I, Kubota K, Tamura Y, Asahina H, Yamada K, Horinouchi H, et al. Innovator and generic cisplatin formulations: Comparison of renal toxicity. Cancer Sci. 2011;102(1):162-5. [ Links ]
Tampellini M, Benedetto S, Rubatto E, Baratelli C, DI Scipio F, Pirro E, et al. Bioequivalence of Branded and Generic Oxaliplatin: From Preclinical Assessment to Clinical Incidence of Hypersensitivity Reactions. Anticancer Res. 2016;36(10):5163-70. [ Links ]
Poirier E, Desbiens C, Poirier B, Hogue JC, Lemieux J, Doyle C, et al. Comparison of serious adverse events between the original and a generic docetaxel in breast cancer patients. Ann Pharmacother. 2014;48(4):447-55. [ Links ]
Grupo español para el desarrollo de la farmacia oncológica (GEDEFO). Documento de Consenso de antineoplásicos orales (Internet). Madrid: GEDEFO; 2009 (accessed 15/7/2018). Available at:http://www.sefh.es/gedefo/documentos/consenso_gedefo_antineoplasicos_orales.pdf [ Links ]
Kefalas CH, Ciociola AA. The FDA’s generic-drug approval process: similarities to and differences from brand-name drugs. Am J Gastroenterol. 2011;106(6):1018-21. [ Links ]
National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) (monography at Internet) version 4.03. US Department of health and human services. National Institutes of Health; 2010 (accessed 20/8/2018). Available at: http://www.hrc.govt.nz/sites/default/files/CTCAE%20manual%20-%20DMCC.pdf [ Links ]
Meza C, Pérez MA, Fuentes MB, Cabello A, Rodríguez JJ, Colón V, et al. Tratamiento adyuvante en cáncer de colon: Nuestra experiencia. Rev Venez Oncol. 2011;23(2):66-75. [ Links ]
Scheithauer W, McKendrick J, Begbie S, Borner M, Burns WI, Burris HA, et al. Oral capecitabine as an alternative to i.v. 5-fluorouracil-based adjuvant therapy for colon cancer: safety results of a randomized, phase III trial. Ann Oncol. 2003;14(12):1735-43. [ Links ]
Schmoll HJ, Cartwright T, Tabernero J, Nowacki MP, Figer A, Maroun J, et al. Phase III trial of capecitabine plus oxaliplatin as adjuvant therapy for stage III colon cancer: a planned safety analysis in 1,864 patients. J Clin Oncol. 2007;25(1):102-9. [ Links ]
Cassidy J, Tabernero J, Twelves C, Brunet R, Butts C, Conroy T, et al. XELOX (capecitabine plus oxaliplatin): active first-line therapy for patients with metastatic colorectal cancer. J Clin Oncol. 2004;22(11):2084-91. [ Links ]
Mas Morey P, Cholvi Llovell M, Nigorra Caro M, Nicolás Picó J, Vilanova Boltó M. Neurotoxicidad asociada a oxaliplatino en la práctica clínica asistencial P. Farm Hosp. 2012;36(5):336-42. [ Links ]
Twelves CJ, Butts CA, Cassidy J, Conroy T, Braud F, Díaz-Rubio E, et al. Capecitabine/oxaliplatin, a safe and active first-line regimen for older patients with metastatic colorectal cancer: post hoc analysis of a large phase II study. Clin Colorectal Cancer. 2005;5(2):101-7. [ Links ]
Comella P, Gambardella A, Farris A, Maiorino L, Natale D, Massidda B, et al. A tailored regimen including capecitabine and oxaliplatin for treating elderly patients with metastatic colorectal carcinoma Southern Italy Cooperative Oncology Group trial 0108. Crit Rev Oncol Hematol. 2005;53(2):133-9. [ Links ]
Recibido: 11 de Octubre de 2018; Aprobado: 19 de Febrero de 2019











 text in
text in 


