My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.44 n.4 Toledo Jul./Aug. 2020 Epub June 28, 2021
https://dx.doi.org/10.7399/fh.11367
ORIGINALES
Prevalencia de polifarmacia y complejidad farmacoterapéutica en personas mayores con VIH en España. Estudio POINT
1Department of Pharmacy, Hospital Clínico Universitario Lozano Blesa, Zaragoza. Spain.
2IIS Institute for Health Research Aragon, Zaragoza. Spain.
3Department of Pharmacy, Hospital Universitario de Getafe, Getafe. Spain.
4Department of Pharmacy, Hospital Universitario Nuestra Señora de Valme, Sevilla. Spain.
Introducción
Actualmente, la infección por virus de la inmunodeficiencia humana (VIH) se considera una enfermedad crónica gracias a la extraordinaria disminución de la mortalidad producida tras la introducción del tratamiento antirretroviral (TAR) de gran actividad y la llegada posterior de nuevos fármacos más potentes y con mejores pautas posológicas. El aumento de la supervivencia ha llevado aparejado un envejecimiento de la población VIH1. Para el año 2030 se estima que un 73% de los pacientes infectados por VIH tendrán más de 50 años2.
Al igual que en la población general, el aumento en la edad lleva consigo la aparición de enfermedades concomitantes, incluso se ha visto que en las personas mayores que viven con VIH, estas comorbilidades aparecen a una edad más temprana que en la población general3,4.
El análisis de poblaciones como la cohorte D:A:D (Data Collection on Adverse Events of Anti-HIV Drugs)5) indica una prevalencia de comorbilidades en el entorno del VIH de aproximadamente 33% de pacientes con hipertrigliceridemias, 22% hipercolesterolemia, 8% hipertensión arterial y 3% diabetes mellitus, entre otras comorbilidades6.
La aparición de patologías concomitantes lleva consigo el incremento en el uso de medicamentos. Diversos estudios muestran cómo a partir de los 50 años el número de medicamentos concomitantes se incrementa considerablemente7,8. El aumento de la medicación concomitante podría incluso afectar a la adherencia al TAR, aspecto clave en el control de la patología9. Diferentes estudios muestran cómo el envejecimiento puede alterar prácticamente todos los procesos farmacocinéticos del organismo, incluyendo la absorción, el metabolismo de primer paso, la biodisponibilidad, la distribución, la unión a proteínas y la eliminación hepática y renal. Todas estas alteraciones contribuyen a aumentar el riesgo de problemas relacionados
con la medicación10.
La polimedicación en pacientes de edad avanzada es un problema de salud pública, dada la prevalencia de uso de múltiples fármacos, lo que habitualmente es conocido como polifarmacia, término que aunque no está uniformemente establecido en la bibliografía existente, se define como el uso de más de seis medicamentos de forma simultánea11. Estudios como el de Maher et al.12 muestran cómo la polifarmacia está asociada a resultados clínicos negativos, además de la aparición de reacciones adversas, interacciones, uso de fármacos inadecuados y empeoramiento o aparición de factores como malnutrición, empeoramiento funcional, caídas, fracturas y hospitalizaciones13-15.
Según el documento de consenso sobre edad avanzada e infección por VIH, se establece como edad de corte para definir edad avanzada en este grupo de población la edad de 50 años, ya que existe evidencia de envejecimiento precoz del sistema inmune por el VIH, y esta edad marca el comienzo del declinar en la respuesta inmunológica. Así, define a las personas con infección por el VIH (PVVIH) con edad igual o superior a 65 años como población muy envejecida11.
A pesar de que se han realizado estudios sobre polifarmacia en PVVIH en España16, hasta la fecha no existen datos representativos del total de la población mayor española que vive con VIH.
El objetivo principal de este estudio es determinar la prevalencia de polifarmacia en PVVIH mayores en TAR y seguimiento farmacoterapéutico en las consultas externas de servicios de farmacia de los hospitales en España. Otros objetivos son: determinar la prevalencia de comorbilidades; describir el tipo de TAR; describir la medicación concomitante más frecuentemente utilizada; la prevalencia de polifarmacia y polifarmacia mayor; analizar la adherencia asociada a la polifarmacia; analizar la complejidad farmacoterapéutica e identificar la prevalencia de interacciones en la población a estudio.
Métodos
Este trabajo es un subanálisis del proyecto POINT, que tiene como objetivo principal determinar la prevalencia de polifarmacia en PVVIH en TAR y seguimiento farmacoterapéutico en las consultas externas de farmacia de los hospitales de toda España. Se trata de un estudio observacional, transversal y multicéntrico. En el presente trabajo se incluyeron PVVIH con edad igual o superior a 65 años, con TAR activo y dispensación de TAR el día del corte transversal prefijado en febrero de 2017, en los servicios de farmacia de los hospitales participantes en el estudio. La Agencia Española del Medicamento clasificó al estudio POINT como “Estudio postautorización con otros diseños diferentes al de seguimiento prospectivo (EPA-OD)”. Fue autorizado por el Comité Ético de Investigación de Sevilla Sur y lleva por título “Prevalencia, factores asociados y complejidad farmacoterapéutica de la polifarmacia en pacientes VIH en España. Estudio POINT”.
Los criterios de exclusión fueron pacientes ingresados el día del estudio, pacientes incluidos en ensayos clínicos y aquellos que no firmaran el consentimiento informado.
Se recogieron las siguientes variables: demográficas, sexo, edad. Variables clínicas, vía de adquisición de la infección por VIH, carga viral y linfocitos CD4 y comorbilidades (enfermedad hepática -virus de las hepatitis B y C-, enfermedad del sistema nervioso central, enfermedad cardiovascular o hipertensión y enfermedad pulmonar crónica -enfermedad pulmonar obstructiva crónica o asma-) en el momento del estudio. El patrón de comorbilidad se clasificó en: cardiometabólico, psicogeriátrico, mecánico-tiroideo o mixto, para ello se debía padecer al menos dos patologías del mismo. Variables farmacoterapéuticas, TAR, que se clasificó en régimen de triple terapia, biterapia, monoterapia u otras combinaciones. Además, se analizaron los regímenes de comprimido único (STR, del inglés single-tablet-regimen); medicación concomitante prescrita, obtenida de la historia clínica y de la entrevista con el paciente. Se definió polifarmacia como “prescripción simultánea de seis principios activos incluyendo TAR” y polifarmacia mayor "como prescripción de 11 principios activos o más"11. Se clasificó a los pacientes según el patrón de polifarmacia: cardiovascular, depresivo-ansioso, enfermedad pulmonar o mixto. Para ello era necesario tener prescritos tres fármacos del mismo patrón.
Se midió la adherencia al TAR y a la medicación concomitante mediante los registros de dispensación en los últimos seis meses y, adicionalmente, el cuestionario SMAQ para TAR y Morisky-Green para tratamiento concomitante. Se consideró paciente adherente si la tasa de posesión de la medicación era mayor de 95% para el TAR (mayor de 90% concomitante) y el cuestionario específico positivo.
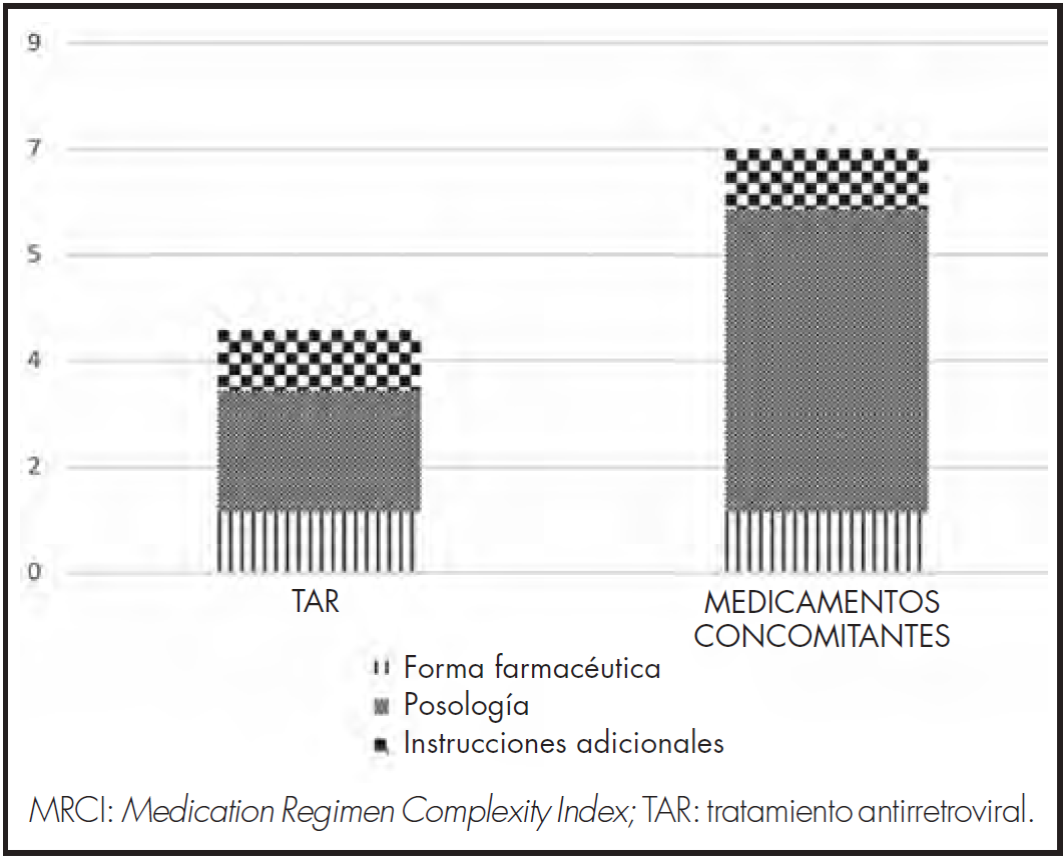
Se calculó la complejidad farmacoterapéutica a través del Medication Regimen Complexity Index (MRCI). Este índice, desarrollado por George et al.17, permite el cálculo de la complejidad de la medicación considerando los siguientes tres apartados: la forma farmacéutica, la posología y las instrucciones adicionales de administración.
Se contabilizó la complejidad total de la medicación prescrita en el momento de la recogida de datos y la realización de la entrevista para el estudio. También se analizó, desde un punto de vista cuantitativo y cualitativo, la complejidad de los distintos subapartados de los que se compone el MRCI. Se analizaron las interacciones y contraindicaciones, para lo que se utilizó la base de datos de Liverpool (www.hiv-druginteractions.com) y Lexicomp.
Análisis estadístico
En primer lugar se realizó una depuración estadística de los datos, procediéndose después a su descripción. Las variables cuantitativas se resumen con medias y desviaciones típicas, o bien con medianas y percentiles P25 y P75 en caso de distribuciones asimétricas, y las variables cualitativas con frecuencias y porcentajes.
El análisis de los datos se realizó con el paquete estadístico IBM SPSS para Windows.
Resultados
En el subanálisis se incluyeron 74 pacientes (86,5% hombres) del estudio POINT que se realizó en 81 hospitales, en los que estaban representadas todas las comunidades autónomas. De ellos, el 71,6% presentaban polifarmacia y un 25,6% polifarmacia mayor, siendo la mediana de fármacos concomitantes 5,0 (intervalo intercuartílico (IQR) 2-7).
Las características sociodemográficas y clínicas de la población a estudio se muestran en la Tabla 1.
Tabla 1. Características demográficas y clínicas de las personas que viven con VIH
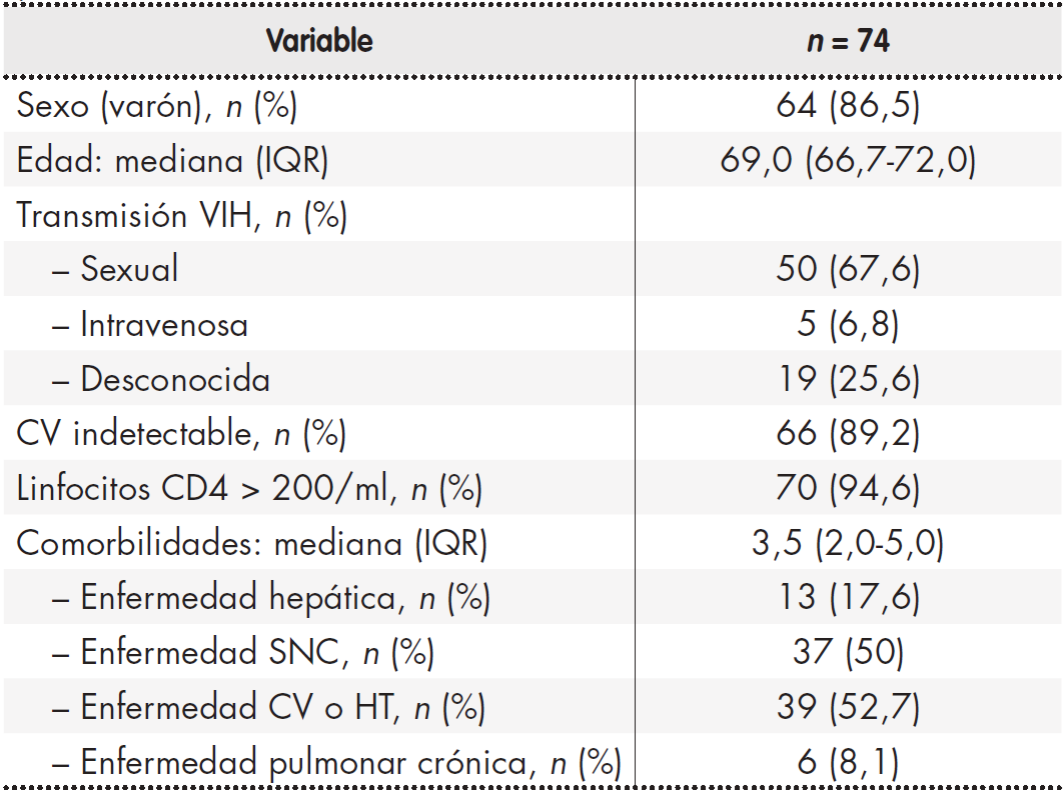
CV: cardiovascular; HT: hipertensión; IQR: intervalo intercuartílico; SNC: sistema nervioso central; VIH: virus de la inmunodeficiencia humana.
De los 50 PVVIH con patrón de comorbilidad, el 58,0% era cardiometabólico, el 12,0% psicogeriátrico, el 6,0% mecánico-tiroideo y mixto un 24,0%. Respecto a los regímenes de TAR, las combinaciones más prescritas fueron dos inhibidores de la transcriptasa inversa análogos de nucleósidos/ nucleótidos (ITIAN) en combinación con un inhibidor de la integrasa (INI) (39,2%), o un inhibidor de la transcriptasa inversa no análogo de nucleósidos (ITINN) (35,1%). El ITIAN, ITINN, inhibidor de la proteasa (IP) e INI más empleados fueron abacavir/lamivudina (75,4%), rilpivirina (46,9%), darunavir (92,9%) y dolutegravir (65,8%), respectivamente. Recibieron triple terapia el 81,1% de la población, biterapia un 10,8% y monoterapia un 4,1%, además de otras combinaciones diferentes un 4,1% de la población. Llevaron un régimen STR el 48,6%. En la Tabla 2 se especifican los tipos de TAR.
Tabla 2. Tratamiento antirretroviral
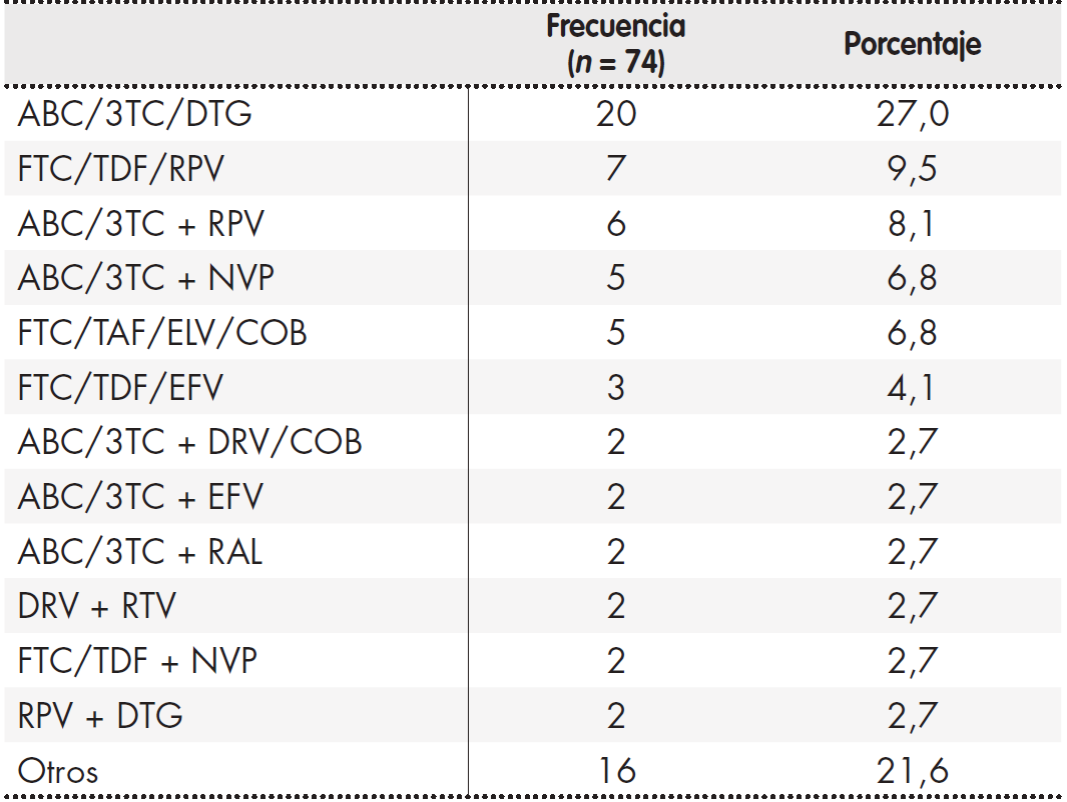
3TC: lamivudina; ABC: abacavir; COB: cobicistat; DRV: darunavir; DTG: dolutegravir; EFV: efavirenz; ELV: elvitegravir; FTC: emtricitabina; NVP: nevirapina; RAL: raltegravir; RPV: rilpivirina; RTV: ritonavir; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato.
Un 56,8% de las PVVIH tenía medicamentos antihipertensivos y para el sistema cardiovascular (C1 a C9 de la Clasificación Anatómica, Terapéutica, Química (ATC)), hipolipemiantes en un 50,0%, antiulcerosos en un 33,8%, psicofármacos (ansiolíticos y antidepresivos, N05, N06) en un 32,4%, antidiabéticos (A10) en un 29,7%, para enfermedades respiratorias crónicas (R03) un 10,8%, tratamiento antiepiléptico un 5,4% y antiparkinsoniano un 2,7%.
Se clasificó a las PVVIH según su patrón de polifarmacia, siendo cardiovascular en un 25,7% de los pacientes, un 5,4% depresivo-ansioso, un 5,4% respiratorio crónico, un 2,7% mixto y en un 60,8% no se encontró ningún patrón predominante.
El porcentaje de PVVIH adherentes al TAR calculado por los registros de dispensación fue del 85,1% y según el cuestionario SMAQ del 68,5%. El porcentaje de PVVIH adherentes a la medicación concomitante, calculado por registros de dispensación, fue del 62,8% y según el cuestionario Morisky-Green del 65,6%.
La mediana del índice de complejidad farmacoterapéutica del tratamiento completo (TAR y concomitante) fue de 13,0 (IQR 8,0-17,6), teniendo más peso el tratamiento concomitante, y sobre todo la posología del mismo (Figura 1).
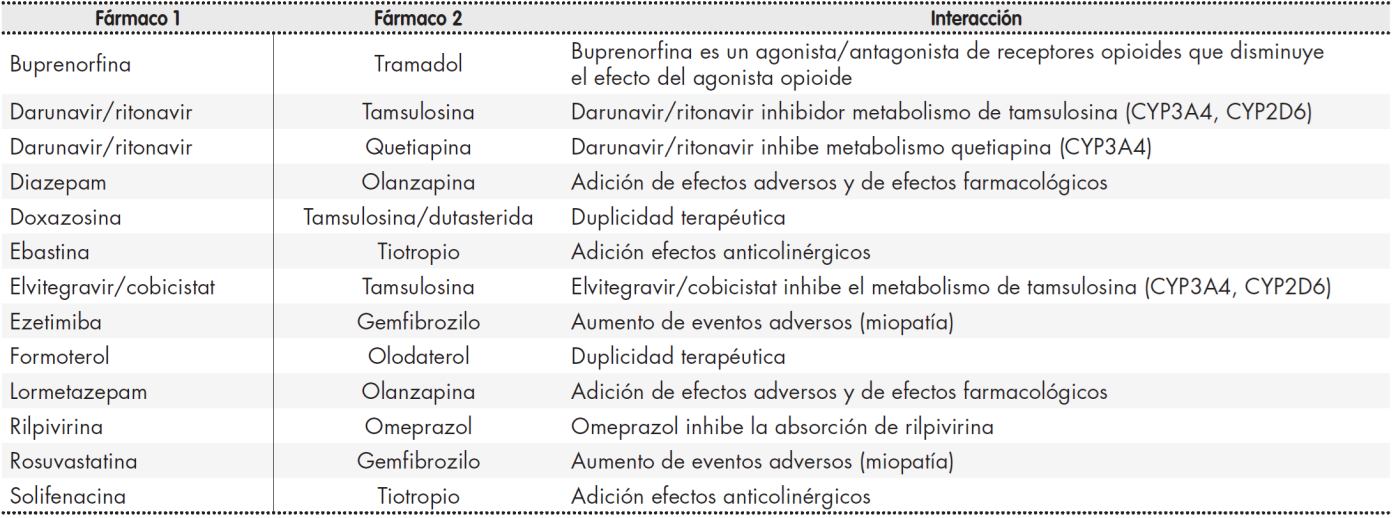
En cuanto al estudio de las interacciones, el 55,4% de las PVVIH tenían al menos una interacción potencial y el 12,2% al menos una interacción contraindicada. El número total de interacciones detectadas fueron 110 (97 interacciones potenciales y 13 contraindicadas, Tabla 3), con una media por paciente de 2,6 (2,4). Las interacciones farmacocinéticas fueron las más frecuentes (71,8%) frente a las farmacodinámicas, siendo el metabolismo la principal vía de interacción (63,3%) seguida de la absorción (26,6%). Las interacciones entre medicamentos concomitantes y TAR fueron más frecuentes (76,6%) que entre medicamentos concomitantes.
El tipo de fármaco antirretroviral más involucrado en las interacciones fue el perteneciente a los ITINN seguido de los IP, 40,7% y 29,6%, respectivamente. Los medicamentos concomitantes más involucrados en presentar una interacción fueron las estatinas, antidiabéticos orales, fármacos urológicos y suplementos minerales, respectivamente, con un 22,7%, 9,1%, 7,3% y 6,4%.
Discusión
Los resultados de este estudio transversal mostraron una muy alta prevalencia de polifarmacia y de complejidad farmacoterapéutica en PVVIH mayores de 65 años en España con TAR.
El patrón de comorbilidad más frecuente en esta población a estudio fue el cardiometabólico, como ocurre en la cohorte GEPPO, cohorte italiana de PVVIH de la misma edad, donde la dislipemia, hipertensión y enfermedad cardiovascular son las comorbilidades más frecuentes(18). Como consecuencia, el patrón de polifarmacia mayoritario fue el cardiovascular, como en otros trabajos7.
La mayor parte de la población del estudio estaba en TAR con triple terapia y el 48,6% con STR, algo que contrasta con el estudio de Guaraldi19, donde se asocia la estrategia de STR con una edad más joven y de mono y biterapia (LDR, less drug regimen) con una mayor edad. Efavirez/ emtricitabina/tenofovir y rilpivirina/emtricitabina/tenofovir son los STR más utilizados en el estudio de Guaraldi, sin embargo, en esta subpoblación del estudio POINT la mayoría de STR fueron con abacavir/lamivudina/ dolutegravir, quizá no disponible en el estudio de Guaraldi, motivo por el cual pueden diferir los resultados. Cabe destacar la baja prevalencia de LDR en nuestra población, cuando el uso de mono y biterapia es una de las estrategias preferentes en pacientes mayores, para disminuir la polifarmacia, posibles interacciones y sus consecuencias20.
La polifarmacia de un 71,6% de las PVVIH y polifarmacia mayor de un 25,7%, son datos algo más elevados que estudios de las cohortes italiana21, canadiense22 o inglesa23. Estas diferencias pueden ser debidas a la definición de polifarmacia empleada; sin embargo, en todos ellos la prevalencia es elevada.
La polifarmacia está asociada con una menor adherencia al TAR9. En la población a estudio, la adherencia al TAR según el registro de dispensaciones fue del 85,1%, pero según el cuestionario SMAQ del 68,5%; esta disparidad se debe a que cada método tiene sus limitaciones y realizan una medición diferente de la adherencia. En cuanto a la adherencia de la medicación concomitante, fue menor que para el TAR. Con estos datos de adherencia al TAR, el 90,9% de los pacientes tenían carga viral indetectable, lo que nos hace reflexionar acerca del nivel de adherencia necesario para alcanzar la supresión viral, que podría ser menor del considerado hasta ahora y fármaco dependiente, como sugiere el estudio de Byrd24.
Una mayor complejidad del tratamiento farmacoterapéutico se asocia con una mayor probabilidad de no adherencia, mayor riesgo de ingreso, menor adherencia al TAR, y aumenta tras un ingreso hospitalario25-27, por lo que su disminución produciría un claro beneficio en el paciente. En la población a estudio se podría disminuir el MRCI mejorando la posología de la medicación concomitante, ya que es lo que más aportó al índice de complejidad. Además, se ha publicado recientemente el valor de 11,25 como el umbral de índice de complejidad total de la farmacoterapia para predecir polifarmacia en PVVIH28, valor que tendremos que tener presente para identificar a nuestros pacientes y mejorar su farmacoterapia.
En cuanto a las interacciones, se describe cómo la polifarmacia está asociada a una mayor probabilidad de tener una interacción29, y esto sucedió en nuestra población, donde el 12,2% de las PVVIH tenían al menos una interacción contraindicada, casi el doble que en el trabajo de Bastida29, estudio unicéntrico, pero similar al de Greene30.
La principal limitación de este estudio fue su diseño transversal, adecuado para cuantificar la polifarmacia, pero no para identificar factores predictivos, ya que el diseño del estudio no permite esa aseveración estadística. El tamaño muestral no fue elevado debido a las características del estudio y existió una limitación en los métodos de medida de la adherencia, que a pesar de ser combinados (cuestionario más registro de dispensaciones) carecen de exactitud. Las fortalezas principales fueron su carácter multicéntrico y la representación de todas las comunidades autónomas españolas. Las futuras líneas de investigación podrían ir dirigidas a conseguir disminuir la polifarmacia y la complejidad farmacoterapéutica en este tipo de pacientes. Recientemente se ha publicado una guía de desprescripción farmacológica de la terapia no antirretroviral en pacientes con infección por VIH31, que nos puede ayudar para desarrollar programas específicos
para estos pacientes.
En conclusión, este estudio muestra cómo las PVVIH mayores tienen una alta prevalencia de polifarmacia y complejidad farmacoterapéutica, baja adherencia al tratamiento concomitante y alta probabilidad de tener interacciones. Estos resultados nos permitirán elaborar estrategias de intervención y optimización farmacoterapéutica en este tipo de población. (Tabla 4, Tabla 5, Tabla 6)
Aportación a la literatura científica
La principal contribución práctica de este estudio es conocer la prevalencia de polifarmacia, factores asociados y complejidad farmacoterapéutica en personas mayores que viven con VIH en una cohorte de práctica clínica real en España. Esta contribución permite elaborar estrategias de intervención y optimización farmacoterapéutica en pacientes con polifarmacia y mayores necesidades de seguimiento.
References
Gueler A, Moser A, Calmy A, Günthard HF, Bernasconi E, Furrer H, et al.; Swiss HIV Cohort Study, Swiss National Cohort. Life expectancy in HIV-positive persons in Switzerland: matched comparison with general population. AIDS. 2017;31:427-36. DOI: 10.1097/QAD.0000000000001335 [ Links ]
Smith M, Brinkman K, Geerlings S, Smit C, Thyagarajan K, Sighem Av, et al.; ATHENA observational cohort. Future challenges for clinical care of an ageing population infected with HIV: a modelling study. Lancet Infect Dis. 2015;15:810-8. DOI: 10.1016/S1473-3099(15)00056-0 [ Links ]
Guaraldi G, Orlando G, Zona S, Menozzi M, Carli F, Garlassi E, et al. Premature age-related comorbidities among HIV-infected persons compared with the general population. Clin Infect Dis. 2011;53:1120-6. DOI: 10.1093/cid/cir627 [ Links ]
Schouten J, Wit FW, Stolte IG, Kootstra NA, van der Valk M, Geerlings SE, et al.; AGEhIV Cohort Study Group. Cross-sectional comparison of the prevalence of age-associated comorbidities and their risk factors between HIV-Infected and uninfected individuals: the AGEhIV cohort study. Clin Infect Dis. 2014;59:1787-97. DOI: 10.1093/cid/ciu701 [ Links ]
D:A:D Study Group, Sabin CA, Worm SW, Weber R, Reiss P, El-Sadr W, et al. Use of nucleoside reverse transcriptase inhibitors and risk of myocardial infarction in HIVinfected patients enrolled in the D:A:D study: a multicohort collaboration. Lancet. 2008;371:1417-26. DOI: 10.1016/S0140-6736(08)60423-7 [ Links ]
Gleason LJ, Luque AE, Shah K. Polypharmacy in the HIV-infected older adult population. Clin Interv Aging. 2013;8:749-63. DOI: 10.2147/CIA.S37738 [ Links ]
Marzolini C, Back D, Weber R, Furrer H, Cavassini M, Calmy A, et al.; Swiss HIV Cohort Study Members. Ageing with HIV: medication use and risk for potential drug-drug interactions. J Antimicrob Chemother. 2011;66:2107-11. DOI: 10.1093/jac/dkr248 [ Links ]
Holtzman C, Armon C, Tedaldi E, Chmiel JS, Buchacz K, Wood K, et al.; HOPS Investigators. Polypharmacy and risk of antiretroviral drug interactions among the aging HIV-infected population. J Gen Intern Med. 2013;28:1302-10. DOI: 10.1007/s11606-013-2449-6 [ Links ]
Cantudo-Cuenca MR, Jiménez-Galán R, Almeida-González CV, Morillo Verdugo R. Concurrent use of comedication reduces adherence in antiretroviral therapy among HIV patients. J Manag Care Pharm. 2014;20:844-50. DOI: 10.18553/jmcp.2014.20.8.844 [ Links ]
Mangoni AA, Jackson SHD. Age-related changes in pharmacokinetics and pharmacodynamics: basic principles and practical applications. Br J Clin Pharmacol. 2004;57:6-14. DOI: 10.1046/j.1365-2125.2003.02007.x [ Links ]
Grupo de expertos de la Secretaría del Plan Nacional sobre el sida (SPNS), Sociedad Española de Geriatría y Gerontología (SEGG). Documento consenso sobre edad avanzada e infección por el virus de la inmunodeficiencia adquirida (noviembre 2015) (accessed 11/2019). Available at: https://www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/publicaciones/profSanitarios/docEdadAvanzadaVIH.pdf [ Links ]
Maher RL, Hanlon J, Hajjar ER. Clinical consequences of polypharmacy in elderly. Expert Opin Drug Saf. 2014;13:57-65. DOI: 10.1517/14740338.2013.827660 [ Links ]
Field TS, Gurwitz JH, Harrold LR, Rothschild J, DeBellis KR, Seger AC, et al. Risk factors for adverse drug events among older adults in the ambulatory setting. J Am Geriatr Soc. 2004;52:1349-54. DOI: 10.1111/j.1532-5415.2004.52367.x [ Links ]
Fialová D, Topinková E, Gambassi G, Finne-Soveri H, Jónsson PV, Carpenter I, et al.; AdHOC Project Research Group. Potentially inappropriate medication use among elderly home care patients in Europe. JAMA. 2005;293:1348-58. DOI: 10.1001/jama.293.11.1348 [ Links ]
Tseng A, Szadkowski L, Walmsley S, Salit I, Raboud J. Association of age with polypharmacy and risk of drug interactions with antiretroviral medications in HIV positive patients. Ann Pharmacother. 2013;47:1429-39. DOI: 10.1177/1060028013504075 [ Links ]
López-Centeno B, Badenes-Olmedo C, Mataix-Sanjuan A, McAllister K, Bellón JM, Gibbons S, et al. Polypharmacy and drug-drug interactions in HIV-infected subjects in the region of Madrid, Spain: a population-based study. Clin Infect Dis. 2019 20 Ago. DOI: 10.1093/cid/ciz811 [ Links ]
George J, Phun YT, Bailey MJ, Kong DC, Stewart K. Development and validation of the medication regimen complexity index. Ann Pharmacother. 2014;38:1369-76. DOI:10.1345/aph.1D479 [ Links ]
Nozza S, Malagoli A, Maia L, Calcagno A, Focà E, De Socio G, et al. Antiretroviral therapy in geriatric HIV patients: the GEPPO cohort study. J Antimicrob Chemother. 2017;72:2879-86. DOI: 10.1093/jac/dkx169 [ Links ]
Guaraldi G, Menozzi M, Zona S, Calcagno A, Silva AR, Santoro A, et al. Impact of polypharmacy on antiretroviral prescription in people living with HIV. J Antimicrob Chemother. 2017;72:511-4. DOI: 10.1093/jac/dkw437 [ Links ]
Guaraldi G, Marcotullio S, Maserati R, Gargiulo M, Milic J, Franconi I, et al. The management of geriatric and frail HIV patients. A 2017 update from the Italian guidelines for the use of antiretroviral agents and the diagnostic-clinical management of HIV-1 infected persons. J Frailty Aging. 2019;8:10-6. DOI: 10.14283/jfa.2018.42 [ Links ]
Guaraldi G, Malagoli A, Calcagno A, Mussi C, Celesia BM, Carli F, et al. The increasing burden and complexity of multi-morbidity and polypharmacy in geriatric HIV patients: a cross sectional of people aged 65-74 years and more tan 75 years. BMC Geriatr. 2018;18:99. DOI: 10.1186/s12877-018-0789-0 [ Links ]
Krentz HB, Gill MJ. The impact of non-antiretroviral polypharmacy on the continuity of antiretroviral therapy (ART) among HIV patients. AIDS Patient Care STDS. 2016;30:1-17. DOI: 10.1089/apc.2015.0199 [ Links ]
Halloran MO, Boyle C, Kehoe E, Bagkeris E, Mallon P, Post FA, et al. Polypharmacy and drug-drug interactions in older and younger people living with HIV: the POPPY study. Antivir Ther. 2019;24:193-201. DOI: 10.3851/IMP3293 [ Links ]
Byrd KK, Hou JG, Hazen R, Kirkham H, Suzuki S, Clay PG, et al.; Patient-Centered HIV Care Model Team. Antiretroviral adherence level necessary for HIV viral suppresion using real-world data. J Acquire Immune Defic Syndr. 2019;18:245-51. DOI: 10.1097/QAI.0000000000002142 [ Links ]
Wimmer BC, Cross AJ, Jokanovic N, Wiese MD, George J, Johnell K, et al. Clinical outcomes associated with medication regimen complexity in older people: a systematic review. J Am Geriatr Soc. 2017;65:747-53. DOI: 10.1111/jgs.14682 [ Links ]
Manzano-García M, Pérez-Guerrero C, Álvarez de Sotomayor Paz M, Robustillo-Cortés MLA, Almeida-González CV, Morillo-Verdugo R. Identification of the medication regimen complexity index as an associated factor of nonadherence to antiretroviral treatment in HIV positive patients. Ann Pharmacother. 2018;52:862-7. DOI: 10.1177/1060028018766908 [ Links ]
Robustillo Cortés MA, Morillo Verdugo R, Barreiro Fernández EM, Pavón Plata A, Monje Agudo P. Influence of hospital admission in the pharmacotherapy complexity of HIV+ patients. Farm Hosp. 2017;41:518-26. DOI: 10.7399/fh.2017.41.4.10751 [ Links ]
Morillo-Verdugo R, Robustillo-Cortés MA, Abdel-Kader Martín L, Álvarez de Sotomayor Paz M, Lozano de León Naranjo F, Almeida González CV. Determination of a cutoff value for medication regimen complexity index to predict polypharmacy in HIV+ older patient. Rev Esp Quimioter. 2019; 32:458-64. [ Links ]
Bastida C, Grau A, Márquez M, Tuset M, De Lazzari E, Martínez E, et al. Polypharmacy and potential drug-drug interactions in an HIV-infected elderly population. Farm Hosp. 2017;41:618-24. DOI: 10.7399/fh.10890 [ Links ]
Greene M, Steinman MA, McNicholl IR, Valcour V. Polypharmacy, drug-drug interactions, and potentially inappropriate medications in older adults with human immunodeficiency virus infection. J Am Geriatr Soc. 2014;62:447-53. DOI: 10.1111/jgs.12695 [ Links ]
Grupo de estudio del sida (GeSIDA). Desprescripción farmacológica de la terapia no antirretroviral en pacientes con infección por VIH. Noviembre 2018 (accessed 11/2019). Available at: http://gesida-seimc.org/wp-content/uploads/2018/09/gesida_desprescripcion_farmacologica_de_la_terapia_no_antirretroviral_en_pacientes_con_infeccion_por_VIH.pdf [ Links ]
Recibido: 20 de Noviembre de 2019; Aprobado: 03 de Marzo de 2020











 text in
text in