My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.44 n.5 Toledo Sep./Oct. 2020 Epub July 26, 2021
https://dx.doi.org/10.7399/fh.11402
ORIGINALES
Estudio observacional de la toxicidad con diferentes formulaciones de docetaxel en pacientes con cáncer de mama
1Pharmacy Department, Hospital General Universitario Gregorio Marañón, Madrid. Spain.
2Pharmacy Department, Hospital Costa del Sol, Marbella, Málaga. Spain.
3Clinical Pharmacy Unit, Hospital Universitario Puerta del Mar, Cádiz. Spain.
4Pharmacy Department, Hospital General Universitario, Alicante. Spain.
5Pharmacy Department, Clínica Universidad de Navarra, Pamplona. Spain.
6Pharmacy Department, Hospital Universitari Arnau de Vilanova, Lleida. Spain.
Introducción
Docetaxel es un antineoplásico que actúa estimulando el ensamblaje de la tubulina en los microtúbulos estables inhibiendo su despolimerización, produciendo un marcado descenso de tubulina libre. Así, inhibe la formación del huso mitótico durante la división celular, bloqueando la mitosis(1.2). Actualmente está indicado en el cáncer de mama, pulmón no microcítico, próstata, adenocarcinoma gástrico y cáncer de cabeza y cuello, administrado en dosis habitualmente de 75-100 mg/m2 cada 3 semanas2.
Los medicamentos genéricos representan una solución para frenar el imparable incremento de los costes de los sistemas de salud al ser más económicos que los de referencia, debido fundamentalmente a que su precio no incluye costes de investigación y desarrollo, y al impacto de la competencia entre diferentes fabricantes para introducir su producto en el mercado3. Según la legislación en la Unión Europea, genérico es “todo medicamento con igual composición cualitativa y cuantitativa en principios activos y la misma forma farmacéutica, y cuya bioequivalencia con el medicamento de referencia haya sido demostrada por estudios adecuados de biodisponibilidad”. Las diferentes sales, ésteres, éteres, isómeros, mezclas de isómeros, complejos o derivados de un principio activo se considerarán un mismo principio activo, a menos que tengan propiedades considerablemente diferentes en cuanto a seguridad y/o eficacia4,5. Medicamentos genéricos e innovadores no difieren en la calidad químico-farmacéutica que deben presentar ante las agencias de medicamentos, siendo necesaria una documentación propia completa y cumplir idénticos requisitos.
Las guías sobre bioequivalencia de la European Medicines Agency (EMA) se centran en las formas farmacéuticas orales, mientras que para las soluciones acuosas parenterales genéricas con igual cantidad de sustancia activa que el producto de referencia, generalmente no se requieren estudios de bioequivalencia. Si presentan excipientes que interactúan con el principio activo, o afectan a la disposición del mismo, se requiere un estudio de bioequivalencia, a menos que ambos productos contengan los mismos excipientes en cantidad similar o se justifique que la diferencia no afecta a la farmacocinética del principio active6.
Uno de los inconvenientes que presenta el docetaxel es su pobre solubilización acuosa, por lo que requiere un vehículo surfactante no iónico para su formulación, el polisorbato 80 (Tween 80), y alcohol. Los excipientes de docetaxel solubilizan la formulación para lograr una solución para perfusión que permanezca estable en las condiciones de conservación y para impedir que el principio activo se adhiera a las paredes del recipiente o precipite durante el periodo de validez de la mezcla.
El artículo 34 del Real Decreto 1345/2007 dispone que “en el etiquetado, en la declaración de la composición del medicamento, se incluirán los excipientes de declaración obligatoria (EDO) cuyo conocimiento resulte necesario para la correcta administración y uso del medicamento” y que “los EDO se irán actualizando conforme a los avances científicos y técnicos y de acuerdo con lo que se establezca en la Unión Europea”. Su anexo III determina que “deberán indicarse todos los excipientes cuando se trate de un producto inyectable, de una preparación tópica o un colirio”.
El medicamento de referencia de docetaxel es Taxotere®, concentrado y disolvente para solución para perfusión de Sanofi-Aventis Francia2. Se aprobó por procedimiento centralizado y se comercializa en Europa desde noviembre de 1995. Las presentaciones originales de 20 y 80 mg contenían dos viales, uno con docetaxel anhidro disuelto en polisorbato, que contenía 40 mg/dl de docetaxel y 1.040 mg/ml de polisorbato 80 y requería ser diluido 1/4 con el solvente, etanol al 13%, del segundo vial, previo a la transferencia a la bolsa de infusión. En 2009, paralelamente a la aparición de los genéricos de docetaxel se produjo un cambio en la formulación de todos los medicamentos con dicho principio activo a un único vial que contiene el fármaco y los excipientes listos para su adición a la solución que será administrada. El cambio de formulación conlleva variaciones en las cantidades de los excipientes, que en el caso de etanol casi duplican, en el mejor de los casos, la cantidad inicial de las presentaciones con dos viales.
Varios estudios han encontrado que cantidades diferentes de polisorbato 80 y etanol contenidas en diversas formulaciones de docetaxel podrían estar relacionadas con diferencias en la incidencia de reacciones de hipersensibilidad agudas graves y en la toxicidad cutánea, con un perfil clínico diferente al previamente observado con la formulación original de docetaxel, de probable origen irritativo7. Un estudio retrospectivo canadiense mostró que una formulación genérica específica de docetaxel producía un número parecido de eventos adversos graves hematológicos que la formulación original en pacientes con cáncer de mama, aunque presentaron más frecuentemente neutropenia febril grado 4 y los episodios de hospitalización por este motivo fueran más prolongados8.
El objetivo principal del presente estudio ha sido analizar las concentraciones de los excipientes e impurezas de los diferentes medicamentos comercializados de docetaxel, y conocer la incidencia de los eventos adversos de cualquier grado derivados de su uso y su repercusión clínica en pacientes con cáncer de mama en el contexto de adyuvancia o neoadyuvancia.
Métodos
Estudio observacional, longitudinal, prospectivo y multicéntrico en el que participaron 26 hospitales de Madrid, Cataluña, Andalucía y Comunidad Valenciana. El estudio fue realizado por el Grupo Español de Farmacia Oncológica (GEDEFO) y el Grupo de Farmacocinética y Farmacogenética clínica (PkGen) de la Sociedad Española de Farmacia Hospitalaria (SEFH). Fue clasificado por la Agencia Española de Medicamentos y Productos Sanitarios como Estudios Posautorización de Seguimiento Prospectivo (EPA-SP). Se solicitó consentimiento informado a los pacientes y fue aprobado en los Comités de Ética de la Investigación de los hospitales participantes. El periodo de reclutamiento fue desde noviembre de 2015 hasta octubre de 2017, con seguimiento hasta la finalización del tratamiento.
El grupo PkGen realizó en la Clínica Universidad de Navarra (CUN) la caracterización de las distintas formulaciones de docetaxel en cuanto a pH, cantidad de docetaxel e impurezas. Por lo que respecta a los excipientes de los medicamentos comercializados con docetaxel, la cantidad de alcohol se recogió de la ficha técnica de cada medicamento y la cantidad de polisorbato 80 mediante consulta a los laboratorios fabricantes. La determinación cromatográfica de las distintas presentaciones de docetaxel se hizo por duplicado, a excepción del vial de Taxotere® 20 mg/1 ml, que se analizó por quintuplicado y fue usado como referencia. Para el análisis cromatográfico se eligió una dilución con acético y acetonitrilo, con el fin de que la composición de las muestras fuese lo más similar posible a la fase móvil empleada en el método cromatográfico y así evitar perturbaciones en los cromatogramas. El análisis de las muestras se realizó en un equipo Agilent 1200. El software para la interpretación de resultados fue ChemStation (Agilent).
Los farmacéuticos oncológicos de los hospitales participaron en la inclusión de todos los pacientes que cumplían los criterios especificados en el estudio y en la recogida de datos demográficos y clínicos, así como en la evaluación clínica de la toxicidad según los criterios Common Terminology Criteria for Adverse Events del National Cancer Institute versión 4.0 (NCI CTCAE v4.0).
Se incluyeron pacientes con cáncer de mama precoz y calidad de vida medida según la escala Eastern Cooperative Oncology Group (ECOG) 0, que iban a recibir tratamiento adyuvante o neoadyuvante con docetaxel-ciclofosfamida (TC) (75 mg/m2 docetaxel y 600 mg/m2 ciclofosfamida por vía intravenosa cada 21 días hasta un máximo de 4-6 ciclos) o con un esquema secuencial de 4 ciclos de docetaxel 100 mg/m2 tras 4 ciclos de adriamicina y ciclofosfamida (AC-T) cada 21 días por vía intravenosa. Se excluyeron pacientes incluidos en ensayos clínicos, con valores de enzimas hepáticas (aspartato-aminotransferasa y/o alanina-aminotransferasa) mayor de 1,5 veces el límite superior, fosfatasa alcalina mayor de 2,5 veces el límite superior, y/o bilirrubina por encima del límite superior.
Se recogieron variables independientes demográficas (edad al diagnóstico, peso, talla, superficie corporal e índice de masa corporal), variables de la enfermedad (subtipo molecular y fecha de la cirugía en el caso del tratamiento adyuvante), variables del tratamiento (administración en régimen de ingreso o ambulatorio, esquema de quimioterapia, dosis, número de ciclos y esquema de premedicación) y variables relativas al medicamento utilizado. Como variables dependientes de los distintos medicamentos con docetaxel utilizados se recogieron los eventos adversos, ciclo de inicio y duración de los mismos, intensidad de cualquier grado según criterios NCI CTCAE v4.0, hospitalizaciones por toxicidad y su duración, duración del tratamiento, ajustes de dosis y causa de interrupción, así como uso de factores estimulantes de colonias.
Para la recogida de datos se diseñó un cuaderno de recogida de datos electrónico (eCRD) con acceso vía web. Se partió de la información registrada en la historia clínica del paciente y sistemas informáticos de prescripción y dispensación del Servicio de Farmacia, y se entrevistó a los pacientes en todos los ciclos de tratamiento para evaluar las toxicidades.
Para el análisis de los datos se realizó un plan de gestión de datos para la exportación de la información recogida en el eCRD al soporte adecuado para el procesado estadístico mediante el programa estadístico IBM SPSS Statistics for Windows, Version 21.0. Se realizó análisis descriptivo utilizando medidas de tendencia central y dispersión para variables cuantitativas y distribución de frecuencias para variables cualitativas. Se evaluó la incidencia acumulada con respectivos intervalos de confianza al 95% de eventos adversos estratificados por medicamento utilizado, evaluando diferencias mediante el test de χ2. Se estableció el nivel de significación estadística en p < 0,05. Se realizó un análisis multivariante en función del medicamento y el esquema terapéutico ajustando por edad.
Resultados
Las Tabla 1 y Tabla 2 muestran la composición en excipientes de los diferentes medicamentos comercializados con docetaxel y los resultados del análisis cromatográfico de las impurezas, cantidad de fármaco y pH, respectivamente.
Tabla 1. Excipientes de los diferentes medicamentos comercializados con docetaxel*
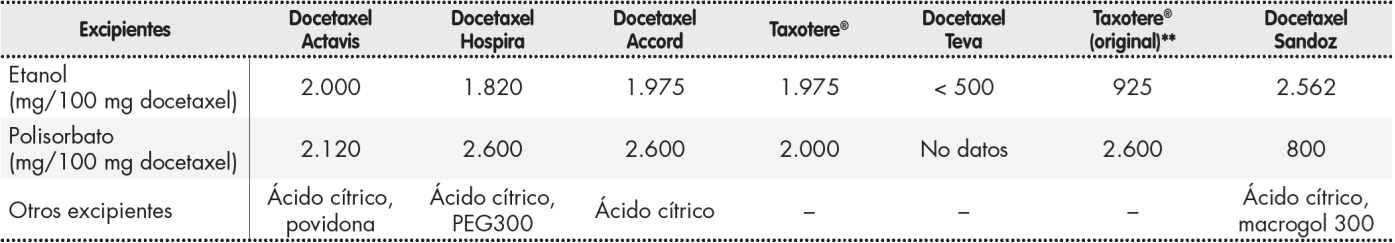
*Algunas de estas presentaciones pueden no estar actualmente comercializadas en España.
**Presentación disponible hasta 2009 en formato de dos viales, año en que se cambia al formato actual de un solo vial, similar al resto de medicamentos con docetaxel.
Tabla 2. Análisis cromatográfico de las impurezas, cantidad de docetaxel y pH de los medicamentos con docetaxel utilizados
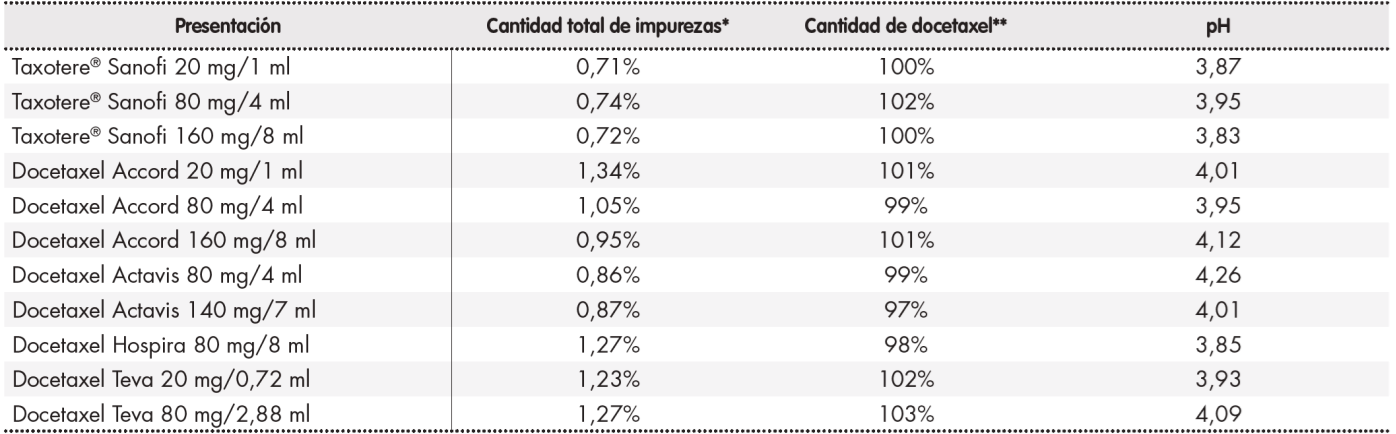
*Suma de las áreas correspondientes a los picos cromatográficos de las impurezas respecto al área correspondiente al pico cromatográfico de docetaxel, expresada
en porcentaje.
**Cantidad de docetaxel de las formulaciones comerciales, calculada respecto a la cantidad de docetaxel en Taxotere® 20, expresada en porcentaje.
Se incluyeron en el estudio un total de 335 pacientes, todas mujeres a excepción de 5 hombres, con una media de edad de 55,3 ± 11,2 años, un peso de medio de 74,8 ± 61 kg y un índice de masa corporal medio de 27 ± 5,5 kg/m2. La distribución por comunidades autónomas fue la siguiente: 117 pacientes de Madrid (34,9%), 95 de Cataluña (28,4%), 81 pacientes de Andalucía (24,2%) y 42 de la Comunidad Valenciana (12,5%). La intención del tratamiento fue adyuvante en el 73,4% de los pacientes y neoadyuvante en el resto, siendo la mayor parte de los pacientes naive para tratamiento quimioterápico (89,9%). Respecto al fenotipo tumoral, el 83,9% de los pacientes presentaban receptores hormonales positivos, frente al 16,1% que presentaban tumores triple negativo. Si bien entre los criterios de exclusión se consideraba pacientes HER2 positivos, en el estudio y datos analizados se incluyen tres pacientes con positividad para HER2 debido a la confirmación posterior por anatomía patológica.
En la Tabla 3 se detalla el porcentaje de utilización de los distintos medicamentos con docetaxel empleados en el estudio y la distribución de los mismos según esquema de tratamiento administrado a los pacientes. Respecto a los dos esquemas de quimioterapia estudiados, la dosis media de docetaxel por ciclo y m2 fue estadísticamente superior en el esquema AC-T frente a TC (89,6 versus 74,6 mg/m2; p < 0,001).
Tabla 3. Esquemas de quimioterapia y ciclos administrados de los medicamentos con docetaxel utilizados en el studio
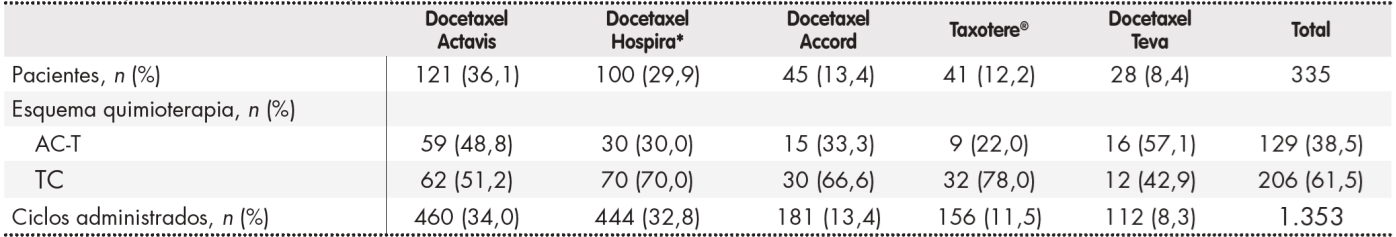
AC-T: esquema secuencial de docetaxel tras adriamicina y ciclofosfamida; TC: esquema de docetaxel y ciclofosfamida.
*En la actualidad comercializado por Pfizer.
El porcentaje de pacientes en los que fue interrumpido el tratamiento con docetaxel fue de 8,9%, 30 pacientes en total, 28 de los casos debido a toxicidad secundaria al fármaco. La Tabla 4 muestra la distribución de incidencia acumulada de eventos adversos por ciclo y medicamento, así como las diferencias entre ellas para cada una de las variables. Se detectaron diferencias estadísticamente significativas entre los medicamentos utilizados con docetaxel en cuanto a la incidencia acumulada por ciclo de: modificación de dosis, visitas a urgencias, anemia, reacciones de hipersensibilidad y anafilaxia, neuropatía sensorial y motora, toxicidad palmo-plantar y dermatológica, toxicidad ungueal y edema facial. Como se detalla en la tabla 4, cada medicamento presentó incidencias diferentes.
Concretamente, Taxotere® presentó diferencias estadísticamente significativas en cuanto a menor incidencia en modificación de dosis, visitas a urgencias, anemia y edema facial y mayor neuropatía motora. La formulación de Accord presentó menos neuropatía y toxicidad palmo-plantar y ungueal, pero mayor porcentaje de modificaciones de dosis y edema facial. Teva presentó menos reacciones de hipersensibilidad/anafilaxia y neuropatía motora, pero más toxicidad ungueal y neuropatía sensorial. Hospira presentó menos toxicidad dermatológica, y Actavis más anemia y reacciones de hipersensibilidad/anafilaxia y mayor toxicidad dermatológica y palmo-plantar.
Tabla 4. Incidencia acumulada de eventos adversos registrados con los diferentes medicamentos de docetaxel utilizados en el estudio
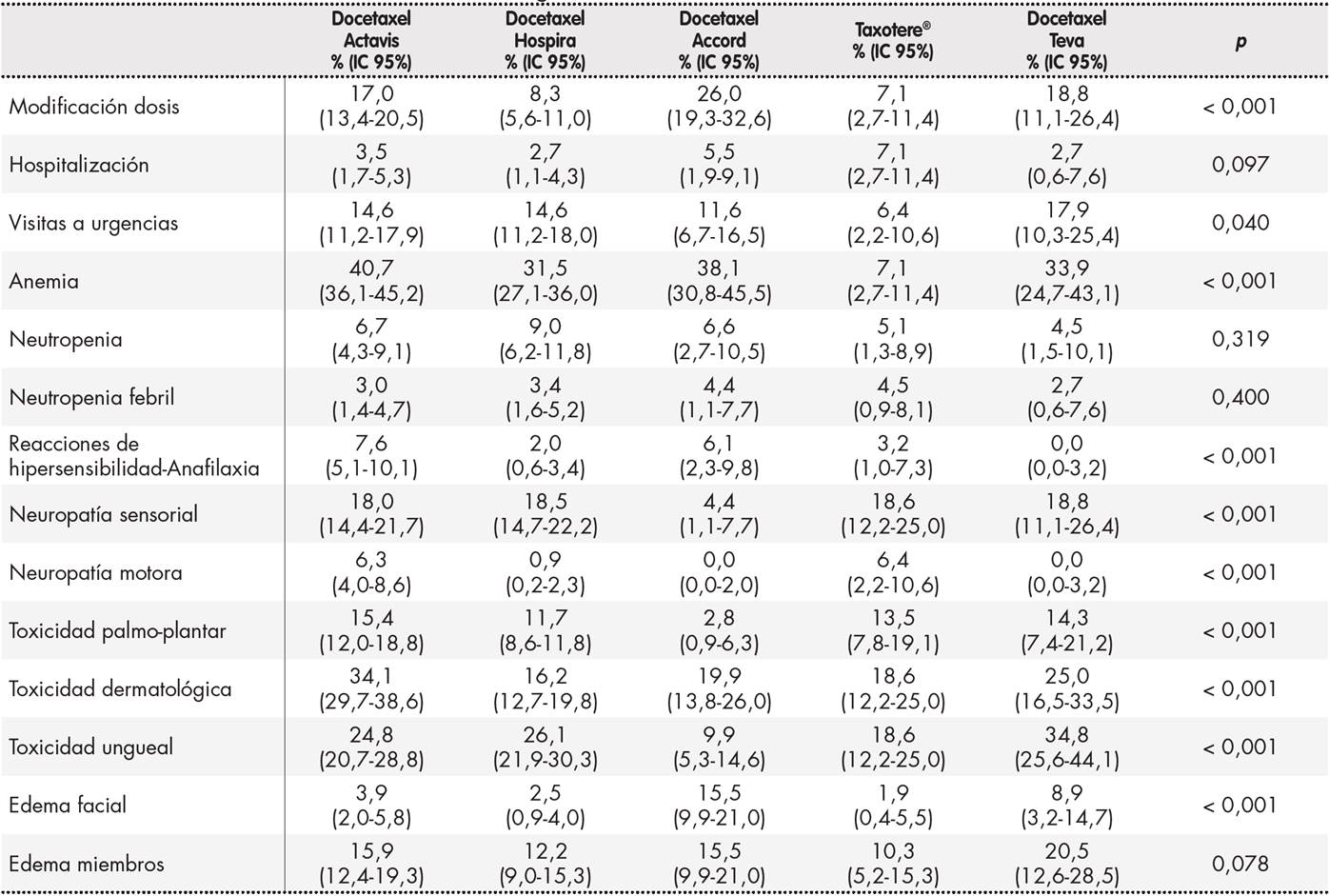
IC: intervalo de confianza.
En el análisis multivariante estratificando por esquema y edad se detectaron menos reducciones de dosis con Taxotere®, aunque solamente con el esquema TC. En cuanto a la anemia, en el grupo de pacientes tratados con el esquema TC se observó menor riesgo para Taxotere® que para Hospira y Teva. En los pacientes tratados con el esquema AC-T, el riesgo fue significativamente menor con Taxotere® que con Actavis y Accord. Para la variable visita a urgencias, se observó una incidencia significativamente menor en el grupo de pacientes tratados con Taxotere®, si bien únicamente en aquellos que recibieron el esquema TC. Con Taxotere® hubo más neuropatía periférica motora que con respecto a Actavis y Accord.
Discusión
Entre los excipientes que se utilizan en las diferentes presentaciones comerciales de docetaxel se encuentran el polisorbato 80 y el etanol. El polisorbato 80 es un vehículo surfactante no iónico cuyo componente principal es monooleato de sorbitán polioxietilenado, similar estructuralmente a los polietilenglicoles. Datos experimentales indican que puede modificar la farmacocinética del fármaco de manera dependiente a su concentración e induce eventos adversos9,10.
El polisorbato 80 se degrada rápidamente tras la inyección intravenosa, al incrementarse las dosis presenta farmacocinética lineal. La adición in vitro en muestras de plasma humana de polisorbato 80 a concentraciones clínicas relevantes (más de 5,0 µl/ml) produce un incremento de docetaxel libre (7% en ausencia de polisorbato 80 versus 44% en presencia de polisorbato 80)1. La concentración de docetaxel libre es inversamente proporcional a la de la proteína alfa-glicoproteína ácida (AAG) en el plasma. Como los pacientes con cáncer presentan gran variabilidad en los niveles de AAG, estas diferencias pueden dar lugar a variabilidad en su farmacocinética y en la actividad y perfil de toxicidad. Bajos niveles de AAG se han correlacionado con mayor severidad de neutropenia y eficacia, mientras que niveles elevados se relacionan con menor eficacia11. Además, este excipiente no es fisiológicamente inerte. Diferentes estudios han demostrado que es un compuesto biológica y farmacológicamente activo, estando implicado en reacciones de hipersensibilidad12, neuropatía periférica12 y retención hídrica/toxicidad vascular13,14. Las reacciones de hipersensibilidad han sido atribuidas en parte a la toxicidad intrínseca del polisorbato 8015, concretamente a la oxidación de productos y ácido oleico, que causan la liberación de histamina. El papel de la histamina en la etiología de las reacciones infusionales se ve apoyado por el hecho de que se minimiza tras la premedicación con corticoides y antihistamínicos8. Además de la histamina, otras sustancias vasoactivas pueden intervenir en las reacciones de hipersensibilidad a docetaxel16. En nuestro estudio no pudimos atribuir diferente perfil de toxicidad en relación con el contenido de polisorbato.
Respecto al etanol, se han descrito casos de intoxicación etílica en pacientes con dosis altas o en pacientes pediátricos, más susceptibles a los efectos del mismo. En el año 2014 la Food and Drug Administration emitió una alerta advirtiendo que la administración de docetaxel puede causar síntomas de intoxicación alcohólica después del tratamiento. Algunos estudios relacionan la toxicidad dérmica de probable origen irritativo con una mayor cantidad de alcohol en la composición de los medicamentos con docetaxel7. En nuestro estudio, se encontraron diferencias significativas en cuanto a toxicidad dermatológica en pacientes tratados con docetaxel Actavis. Si bien fue el medicamento con mayor cantidad de etanol, las diferencias en la composición entre los distintos medicamentos no fueron tan patentes como las referidas en el anterior estudio, donde se incluyeron formulaciones con un contenido en alcohol notablemente superior a las evaluadas en el nuestro, por lo que posiblemente influyan otra serie de factores en este aspecto. Por lo tanto, en relación con la cantidad de excipientes, no se ha podido establecer en nuestro estudio un medicamento con un mejor perfil de toxicidad.
Con respecto al contenido de impurezas de los distintos medicamentos comercializados, existen datos publicados que muestran un incremento de toxicidad hematológica, cutánea y de tasa de discontinuaciones con formulaciones genéricas de docetaxel17. Algunos de estos datos se relacionan con los de nuestro estudio, en el que se observó una menor incidencia de anemia, menor número de reducciones de dosis y visitas a urgencias con Taxotere®, medicamento con el menor contenido en impurezas de las evaluadas en la muestra, aunque la presentación de Hospira, con un mayor contenido de impurezas, fue con la que se observó un menor porcentaje de toxicidad cutánea, por lo que los resultados hay que tomarlos con cautela.
Se observaron diferencias en el perfil de toxicidad y repercusión clínica de los distintos medicamentos de docetaxel utilizados, con diferencias significativas entre ellos en algunas de las variables estudiadas. Estos resultados fueron similares a los encontrados en otro estudio realizado en pacientes de cáncer de mama tratados con diferentes presentaciones comerciales de docetaxel, en el que también se pone en evidencia perfiles de toxicidad distintos asociados a las distintas marcas18.
Una de las principales limitaciones del estudio es que, al tratarse de un estudio observacional, se mezclaron dos esquemas de tratamientos con dosis muy dispares de docetaxel (una de ellas 33% superior), en los que las distintas formulaciones no estuvieron bien balanceadas. Considerando que la dosis de docetaxel es el mayor factor condicionante de la toxicidad, aunque se realizó un análisis multivariante para evitar este sesgo, sería conveniente realizar un estudio para comparar la influencia de excipientes e impurezas en dichos esquemas por separado. Otra de las limitaciones fue que a pesar de ser un estudio prospectivo y multicéntrico, fue observacional, con un número limitado de pacientes en diferentes hospitales y un uso de premedicación y factores estimulantes de colonias según la práctica habitual de cada centro, que podrían influir en el perfil de toxicidad y repercusión clínica que se observó.
En conclusión, los resultados de nuestro estudio muestran diferencias en las concentraciones de los excipientes e impurezas de las presentaciones con docetaxel utilizadas. Existen diferencias en el perfil de toxicidad y repercusión clínica de los distintos medicamentos de docetaxel, con diferencias significativas en algunas de las variables estudiadas, sin poder identificar un medicamento con un mejor perfil de toxicidad.
Bibliography
Reddy LH, Bazile D. Drug delivery design for intravenous route with integrated physicochemistry, pharmacokinetics and pharmacodynamics: Illustration with the case of taxane therapeutics. Adv Drug Deliv Rev. 2014;71:34-57. DOI: 10.1016/j.addr.2013.10.007 [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Approved label for Taxotere® (website). Centro información online de medicamentos (CIMA). Madrid: Agencia Española de Medicamentos y Productos Sanitarios; 2009. Available at: https://cima.aemps.es/cima/pdfs/es/ft/95002005/FT_95002005.html.pdf [ Links ]
Dylst P, Vulto A, Simoens S. Societal value of generic medicines beyond cost-saving through reduced prices. Expert Rev Pharmacoecon Outcomes Res. 2015;15(4):701-11. DOI: 10.1586/14737167.2015.1017565 [ Links ]
Directive 2001/83/EC of the European Parliament and of the Council of 6 April 2001 on the Community Code Relating to Medicinal Products for Human Use (website). Official Journal of the European Communities L 311, 67-128. 28-11-2001. Available at: https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/dir_2001_83_consol_2012/dir_2001_83_cons_2012_en.pdf [ Links ]
Ley de garantías y uso racional de los medicamentos y productos sanitarios (Law on Guarantees and Rational Use of Medicines and Medical Devices). 29/2006. BOE nr 178 (July 27, 2006) Available at: https://www.boe.es/buscar/pdf/2006/BOE-A-2006-13554-consolidado.pdf [ Links ]
Committee for Medicinal Products for Human Use (CHMP). Guideline on the Investigation of Bioequivalence. 20-1-2010. London European Medicines Agency (EMA); 2010. Available at: https://www.ema.europa.eu/documents/scientific-guideline/guideline-investigation-bioequivalence-rev1_en.pdf [ Links ]
Garrido-Siles M, Arenas-Villafranca JJ, Pérez-Ruiz E, de Linares Fernández MF, Tortajada B, Rivas-Ruiz F, et al. New cutaneous toxicities with generic docetaxel: are the excipients guilty? Support Care Cancer. 2015;23(7):1917-23. DOI: 10.1007/s00520-014-2499-2 [ Links ]
Poirier E, Desbiens C, Poirier B, Hogue JC, Lemieux J, Doyle C, et al. Comparison of serious adverse events between the original and a generic docetaxel in breast cancer patients. Ann Pharmacother. 2014;48(4):447-55. DOI: 10.1177/1060028013514941 [ Links ]
Kay ER. Effects of polysorbate 80 on the growth of the Ehrlich-Lettre ascites carcinoma. Experientia. 1965;21(11):644-5. DOI: 10.1007/BF02144055 [ Links ]
Kubis A, Witek R, Olszewski Z, Krupa S. The cytotoxic effect of polysorbate 80 on Ehrlich ascites cancer cells in mice. Pharmazie. 1979;34(11):745-6. [ Links ]
Bruno R, Olivares R, Berille J, Chaikin P, Vivier N, Hammershaim B, et al. α-1-Acid glycoprotein as an independent predictor for treatment effects and a prognostic factor of survival in patients with non-small cell lung cancer treated with docetaxel. Clin Cancer Res. 2003;9(3):1077-82. [ Links ]
Tije AJ, Verweij J, Loos WJ, Sparreboom A. Pharmacological effects of formulation vehicles: implications form cancer chemotherapy. Clin Pharmacokinet. 2003;42(7):665-85. DOI: 10.2165/00003088-200342070-00005 [ Links ]
Drori S, Eytan GD, Assaraf YG. Potentiation of anticancer-drug cytotoxicity by multidrug-resistance chemosensitizers involves alterations in membrane fluidity leading to increased membrane permeability. Eur J Biochem. 1995;228(3):1020-9. [ Links ]
Mark M, Walter R, Meredith DO, Reinhart WH. Comercial taxane formulations induce stomatocytosis and increase blood viscosity. Br J Pharmacol. 2001;134(6):1207-11. DOI: 10.1038/sj.bjp.0704387 [ Links ]
Weiszhar Z, Czucz J, Revesz C, Rosivall L, Szebeni J, Rozsnyay Z. Complement activation by polyethoxylated pharmaceutical surfactants: cremophor-el, tween-80 and tween-20. Eur J Pharm Sci. 2012;45(4):492-8. DOI: 10.1016/j.ejps.2011.09.016 [ Links ]
Ardavanis A, Tryfonopoulos D, Yiotis I, Garasimidis G, Baziotis N, Rigatos G. Nonallergic nature of docetaxel-induced acute hypersensitivity reactions. Anticancer Drugs. 2004;15(6):581-5. [ Links ]
Elm’hadi C, Tanz R, Khmamouche MR, Toreis M, Mahfoud T, Slimani KA, et al. Toxicities of docetaxel: original drug versus generics-a comparative study about 81 cases. Springerplus. 2016;5(1):732. DOI: 10.1186/s40064-016-2351-x [ Links ]
Tagawa N, Sugiyama E, Tajima M, Sasaki Y, Nakamura S, Okuyama H, et al. Comparison of adverse events following injection of original or generic docetaxel for the treatment of breast cancer. Cancer Chemother Pharmacol. 2017;80(4):841-9. DOI: 10.1007/s00280-017-3425-3. [ Links ]
Recibido: 08 de Enero de 2020; Aprobado: 14 de Junio de 2020











 text in
text in 


