My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.14 n.7 Madrid Oct. 2007
REVISIONES
¿Qué debemos conocer de los inhibidores de bomba protones, para su uso en las unidades de dolor?
What need to know the Proton Pump Inhibitors to use in the chronic pain clinic?
J. A. García-García
Facultativo Especialista de Área. Hospital Universitario de Getafe.
Dirección para correspondencia
SUMMARY
Protón Pump Inhibitors (PPIs) have shown their usefulness in the treatment of acid-related disorders, highly prevalent in normal population. Pain units are used to treating patients with a wide range of diseases, including acid related-disorders, who are also being prescribed many different drugs, like NSAIDs, corticosteroids or biphosponates, which may reactívate or even worsen acid-related disorders.
Knowledge of the pharmacological aspects of PPIs, both their pharmacokinetics and pharmacodynamics, is needed to properly choose the one which fits most to our multi-pathologic, multi-treated patients, in order to avoid possible pharmacological interactions than could endanger their health condition.
Key words: Proton Pump Inhibitors, omeprazole, pantoprazole, lansoprazole, rabeprazole, esomeprazole, hepatic metabolism, pharmacological interactions.
RESUMEN
Los inhibidores de la bomba de protones (IBP) son fármacos útiles para el control de la patología asociada con la acidez gástrica, patología con una alta prevalencia dentro de la población general. En las Unidades de dolor tratamos pacientes con pluripatología y polimedicados, entre ellas patologías asociadas con la acidez gástrica. Así como también utilizamos fármacos como AINES, glucocorticoides, bifosfonatos... que pueden reactivar, empeorar la patología ligada a la acidez.
El conocimiento de los aspectos farmacológicos de los IBP, tanto farmacocinéticos como farmacodinámicos, es necesario y preciso para poder elegir el más adecuado para nuestros pacientes con pluripatologia y polimedicados evitando las posibles interacciones farmacológicas que podrían afectar al estado de salud de nuestros pacientes.
Palabras claves: inhibidores de la bomba de protones, omeprazol, pantoprazol, lansoprazol, rabeprazol, esomeprazol, metabolismo hepático. interacciones farmacológicas.
Introducción
Los pacientes que acuden a las unidades de dolor son pacientes polimedicados con pluripatologia, por lo que la prescripción de cualquier fármaco debe atender a cuatros puntos fundamentales: maximizar los beneficios, minimizar los efectos adversos, minimizar los costes y respetar la elección del paciente. En este sentido, es importante recordar la farmacología de los sustancias que protegen la mucosa gastroduodenal. La patología gastroesofágica afecta a más del 30% de los adultos de los países occidentales.
También es verdad que dentro de nuestro arsenal terapéutico, los antiinflamatorios no esteroideos (AINES) tienen como uno de sus efectos adversos más destacables producir patología gastroduodenal, en cualquiera de las presentaciones clínicas: desde una simple dispepsia hasta una perforación digestiva pasando por una hemorragia digestiva alta.
Posiblemente los inhibidores de la bomba de protones (IBP) representa uno de los grupos farmacológicos más recetados, tanto en las consultas de atención primaria como en algunas de atención especializada, y por supuesto, en las unidades de dolor.
De ahí, la importancia de conocer tanto la farmacología como las interacciones farmacológicas que puedan surgir con este grupo farmacológico de los IBP en diversas patologías, o con diferentes grupos farmacológicos.
Fisiología de la mucosa gastroduodenal
La integridad de la mucosa intestinal superior (esófago, gastroduodenal) es el resultado de un equilibrio entre los mecanismos de protección endógenos y los factores agresivos.
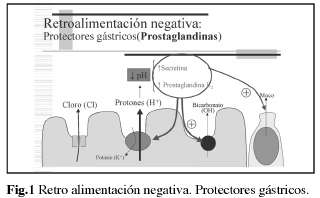
Dentro de los factores agresivos destaca la producción de hidrogeniones a nivel de las células parietales del estómago, por la bomba de protones. Estos hidrogeniones atraviesan el moco por efecto de la retrodifusión (como consecuencia de un gradiente en la concentración de los mismos entre el lumen gástrico y la superficie celular). A su vez, por la producción y liberación de mucina por su efecto tampón ralentiza la retrodifusión de los hidrogeniones (Fig.1).
Este proceso depende de la disponibilidad de los principales componentes del moco, como la mucina, los ácidos grasos asociados a la mucina (altamente hidrófobos), los fosfolípidos, las prostaglandinas. Es decir, a mayor concentración mayor viscoelasticidad, mayor espesor de la barrera protectora y mayor capacidad de protección.
La inhibición de la secreción ácida, la reducción de la concentración de los hidrogeniones y el consiguiente aumento del ph gástrico son características comunes de todos los IBP Algunos de ellos tienen además la capacidad de aumentar el contenido de mucina, como el rabeprazol. El rabeprazol es el IBP capaz de aumentar el contenido de mucina gástrica en animales de experimentación (1) Esta propiedad farmacológica ha sido confirmada en el humano (2). Después de 7 días de administración el rabeprazol incrementa el contenido de mucus gástricos en los jugos gástricos (5%) y el contenido de mucina gástrica (165%). Jaworski el al (2) confirma que el rabeprazol restaura la mucosa y mejora la mucina gástrica durante la administración de naproxeno. Otros estudios de otros IBP mejora el bloqueo de los hidrogeniones no afectando a la mucosa gástrica.
Farmacología de los IBP
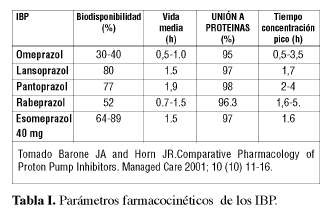
Los IBP son fármacos efectivos para el control del exceso de secreción ácida que se asocia con los trastornos relacionados con el ácido. Las características farmacocinéticas de los IBP se resume en la (Tabla I).
El comienzo de la acción, el grado y la duración de la supresión ácida con los IBP son los puntos mas relevantes del tratamiento de la patología relacionada con la acidez (1,2). La mayoría de los autores considera que la primera dosis de IBP debería proporcionar una fuerte y rápida inhibición ácida. Así, se ha visto que en estudios in vitro, que el más rápido es el rabeprazol, seguido del esomeprazol-omeprazol y lansoprazol, el más lento es pantoprazol. En el estudio de Pantofliclova y col (3) demostraban que el rabeprazol es un inhibidor más potente que el lansoprazol, omeprazol y esomeprazol. El rabeprazol produce un mayor aumento del pH intragástrico, además de mantenerlo por mayor período de tiempo. Los mecanismos por el cual explicaría su mayor eficacia en el 1er día seria por la mayor estabilidad ácida (pka) y la inhibición de la bomba de protones, que es el factor determinante de la potencia de la inhibición ácida. La estabilidad ácida de un IBP determina la fracción de acumulación de profármaco en los canalículos secretores ácidos de la célula parietal y la razón de formación de ácido. El rabeprazol es 10 veces más potente que otros IBP en condiciones ácidas.
Activacion
Todos los IBP son profármacos que requiere su activación por la inducción de los ácidos gástricos. Después de su absorción, los IBP pasan al torrente circulatorio y, pasan posteriormente al espacio canalicular. Al ser los IBP bases débiles, se ionizan cuando pasan al espacio canalicular. Una vez la molécula se une a la bomba de protones por el hidrogenión en la célula parietal, ésta comienza a estar inactivada. La mayoría de los IBP tienen un lugar común de unión, y pueden tener entre uno y 4 lugares adecuados para la unión. Una vez ionizados, los IBP están atrapados en el medio ácido donde se concentran en el lugar de acción (4,5).
Aunque este proceso de activación es similar en todos los IBP, la hidrogenización y la etapa de activación son dependientes del pH y del fármaco. Esto va a depende de la reactividad de la molécula (pKa). El pKa de un IBP es el pH al cual la mitad de la molécula está ionizada y la otra mitad no inonizada. El valor del pKa de los IBP que existen en el mercado se encuentra entre los valores de 3,8 a 5.0. Hay diferencias entre los IBP, por ejemplo, a un pH 5.0 la vida media de activación de los IBP es variable, aproximadamente 7 minutos para el rabeprazol, cerca de 90 minutos para el omeprazol y lansoprazol y aproximadamente 5 horas para el pantoprazol (5), (Tabla II).
El comienzo de acción (como inhibición de la acidez gástrica) se correlación con el valor del pKa. El rabreprazol es la sustancia que más rápidamente se convierte en un derivado activo sulfenamida.
Secreción ácida
Es el punto de control esencial de cualquier IBP, aunque existen diferencias entre el grado de control de acidez y la consistencia de dicho control. En un estudio de 23 pacientes sanos con un test de helicobacter pylori negativo tratados en un estadio de cicatrización con rabeprazol, omeprazol y placebo una vez al día (después del desayuno). Se observó que la acidez gástrica disminuía por la ingesta de alimentos y que se incrementaba después por la secreción ácida (6). El estudio mostró que el rabeprazol producía un reducción estadísticamente significativa en la producción ácida comparada con el omeprazol durante 24 horas incluido en los periodos postpandriales. incluso durante el pico nocturno. Algunos autores demuestran que el rabeprazol es el IBP que más disminuye el pH gástrico en 1 día y durante 24 horas si lo comparamos con el lansoprazol, pantoprazol, omeprazol y/o placebo (7). Así, autores como Wilder-Smith y col (8) y Warrington et al (9) demuestran que el rabeprazol (20 mg/día) aumenta significativamente el pH gástrico > 4.0 frente a esomeprazol.
Potencia
En la literatura se afirma que las diferencias de potencia entre los IBP se debe a la consistencia de sus efectos sobre la reducción de la secreción ácida. Williams et al (6) afirma que es más consistente con el rabeprazol.
Metabolismo
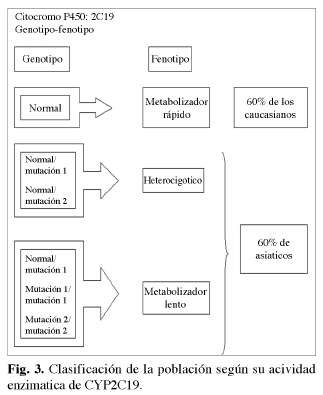
El metabolismo de los IBP se relaciona con la biotransformación hepática , fundamentalmente con la via del citocromo P 450 (CYP2C19) enzima que presenta una distribución muy polimórfica. Existiendo una variabilidad intraindividual Se ha demostrado que existe una mayor dependencia de la variabilidad interindividual con el pantoprazol y el omeprazol no así con el lansoprazol y el rabeprazol (Fig. 2).
En la población general, los individuos pueden ser clasificados como homocigóticos, heterocigóticos, metabolizadores lentos o rápidos basándose en la actividad enzimática de la CYP2C19 (10). así se ha demostrado que omeprazol 20 mg no tenía ningún efecto en el pH de los homocigóticos (por ej, muy rápido), en los heterocigóticos (por ej. metabolizadores rápidos o intermedios) experimentan un significativo incremento del pH gástrico. Los metabolizadores lentos de omeprazol (con menor cantidad de CYP2C19 hepática) experimentan un incremento significativo pH respecto al placebo y tiene un aumento de la concentración plasmática (10) (Fig. 3).
La diferencia entre los metabolizadores puede llegar a ser de hasta 6 veces mayor la inhibición de la secreción.
Este polimorfismo se manifiesta porque la dosis requerida por los pacientes es mayor. Por ejemplo, en USA existe un 4% de la individuos que son metabolizadores lentos. Este efecto no están tan marcado con otros IBP.
Sayito (11) cree que los metabolizadores rápidos (CYP2C19) podrían ser más precisos para la diferenciación y evolución de los efectos inhibitorios de la secreción ácida de los IBP (rabeprazol, lansoprazol, pantoprazol, omeprazol) examinándolos mediante el cambio en el pH intragástrico después de una administración única.
Farmacodinamia
Todos los IBP suprimen la secreción ácida al bloquear la bomba ácida gástrica (H/K ATPasa) (12). Besancon et al (13) comparan la inhibición de los IBP in vitro (Fig. 1). La inhibición más rápida se logra con el rabeprazol seguido del lansoprazol, omeprazol y el pantoprazol. Esta diferencia entre los distintos IBP se debe a la conversión a los sulfenamidas tetracíclicas activadas. Todos los IBP son profármacos y su activación ácida a metabolitos sulfanamidas dentro de los canalículos de la célula parietal determinará el comienzo de la acción de los mismos (14). Los fármacos sulfenamidas de los IBP se unen por enlaces covalentes a la bomba de hidrogeniones ATPasa dependiente e inhibe su actividad. La proporción de la administración de IBP que se convierte en su derivado sulfenamida es inversamente proporcional a la estabilidad ácida del fármaco. Kromer y al (5) refiere que la vida media de activación de los IBP depende del pKa de cada uno junto con el pH al cual está expuesto. Con un pH 1,2 la vida media de activación para los IBP está entre 1,3 - 4,6 minutos. Quizás a un pH de 5,1 la vida media del rabeprazol es de 0,12 h, omeprazol 1,4 horas; lansoprazol 1,5 h, pantoprazol 4,7 h.
El pKa de los IBP afecta significativamente a su comienzo y a su potencia. El pKa influye en la acumulación en el lugar de acción, el canalículo de la célula parietal (12). El espacio del canalículo en la mayoría de las células parietales pueden tener un pH 1 durante la secrección ácida activa, pero puede ser mucho más alto en ausencia de secreción ácida. A un pH 1, el omeprazol y rabeprazol muestra una acumulación de 1.000 a 10.000 veces mayor en el canalículo versus el plasma respectivamente; a un pH 3 los valores caen a 10 a 100 veces (12).
En estudios recientes basados en miligramo a miligramo de administración de los IBP en voluntarios sanos, muestran que el rabeprazol 20 mg/ día es más efectivo que la misma dosis que esomeprazol en el 1er día de administración en la supresión ácida (9). Tras un día de tratamiento el pH intragástrico medio bajo el área de la curva de tiempo- concentración plasmática es mayor con el rabeprazol que con esomeprazol. Incluso el porcentaje medio de tiempo para pH gástrico > 3 y > 4 era mayor significativamente con rabeprazol que con esomeprazol, aunque otros autores como Baisley et al. no encuentran diferencias entre el rabeprazol y esomeprazol (15).
De los datos disponibles podemos afirmar que la proporción de inhibición de la bomba de protones es la llave que determina la velocidad con la que se produce la supresión ácida.
Farmacocinética
Los resultados de los estudios muestran diferencias mínimas en cuanto a las variables farmacocinéticas (4), vida media y tiempos máximos de concentración sólo aparecen diferencias en la concentración máxima plasmática con el área bajo la curva de tiempo-concentración. El área bajo la curva de omeprazol- esomeprazol se incrementa en una forma no lineal con administración no repetida, posiblemente por un mecanismo de autoinhibición de su sistema de aclaramiento y el metabolismo de primer paso. Tanto el lansoprazol, pantoprazol como el rabeprazol muestran una correlación tanto en la concentración máxima como el área bajo la curva tiempo concentración de 0 a 24 con dosis repetidas. Tanto el esomeprazol como el omeprazol inhiben el citocromo P450 (CYP2C19) responsable de su aclaramiento.
Metabolismo hepático
La oxidación hepática juega un papel central en el metabolismo de muchos fármacos. En el proceso está incluido el sistema CYP o citocromo P 450, de cual existe multitud de isoenzimas 1A2, 2C9, 2C19, 2D6, 2E1 Y 3A4 (16). La multitud de diferencias interindividuales en la capacidad enzimática es el resultado tanto del polimorfismo genético existente como de factores medioambientales como la administración de otros fármacos (16) (Fig. 3).
El metabolismo hepático a través de las enzimas CYP2C19 Y CYP3A4. Todos los IBP, excepto el rabeprazol, se metaboliza por la vía de la isoenzima CYP2C19 (17). El omeprazol y esomeprazol progresivamente inhiben la actividad de CYP2C19 con la administración repetida resultando la acumulación tanto de la sustancia como de los metabolitos sulfenamidas. Los estudios de farmacocinética sugieren que la exposición a rabeprazol puede estar menos influenciada por la genética, por los cambios producidos por los fármacos en el metabolismo hepático que en el de otros IBP
El polimorfismo genético que puede afectar al metabolismo y supresión ácida (18).
Se conoce la existencia de un polimorfismo genético en relación con CYP2C19 pudiendo afectar al metabolismo de un amplio número de sustancias, tales como anticonvulsivantes, ansiolíticos, antidepresivos, IBP (18).
Así encontramos que entre un 3-5% de los caucásicos son metabolizadores lentos, un porcentaje similar en los afroamericanos y entre un 12-25% de diferentes poblaciones asiáticas. Clínicamente este polimorfismo puede significar que un metabolizador rápido no es un buen respondedor de los IBP, por tanto, la dosis de IBP debe ser incrementada o debe cambiarse de IBP por uno que sea menos influenciable para su biotransformación (18).
Los metabolizadores rápidos CYP2C19 exhiben un aclaramiento más rápido de omeprazol, pantoprazol, lansoprazol que los metabolizadores lentos con esta enzima. El metabolismo del esomeprazol es, también, primariamente dependiente de CYP2C19 pero tiene una eliminación más lenta que el omeprazol (19).
La eliminación del rabeprazol es menos dependiente del metabolismo oxidativo, es decir, de la CYP2C19 que la de otros IBP, como resultado tenemos mínimas diferencias en el aclaramiento y exposición en pacientes que sean metabolizadores rápidos o lentos (20).
Furuta et al (20) han demostrado que estas diferencias en voluntarios sanos con dosis única de omeprazol. Horai et al (21). recientemente demostró que la supresión ácida con rabeprazol era ligeramente menor en individuos sanos metabolizadores rápidos, aunque con dosis repetidas no era significativamente está reducción.
Interacciones medicamentosas
Los trastornos relativos a la acidez gástrica requieren tratamientos prolongados por la presencia de condiciones crónica que los perpetúan. Las interacciones son comunes para medicamentos donde se precisa un metabolismo oxidativo (citocromo P 450-CYP Los IBP pueden alterar la absorción de algunos fármacos al disminuir la acidez del estómago.
El omeprazol (22) altera la absorción, metabolismo y/o la excreción de un amplio margen de fármacos: bismuto, cafeína, diacepam, digoxina, fenitoína, methotrexate, nifedipina y warfarina.
No tiene interacciones con teofilinas, metoprolol, etanol ni ciclosporina.
Tiene un mecanismo de inhibitorio, así puede inhibir el metabolismo del citalopram, escitalopram, fluoxetina, olanzapina, pentamidina, sertralina y variconazol (23).
Esto mismo puede pasar con el esomeprazol.
El metabolismo del omeprazol puede verse alterado por la coadministración de ketoconazol. Se disminuye el aclaramiento con la fluxovaxamina.
La significación clínica de las interacciones farmacocinéticas no son evaluados adecuadamente en los estudios clínicos, pero, a menudo, se publican casos clínicos. Así el omeprazol interactúa con la ciclosporina aumentando los niveles plasmáticos. La administración de omeprazol junto a triazolam produce la aparición más exagerada de mareos-vértigos y dificultad para la marcha. En los pacientes que son tratados con warfarina y además se inicia tratamiento con omeprazol se produce sangrado y hipoprotrombinemia por una reducción del aclaración e incremento de los niveles plasmáticos (24).
Lansoprazol
Se han documentado menos interacciones que con el omeprazol (17). No existen interacciones significativas con warfarina, fenitoína, prednisona, diazepam o anticonceptivos orales.
La administración conjunta con claritromicina produce un incremento de la concentración de lansoprazol al inhibir el metabolismo del lansoprazol mediado por la CYP3A4 (25). así han aparecido casos clínicos donde se indica la interacción de lansoprazol y el tacrolimus ( fármaco utilizado en la inmunosupresión de los trasplantados) (26).
Pantoprazol
Los datos que se disponen indican que existen mínimas interacciones farmacológicas con teofilina, fenitoína, warfarina, diacepam, metroprolol, etanol o carbamacepina.
En algún caso se ha informado la aparición de mialgias tras la utilizazción de pantoprazol y methotrexate (27).
Se ha visto como en otros IBP, la disminución de la absorción de ketoconazol e itraconazol con resultado de la acidez gástrica (23).
Rabeprazol
Los estudios revelan nulas interacciones farmacológicas con teofilina, fenitoína, warfarina o diacepam (17).
Esomeprazol
Las interacciones son muy similares al omeprazol, reduce la aclaración del diacepam y en menor medida, de la fenitoína y la warfarina (28). La administración conjunta con claritromicina dobla.
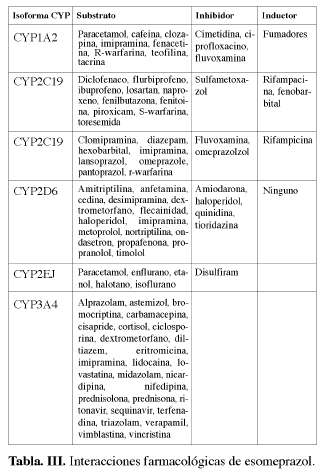
Las concentraciones plasmáticas de esomeprazol. Se produce una mayor inhibición del CYP2C19 que con omeprazol y tiene un mayor potencial para las interacciones farmacológicas (29) (Tabla III).
Consecuencias clínicas y recomendaciones
1. Esofagitis erosiva
a. La duración de la supresión ácida es uno de los principales factores para la curación de los pacientes con reflujos gastroesofágico. En un reciente estudio comparativo de la tasa de curación de la esofagitis erosiva en pacientes con reflujo gastroesofágico no muestran diferencias significativas entre los IBP (30). Aunque otros estudios a más largo plazo (8 semanas) muestra una mayor tasa de curación con esomeprazol 40 mg/dia que con omeprazol (94% vs 84%, p < 0,001) (31).
b. Si comparamos esomeprazol con lansoprazol. Howden y al (32) 40 mg vs 30 mg/día indica que ambos tratamientos son igualmente efectivos en la curación de las erosiones (91,5% vs 89% a las 8 semanas). En un estudio de 5241 pacientes (33) con esofagitis erosiva muestra una mayor curación los pacientes que eran tratados con esomeprazol (40 mg/dia que con lansoprazol (92,6 vs 88,8%, p= 0.001) a las 8 semanas. En aquellos que presentaban un grado C y/o D no así en el grado A o B de la enfermedad (31).
2. Úlcera gástrica y/o duodenal.
a. Cualquiera de los IBP junto con los antibióticos se han utilizado para erradicar el Helicobacter pylori en Europa, en general con una duración de la triple terapia entre 7 a 14 días. En USA, tanto el lansoprazol como esomeprazol están indicados en la erradicación del H. P junto con la amoxicilina y claritromicina durante 10 a 14 días o 10 días respectivamente. El rabeprazol ha sido aprobado para su uso en los últimos años, en un régimen de 7 días junto con la amoxicilina o la claritromicina.
b. El uso de la AINES ha incrementado la aparición de casos de ulcus pépticos con HP negativos. En diferentes artículos se ha demostrado la eficacia del lansoprazol (34).
c. El esomeprazol y los inhibidores de la COX2 durante el uso de 6 meses fueron eficaces en la prevención de la úlceras gástricas (estudios VENUS Y PLUTO) aunque los autores también refieren que no es posible establecer si en pacientes que reciben un IBP el uso de un inhibidor de la COX2 comporte un menor riesgo de aparición de úlceras que la utilización de un AINE NO SELECTIVO (35). También los autores concluyen que existe una mejoría de los síntomas (pirosis y regurgitación) y como una mejoría de la calidad de vida (36).
3. Alivio de síntomas.
a. El alivio de los síntomas debido a la acidez gástrica es muy importante en la mayoría de los pacientes por los síntomas, tales como ardor, quemazón. Tiene un impacto importante en la calidad de vida de los mismos pacientes.
b. Todos los IBP alivian los síntomas de regurgitación, pero existen diferencias en cuanto a las propiedades farmacológicas de estos agentes (fundamentalmente, la proporción que esta activada y en la sensibilidad en su conversión a pH intragástrico).
c. Existen multitud de estudios, entre diferentes IBP Y PLACEBO, y a diferentes dosis así, (37,38) en un estudio de omeprazol frente a placebo en pacientes con endoscopia negativa se alivia el ardor en un tiempo medio de 2 días con omeprazol frente 5 días con placebo. En un estudio con lansoprazol (39) con dosis de 15 mg se reducen en un 1 días el alivio de los síntomas frente a placebo. Miner et al analizaron la eficacia del rabeprazol 10 y 20 mg/día encontraron un alivio significativo del ardor en el primer día con ambas dosis y eran superior a placebo en las 24 primeras horas.
4. Mantenimiento y terapia de demanda
a. En la mayoría de las guías clínicas se recoge que la terapia con IBP es eficaz y apropiada como terapia de mantenimiento en los pacientes después de sintomatología relacionada con la secreción ácida tras la remisión de los síntomas.
b. Actualmente no existe evidencia, de la reducción del riesgo de evolución hacia un esófago de Barret o hacia un cáncer, por el tratamiento mantenido con IBP
c. En los pacientes que se automedican para un rápido control de los síntomas de acidez. Aunque se ha realizado unos pocos estudios de IBP frente a placebo. En un estudio con esomeprazol (40) el 53% de los pacientes usan al menos durante 3 días consecutivos, el 22% durante 4-6 días y 26% durante 7 o más días consecutivos. En un estudio con omeprazol el 54% de los pacientes en un periodo de 7 días o más consecutivo, el 26% durante 14 días o más consecutivos, 21,3% durante 28 días o más. Se siguió a los pacientes durante más de 6 meses.
d. En un estudio con rabeprazol (41), el 27% de los pacientes lograron un alivio de los síntomas completos sólo después de tomar 1-2 días de tratamiento y el 56% el control de los síntomas en menos de 4 días.
Usos en pacientes que toma warfarina vs acenocumarol
La monitorización del INR y la dosis que ajusta de warfarina pueden ser influenciados por cambios en la medicación concomitante como con la dieta, el consumo de alcohol, enfermedad aguda, cambios hepáticos y factores desconocidos.
La S-warfarina es metabolizada por P450. Los inhibidores potenciales del efecto de la warfarina son amiodarona, fluconazol, fluvoxamina, isoniacida, lovastatina, fenilbutazona y sertralina. Inductores conocidos de la CYP2CA es la rifampacina y el secobarbital (42).
La R-warfarina es metaboliza CYP1A2 Y CYP3A4 inhibida por las quinolonas, macrólidos, así como metronidazol, fluconazol.
Existen por tanto múltiples interacciones de la warfarina, pero centrándonos en los IBP
Con pantoprazol no existe ningún efecto. Existe un a potenciación del efecto de la warfarina con omeprazol (43). Thijssen y col muestran que el acenocumarol es una mezcla racémica, el (S) enantiómero no tiene efecto farmacológico como la forma (R). La forma (R) es metabolizada por las enzimas CYP1A2, y CYP2C19 que como hemos visto anteriormente pueden interferir con sustancias tales como el omeprazol potenciando el efecto anticoagulante del acenocumarol (44).
Conclusiones
Todos los IBP van a reducir la secreción ácida a nivel gastrointestinal. Las diferencias farmacocinéticas y farmacodinámicas nos van a marcar su utilización. Es muy importante tener presente las posibles interacciones farmacológicas con diferentes grupos farmacológicos propios del tratamiento del dolor crónico, como anticonvulsivantes, antidepresivos. Además debemos pensar en aquellos pacientes que utilizan anticoagulantes orales y acuden a nosotros para el manejo del dolor.
No debemos olvidar que utilizamos AINES (selectivos como no selectivos) que pueden dañar la mucosa gastrointestinal.
Dentro de los IBP, el rabeprazol (45) por su perfil farmacocinética y farmacodinámico es el inhibidor de la bomba de protones más adecuado para su uso en nuestras unidades, aunque todavía faltan estudios que muestren esta evidencia clínica. Es un fármaco con poca interacciones farmacológicas, con mínimas alteraciones en su metabolismo por el polimorfismo de la isoenzimas hepáticas, además de ser una terapia eficaz para el control de la acidez gástrica a demanda como en terapia de mantenimiento por problemas digestivos.
Bibliografía
1. Skoczylas T et al. Significant enhancement of gastric mucin content after rabeprazole administratioin. Its potencial clinical significance in acid-related disorders. Digestive Diseases and Sciences, 2003; 48: 322-328. [ Links ]
2. Jaworski T. et al. Restorative impact of rapebrazole on gstric mucus and mucin production impairment during naproxen administration: its potencial clinical significance. Digestive Diseases and Science, 2005; 50: 357-365. [ Links ]
3. Pantoflickova D, Dorta G, Ravic M, Jornod P, Blum AL. Acid inhibition on the first day of dosing: comparison of four protón pump inhibítors. Aliment Pharmacol Ther 2003; 17: 1507-1514. [ Links ]
4. Barnett J.L, Robinson M. Optimizing Acid-Suppresion Therapy. Managed Care, 2001; 10 Suppl.: 17-21. [ Links ]
5. Kromer W, Kruger U, Huber R, Hartmann M, Steinijans vW. Differences in pH-dependent activation rates of substituted benzimidazoles and biological in vitro correlates. Pharmacology, 1998; 56: 57-70. [ Links ]
6. Willians MP, Sercombe J, Hamilton MI, Pounder RE. A placebo-controlled trial to assess the effects of 8 days of dosing with rabeprazole versus omeprazole on 24- h intragastric acidity and plasma gastan concentration in young healthy male subjects. Aliment Pharmacol Ther. 1998; 12: 1079-1089. [ Links ]
7. Robinson M, Horn J. Clinical Pharmacology of Protón Pump Inhibitors. What the Practising Physician Needs to Know. Drugs 2003; 63: 2739-2754. [ Links ]
8. Wilder-Smith C, Claar-Nilson c, Hasselgren G et al. Esomeprazole mg provides faster and more effective acid control than rabeprazole 20 mg in patients with symptoms of GERD (abstract nº 137). Am j Gastroenterol 2001 Sep; 96 Suppl; S 45. [ Links ]
9. Warrington S, Baisley K, Boyce M et al. Effeets of rabeprazole, 20 mg, or esomperazole 20 mg, on 24 h. intragastric pH and serum gastan in healthy subjects. Aliment Pharmacol Ther 2002 Jul; 16: 12:1301-7. [ Links ]
10. Futura T, Ohashi K, Kosuge K et al. CYP2C19 genotype status and effect of omeprazole on intragastriaca pH in humans. Clin Pharmacol Ther.1999; 65: 552-561. [ Links ]
11. Saitoh t, Fukushima Y, Otsuka H, et al. Effects of rabeprazole,lansoprazole and omeprazole on intragastric pH in CYP2C19 extensive metabolizers. Aliment Pharmacol Ther 2002; 16: 1811-1817. [ Links ]
12. Sachs G. Improving on PPI-based therapy of GORD. Eur j Gastroenterol Hepatol.2001; 13 Suppl. 1: S 35-41. [ Links ]
13. Besancon M, Simón A, Sachs G et al. Sites of reaction of gastric H, K-ATPase with extracytoplasmic thiolre-agents. J Biol Chem.1997, 5; 272: 22438-46. [ Links ]
14. Kromer W. Relative efficacies of gastric proton-pump inhibitors on a milligram basis: desired and undesired Sh reactions impact of Chirality. Scand J Gastroente-rol. 2001; 234: 3-9 [ Links ]
15. Baisley KJ, Warrington SJ, Tejura B et al. Rabeprazole 20 mg compared with esomeprazole 40 mg in the control intragastric pH in healthy volunteers (abstract nº 229). Gut .2002, 50 suppl II: A 63. [ Links ]
16. Touw DJ. Clinical Implications of genetic plymorphisms and drug interaccions mediated by cytrocromo P 450 enzymes. Drug metabol Drug Interact 1997; 14: 55-82. [ Links ]
17. Ishizak T, Horai Y. Review article cytochrome P45= and the metabolism of protón pump inhibitors: emphasis on rabeprazole. Aliment Pharmacol Ther. 1999; 13 Suppl. 3: 27-36. [ Links ]
18. Goldstein JA. Clinical relevance of genetic polymorhisms in the human CYP2C subfamily. Br j Clin Pharmacol. 2001; 52: 349-55. [ Links ]
19. Anderson T, Rohss K. Bredberge et al. Pharmacokineics and pharmacodynamics of esomeprazole. The (s)- isomer of omeprazole. Aliment Pharmacol Ther. 2001; 15: 1563-9. [ Links ]
20. Futura T, Kyoichi O, Kosuge K et al. CYP2C19 genotype status and effect of omeprazole on intragastric pH in humans. Clin Pharmacol Ther. 1999; 65: 552-61. [ Links ]
21. Horai Y, Kimura m Furvie H eta al. Phamiacodynamic effect and Kinect disposition of rabeprazole in relation to CYP2C19 genotypes. Aliment Pharmacol Ther. 2001; 15: 793-803. [ Links ]
22. Humphries TJ, Merritt GJ. Review arricie: drug interactions with agents used to treat acid-related diseases. Aliment Pharmacol Ther. 1999; 13 Suppl. 3: 18-26. [ Links ]
23. Hansten P, Horne J. The top 100 drug interactions: a guide to patients managemente. Edmonds(WA): H andH Publications, 2003; 30: 121-34. [ Links ]
24. Ahmad S. Omeprazole-warfarin interaction (letter). South Med J. 1991; 84 :674-5. [ Links ]
25. Ushima H, Echizen H, Ñachi S, et al. Dose-dependent inhibition of CYP3A4 activity by clarithromycin durn Helicobacter pylori eradication therapy assessed by changes in plasma lansoprazole levéis and partial cortisol clearance to 6B-hydroxiycortisol. Clin Pharmacol Ther. 1995; 58: 155-64. [ Links ]
26. Homma m, itagki F, Yuzawa K et al. Effects of lansoprazole and rabeprazole on tracrolimus blood concentrations: case of a renal transplant recipient with CYP2C19 gene mutation. Translantation. 2002, 27; 73: 303-4. [ Links ]
27. Tróger U, Stótzel B, Martens-Lobenhoffer J, et al. Drug points: sever myalgia from an interaction between treatments with pantoprazole and methotrexate. BMJ. 2002; 22: 324:1497. [ Links ]
28. Anderson T, Hassan-Alin m Hasselgren G et al. Drug interaction studies with esomeprazole, the (S)-isomer of omeprazole. Clin Pharmacokinet .2001; 40: 523-37. [ Links ]
29. Tybring G, Bottiger Y, Widen J eta al. Enantioselective hydroxylation of omeprazole catalyzed by CYP 2CPY19 IN Swedish white subjects. Clin Pharmacol Ther. 1997; 62: 129-37. [ Links ]
30. Caro JJ, Salas M Ward A. Healing and relapse rates in gastroesophageal reflux disease treated with the newer proton-pump inhibors lansoprazole, rabeprazole, and pantoprazole compared with omeprzole, ranitidine, and placebo: evidence from ramdomized cliniced triáis. Clin Ther. 2001; 23: 998-1017. [ Links ]
31. Richter JE, Kahrilas PJ, Johanson J et al. Efficay and safety of esomeprazole compared with omeprazole in GERD patients with erosive esophagitis: a randomized controlled trial. Am J Gastroenterol. 2001; 96: 656-65. [ Links ]
32. Howden C, Bllard D, Robieson W. Evidence for therapeutic equivalence of lansoprazole 30 mg and esomeprazole 40 mg in the treatment of erosive oesophagitis. Clin Drug Invest 2002; 22: 99-109. [ Links ]
33. Castell DO, Kahrilas PJ, Richter JE et al. Esomeprazole (40mg) compared with lansoprazole 30mg in the treatment of erosive esophagitis. Am J Gastroenterol. 2002; 97: 575-83. [ Links ]
34. Lai KC, Lam SK, Chu KM et al. Lansoprazole for the prevention of recurrences of ulcer complications from long-term low dosi aspirine use. N Engl. J Med. 2002, 26; 347: 2104-10. [ Links ]
35. Sheiman JM, Yeomans ND Talley N J et al. Prevención de úlceras con esomeprazol en pacientes de riesgo bajo tratamiento con AINE no selectivo e inhibidores COX-2. Am J Gastroenterol. 2006; 101: 1-10. [ Links ]
36. Landes BD, Petite JP, Fluovat B. Clinical Pharmacokinetics of lansoprazole. Clin Pharmoacokinet. 1995; 28: 458-70. [ Links ]
37. Bate CM, Griffin SM, Keeling PWN et al. Reflux sympton relief with omeprazole in patients without unequivocal esophagitis. Aliment Pharmacol Ther. 1996; 10: 547-55. [ Links ]
38. Venables TL, Newland RD, Patel AC et al. Maintenance treatment for gastroesophageal reflux desease: a placebo-controlled evaluation of 10 milligrams omeprazole once daily in general practice. Scand J Gastroenterol. 1997; 32: 627-32. [ Links ]
39. Richter JE, Kovacs TO, Greski-Rose PA et al. Lansoprazole in the treatment of heartburn in patients without erosive oesophagitis. Aliment Pharmacol Ther. 1999; 13: 795-804. [ Links ]
40. Talley N J. Lauritsen K, Tunturi-Hihnala H et al. Esomeprazole 20 mg maintains sympton control in endoscopy negative gastroesopheageal reflux disease: a controled trial of on demand therapy for 6 months. Aliment Pharmacol Ther. 2001; 15: 347-54. [ Links ]
41.Byzter P Blum AL, de Herdt D. Fast and complete control of heraburn in on demand rebeprazole maintenance therapy in patients with nonerosive reflux disease. Gastroenterology. 2003; 124 suppl. 1: A 228. [ Links ]
42. HolbrooK, AM, Pereira JA, Labiris R et al. Systematic overview of warfarin and its drug and food interactions. Arch Intern Med. 2005; 165: 1095-1106. [ Links ]
43. Thojodleifsson Bm Beker JA eta la. Rabeprazole versus Omeprazole in Preventing relapse of erovise or ulcerative gastroesophageal reflux disease. A double blind, Multicenter, European Trial. Disgestive Diseases and Sciences. 2000; 45, 5: 845-853. [ Links ]
44. Thijssen, HH, Flinois JP, Beaune PH. Cytochrome P4502c9 is the principal catalyst of racemic acenocoumarol hydroxylation reactions in human liver microsomes. Drug Metabolism and Disposition. 2000; 28: 1284-1290. [ Links ]
45. Caos A, Moskovitz M, et al. Rabeprazole for the prevention of pathologic and symptomatic relapse of erosive or ulcerative gastroesophageal reflux disease. Am J Gastroenterology. 2000; 95: 3081-88. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
e-mail: jgarciaga.hug@salud.madrid.org
Financiación: Ninguna
Conflictos de interés: No declarados
Recibido: 26/03/2007
Aceptado: 27/05/2007