My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.18 n.2 Madrid Mar./Apr. 2011
Epidemiología del dolor por cáncer
Epidemiology of cancer pain
D. Reyes Chiquete1, J. C. González Ortiz2, A. Mohar Betancourt3 y A. Meneses García3
1Clínica del Dolor. Instituto Nacional de Cancerología. México.
2Clínica del Dolor. Instituto de Seguridad Social al Servicio de los Trabajadores del Estado. Xalapa, Veracruz. México.
3Instituto Nacional de Cancerología. México
Financiación: Ninguna
Conflicto de intereses: No declarados
Dirección para correspondencia
RESUMEN
Cada año se diagnostican aproximadamente nueve millones de personas con cáncer. El dolor es uno de los síntomas más comunes en este tipo de población. Su fisiopatología es múltiple y va desde el síntoma doloroso causado por la propia enfermedad, hasta el relacionado a procedimientos diagnósticos y/o terapéuticos, pasando por el asociado a enfermedades no oncológicas ligadas al cáncer. Esta revisión representa un análisis crítico de los estudios epidemiológicos sobre la prevalencia de dolor por cáncer en la población mundial. Se muestran grandes variaciones en cuanto a la prevalencia, debido quizá a aspectos metodológicos que dificultan la comparación de los resultados o, dicho de otra manera, por los diferentes criterios utilizados para conceptualizar y caracterizar el dolor por cáncer, los contrastes entre la población estudiada y los métodos de recolección de datos.
Si a esto le agregamos que existen diferentes tipos de dolor y que la terapéutica puede diferir de un medio hospitalario a otro, no es raro que la validez de los reportes se limite y su uniformidad varíe considerablemente. La sociedad mexicana poco conoce sobre la prevalencia de dolor oncológico y sobre los prejuicios personales y socioeconómicos que conlleva esta temible enfermedad, por lo que, considerando los estudios existentes en la literatura, sugerimos que las pesquisas epidemiológicas en nuestro país deberán realizarse bajo estricto control metodológico, estudiando los diferentes grupos de edad, tipo de dolor, intensidad, diagnóstico oncológico, estadio clínico, terapéutica anticáncer, terapia analgésica farmacológica y no farmacológica, y los fármacos coadyuvantes.
Palabras clave: Epidemiología. Dolor. Cáncer.
ABSTRACT
Each year, approximately, nine million people with cancer are diagnosed. Pain is one of the most common symptoms in this population. Its pathophysiology is multiple and varies from the painful symptoms caused by the disease itself until linked to diagnostic procedures and therapeutic, or else to that pain associated with non-oncological diseases linked to cancer. This review represents a critical analysis of epidemiological studies on the prevalence of cancer pain in the world population. Great variations are shown in prevalence, perhaps because of methodological issues that hinder the comparison of results. In others words, by different criteria used to conceptualize and characterize cancer pain, the contrasts among the study population and data collection methods. If we add to this that there are different types of pain therapeutics and may differ from one hospital to another, the validity and consistency of the reports are limited considerably. Mexican society little known about the prevalence of cancer pain and on personal and socioeconomic bias involved in this terrible disease. Whereas existing studies in the literature, we suggest that epidemiological investigations should be conducted under strict methodological control, studying the different age groups, type of pain, intensity, oncology diagnosis, clinical stage, used anticancer therapeutics, drug therapy and nonpharmacologic analgesic; without forgetting the adjuvant drugs associated with this management.
Key words: Epidemiology. Pain. Cancer.
Introducción
Existe escasa literatura acerca de este tipo de estudios epidemiológicos y si hay cierta reserva en publicar los registros relacionados al dolor por cáncer en países industrializados, en las naciones en vías de desarrollo es más aguda aún. Bernabei y cols. reportan que la prevalencia de dolor en pacientes con cáncer disminuye con la edad, que esta va desde 38% en los individuos de 65-74 años, hasta 24% en aquellos mayores de 85 años. Sin embargo, no hay suficientes estudios que soporten esta afirmación (1).
En los últimos años se ha avanzado significativamente en las estrategias farmacológicas e intervencionistas para el manejo del dolor por cáncer, sin embargo persiste cierta insatisfacción de los pacientes por las medidas terapéuticas empleadas, lo que exige una acción más eficiente del equipo médico (2,3).
El conocimiento de la prevalencia y del tratamiento integral del dolor por cáncer permitiría optimizar la atención, mejorando la disponibilidad de los opioides e implementando políticas de educación en dolor, con una adecuada asignación de recursos económicos, principalmente en el campo de la investigación (2).
Debemos considerar que la salud, además de representar uno de los derechos fundamentales del ser humano, constituye un valor esencial para el bienestar familiar y el desarrollo social y económico de una nación -una condición indispensable para la auténtica igualdad de oportunidades en la población (3)-. En el año 2000, la esperanza de vida al nacimiento alcanzó los 77,6 años para las mujeres y 73,1 años para los hombres, tales cifras trajeron consigo obvias transformaciones en el perfil epidemiológico (3,4).
Sin duda, el cáncer, uno de los principales problemas de salud, afecta tanto a las poblaciones con mayor desarrollo económico y humano, como a las que presentan rezagos. El avance tecnológico y la modernización hicieron posible el desarrollo industrial y la urbanización a nivel mundial, con lo que México registró el siglo pasado cambios sustanciales en su estructura y dinámica poblacional que lo han llevado a una transición demográfica y epidemiológica. Entre los cambios más importantes destacan la reducción progresiva y continua de la mortalidad, particularmente de la infantil, el abatimiento de la fecundidad y el incremento de la esperanza de vida al nacimiento (5).
Existen datos que indican que la pirámide de población se ha modificado, presentando un angostamiento relativo en su base y un mayor crecimiento de los grupos de adolescentes y de mujeres en la etapa post-reproductiva (6).
Reportes, como el de la CANAPO, concuerdan en que la mortalidad aumentará hasta 10,4 por cada mil habitantes en 2050 y en que el crecimiento en la tasa de mortalidad a partir de 2007 se producirá por el incremento relativo en la población de adultos mayores, lo cual propiciará un mayor número de defunciones, a pesar de que continuarán las ganancias en la esperanza de vida. El proceso de envejecimiento demográfico de México no es reversible, pues los adultos mayores del mañana ya nacieron. Las generaciones más numerosas, las nacidas entre 1960 y 1980, ingresarán al grupo de 60 años y más a partir de 2020 (7).
Por este motivo, es innegable la transferencia epidemiológica de las enfermedades infecto-contagiosas a una alta y progresiva incidencia de patologías crónico-degenerativas como el cáncer, que ocupa el segundo lugar como causa de mortalidad general en nuestro país, acompañado por múltiples síntomas, entre ellos, el dolor (8). Desafortunadamente en México todavía existen serios problemas en el llenado de los certificados de defunción y sus repercusiones van en detrimento de la calidad en las estadísticas de mortalidad (9).
El estudio y tratamiento del dolor ha sido una de las preocupaciones más importantes en los últimos 30 años en el ámbito médico mundial. Sin embargo, tal interés no se da en todos los países, en algunos aún no se reconoce o minimiza el uso de unidades hospitalarias en las que se integren clínicas para el manejo del dolor, lo que provoca una deficiente política sanitaria. El dolor agudo y crónico de origen oncológico en niños y adultos presenta una doble problemática: el sufrimiento del individuo y su núcleo familiar, con la consecuente baja en su calidad de vida; además de una fuente de cuantiosas pérdidas económicas (10).
Según estimaciones publicadas por el National Institute of Health en 1998, 90 de los 250 millones de habitantes de los Estados Unidos sufrieron dolor, y 22 millones de ellos están parcial o totalmente discapacitados. La American Pain Society ha estimado que el costo acumulado de la asistencia sanitaria, la discapacidad y la pérdida de productividad asociada al dolor en ese país, representa uno de los mayores gastos en políticas sanitarias. Tan sólo en el dolor lumbar se gastan 50.000 millones de dólares al año según el National Institute of Neurological Disorders and Stroke (11).
Casi una cuarta parte de los días de trabajo perdidos se atribuyen al dolor. Pese al considerable costo invertido en el diagnóstico y alivio de este, entre el 60 y el 80% de los pacientes no están satisfechos con el tratamiento que reciben (12,13) y el 25% de todos los pacientes con cáncer en el mundo mueren sin recibir tratamiento apropiado para el dolor (14).
El costo estimado en salud de los Estados Unidos por dolor crónico (atención médica, tratamientos, incapacidades y hospitalizaciones) es de $150 billones de dólares anuales. Solamente el costo de recetas de AINE fue de 312 millones y de opioides de 137 millones de dólares en el 2002 (15).
En Europa también tienen cifras de los gastos que implica a los sistemas de salud el manejo de dolor crónico. Tan sólo en España se ha estimado que la mala atención que reciben los pacientes ha generado un costo económico superior a los 13.000 millones de euros anuales. Se considera que un hospital de aquella nación puede gastar un promedio de dos millones de euros mensuales en fármacos para este tipo de pacientes, o unos 30.000 euros por persona para una supervivencia media de 25 meses, esto incluyendo quimioterapia, adyuvantes, analgésicos, etc. (16).
En México no hay cifras concluyentes acerca de cuánto dinero se gasta en la atención del dolor. Existen datos de dominio público que indican, por ejemplo, que en 1999, el Hospital de Oncología del Centro Médico Nacional Siglo XXI del Instituto Mexicano del Seguro Social (IMSS) gastó 451 millones de pesos en atención al derechohabiente con cáncer, es decir, 43 millones de pesos más que el presupuesto anual destinado para su combate en 1999, y que el de 2001 del Hospital Civil de Guadalajara, institución abocada al tratamiento integral de niños con cáncer. La terapia en pacientes oncológicos pediátricos varía de acuerdo a su patología, y su costo va de 1.500 hasta 50.000 pesos mensuales; mientras que en un adulto la cifra puede elevarse hasta los 70.000 pesos, cifras que tampoco representan el costo de la atención específica del dolor en este tipo de pacientes (17).
Objetivo
Existen distintas publicaciones sobre epidemiología en cáncer y dolor por cáncer, en donde se expresan datos sobre incidencia y prevalencia en general; sin embargo, aún no ha habido ninguna sobre la prevalencia del dolor con relación al tipo de neoplasia, etapa clínica y tratamiento. Así, el objetivo de la presente revisión es abordar la prevalencia del dolor por cáncer de manera global: en comparación con otros síntomas, con las consecuencias del tratamiento establecido y de acuerdo con su etapa clínica, y describir, en lo posible, el caso de México.
Definiciones
Epidemiología
La epidemiología tiene entre uno de sus objetivos primordiales el estudio de la distribución y los determinantes de las diferentes enfermedades. La cuantificación y la medida de la enfermedad o de otras variables de interés son elementos fundamentales para formular y plantear hipótesis, así como para permitir comparar las frecuencias de enfermedad entre diferentes poblaciones o entre personas con o sin una exposición o característica dentro de una población determinada (18).
En epidemiología, las medidas de frecuencia de enfermedad más comúnmente utilizadas se engloban en dos categorías: prevalencia e incidencia (18,19).
- Prevalencia: la prevalencia (P) cuantifica la proporción de individuos de una población que padecen una enfermedad en un momento o periodo determinado (19,20).
- Incidencia: se define como el número de casos nuevos de una enfermedad que se desarrollan en una población durante un periodo determinado (20,21).
Relación entre incidencia y prevalencia
Prevalencia e incidencia son conceptos muy relacionados entre sí. La prevalencia depende de la incidencia y de la duración de la enfermedad. Si la incidencia de una enfermedad es baja, pero los afectados tienen la enfermedad durante un período largo, la proporción de la población que tenga la enfermedad en un momento dado puede ser alta en relación con su prevalencia. Inversamente, si la incidencia es alta y la duración corta, ya sea porque se recuperan pronto o fallecen, la prevalencia puede ser baja con relación a la incidencia. Por lo tanto, los cambios de prevalencia de un momento a otro pueden ser resultado de cambios en la incidencia, cambios en la duración de la enfermedad, o de ambos (21,22).
Dolor
La Asociación Internacional para el Estudio y Tratamiento del Dolor (IASP) define "dolor" como "una experiencia sensorial y emocional desagradable, asociada o no a daño tisular real o potencial de los tejidos o descrito en términos de dicho daño" (23,24).
La forma de experimentar el dolor depende de los aspectos biológicos y neurofuncionales involucrados, además de variables como la personalidad, experiencias dolorosas previas, status socio-cultural, estado emocional en el momento del estímulo nociceptivo e incluso de las experiencias dolorosas de personas cercanas (24-26).
Al ser el dolor una experiencia multidimensional, se pueden distinguir los componentes neurofuncionales que llevan a una mayor o menor repercusión psicoafectiva, cultural, social, económica y espiritual. A la suma de estos componentes se le ha denominado "dolor total" (23,26,27).
Taxonomía del dolor
Existen clasificaciones que toman en cuenta diferentes aspectos de los síndromes dolorosos, como son intensidad, duración, topografía, características neurofisiológicas, factibilidad de tratamiento, entre otras, que tratan de acercarse al entendimiento del dolor (23,28).
- Intensidad: es la característica más reportada del dolor y la forma más simple de clasificarlo. Se sugiere el empleo de escalas unimodales y multimodales, como la Escala Verbal Análoga (EVERA) y Escala Visual Análoga (EVA), entre otras (27).
- Duración: dependiendo de la duración, el dolor se clasifica en agudo o crónico. El Comité de Taxonomía de la IAPS considera dolor crónico a aquel que tiene una duración mayor de tres meses. Este tipo de dolor se caracteriza por modificarse de acuerdo a la respuesta adaptativa fisiológica, además, de tener escaso o nulo efecto vegetativo y acompañarse de un significativo componente psicoafectivo. La duración del dolor agudo es menor de tres meses, con una importante respuesta neurovegetativa y neuroendocrina (24,27).
- Características neurofisiológicas: esta clasificación se basa en la inferencia para el dolor. Hay dos tipos fundamentales: nociceptivo y no nociceptivo.
El dolor nociceptivo se divide a su vez en somático y visceral. El somático se presenta por afección de partes blandas y óseas, generalmente está bien localizado y se describe como punzante, agudo, pulsante o compresivo. Mientras que el dolor nociceptivo visceral involucra órganos y estructuras internas, es difuso y se percibe en áreas mayores, es descrito como punzante, profundo o palpitante, de presentación aguda si están involucradas las cápsulas de los órganos (27,29,30).
El dolor neuropático es causado por una lesión en el sistema nervioso central o periférico, tiene un alto grado de complejidad y se define con frecuencia por presentarse en ausencia de daño tisular agudo concurrente o progresivo. Su intensidad puede ir de leve a severa o incapacitante, esta última variedad puede incluso impulsar a quien la padece al suicidio. Se caracteriza por ser disestésico, quemante, urente, paroxístico, con déficit sensorial y respuesta anormal a estímulos: alodinia e hiperpatía (27).
El dolor central se presenta en pacientes con daños en el sistema nervioso central, como secuelas de accidentes cerebrovasculares, hiperpatía talámica o miembro fantasma. Es un dolor espontáneo, sin causa determinada, urente, punzante o continuo, de moderada a severa intensidad (27,31).
El dolor somatoforme, también denominado psicógeno, se caracteriza porque el paciente siente dolor, sin etiología orgánica, por lo que se llega a él con diagnósticos de exclusión, generalmente asociado a ganancias secundarias (27).
Si atendemos al patrón temporal, podemos mencionar el "dolor episódico", que se caracteriza por ser de difícil control (3). Utilizando los criterios de Coluzzi y Madrid, podemos definir este dolor como aquel que aparece de manera intermitente, alcanza gran intensidad y su duración es breve (32,33).
Existen pocos trabajos publicados en torno a la prevalencia, etiología y tipos de dolor episódico, los cuales además utilizan diferentes nomenclaturas por lo que es difícil compararlos. Aún así se han descrito tres variedades (33):
• Dolor al final de dosis: exacerbaciones de dolor que aparecen típicamente al final del intervalo de dosificación, justo antes de la toma de la siguiente dosis de analgésico.
• Dolor incidental, llamado en inglés incidental pain: dolor ligado a un estímulo voluntario, como el movimiento, o involuntario, como las funciones corporales.
• Dolor irruptivo: dolor de aparición espontánea y de causa idiopática, no ligado a una pauta analgésica determinada, ni a funciones o movimientos corporales, y cuyo equivalente en inglés es el breakthrough pain.
El cáncer se caracteriza por tener progresión espontánea, lo que causa varios síntomas, entre ellos el dolor. Así, en el área oncológica se han llevado a cabo numerosas investigaciones sobre la oncogénesis y proliferación tumoral, además de que también se ha avanzado en el estudio, diagnóstico y tratamiento del dolor por cáncer. Se estima que el 30% de los pacientes con cáncer se diagnostican en etapa temprana y el 70% tardíamente. De los pacientes oncológicos, el 58% presenta dolor, y de estos, el 33% refiere un solo tipo de dolor, otro 33% dos tipos y el restante 33% presenta tres o más tipos de dolor (24-27,34-36).
Metodología
En una revisión sistémica que comprendió el periodo de 1966 a 2005, van den Beuken-van Everdingen y cols. (2007) documentaron que la prevalencia de dolor posterior a procedimientos curativos de patología oncológica era del 33% (95% IC, 21 a 46%). Mientras que en los que eran manejados con terapia anticáncer, el dolor se presentaba en el 59% (IC 44 a 73%); en aquellos con enfermedad avanzada, terminal y con metástasis en el 64% (58 a 69%) y en pacientes con cualquier estado de la enfermedad en el 53% (IC 43 a 63%). De los pacientes con dolor, más de un tercio presentaban una intensidad de moderada a severa, con una alta prevalencia en pacientes con cáncer de cabeza y cuello (70%; 95% IC 51 a 88%) (37).
Incidencia y prevalencia del dolor por cáncer
En la actualidad el dolor por cáncer es una entidad conocida, pero limitada en registros. No existen reportes concluyentes acerca del número de sujetos que sufren dolor por esta enfermedad. Una encuesta del ECOG (Eastern Cooperative Oncology Group) muestra que del 57 al 76% de los médicos oncólogos no preguntan a sus pacientes sobre el dolor, además de que este solo se menciona en el 10% de los registros médicos oncológicos (37-39).
Aunque la Organización Mundial de la Salud (OMS) considera el dolor severo secundario a cáncer como un problema de salud mundial, no existen políticas claras de salud que aborden este tema y menos aún programas específicos de atención a los pacientes que lo padecen. Según la OMS, del 30 al 50% de los pacientes con cáncer experimentan dolor debido principalmente a la falta de disponibilidad de analgésicos opioides o a su mala administración. De acuerdo con datos derivados de investigaciones en varios centros hospitalarios de países desarrollados, el dolor es la causa más importante de hospitalización, y la prevalencia de este síntoma en pacientes con cáncer varía del 47 al 54% (25,40).
Sobre la prevalencia de dolor continuo/episódico en enfermos con cáncer en situación terminal, Nabal en 2001 evaluó en un estudio prospectivo observacional a pacientes que acudían a una unidad de cuidados paliativos, tanto hospitalizados como ambulatorios, y mostró que de 46 enfermos, el 97% estaba relacionado a una patología oncológica, y que de ellos el 33% presentaron dolor, en 40% este era exclusivamente continuo, episódico en 0% y continuo más episódico en un 60%. En el 66,6% el mecanismo de dolor fue visceral, en el 33,33% somático y 0% presentaron dolor neuropático, quizá porque el estudio fue transversal y por su duración. El número medio de episodios/día fue de 3,22. La intensidad media del dolor basal medido mediante EVA fue de 29,2/100 y la intensidad media del dolor en crisis resultó de 57,5/100 (41).
A pesar de la importancia del dolor episódico se ha estudiado poco en niños con cáncer. En un reporte realizado por Friedrichsdorf y cols. (2007), en el que se incluyeron a 28 niños de 7 a 18 años con dolor severo y en tratamiento con opioides, se documentó que 57% de ellos referían uno o más episodios de dolor irruptivo en 24 horas, cada episodio variaba desde segundos (31%) hasta minutos (63%), y en promedio de 3 a 4 veces por día (media de 3,6). Este se caracterizó por ser severo y de instalación rápida (56%), en forma de disparos (50%), profundo (38%), quemante (31%) y como hormigueo (31%). Los niños de menor edad (7 a 12 años) tuvieron más episodios de dolor que los mayores, no habiendo diferencia de presentación entre el día y la noche. Ninguno refirió dolor incidental. Siendo el tratamiento más efectivo para los episodios de irrupción la analgesia controlada por el paciente por medio de bolo de opioides (69%). De estos 28 niños (Tabla I), 18 (64%) refirieron dolor asociado al tratamiento antineoplásico y sus complicaciones (mucositis, dolor abdominal, herpes zoster agudo), 3 pacientes refirieron dolor causado directamente por el tumor y los restantes 7 tuvieron dolor postoperatorio en el sitio del tumor (42,43) (Tabla I).
En México, existen tres estudios del Instituto Nacional de Cancerología relacionados con la epidemiología del dolor por cáncer. Romero (44), en 1988, reportó en un trabajo con 190 pacientes de nuevo ingreso, que 90 (47%) refirieron dolor, y en 63 (33%) el síntoma se relacionó con el tumor. El dolor más intenso lo presentaron los pacientes con cáncer de pulmón, ovario y/o linfoma, pero sólo el 53% recibió tratamiento antiálgico. Allende (35), en 1996, presentó un estudio realizado a 100 pacientes con algún tumor maligno, donde el 89% experimentó dolor. En 2002, Reyes Chiquete (10) estudió a 952 pacientes oncológicos hospitalizados, donde 292 (32,7%) presentaron dolor; de los cuales el 44,3% era crónico, el 37,2% agudo postquirúrgico, 10,6% oncológico agudizado, 3,2% no oncológico, 2,9% crónico no oncológico y 1,6% oncológico crónico agudizado. El 61,2% de los pacientes estaban bajo control. La mayor neoplasia registrada con dolor fue la de cáncer cérvico-uterino con un 17%; el mayor número de pacientes internados se encontró en oncología médica (19%); de acuerdo con la terapéutica establecida, el 73% recibió algún tipo de AINE, el 40% opioides y el 41% adyuvantes. El mayor efecto adverso por terapia farmacológica fue constipación intestinal (4,1%).
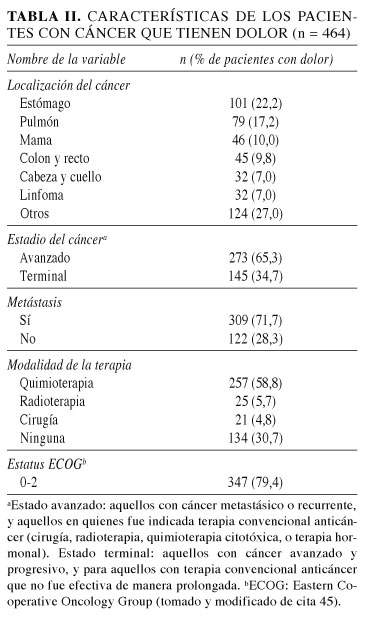
En la literatura mundial podemos encontrar reportes en donde se muestra la prevalencia de dolor en los diferentes tipos de cáncer. De los cuales en el que más se reporta dolor es en el de cabeza y cuello con 70% de los pacientes, posteriormente se reportan el cáncer gastrointestinal, el de pulmón y bronquios, mama, urogenital y ginecológico con 59, 55, 54, 52 y 60%, respectivamente (37). Estos datos pueden variar dependiendo de la situación geográfica, edad del paciente y tipo de terapias empleadas para el control de la enfermedad oncológica. Un artículo publicado por Ho Yun (Tabla II) lo detalla (45).
Impacto del dolor por cáncer en el paciente y su familia
La evidencia actual sugiere que hay relación estrecha entre el dolor que presentan los pacientes y su entorno social. Cuando los niveles de dolor son altos hay factores sociales que pueden exacerbarlo, por ejemplo: tensión en el cuidador primario y el sentimiento de carga para la familia. Además cuando la familia duda de su capacidad para cuidar al paciente o juzgan mal la percepción del dolor de este, se reporta mayor intensidad de dolor acompañado de angustia psicológica.
Hacen falta más investigaciones que examinen de manera amplia los factores sociales y culturales que influyen en el dolor al final de la vida, como el apoyo psicosocial, la satisfacción marital, etc. (46).
En un estudio en el que se incluyeron a 218 pacientes ambulatorios con diagnóstico de cáncer, se observó que el dolor estaba presente en el 77% de ellos, la mayoría refirió que este no se encontraba adecuadamente tratado (81%), y el 75% estaba sub-medicado. Las actividades diarias de la mayoría de los pacientes (64%) estaban afectadas de forma moderada a severa. El dolor no se encontraba asociado a factores sociodemográficos o tratamientos previos (47).
El control del dolor, como se ha mencionado, históricamente ha sido pobre; en gran parte por el sub-tratamiento o mal manejo de este, pues muchos de los médicos no tienen experiencia en la prescripción de medicamentos analgésicos potentes o en los procedimientos auxiliares, debido a la falta de información en las escuelas de medicina y enfermería, o bien porque a los médicos y familiares les preocupa crear una supuesta adicción en los pacientes. El miedo a los medicamentos para aliviar el dolor por falsas creencias afecta a los enfermos, llevando a muchos de ellos a ideaciones suicidas, y también a sus familiares (48-50).
La OMS, a través de un comité de expertos en alivio del dolor, publicó en 1986 lineamientos de evaluación y tratamiento encaminados al alivio del dolor por neoplasias con hincapié en la escalera analgésica, un método analgésico eficaz para pacientes con cáncer, también hizo algunas recomendaciones a los gobiernos de todo el mundo. A pesar de que estas publicaciones han sido traducidas a más de 22 idiomas y difundidas por todo el mundo, la realidad es que se conocen poco, no se han tomado en cuenta y mucho menos se han llevado a cabo (51).
En un estudio realizado en Corea, Ho Yun y cols. registraron que de 655 pacientes con cáncer avanzado, el 70,8% (n = 464) referían dolor, de los cuales su EVA promedio era de 5 o mayor en una escala de 0 a 10. El 39% de los pacientes no recibieron ningún analgésico y el 53,2% no recibió manejo óptimo para el dolor, concordando con los resultados de varios países que demuestran que del 50 al 60% de los pacientes con dolor no reciben una adecuada terapia analgésica: EE. UU. con 42%, Francia 51%, Nueva Delhi 79% y Beijing 67%. Los pacientes con manejo más pobre eran aquellos con cáncer en etapas avanzadas. Demostrando con esto que a pesar de la alta prevalencia y severidad del dolor por cáncer, el diagnóstico y el manejo son inadecuados (45).
El índice de satisfacción por el manejo de dolor en los pacientes con cáncer va de 2,3% en aquellos que se refieren como muy insatisfechos, moderadamente insatisfechos 9,1%, poco insatisfechos 17,7%, poco satisfechos 27,0%, moderadamente satisfechos 38,1% y muy satisfechos en un 5,9% (52).
Deandrea y cols. (2008) describieron todos los estudios presentados entre 1987 y 2007 en los que se mencionara el sub-tratamiento (mal manejo) del dolor por cáncer basados en un Índice de Manejo del Dolor (IMD), estimando la prevalencia de este fenómeno en muestras homogéneas de pacientes con cáncer. Dentro de sus hallazgos se mostró que el 43% de los pacientes incluidos tenían una puntuación negativa de IMD: casi representando en promedio uno de dos pacientes sub-tratados como se muestra en la tabla III (53).
Lo anterior es de especial importancia, ya que se sabe que las condiciones crónicas dolorosas, como el dolor por cáncer y el dolor lumbar, presentan altos índices de ideación suicida hasta en un 6,5% de los pacientes (54,55).
En algunas ocasiones, la terapia para combatir el cáncer conlleva repercusiones psicológicas, como en las mastectomías, que llevan a las pacientes a someterse a reconstrucciones y terapias implantables que aumentan la incidencia de dolor (53%) -en comparación con aquellas que no optaron por los implantes (30%)-, registrando una intensidad de moderado a severo en estudios a 2 años de seguimiento (56).
Panorama mundial de la incidencia y prevalencia del dolor por cáncer
Incidencia y prevalencia del dolor por cáncer
La OMS calcula que el número de casos nuevos pasará de 10 millones registrados en el año 2000 a 30 millones antes del 2020 y que cerca de 60% se presentará en los países del tercer mundo. Actualmente el cáncer es la decimosegunda causa de muerte a nivel mundial, con un número anual de fallecimientos de 6 millones. Se espera que para el año 2020 las defunciones por cáncer sumen 10 millones y que este padecimiento se encuentre dentro de las tres primeras causas de muerte (57,58).
La prevalencia del dolor se incrementa con la progresión de la enfermedad oncológica, mientras que la intensidad, tipo y localización varía de acuerdo al sitio primario del tumor, extensión y progresión de la patología y del tratamiento empleado (45).
De acuerdo a la progresión de la tumoración, estudios recientes (2006) reportan que en una población de 772 pacientes con cáncer avanzado, el dolor se presenta en el 28, 46, 67, 75 y 79%, a los 6 meses, 3 meses, 1 mes, 1 semana y 1 día antes de la muerte de los pacientes (58).
Von Roenn realizó un estudio en EE. UU. con 1.308 pacientes oncológicos ambulatorios, de los cuales el 67% reportó dolor reciente, y de ellos 36% refirieron dolor severo que les resultaba incapacitante (59).
Larue reportó en Francia que 69% de los pacientes estudiados de la tercera edad con cáncer en etapa paliativa sufrían un dolor tan intenso que los inhabilitaba, lo cual es preocupante, ya que eran personas con bajos ingresos económicos y con educación mínima, que fueron tratados en forma deficiente (60).
Portenoy informó que más del 90% de los pacientes ambulatorios con recurrencia o metástasis de cáncer de colón o pulmón experimentó dolor durante más de la cuarta parte del tiempo de padecimiento. Más de la mitad de los pacientes reportaron de una moderada a severa interferencia en sus actividades generales y laborales. Más de la mitad indicaron interferencia de moderada a severa en su patrón de sueño, estado de ánimo y calidad de vida. Además reportó que el dolor se presentó en el 63% de los 246 pacientes hospitalizados y ambulatorios y de estos el 43% presentó una intensidad de moderada a severa, sobre todo los que padecen cáncer de ovario, colon, próstata y mama (61).
Podríamos referirnos a cientos de artículos disponibles acerca de la prevalencia del dolor en el paciente oncológico, sin embargo, a nuestro parecer, el publicado por van den Beuken-van Everdingen de manera reciente, y luego de una revisión sistémica de 40 años, es el más representativo (37).
Etiología del dolor por cáncer
La localización y causas del dolor oncológico son muy variadas (57,62). Las principales son las referidas en la tabla IV:
1. La invasión tumoral de estructuras adyacentes (70%): invasión de estructuras óseas, invasión de elementos vasculares o nerviosos, obstrucción intestinal o la infiltración de vísceras huecas.
2. Procedimientos diagnósticos y terapéuticos (20%): intervenciones quirúrgicas, efectos secundarios propios de la quimioterapia (mucositis gastrointestinal y bucofaríngea, neurotoxicidad) y/o de la radioterapia (enteritis rádica, cistitis rádica, esteonecrosis rádica).
3. Síndromes inducidos por la neoplasia (< 10%): como los síndromes paraneoplásicos.
4. Otras causas extraoncológicas: artrosis, osteoporosis, cardiopatía isquémica, infarto de miocardio, etc.
Dolor ocasionado por el tumor
La mayoría de los estudios reportan dolor ocasionado únicamente por el tumor en un rango que va del 46 al 92% (63-68).
Difícilmente se podrá mencionar una prevalencia del dolor ocasionado por la tumoración, ya que este variará dependiendo de otras causas. Si sólo atendemos a la tumoración per se, se reportan algunos datos como los siguientes:
- En lo que respecta al cáncer cervicouterino, Allende y cols. (2000) documentan, después del seguimiento que se les realizó a mujeres atendidas en el Instituto Nacional de Cancerología de la Ciudad de México, que el síntoma más frecuente es el dolor, en un 98,3% de los casos, seguido de estreñimiento y depresión. El 17,3% de estas pacientes requiere tratamiento paliativo oncológico con cirugía, quimioterapia o radioterapia para el control de los síntomas. En el 94% se utiliza tratamiento farmacológico para el dolor, principalmente a base de morfina oral (69).
- En lo que respecta al cáncer de mama, conocido como el tumor más frecuente en el mundo, la prevalencia de dolor es del 23-27,1% del total de las pacientes diagnosticadas y previo a intervención quirúrgica. En 1985 se informaron 719.000 nuevos casos (19% del total de cánceres en la mujer) por la OMS. Su frecuencia varía ampliamente y los países norteamericanos y europeos son los que tienen la frecuencia más elevada, mientras que los países de Asia y África tienen la más baja. En México hay estados donde el cáncer de mama ha rebasado ya al carcinoma cervicouterino como primera causa de mortalidad en mujeres, como lo demuestran las estadísticas nacionales en el estado de Jalisco, donde desde 1997 el cáncer de mama ocupa el primer lugar, con una tasa de mortalidad de 15,82% por 100.000 (70-72).
- En el cáncer de pulmón se reporta que de 752 pacientes hasta el 74% refieren algún dolor (42% leve, 24% moderado y 7% severo), en el 50% el dolor afecta las actividades diarias (30% un poco, 16% bastante y 3% mucho). Las metástasis óseas se relacionan en su mayoría con dolor. De acuerdo al Índice de Manejo de Dolor (IMD) del total de pacientes hasta un 82% reportan manejo inadecuado del dolor (n = 616) (73). Los sitios de dolor más comúnmente reportados son el tórax en 63% y la columna lumbar en 32%, aunque el 38% de los pacientes, según Portenoy y cols., presentan dos o más sitios distintos de dolor (74).
- En cuanto al dolor ocasionado por cáncer de próstata, Gerbershagen y cols. (2007) analizaron a 115 pacientes y el 69,9% (n = 80) refirieron dolor al menos durante los meses previos al periodo preoperatorio. El 28,7% de los pacientes refirieron dolor asociado a enfermedades urológicas. Los pacientes con estados avanzados de cáncer como el II y el III refirieron dolor crónico severo en 38,8 y 11,3% respectivamente. Aquellos que no referían dolor tenían mejor calidad de vida, menos ansiedad (31,3 vs. 8.6%) y depresión, así como un adecuado patrón de sueño. El 33,3% de los pacientes reportaron un solo tipo de dolor, 20% dos sitios, y 46,2% tres o más sitios (75).
- El cáncer de páncreas es uno de los tumores más letales, representando la cuarta causa de muerte en los hombres y la quinta en las mujeres en los Estados Unidos. El cáncer pancreático es refractario a los tratamientos estándar: el índice de sobrevida al año es de 24% y a los 5 años de cerca de 4%. Para los pacientes con cáncer resecable, el índice de sobrevida a los 5 años es de 17% (76).
Dolor ocasionado por el tratamiento del cáncer
Los porcentajes variaron en un rango del 17 al 37%, específicamente en cuanto al dolor postoperatorio (10,77).
En mujeres sometidas a mastectomía por cáncer el índice de dolor varía del 20 al 65%, la mayoría situaba el dolor en la axila/brazo (80,8%), en la zona de la cicatriz (55,8%), y 75% en más de una ubicación (78-80).
Dentro de los agentes que se manejan para el tratamiento de cáncer de mama se encuentran los taxanos (paclitaxel y docetaxel), los agentes de platino (carboplatino y cisplatino), y los alcaloides de la vinca (vinorelbine, capecitabine y gemcitabine), los cuales se relacionan con la mayoría de las manifestaciones de dolor neuropático en este tipo de pacientes. La radioterapia también se relaciona con el dolor neuropático, principalmente por la afección del plexo braquial a nivel de la fosa supraclavicular hasta en un 33% de las mujeres tratadas (81).
Los pacientes con cáncer de pulmón generalmente mueren al año de su diagnóstico (80-90%). El dolor se presenta en el 11% de ellos, con algunas variaciones consideradas dependiendo del estadio de la tumoración, siendo más frecuente el dolor nociceptivo (73%, rango de 75-86%) que el dolor neuropático que ocurre en el 30% de los casos (74,82).
Entre el 50 y 80% de los pacientes sometidos a toracotomía experimentan dolor crónico severo hasta varios meses después del procedimiento, y el 30% de ellos puede aún tener dolor durante los 4 ó 5 años posteriores a la cirugía con un dolor neuropático reportado como el más frecuente (83).
En un estudio de 48 pacientes con adenocarcinoma pancreático localmente avanzado e irresecable, que recibieron radioterapia, capacitabine y bevacizumab, donde 42% de ellos fueron hombres, el 92% caucásicos, el 69% de los tumores estaban localizados en la cabeza del páncreas, el 13% en el cuerpo de este, 8% en el cuello y 10% en múltiples sitios. El 94% de los tumores fueron irresecables por comprometer el plexo celiaco o la arteria mesentérica superior, 74% de los pacientes presentaron comorbilidades como diabetes, enfermedades cardiovasculares, pulmonares, hepáticas o renales. En cuanto al dolor, se presentaba en el 13% de los pacientes posterior al tratamiento contra 19% que lo mencionaban antes de la radioquimioterapia (76,84).
En tumores de cabeza y cuello, la cirugía induce dolor en el 52% de los pacientes, además de pérdida de la función. La duración promedio del dolor tanto neuropático como somático es de 1 a 92 semanas con una media de 26,9 (83).
En tumores óseos o en donde se compromete una extremidad, la amputación se relaciona con una prevalencia de dolor en un 60%, con presencia de miembro fantasma desde semanas hasta meses posteriores a la cirugía, aunque se ha llegado a documentar su aparición hasta varios años después (85).
La radiación de la próstata y los carcinomas cervicales y de endometrio se relacionan a proctitis en 2 a 5% de los sobrevivientes, sin demostrarse relaciones entre la proctitis aguda y el desarrollo de dolor crónico (83).
Intensidad del dolor
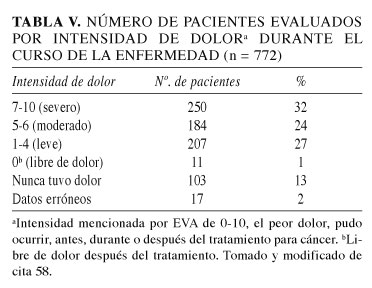
De manera general se acepta que en la mayoría de los estadios avanzados del cáncer se presenta una intensidad de dolor referida como severa (56,65,86-90) (Tabla V).
Dolor episódico
Hay pocos estudios en relación al dolor episódico en pacientes con cáncer. Portenoy y cols. (1999) definieron que de 178 pacientes estudiados, 164 (92,2%) presentaron datos de dolor episódico, de los cuales 84 (51,2%) habían experimentado dolor incidental durante el día previo. La media de episodios día fue de 6 y la duración de 3 min (rango de 1 segundo a 30 minutos). A pesar de que 2/3 partes (71,7%) pudo identificar los factores precipitantes (movimiento 20,4%; dolor al final de dosis 13,2%), el dolor fue impredecible en la mayoría (78,2%) (91).
Por otro lado, Swanwick y cols. documentaron la prevalencia de dolor episódico de pacientes con diagnóstico de cáncer que ingresaban a 4 hospitales. De 242 pacientes, 142 refería haber tenido dolor episódico al menos 24 h previas a su internamiento. De estos, el 93% dijo tener al menos un episodio de dolor. En total fueron descritos 228 dolores, de etos 211 se mencionaban como episódicos con variaciones en sus características, intensidad y limitación. Ciento cincuenta y dos dolores incidentales tenían un factor precipitante como el movimiento. Ciento sesenta y ocho dolores episódicos tenían un factor de alivio, y en un 54% este lo relacionaban a la medicación proporcionada.
Es importante mencionar que el tipo de dolor según su etiología era la siguiente: somático 90 pacientes, neuropático 25, visceral 20 y dolor mixto 7, descrito como somático/neuropático 6; visceral/neuropático 1 (92).
Dolor por cáncer en comparación con otros síntomas
La prevalencia de los síntomas en pacientes con cáncer incurable fue estudiada de manera detallada por Saskia y cols. en 2007 (Tabla VI), quienes realizaron una revisión sistémica, incluyendo 44 estudios de manera general (25.074 pacientes) con prevalencia de los síntomas (grupo 1) y 6 estudios (incluyendo 2.219 pacientes) con síntomas prevalentes en las últimas dos o una semana de vida (grupo 2). Se identificaron 37 síntomas evaluados en al menos 5 estudios.
Casi todos los síntomas ocurrieron en más del 10% de los pacientes. Cinco síntomas (fatiga, dolor, pérdida de energía, debilidad y pérdida del apetito) se produjeron en más del 50% de los pacientes del grupo 1; y el dolor, náuseas y síntomas urinarios ocurrieron con menor frecuencia (93) (Tablas VI y VII).
En México se reporta un estudio realizado por Montejo-Rosas (Tabla VII) en el Hospital Civil de Guadalajara en 2002, y en el que se reporta el dolor como principal síntoma del paciente con cáncer (94).
En la fase terminal del cáncer pulmonar, el 99% de los pacientes tiene al menos uno o más síntomas asociados con dolor, por ejemplo: disnea, náuseas, tos, hemoptisis, alteraciones psicológicas y/o neurológicas. Los síntomas más frecuentes son el dolor, las alteraciones psicológicas y la disnea. Una cuarta parte de los pacientes refieren náuseas, tos y síntomas neurológicos, y sólo una décima parte muestra hemoptisis. Dos tercios de estos pacientes presentan tres o más síntomas. De 1 a 4 meses posteriores a toracotomía se presentan fatiga en 57%, disnea 49%, tos 29% y dolor en el 20% del total de los pacientes a quienes se les realiza esta intervención (95).
Skaug y cols. (2007) reportaron un estudio en 271 pacientes con diagnóstico de cáncer pulmonar en cualquiera de sus etapas, y en el que mostraron, a 8 semanas previas a su muerte, un 85% de síntomas psicológicos (ansiedad, insomnio y/o depresión en 71%), disnea en 54%, síntomas neurológicos en 28%, tos en 24%, náuseas en 21% y hemoptisis en 9%. La disnea fue más frecuente en pacientes en estado III, y las náuseas en el estado IV (96).
En el cáncer de páncreas, el 95% de los pacientes reportaron 13 síntomas en la fase inicial de la enfermedad, siendo significativos la fatiga, la pérdida de apetito y el dolor. En la presentación inicial de dicha patología la proporción de pacientes que reportaron síntomas de moderada a severa intensidad incluyeron pérdida del apetito (24%), dolor (19%), fatiga (19%), disturbios en el sueño (10%) y náusea (4%). En quienes reportaron disminución del dolor de severo a moderado durante el tratamiento (15%) también tuvieron incremento de la fatiga (25%), náusea (13%) y trastornos en el sueño (12%); no hubo cambios en la pérdida del apetito (23%). En lo que respecta al periodo posterior al tratamiento, la proporción de pacientes que reportaron síntomas de moderado a severo disminuyó respecto a la basal en 7% a la pérdida del apetito, 7% para el dolor, 13% para la fatiga, 3% para náusea, y 7% para los trastornos en el sueño (76,97).
En un estudio realizado en el Instituto Nacional de Cancerología de la Ciudad de México, con 230 pacientes con diagnóstico de cáncer cérvico-uterino avanzado, los síntomas que más frecuentemente se asociaron al dolor (60-75%) fueron: anorexia (71%), astenia (60%), adinamia (80%), caquexia (40-80%), disnea y tos (40-50%), náusea y vómito (62%), y estreñimiento (50-86%). Acompañándose por linfedema (58%), infecciones (40%), caquexia (42%), anemia (44%), insuficiencia renal (66%), uropatía obstructiva (57%), hemorragia transvaginal (43%), ansiedad (58%) y depresión (85%). Para el caso de las pacientes con cáncer cérvico-uterino avanzado encontramos en promedio 7,5 síntomas (rango de 3 a 10). El tipo de síndrome doloroso más frecuentemente referido es el debido a plexopatía lumbosacra (98,3%), seguido del dolor somático por actividad tumoral que invade hasta la pared pélvica (80%) y el dolor visceral (70%). Por su parte, Torres-Labatón y cols., en un estudio retrospectivo realizado con pacientes con diagnóstico de cáncer de ovario del Hospital General de México, refieren que 78,9% de las pacientes presentan dolor abdominal, lo que corresponde a las cifras anteriormente mencionadas (69,98).
Si a todo esto le sumamos la prevalencia de los efectos secundarios relacionados al consumo de analgésicos en donde la mayoría de los estudios muestra eventos adversos provocados por la terapia farmacológica como aquellos relacionados con los opioides: estreñimiento (27-70%), náuseas y vómitos (10-30%), sedación (20-70%), dificultad para dormir (19-31%) y somnolencia diurna (69-86,2%), significa que debemos tener en cuenta el tipo de medicamentos utilizados para el alivio del dolor y sus efectos en el pacientes por la interacción e integración de la interpretación de la experiencia dolorosa (99).
Medicamentos para el control del dolor
En 1986, la Organización Mundial de la Salud (OMS) publicó "El Método de la OMS para el Alivio del Dolor por Cáncer", que desde entonces fue conocido como Escalera Analgésica de la OMS. Esta incorpora medidas farmacológicas con propiedades analgésicas y otras no directamente analgésicas (adyuvantes), que administradas de manera conjunta y valiéndose de diferentes mecanismos de acción genera un adecuado control de dolor. Aunque criticada continúa siendo el "gold standard" a nivel internacional para el alivio del dolor por cáncer (100,101).
El tipo de medicamentos y terapias aprobadas para el manejo de dolor por cáncer se encuentran bien especificados en esta escalera analgésica. Holtan y cols. en 2007, realizaron un estudio en Noruega, donde valoraron el tipo de fármacos utilizados para el manejo del dolor por cáncer en pacientes hospitalizados, documentando que de 872 pacientes, el 75% usaba analgésicos. Sólo 453 pacientes tenían dolor relacionado al cáncer. De estos el 60% (n = 272) usaban paracetamol, el 19,6% (n = 89) algún tipo de AINE, el 20,8% (n = 94) algún opioide débil, el 62% (n = 281) algún opioide potente, el 13,9% (n = 63) antidepresivos tricíclicos y/o antiepilépticos, el 23,8% (n = 108) esteroides y el 36,9% (n = 167) no recibieron ningún tipo de analgésicos. Un tercio de los pacientes había usado opioides débiles más opioides potentes. Sobre la ruta de administración de los opioides, la vía oral fue la más utilizada (74%, n = 284), seguida por la parenteral (29%, n = 111) y la ruta transdérmica (27%, n = 104). El 10% (n = 88) usaba paracetamol más algún tipo de AINE (102) (Tabla VIII).
Beck y cols. (2001), en Sudáfrica, documentan que de 838 pacientes estudiados, el 61,7% (n = 263) toma medicamentos no opioides (p. ej. paracetamol), el 41,3% (n = 176) opioides débiles, el 36,2% (n = 154) opioides potentes, el 3,5% (n = 15) antidepresivos, el 12,2% (n = 52) anticonvulsivantes, otras drogas el 31,2% (n = 133), ningún medicamento el 5,9% (n = 25) y medicamentos no conocidos el 4,7% (n = 20) (103).
En México, Tapia-Conyer y cols. reportaron que el consumo de opioides en mexicanos de 60-65 años de edad es del 6,7% en las mujeres y de 5,2% en los hombres, que representan a aquellas personas con dolor moderado a severo con acceso a este tipo de medicamentos, pero sin especificar el padecimiento primario (104).
Weaver y cols. midieron la prevalencia de adicción en 125 pacientes con dolor crónico, demostrando que 70% tomaban analgésicos opioides, de estos 10% respondieron a los criterios del DSM IIIR para abuso de sustancias o dependencia a las mismas y solo 12% fueron diagnosticados con abuso de sustancias, con lo cual concluyen que sólo una minoría de pacientes con dolor crónico están en alto riesgo de desarrollar problemas de adicciones (105).
En un estudio realizado por Katza y cols. (2005) señalan que posterior a la mastectomía, el 33,9 de las pacientes no toma ningún analgésico u opioides versus el 49,5% de aquellas que sí lo hacen con terapia opioide. En el día 10 postmastectomía, el 18,3% de ellas no toma ningún analgésico u opioide versus 25,7% que toma analgésico opioide, y al día 30 postmastectomía, el 17,7% no toma ningún analgésico u opioide versus 6,3% que sí toma analgésico opioide (72) (Tabla IX).
Conclusiones
La heterogeneidad de los estudios, los métodos objetivos para evaluar el dolor y la diferencia en las variables estudiadas hacen difícil analizar en conjunto estas investigaciones. Sin embargo, es evidente que el dolor involucra a un amplio porcentaje de pacientes conforme progresa la enfermedad.
La probabilidad de sufrir una afección tumoral aumenta en la mayor parte de los países, tanto por el aumento en la media de vida como por el incremento en los factores de riesgo. No todos los pacientes sufren dolor, sin embargo, es el síntoma que más preocupa al paciente, sobre todo cuando no es la historia natural de la enfermedad la que lo genera, sino los tratamientos.
El dolor de origen neoplásico constituye un problema de enorme importancia sanitaria y social. Es una enfermedad frecuente que debe ser correctamente atendida, por lo que es necesario realizar investigaciones epidemiológicas y encontrar tratamientos farmacológicos e intervencionistas idóneos para el manejo del dolor en pacientes con cáncer avanzado, además de proyectar la atención médica a un futuro próximo. Resulta elemental que el gobierno y los organismos no gubernamentales incluyan en sus normas las recomendaciones de la OMS, a fin de que se pueda garantizar la atención, mediante la disponibilidad, distribución, prescripción y administración de opioides.
El conocimiento acerca de la prevalencia de los síntomas es importante para la práctica clínica tanto para médicos como para el resto del personal de salud, pues su identificación y atención puede ayudar a anticipar problemas y planear el cuidado de los pacientes elaborando directrices de tratamiento y cuidado óptimo.
Afortunadamente en México se ha modificado la Ley General de Salud en materia de Atención del Dolor y Cuidados Paliativos (106,107). Aunque esta reglamentación es reciente, nuestro país ha demostrado un gran avance en las políticas de salud y se sitúa dentro de los pocos a nivel mundial con este tipo de legislación. De esta manera, finalmente nuestra población tiene garantías dentro de un marco legal para recibir atención y manejo del dolor, con los síntomas que lo acompañan. Si esto no se cumpliera el personal de salud estaría transgrediendo un derecho constitucional de los mexicanos.
Los poderes legislativo, ejecutivo y judicial, o sus similares de todos los países, deberán trabajar ardua, racionalmente y en conjunto para garantizar el derecho a la atención individual y familiar en el alivio del dolor en las diferentes fases de las enfermedades neoplásicas, para mejorar la calidad de vida y de muerte de los enfermos que son afectados por este mal.
Bibliografía
1. Bernabei R, Gambassi G, Lapane K, et al. Management of pain in elderly patients with cancer. JAMA 1998; 279:1877-82. [ Links ]
2. Franks PJ, Salisbury C, Bosanquet N, et al. The level of need for palliative care: a systematic review of the literature. Palliat Med 2002;14(2):93-104. [ Links ]
3. Programa de acción "Cáncer de Mama". Secretaría de Salud. México; 2002. [ Links ]
4. Programa de acción "Cáncer Cervicouterino". Secretaría de Salud. México; 2002. [ Links ]
5. Perera TS, Gutiérrez SJ, González JA. Cáncer en México: correlación entre los factores socioeconómicos y la alimentación. Med Int Méx 2006;22:36-43. [ Links ]
6. Ortiz AM, Gerónimo ML. El envejecimiento en México Aspectos territoriales y repercusiones sociales. 2008;10(26):79-82. Disponible en: http://w3.dsi.uanl.mx/publicaciones/trayectorias/26/pdf/05_2_ambito_el_envejecimiento_en_mexico.pdf (Acceso 01-09-2009). [ Links ]
7. Estimaciones de la CONAPO 2005. El envejecimiento de la población en México. Transición demográfica de México. Disponible en: http://www.conapo.gob.mx/publicaciones/enveje2005/enveje02.pdf (Acceso 01-09-2009). [ Links ]
8. Registro Histopatológico de Neoplasias Malignas: Compendio de mortalidad y morbilidad. Dirección General de Epidemiología. Secretaría de Salud. México; 2001. [ Links ]
9. Estadísticas de mortalidad en México: muertes registradas en el año 2000. Salud Pública de México 2002; 44(3):266-82. [ Links ]
10. Reyes D, Plancarte R, Mayer J, et al. Prevalencia del dolor en pacientes hospitalizados en un centro médico nacional de atención oncológica. Póster presentado en la XIX Reunión Nacional Médica del Instituto Nacional de Cancerología de México, 19-23 de febrero de 2002. [ Links ]
11. National Institute of Neurological Disorders and Stroke. Available at: http://espanol.ninds.nih.gov/trastornos/dolor_lumbar.htm (Access 01-09-2009). [ Links ]
12. Dubois MY. La medicina del dolor es ya una realidad. Rev Soc Esp Dolor 2001;8:1-2. [ Links ]
13. Ortega R. Prevalencia del dolor. En: Aldrete A. Tratado de Algología. México: jgh editores; 1999. p. 83-92. [ Links ]
14. Infante-Cosío G. Tratamiento farmacológico del dolor por cáncer. Revista Digital Universitaria. Disponible en: http://www.revista.unam.mx/vol.7/num4/art24/art24.htm (Acceso 01-09-2009). [ Links ]
15. Bistre S. El Dolor Crónico en América Latina. Rev Iberoamericana del Dolor 2007;3:7-9. [ Links ]
16. Barutell C. La Escalera analgésica de la OMS para el tratamiento del dolor necesita actualizarse. Disponible en: http://www.economiadelasalud.com/Ediciones/45/08_pdf/afondo.pdf (Acceso 01-09-2009). [ Links ]
17. Las cifras fatales del cáncer en México. Periodismo de Ciencia y Tecnología. Septiembre 2001. Disponible en: http://www.invdes.com.mx/anteriores/Septiembre2001/htm/cancer.html#arriba (Acceso 01-09-2009). [ Links ]
18. Tapia GJA. Medidas de prevalencia y relación, incidencia-prevalencia. Med Clin (Barcelona, España) 1995; 105:216-8. [ Links ]
19. Tapia GJA. Incidencia: concepto, terminología y análisis dimensional. Med Clin (Barcelona, España) 1994; 103:140-2. [ Links ]
20. Argimón JM, Jiménez VJ. Métodos de Investigación Clínica y Epidemiológica. 2a ed. Madrid: Harcourt; 2000. [ Links ]
21. Freeman J, Hutchinson GB. Prevalence, incidente and duration. Am J Epidemiol 1980;112:707-23. [ Links ]
22. Szklo M, Nieto J. Epidemiología intermedia. Conceptos y aplicaciones. Madrid: Díaz de Santos; 2003. [ Links ]
23. Merskey H. Classification of chronic pain. Descriptions of chronic syndromes and definitions. Pain 1986; S3:S345-56. [ Links ]
24. IASP-subcommittee on Taxonomy. Classification of chronic pain. Descriptions of chronic pain syndromes and definitions of pain terms. 2002;1-36. [ Links ]
25. Zylicz Z. The Netherlands: status of cancer and palliative care. J Pain Symptom Manage 1996;12:136-8. [ Links ]
26. Twycross R, Wilcock A. Pain relief. In: Twycross R. Symptom Management in Advanced Cancer. 3rd ed. Cornwall UK. British 2001. p. 17-22. [ Links ]
27. Plancarte RS, Mille L JE, Mayer RJ. Manejo del dolor por cáncer. Cir Ciruj 2002;70:356-68. [ Links ]
28. Fainsinger RL, Nekolaichuk CL. Cancer pain assessment -Can we predict the need for specialist input? Europ J Cancer 2008;44(8):1072-7. [ Links ]
29. Jacox A. Carr DB, Payne R, et al. Management of cancer pain. Clinical Practice Guideline No. 9. AHCPR Publication No. 94-0592. Rockville, MD. Agency for Health Care Policy and Research. U.S. Department of Health and Human Services. Public Health Service. March 1994. [ Links ]
30. Schrijvers D. Pain control in cancer: recent findings and trends. Ann Oncol 2008;18:37-42. [ Links ]
31. Turk DC, Okifuji A. Pain terms and taxonomies of pain. Loeser JD. Bonica's management of pain. 3rd ed. Philadelphia: Lippincott Williams & Wilkins; 2001. p. 17. [ Links ]
32. Coluzzi PH. Cancer pain management: newer perspectives on opioids and episodic pain. Orange, California. Am J Hosp Palliat Care 1998;15:13-22. [ Links ]
33. Madrid J. Dolor episódico, irruptivo, esporádico, incidental o en crisis: ¿hablamos de lo mismo? Medicina Paliativa 2000;7:1-3. [ Links ]
34. Silva JH. Manejo integral del dolor por cáncer. En: Bistre S, Araujo M. Dolor: síntoma, síndrome y padecimiento. México: Azerta Comunicación Creativa; 2003. p. 153-8. [ Links ]
35. Allende, S, Carvell HC. México: status of cancer and palliative care. J Pain Symptom Manage 1996;12:127-9. [ Links ]
36. Mohar A. Epidemiología del cáncer. En: Manual de Oncología: Procedimientos Médico-Quirúrgicos. Instituto Nacional de Cancerología. México: Mc Graw Hill Interamericana; 2000. p. 9-15. [ Links ]
37. Van den Beuken-van Everdingen MH, de Rijke JM, Kessels AG, et al. Prevalence of pain in patients with cancer: a systematic review of the past 40 years. Ann Oncol 2007;18(9):1437-49. [ Links ]
38. Guevara-López U, Covarrubias-Gómez A, Ochoa-Carillo FJ, et al. Parámetros de práctica para el manejo del dolor en cáncer. Cir Ciruj 2006;74:381-96. [ Links ]
39. Von Roenn JH, Cleeland CS, Gonin R, et al. Physician attitudes and practice in cancer pain management. A survey from the Eastern Cooperative Oncology Group. Ann Intern Med 1993;119:121-6. [ Links ]
40. Moris JN, More V, Gilberg RJ. The effect of treatment setting and patient characteristic on pain in terminal cancer patient: a report from the national hospice study. J Chron Dis 1986;39:27-35. [ Links ]
41. Nabal M, Naudi C, Ramírez M, Ormo C. Prevalencia del dolor episódico y continuo en cuidados paliativos. Rev Soc Esp Dolor 2001;8:265-8. [ Links ]
42. Friedrichsdorf SJ, Finney D, Bergin MJ, et al. Breakthrough pain in children with cancer. J Pain Symptom Manage 2007;34:209-16. [ Links ]
43. Mercadante S. Breakthrough pain in cancer patients. Pain Clin Updates 2006;14:1-4. [ Links ]
44. Romero J, Plancarte A, Guerrero G, et al. Prevalencia del dolor por cáncer en una población de pacientes de nuevo ingreso en el Instituto Nacional de Cancerología. J Pain Symptom Manage 1988;S3:S571. [ Links ]
45. Ho Yun Y, Seog Heo D, Goo Lee I, et al. Multicenter study of pain and its management in patients with advanced cancer in Korea. J Pain Symptom Manage 2003;25:430-7. [ Links ]
46. Suttona LM, Porterb LS, Keefec FJ. Cancer pain at the end of life: a biopsychosocial perspective. Pain 2002;99:5-10. [ Links ]
47. Shvartzman P, Friger M, Shani A, et al. Pain control in ambulatory cancer patients -can we do better? J Pain Symptom Manage 2003;26:716-22. [ Links ]
48. Waldman SA, Borsook D. Cuidados paliativos del dolor canceroso. En: Borsook D, LeBel A, McPeek B. Massachusetts General Hospital Tratamiento del Dolor. España: Marban; 2000. p. 354-60. [ Links ]
49. Quero-Arroyo RM, Fernández-Parra A, Gálvez-Mateos R. Alteraciones psicológicas, problemas psicosociales y características del dolor en una muestra de pacientes con cáncer avanzado y dolor crónico. Rev Soc Esp Dolor 1998;5:8-16. [ Links ]
50. Rebolledo J. Dolor y Sufrimiento. En: Bistre S, Araujo N. Dolor. México: Azerta Com Creativa; 2003. p. 234-9. [ Links ]
51. Dickerson D. Commentary: Pain relief pyramid. Am J Pain Man 2002;12:99-101. [ Links ]
52. Wang XS, Mendoza TR, Gao SZ, et al. The Chinese Version of the Brief Pain Inventory (BPI-C): its development and use in a study of cancer pain. Pain 1996;67:407-16. [ Links ]
53. Deandrea S, Montanari M, Moja L, et al. Prevalence of undertreatment in cancer pain. A review of published literature. Ann Oncol 2008;19:1985-91. [ Links ]
54. Breitbart W. Suicide risk and pain in cancer and AIDS patients. In: Chapman CR, Foley KM, editors. Current and emerging issues in cancer pain: research and practice. New York: Raven Press; 1993. p. 49-65. [ Links ]
55. Fishera BJ, Haythornthwaiteb JA, Leslie J, et al. Suicidal intent in patients with chronic pain. Pain 2001;89:199-206. [ Links ]
56. Randy S, Lowery JC, Davis J, et al. Persistent pain following postmastectomy breast reconstruction long-term effects of type and timing of surgery. Ann Plast Surg 2007;58:371-6. [ Links ]
57. Guillén-Núñez MR. Etiología del dolor por cáncer. Dol Clin Ter 2005;III:5-7. [ Links ]
58. Ling-Peng W, Jhe-Wu G, Zen-Sun W, et al. Multidisciplinary management of cancer pain: a longitudinal retrospective study on a cohort of end-stage cancer patients. J Pain Symptom Manage 2006;32:444-52. [ Links ]
59. Von Roenn JH, Cleeland CS, Gonin R, et al. Physician attitudes and practice in cancer pain management. A survey from the Eastern Cooperative Oncology Group. Ann Intern Med 1993;119:121-6. [ Links ]
60. Larue F, Fountain A, Brasseur L. Status of cancer and palliative care. J Pain Symptom Manage 1996;12:106-8. [ Links ]
61. Portenoy RK, Miransky J, Thaler HT, et al. Pain in ambulatory patients with lung or colon cancer: prevalence, characteristics, and effect. Cancer 1992;70:1616-24. [ Links ]
62. Khosravi SP, Del Castillo R, Pérez MG. Manejo del dolor oncológico. An Med Interna (Madrid) 2007;24:554-7. [ Links ]
63. Gómez BX. Prevalencia de síntomas en enfermos terminales de cáncer en 10 servicios de oncología. III Congreso Nacional de Oncología Médica. Palma de Mallorca: Sociedad Española de Oncología Médica; 1991. p. 54-6. [ Links ]
64. Abraham JL. A physician's guide to pain and symptom management in cancer patients. John Hopkings University Press; 2000. p. 79-121. [ Links ]
65. Allende SP, Lara AT. El dolor por cáncer. En: Manual de Oncología: procedimientos médico-quirúrgicos. México: Mc Graw Hill; 2000. p. 77-84. [ Links ]
66. Reddy SK. Introduction to pain. In: Elsayem A, Driver L, Bruera E. 2nd ed. The MD Anderson symptom control and palliative care handbook. Texas, USA: Printing services; 2002. p. 3-7. [ Links ]
67. Waller A, Caroline N. Handbook of palliative care in cancer. 2nd ed. Butterworth, USA: Heinemann Publisher; 2000. p. 11-21. [ Links ]
68. Bruera E. Manejo farmacológico del dolor por cáncer. Monografía sobre cuidados paliativos. Fundación Hackenbert; 1988. p. 35-42. [ Links ]
69. Allende-Pérez S, Flores CP, Castañeda C. Cuidados paliativos domiciliarios en pacientes con cáncer cervicouterino en etapas avanzadas. Rev Inst Nal Cancerol (Mex) 2000;(1):46. [ Links ]
70. Rodríguez-Cuevas AS. Cáncer de mama. Cir Ciruj 2005;73(6):423-4. [ Links ]
71. Steegers MA, Wolters B, Evers AW, et al. Effect of axillary lymph node dissection on prevalence and intensity of chronic and phantom pain after breast cancer surgery. The Journal of Pain 2008;9:813-22. [ Links ]
72. Katza J, Ellen L, Poleshuckc D, et al. Risk factors for acute pain and its persistence following breast cancer surgery. Pain 2005;119:16-25. [ Links ]
73. Di Maio M, Gridelli C, Gallo C, et al. Prevalence and management of pain in Italian patients with advanced non-small-cell lung cancer. BJC 2004;90:2288-96. [ Links ]
74. Potter J, Higginson IJ. Pain experienced by lung cancer patients: a review of prevalence, causes and pathophysiology. Lung Cancer 2004;43:247-57. [ Links ]
75. Gerbershagen HJ, Ozgür E, Straub K, et al. Prevalence, severity, and chronicity of pain and general health-related quality of life in patients with localized prostate cancer. Europ J of Pain 2008;12:339-50. [ Links ]
76. Reyes GC, Wenyaw C, Abbruzzese JL, et al. Patterns of self-reported symptoms in pancreatic cancer patients receiving chemoradiation. J Pain Symptom Manage 2007;34(3):244-52. [ Links ]
77. Hewitt D. The management of pain in the oncology patient. Obstetrics and Gynecology Clinics North Am 2001;28(4):819-46. [ Links ]
78. Smith WC, Bourne D, Squair J, et al. A retrospective cohort study of post mastectomy pain syndrome. Pain 1999;83:91-5. [ Links ]
79. Blunta C, Schmiedelb. Some cases of severe post-mastectomy pain syndrome may be caused by an axillary haematoma. Pain 2004;108:294-6. [ Links ]
80. Vilholm OJ, Cold S, Rasmussen L, et al. The postmastectomy pain syndrome: an epidemiological study on the prevalence of chronic pain after surgery for breast cancer. BJC 2008;99:604-10. [ Links ]
81. Junga BF, Herrmannb D, Griggs J, et al. Neuropathic pain associated with non-surgical treatment of breast cancer. Pain 2005;108:10-4. [ Links ]
82. Hsu TH, Lu MS, Tsou TS, et al. The relationship of pain, uncertainty, and hope in Taiwanese lung cancer patients. J Pain Symptom Manage 2003;26(3):835-42. [ Links ]
83. Polomano RC, Farrar JT. Pain and neuropathy in cancer survivors. AJN 2006;106(3):40-7. [ Links ]
84. Demeure MJ, Doffek KM, Komorowski RA, et al. Molecular metastases in stage I pancreatic cancer: Improved survival with adjuvant chemoradiation. Surgery 1998;124:663-9. [ Links ]
85. Olarra J, Longarela A. Sensación de miembro fantasma y dolor de miembro residual tras 50 años de la amputación. Rev Soc Esp Dolor 2007;6:428-31. [ Links ]
86. Reyes-Chiquete D, Guillén-Nuñez MR, Alcázar-Olán R, et al. Epidemiología del dolor por cáncer. J Rev Inst Nal Cancerol Méx 2006;1: 233-44. [ Links ]
87. Davis MP, Walsh D. Epidemiology of cancer pain and factors influencing poor pain control. Am J Hosp Palliat Care 2004;21(2):137-42. [ Links ]
88. Woodruff R. Dolor asociado al cáncer. Definiciones, clasificaciones y causas. En: Dolor por cáncer. México: Medigraphic editores; 1997. p. 1-10. [ Links ]
89. Caraceni A, Portenoy RK, Asbby MA, et al. An international survey of cancer pain characteristics and syndromes. Pain 1999;82(3):263-74. [ Links ]
90. Caraceni A, Portenoy RK y Grupo de trabajo de la IASP sobre dolor asociado a cáncer. Encuesta internacional sobre las características y síndromes del dolor asociado a cáncer. Rev Soc Esp Dolor 2000;7:200-13. [ Links ]
91. Portenoy RK, Payneb D, Jacobsenc P. Breakthrough pain: characteristics and impact in patients with cancer pain. Pain 1999;81:129-34. [ Links ]
92. Swanwick M, Haworth M, Lennard RF. The prevalence of episodic pain in cancer: a survey of hospice patients on admission. Palliat Med 2001;15:9-18. [ Links ]
93. Sashia CC, Teunissen M, Wesker W, et al. Symptom prevalence in patients with Incurable Cancer: A systematic review. J Pain Symptom Manage 2007;34:94-104. [ Links ]
94. Montejo-Rosas G, Galaviz-Muro A, Espinoza-Rodríguez N, et al. Cuidados paliativos en cáncer avanzado. Experiencia de siete años en el Hospital Civil de Guadalajara, Jalisco, México, Dr. Juan I. Menchaca. Gac Méd Méx 2002;138(3):231-4. [ Links ]
95. Sarna L, Cooley ME, Brown JK, et al. Symptom severity 1 to 4 months after thoracotomy for lung cancer. AJCC American Journal of Critical Care 2008;17(5): 455-68. [ Links ]
96. Skaug K, Eide GE, Guisvik A. Prevalence and predictors of symptoms in the terminal stage of lung cancer. A Community Study. CHEST 2007;131:389-94. [ Links ]
97. Takhar AS, Palaniappan P, Dhingsa R, et al. Recent developments in diagnosis of pancreatic cancer. BMJ 2004;329:668-73. [ Links ]
98. Torres LA, Kippes P, Bassaure R, et al. Neoplasias germinales malignas del ovario. Incidencia en el Servicio de Oncología del Hospital General de México. GAMO 2007;6(2):38-41. [ Links ]
99. Villars P, Dodd M, West C, et al. Differences in the prevalence and severity of side effects based on type of analgesic prescription in patients with chronic cancer. J Pain Symptom Manage 2007;33(1):67-77. [ Links ]
100. Reid CM, Forbes K. Pain in patients with cancer: still a long way to go. Pain 2007;132:229-30. [ Links ]
101. Cormie PJ, Aass N, Nordoy T, et al. Control of pain in adults with cancer: summary of SIGN guidelines. BMJ 2008;337:1105-9. [ Links ]
102. Holtan A, Aass N, Nordoy T. Prevalence of pain in hospitalized cancer patients in Norway: a national survey. Palliative Medicine 2007;21:7-13. [ Links ]
103. Beckab S, Falksonb G. Prevalence and management of cancer pain in South Africa. Pain 2001;94:75-84. [ Links ]
104. Tapia-Conyer R, Cravioto P, Borges-Yáñez A, De la Rosa B. Consumo de drogas médicas en población de 60 a 65 años en México. Encuesta Nacional de Adicciones 1993. Salud Pública Mex 1996;38:458-65. [ Links ]
105. Weaver M, Scholl S. Abuse liability in opioid therapy for pain treatment in patients with an addiction history. Clin J Pain 2002;18(Supl.4):S61-9. [ Links ]
106. Guevara-López U, Covarrubias-Gómez A. Cronología de eventos hacia una reforma legislativa en materia de dolor y cuidados paliativos. Rev Mex Anest 2008; 31(4):328-33. [ Links ]
107. Diario Oficial de la Federación. Secretaría de Gobernación. Disponible en: http://dof.gob.mx/nota_detallephp?codigo=5076793&fecha=05/01/2009 (Acceso 01-09-2009). [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
David Reyes Chiquete
e-mail: dvdchiquete@yahoo.com.mx
Recibido: 17-08-10.
Aceptado: 17-12-10.