My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.21 n.3 Madrid May./Jun. 2014
https://dx.doi.org/10.4321/S1134-80462014000300007
¿Influye la anestesia en los resultados de la cirugía oncológica?
Does the anesthesia have any influence on surgical outcome?
N. Esteve, A. Ferrer, C. Mora, G. Gómez, H. Ribera y P. Garrido
Servicio de Anestesiología, Reanimación y Terapia del Dolor. Hospital Universitario Son Espases. Palma de Mallorca, Islas Baleares
Dirección para correspondencia
RESUMEN
Los criterios de calidad en la cirugía oncológica radical se basan en la extirpación completa del tumor, con márgenes libres, sin enfermedad macroscópica residual, en una linfadenectomía adecuada y en la mínima manipulación tumoral posible.
A pesar de conseguir estos objetivos, tras la extirpación puede quedar enfermedad residual no visible o micrometástasis, con potencial de crecimiento y diseminación, dependiendo de la capacidad tumoral y de las defensas del huésped. Tres factores perioperatorios pueden desplazar potencialmente el equilibrio hacia la progresión de la enfermedad residual mínima: a) la cirugía, por la manipulación, libera células tumorales a la circulación, deprime la inmunidad celular (IC), incluyendo la actividad citotóxica de las células Th1 (T helper) y las NK (natural killer), reduce los factores anti-angiogénicos e incrementa los pro-angiogénicos; b) los anestésicos generales, excepto el propofol, disminuyen la IC; y c) los opioides inhiben la IC y humoral y promueven el crecimiento tumoral.
La anestesia y la analgesia regional bloquean las aferencias nociceptivas intraoperatorias y disminuyen o eliminan el dolor agudo postoperatorio. Combinada con la anestesia general, disminuiría el consumo de anestésicos volátiles, potencialmente inmunosupresores. Estas acciones preservan la inmunidad al disminuir la respuesta neuroendocrina e inflamatoria al estrés y el consumo de opioides.
Los estudios experimentales apoyan esta hipótesis. Los estudios clínicos presentan resultados contradictorios. Desde el año 2000, se han realizado 21 estudios en cáncer de mama, próstata, colon y recto, pulmón, hígado y melanoma. Dieciséis son retrospectivos, 5 muestran resultados positivos en cuanto a la asociación de la analgesia epidural y la disminución de la recurrencia oncológica. Otros 5 muestran resultados parciales, y 6 estudios no mostraron ninguna asociación. Los 5 estudios prospectivos también muestran resultados variables.
Los diferentes resultados clínicos pueden deberse a múltiples factores de confusión, como distintos grados histológicos, radioterapia y quimioterapia previas, diversos grados de dificultad y de radicalidad quirúrgica, la presencia de anemia previa, sangrado, transfusión o hipotermia. También pueden existir diferencias entre las técnicas anestésicas y el uso o no de la analgesia epidural en el intraoperatorio. La administración de fármacos potencialmente inmunoprotectores, como AINE, tramadol, β-bloqueantes y estatinas, pueden contribuir a enmascarar los resultados.
Existen además problemas metodológicos, como tamaños de muestra pequeños para un potencial efecto positivo inferior al 30 %, mezclas heterogéneas de pacientes, de procedimientos quirúrgicos y de series antiguas y finalmente la dificultad de aislar un efecto dentro del entorno perioperatorio complejo y multifactorial.
Quedan muchas preguntas pendientes, a la espera de ensayos prospectivos que acabarán dentro de 3 a 7 años. Los nuevos abordajes laparoscópicos, la cirugía mínimamente invasiva y la neoadyuvancia, han cambiado radicalmente el grado de agresión quirúrgica y probablemente también el impacto de las técnicas anestésicas inmunoprotectoras en la recurrencia quirúrgica.
En la actualidad no hay evidencia que apoye una técnica anestésica sobre otra en la supervivencia oncológica.
Palabras clave: Anestesia y recurrencia oncológica. Anestesia y metástasis. Analgesia y recurrencia oncológica. Anestesia regional y cáncer.
ABSTRACT
The following quality criteria management is considered in radical surgery for cancer, complete eradication of the tumor with negative surgical margins and without macroscopic residual tumor, adequate removal of lymph nodes and minimal manipulation of the tumor.
Despite getting all these objectives, residual non-visible tumor or micrometastasis may persist after tumor resection therefore cancer cells can growth and disseminate depending on the aggressiveness of the tumor and host defenses. Three perioperative factors can contribute to cancer advance: a) Surgical manipulation that releases cancer cells to the bloodstream, diminishes cellular immunity, including T helper 1 (TH1) and natural killer (NK) cell activity, decreases anti-angiogenic factors and increases pro-angiogenic factors; b) general anaesthetics, except propofol, diminish cellular immunity; and c) opioids inhibit cellular and humoral immunity and promote cancer cell growth.
Regional anaesthesia and analgesia block nociceptive afferents and decrease or eliminate acute postoperative pain. Combined with general anaesthesia would reduce the consumption of volatile anesthetics, potentially immunosuppressive. These actions preserve immunity due to the decrease of neuroendocrine and inflammatory response to stress and the consumption of opioids.
Experimental studies support this hypothesis. Clinical studies show contradictory results. Since the year 2000, twenty one cancer studies for many types of cancer (breast, prostate, colon and rectum, lung, liver and melanoma) have been published. Sixteen studies are retrospective, 5 studies show positive correlation between epidural analgesia and decrease of cancer recurrence risk. Five studies show partial results and 6 studies did not show any association. Data from 5 prospective studies also show variable results.
Differences in clinical studies results may be due to several confounding factors like different histological grading, radiotherapy and chemotherapy used previously, different technical difficulty and radical surgery grade, perioperative anaemia, bled, transfusion or hypothermia. Other causes of conflicting results are related to anaesthetic technique and the use or not of intraoperative epidural analgesia. The administration of drugs with potential immunosuppressive effects like non-steroidal anti-inflammatory drugs, tramadol, beta blockers and statins can also mask the results.
There exist moreover methodological problems like small sample size to get a potential positive effect less than 30 %, patients, surgical procedures and old series heterogeneity and finally difficulty to isolate an effect from the complex and multifactorial perioperative environment.
Many outstanding questions are waiting for prospective trials that end within 3 to 7 years. The new laparoscopic approaches, minimally invasive surgery and neoadjuvancy have radically changed the degree of surgical aggression and probably also the impact of the immunoprotective anesthetic techniques on surgical recurrence. Currently there is no evidence that supports one anesthetic technique over another in cancer survival.
Key words: Anaesthesia and cancer recurrence. Anaesthesia and metastasis. Analgesia and cancer recurrence. Regional anaesthesia and cancer.
Introducción
A pesar de que el tratamiento quirúrgico es capaz hoy en día de extirpar totalmente el tumor primario y conseguir una citorreducción macroscópica completa, el 90 % de las muertes relacionadas con el cáncer son debidas a las metástasis y no al tumor primario. Paradójicamente, la cirugía oncológica curativa puede contribuir a la diseminación metastásica por la propia manipulación quirúrgica tumoral. Además, se produce una inmunosupresión perioperatoria (1) que facilitaría el crecimiento de micrometástasis pre-existentes y la diseminación tumoral a distancia.
Por ello, prevenir la inmunosupresión en el postoperatorio inmediato, puede tener mucha importancia a la hora de frenar el crecimiento tumoral en este periodo de alto riesgo oncológico.
Estudios in vitro y en modelos animales (2-7) han mostrado un efecto inmunomodulador de la anestesia y la analgesia regional, así como de algunos anestésicos, fármacos y factores perioperatorios.
Realizamos una revisión de los estudios clínicos que tratan de relacionar las técnicas anestésicas y analgésicas con los resultados oncológicos a largo plazo.
Se ha realizado una búsqueda en PubMed© desde el año 2000 hasta diciembre de 2012. Las palabras clave utilizadas han sido "anaesthesia and cancer recurrence", "anaesthesia and metastasis", "analgesia and cancer recurrence" y "regional anaesthesia and cancer". Las referencias relevantes de los artículos identificados también fueron revisadas.
Objetivos de la cirugía oncológica radical
Los criterios de calidad en la cirugía oncológica radical se basan en la extirpación completa del tumor, con márgenes libres, sin enfermedad macroscópica residual (R = 0), en una linfadenectomía adecuada y en la mínima manipulación tumoral posible ("non-touch technique").
A pesar de conseguir estos objetivos, tras la extirpación puede quedar enfermedad residual no visible, micrometástasis, con potencial de crecimiento y diseminación, dependiendo de la agresividad biológica tumoral y de la defensa inmunitaria del paciente.
Periodo crítico perioperatorio
El periodo perioperatorio se caracteriza por la activación de la respuesta al estrés quirúrgico, que desencadena una serie de reacciones neuroendocrinas, humorales e inmunitarias complejas, con el resultado neto de una inmunosupresión postoperatoria. Esta disminución de la capacidad defensiva inmunitaria es transitoria (8), durando unos 3 a 10 días. Este periodo se caracteriza por una máxima vulnerabilidad para el crecimiento y la diseminación metastásica.
Con el fin de bloquear una posible diseminación y crecimiento tumoral, se administra la quimioterapia y la radioterapia postoperatoria. No obstante, estas terapias no pueden iniciarse hasta pasado un periodo de seguridad postoperatoria (9) para permitir la cicatrización y preservar la inmunidad. Esta ventana temporal quizás sea crítica en la capacidad de diseminación tumoral y en la supervivencia oncológica a largo plazo.
En la tabla I se muestran los factores perioperatorios que pueden influir en la recurrencia tumoral y las metástasis (1,10-12).
Todos estos factores activan o inhiben las siguientes respuestas inmunitarias perioperatorias (1,9,12-14).
- Respuesta neuroendocrina: liberación de catecolaminas (CAT) que se unen a los receptores β de las células tumorales, estimulando el crecimiento y la diseminación tumoral y la angiogénesis (1). También se unen a los receptores β2 de las células citotóxicas (15), disminuyendo la inmunidad celular (IC).
- Activación del eje hipotálamo-hipofisario-adrenal: se produce una inmunosupresión por la liberación de glucocorticoides y CAT que inhiben la IC.
- Respuesta inflamatoria: se crea un microentorno tumoral con la liberación de citoquinas (CK), interleukinas (IL) y prostaglandinas (PG) que promueve la diseminación tumoral y la angiogénesis. La IL-2, la IL-12, el interferón-γ (IFN-γ) y el factor de necrosis tumoral (TNF) estimulan la actividad de las células natural-killer (CNK) de la inmunidad celular (15). El resto de IL, sobre todo la IL-6, la IL-8 y la IL-10 son inmunosupresoras al deprimir la IC. El balance neto en el perioperatorio se inclina hacia la inmunosupresión.
- Inmunidad celular: las CNK son la primera línea de defensa antitumoral. Bajos niveles de actividad de las CNK en el perioperatorio son predictivos de alto riesgo de recidiva tumoral (16), independientemente de factores como la edad, el sexo, el tamaño, la diferenciación y el grado de invasión del tumor.
Las células T-helper pueden transformarse en Th1 o en Th2. Cuando el equilibrio se desvía hacia la producción de células Th2, se produce una disminución de la IC. Las células dendríticas y las células mononucleares, forman parte también de la IC. Se han descrito nuevas estirpes de linfocitos T citotóxicos (LT). Los LT marginales hepáticos y pulmonares, y los LT pit hepáticos. Estas células se localizan en los sinusoides de órganos como el hígado o el pulmón, presentando una gran capacidad de depuración de las células tumorales. A raíz de los nuevos descubrimientos de poblaciones linfocitarias citotóxicas (17), se cree que la IC juega un papel protagonista en la defensa antitumoral y anti-metastásica.
- Angiogénesis: el desarrollo de nuevas redes capilares es vital para el crecimiento tumoral. Los tumores no pueden sobrevivir más allá de los 2 mm de diámetro sin angiogénesis (18). Este proceso es estimulado por la liberación de factores pro-angiogénicos desde el tumor, incluyendo el factor vascular de crecimiento endotelial (VEGF) y la prostaglandina E2, que también son activados por muchos factores pro-tumorales, como lo opioides. La acción anti-angiogénica se ejerce a través de la liberación de angiostatina y endostatina, que disminuyen tras la extirpación quirúrgica del tumor primario.
- Liberación de factores de crecimiento: durante la cirugía se produce una liberación de factores de crecimiento, migración y adherencia tumoral. Todos los anestésicos excepto el propofol activan el factor inducido por la hipoxia (HIF) (13) que se localiza en el centro de la masa tumoral, y que promueve la proliferación y migración celular, la diseminación hematógena y la angiogénesis. Se plantea que el potencial efecto organoprotector de los anestésicos volátiles frente a la lesión de isquemia-reperfusión, pueda jugar un papel negativo en la preservación de la inmunidad celular (13).
Resumimos en el esquema de la figura 1 los efectos de la cirugía, la anestesia y los factores perioperatorios sobre la inmunidad tumoral.
Estudios clínicos
Desde el año 2000, se han realizado 21 estudios clínicos en cáncer de mama, próstata, colon y recto, pulmón, hígado y melanoma, que relacionan el tipo de anestesia y de analgesia con la recurrencia oncológica o la supervivencia. De estos 21 ensayos, 16 son retrospectivos. Entre los estudios retrospectivos, cinco muestran resultados positivos en cuanto a la asociación de la analgesia epidural y la disminución de la recurrencia oncológica. Otros cinco estudios retrospectivos muestran resultados parciales. Finalmente, seis estudios no registraron asociación entre el tipo de analgesia y la evolución oncológica. Los cinco estudios prospectivos muestran resultados variables. Tres registran resultados analíticos positivos, sin traducción en resultados clínicos, uno muestra resultados parciales y el último no encuentra asociación entre el tipo de anestesia-analgesia y los resultados oncológicos a largo plazo.
Resumimos en las tablas II y III las principales características de los estudios y los resultados.
Realizamos una revisión crítica de los principales resultados agrupados por procedimiento quirúrgico y tipo de tumor.
Cáncer de ovario
El estudio de Lin y cols. (22) es retrospectivo con datos desde 1994 a 2006. Agrupa 106 pacientes con anestesia general (AG) y anestesia epidural (AE) y 37 con AG y analgesia opioide (AO) sometidas a cirugía citorreductora de cáncer de ovario. Muestra una mayor supervivencia a los 3-5 años del grupo de pacientes con AE. El grupo AG presenta un incremento de mortalidad del 21,4 % (95 % CI, 7,5-43,1 %) comparado con el grupo AE, que corresponde a un riesgo relativo (RR) de 1,214 (95 % de intervalo de confianza (IC), 1.075-1.431, p = 0.043) en el modelo multivariable ajustado de regresión COX.
No obstante, los datos son muy antiguos y retrospectivos. Por lo tanto, no son homogéneos en cuanto a técnicas anestésicas, quirúrgicas y cuidados postoperatorios, que han avanzado notablemente desde 1994. El grupo de AG es muy pequeño y no se puede excluir un sesgo de selección y que sean pacientes más graves.
El trabajo de De Oliveira y cols. (23) aporta una diferencia interesante al comparar retrospectivamente datos desde 2000 a 2006, de 127 pacientes con AG y AO, 29 con AG y AE postoperatoria y 26 con AG y AE intra y postoperatoria. A pesar de que este último grupo es muy pequeño, es el único que muestra disminución significativa de recurrencia oncológica (RR 0,37 95 % IC, 0,19-0,73, p = 0,004). No obstante se señala que las pacientes con AG presentan mayor comorbilidad y estadios oncológicos más avanzados.
Carcinoma hepatocelular-radiofrecuencia
Lai y cols. (26) estudian 179 pacientes, desde 1999 a 2008, sometidos a radiofrecuencia por carcinoma hepatocelular, bajo AG o AE. Paradójicamente, encuentra más recurrencia en el grupo AE, RR 4,31 (95 % CI, 2,24-8,29; p = 0,001) sin diferencias en supervivencia. No obstante no pueden descartar una analgesia incompleta del grupo AE, que dificultaría la técnica de radiofrecuencia. Además, este es un procedimiento de baja agresión quirúrgica y por ello provocará una respuesta al estrés de menor intensidad.
Carcinoma de cérvix-braquiterapia
El trabajo de Ismail y cols. (27) es otro ejemplo de procedimiento de baja agresividad quirúrgica. Estudian retrospectivamente 132 mujeres sometidas a braquiterapia por carcinoma avanzado de cérvix, 63 con anestesia intradural y 69 con AG. No encuentran diferencias en recurrencia oncológica entre ambos grupos. El grado de manipulación tumoral, de respuesta al estrés y de dolor postoperatorio, no es comparable con una intervención quirúrgica. Del mismo modo, el tiempo y las dosis de exposición al anestésico local intradural son muy pequeños. No se registra la comorbilidad y el grupo de anestesia intradural son mujeres más mayores, por lo que no se puede descartar que estén más enfermas.
Cáncer colorrectal
La cirugía del cáncer colorrectal es la que acumula un mayor número de estudios que comparan la AG y la AE con respecto a la supervivencia y a la recurrencia oncológica.
El estudio de Gottschalk y cols. (28), sobre un total de 509 pacientes, muestra una discreta diferencia en el porcentaje de pacientes libres de recurrencia oncológica en el grupo de AE mayores de 64 años. El resto no mostró diferencias. Los autores plantean que el efecto inmunoprotector de la epidural puede depender de la edad. Los pacientes más jóvenes presentarían tumores más agresivos. No obstante, el seguimiento de los pacientes es muy corto, de 1,8 años, y no se pueden descartar diferencias con un seguimiento a más largo plazo.
Gupta y cols. (29) estudian una base de datos de 655 pacientes, desde 2004 a 2008, con cirugía colorrectal abierta, comparando analgesia epidural y analgesia intravenosa opioide controlada por el paciente (PCAIV). Encuentran una reducción de todas las causas de mortalidad en el grupo de cáncer rectal y AE, pero no en el de colon (Fig. 2). Estos resultados plantean la posibilidad de que el efecto protector de la analgesia epidural, además de depender de la edad, se asocie a distintos tipos de tumor y localización. No obstante, esta base de datos puede contener pacientes con distintos estadios tumorales en el momento de la cirugía y además es difícil homogeneizar la definición de recurrencia oncológica en algunos tipos de cáncer, como el de recto. La técnica quirúrgica, como la excisión total del meso-recto en estos tumores es determinante en el pronóstico.
Recientemente, Cumming y cols. (30) realizaron un estudio prospectivo sobre la base de datos de Medicare, evaluando 42.000 pacientes mayores de 66 años, diagnosticados de cáncer de colon entre los años 1996 y 2005, sometidos a resección de colon abierta. La supervivencia a los 5 años fue mayor para los pacientes que recibieron analgesia epidural (9.670, 30 %), 61 % comparado con 55 % para los que recibieron analgesia convencional. El análisis ajustado a múltiples variables, detecta una asociación significativa entre el uso de la epidural y la mayor supervivencia media (OR 0,91, 95 % IC [0,87, 0,94], p < 0,001). La tasa de recurrencia, medida como consumo de quimioterapia o radioterapia, no varió entre los dos grupos.
Estos resultados positivos, presentan algunas limitaciones. El uso de bases de datos administrativas en los estudios observacionales, si bien aportan un gran número de pacientes, también pierden información clínica que puede ser relevante. Por ejemplo, no sabemos el uso intra y/o postoperatorio de la analgesia epidural. Tampoco el estadio tumoral ni datos intraoperatorios. Además, estos resultados se aplican sólo a una población mayor de 66 años.
El estudio retrospectivo de Day y cols. (32) es el único que evalúa el impacto de la analgesia epidural o la intradural frente a la analgesia intravenosa con opioides en cirugía colorrectal laparoscópica.
Estudian 424 pacientes intervenidos desde 2003 a 2010. No encuentran diferencias en la supervivencia a los 5 años, ajustando por variables de comorbilidad y de estadio oncológico. Tampoco hay diferencias separando cáncer de colon y recto. El grupo AE tiene más pacientes ASA III, más estancia media y menos pacientes en los últimos años (de 2008 a 2010). Ello se debe a la progresiva desaparición de la técnica epidural como analgesia de elección en la cirugía laparoscópica.
Los autores plantean que con el abordaje laparoscópico se produce una reducción del grado de inmunosupresión y de la respuesta al estrés quirúrgico. En este contexto, las potenciales ventajas de la analgesia regional pueden no ser evidentes.
Cirugía abdominal mayor abierta
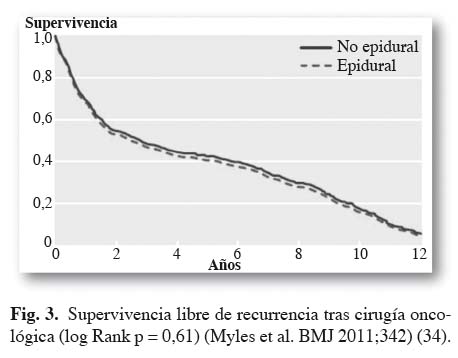
El único estudio prospectivo (34) realizado en pacientes sometidos a cirugía abdominal abierta por cáncer, forma parte del estudio MASTER (35) que evaluaba la morbilidad y la mortalidad postoperatoria asociada al uso de analgesia epidural.
Estudian 230 pacientes con analgesia epidural y 216 con analgesia convencional. No encuentran diferencias en el tiempo medio de recurrencia oncológica o muerte, entre los dos grupos (2,6 años vs. 2,8 años, p = 0,61). Tampoco hay diferencias en la supervivencia libre de recurrencia (Fig. 3). En el análisis de regresión se identifican los siguientes factores predictores de muerte precoz o recurrencia del cáncer: edad avanzada, sexo femenino y transfusión.
No obstante, este estudio es muy heterogéneo en cuanto a los tipos de tumor y los distintos procedimientos quirúrgicos. Además, tal como plantean los autores, no detecta diferencias inferiores al 30 % en la reducción del riesgo, por lo que no es capaz de detectar efectos positivos, clínicamente relevantes, de la analgesia epidural en subgrupos de neoplasias.
Cáncer de próstata
En 2008 Biki y cols. (36) publicaron los primeros resultados que relacionaban la disminución de la recurrencia oncológica en los pacientes operados de cáncer de próstata, con el uso de analgesia epidural.
Posteriormente, Wuethrich y cols. (37) demostraron diferencias en recurrencia clínica a favor del grupo AE, RR 0,45 (0,27-0,75 p = 0,002), pero no diferencias en recurrencia bioquímica, ni en supervivencia oncológica o por otros motivos. Es un trabajo retrospectivo y secuencial. Evalúan 103 pacientes en los años 1994-1997 y 158 pacientes en el periodo 1997-2000. Existen, por tanto, muchos probables factores de confusión.
Forget y cols. (38) examinaron 1.111 pacientes sometidos a prostatectomía radical abierta, desde 1993 a 2006. No encuentran diferencias en recurrencia bioquímica (antígeno prostático específico, PSA) entre el uso de AE, AG o ketorolaco. Se registra una disminución de recurrencia bioquímica con el uso intraoperatorio de sufentanilo, pero el grupo sin opioide es muy pequeño (3 % frente a 97 %). Además, existe un sesgo asociado a la evolución técnica y diagnóstica desde el año 1993.
Melanoma
En el año 2000, Schlagenhauff y cols. (40) describieron una disminución de la supervivencia relacionada con el uso de AG frente a anestesia local, en la exéresis del melanoma cutáneo (RR 1,46 p < 0,0001). Estos resultados no se confirmaron posteriormente en un trabajo de Gottschalk y cols. (41), que comparó AG y anestesia intradural (AI) en 273 pacientes sometidos a resección ganglionar inguinal. Se observó una tendencia a una mayor supervivencia en el grupo de la AI [tiempo medio de supervivencia AI: 95,9 meses; 95 % IC, 81,2-11,5 meses; AG: 70,4 meses; 95 % IC, 53,6-87,1 meses; p = 0,087], sin significación estadística. Los autores plantean que quizás el mal pronóstico del melanoma maligno con ganglios positivos enmascare los potenciales efectos inmunoprotectores de la AI.
Cáncer de mama
Uno de los primeros trabajos en el campo de la anestesia y la recurrencia oncológica, fue realizado por Exadaktylos y cols. (42) en 2006. Este trabajo retrospectivo mostraba una reducción del 17 % del riesgo de recidiva del cáncer de mama, si la paciente recibía un bloqueo paravertebral (BPV). Este resultado no ha sido corroborado hasta ahora por ningún estudio prospectivo.
Looney y cols. (43) estudian prospectivamente 40 pacientes sometidas a cirugía de cáncer de mama, 20 con AG, sevoflurano y analgesia opioide y 20 con BPV y propofol. Se registra un mayor aumento de factor vascular de crecimiento endotelial (EVFG) en el grupo de AG. Pero el incremento es moderado y transitorio y no se registran las potenciales consecuencias clínicas. No se pueden excluir otros factores de confusión, como la hipotermia, el uso de AINE, β-bloqueantes o la intensidad del dolor postoperatorio. Pese a que in vitro se ha demostrado el poder angiogénico del VEGF, no se ha podido demostrar un valor predictivo de los niveles de VEGF en el cáncer de mama.
Discusión
Factores de confusión
Los diferentes resultados clínicos pueden deberse a múltiples factores de confusión (44), como distintos grados histológicos, radioterapia y quimioterapia previas, diversos grados de dificultad y de radicalidad quirúrgica, la presencia de anemia previa, sangrado, transfusión o hipotermia. También pueden existir diferencias entre las técnicas anestésicas y el uso o no de la analgesia epidural en el intraoperatorio. La administración de fármacos potencialmente inmunoprotectores, como AINE, tramadol, β-bloqueantes y estatinas pueden contribuir a enmascarar los resultados.
Por otro lado, todos los estudios de procedimientos quirúrgicos con AE van asociados ineludiblemente a AG, que puede ser inhalatoria o con propofol, lo cual puede alterar los resultados. Además, sabemos que la acción inmunoprotectora de la analgesia epidural, sólo es evidente si se inicia en el periodo intraoperatorio (23). Tenemos que contar con un 17-37 % de epidurales fallidas (45) y también con la heterogeneidad de fármacos, dosis y uso de PCA que se observa en las pautas analgésicas.
Existen, además, problemas metodológicos (12), como tamaños de muestra pequeños para un potencial efecto positivo inferior al 30 % (46), mezclas heterogéneas de pacientes, de procedimientos quirúrgicos y de series antiguas, dificultad para definir de una forma homogénea el grado de recidiva y finalmente la imposibilidad de aislar un efecto dentro del entorno perioperatorio complejo (47) y multifactorial.
La tendencia actual a diseñar estudios con gran número de pacientes (> 1.000) (48) se basa en la incidencia cada vez menor de los eventos estudiados. Así, por ejemplo, para encontrar un efecto positivo de un 15 % de reducción de riesgo de un evento, cifra muy real en oncología, se necesitarían 10.850 pacientes.
El uso de la quimioterapia y/o radioterapia puede ser precoz o tardía y alterar con ello los resultados. Puede iniciarse en el periodo preoperatorio, como terapia coadyuvante, y disminuir o eliminar completamente el tumor. En este caso, el grado de diseminación tumoral será mínimo, con lo que también disminuirá la probabilidad de diseminación metastásica. La expansión de las terapias coadyuvantes preoperatorias, introduce una nueva variable a explorar en el campo de la inmunosupresión perioperatoria.
La introducción de la laparoscopia y la cirugía mínimamente invasiva ha cambiado radicalmente los resultados postoperatorios (49). La laparoscopia se asocia a una disminución de la mortalidad (OR 0,33), de la infección de la herida quirúrgica (OR 0,65 %), del íleo postoperatorio (38,8 %), de las pérdida hemáticas y de la estancia media.
El impacto de la laparoscopia en el dolor postoperatorio es también significativo, observándose una disminución media de un 34,8 % en el dolor en reposo, de un 33,9 % en el dolor al movimiento (50) y una reducción de un 37 % en el consumo de opioides, comparado con la laparotomía. Esta disminución de los requerimientos analgésicos, nos obliga a replantear la indicación de la analgesia epidural en la cirugía laparoscópica (51).
Todos los estudios, excepto el de Day (32), se han realizado con cirugía abierta. Por otro lado, hoy en día se considera el abordaje laparoscópico como la mejor estrategia perioperatoria en la cirugía colorrectal (52). Se ha demostrado que la cirugía laparoscópica produce una menor respuesta al estrés, por lo que cambia totalmente el escenario inmunitario (53,54) de la agresión quirúrgica de la laparotomía. Por ello, hacen falta nuevos estudios (55) que relacionen los factores perioperatorios inmunoprotectores con las técnicas mínimamente invasivas (8).
Futuros ensayos
Se hace patente la necesidad de estudios prospectivos, ajustados a las múltiples variables oncológicas de los pacientes y que estandaricen al máximo las técnicas anestésicas y quirúrgicas, los fármacos y los factores perioperatorios, que puedan enmascarar los resultados.
En la actualidad están en marcha 11 ensayos prospectivos para valorar los efectos de la anestesia/analgesia regional en el cáncer de mama, pulmón, colorrectal, endometrial y en el melanoma. También hay en marcha un ECA para comparar los efectos inmunomoduladores del propofol y los anestésicos inhalatorios.
Mostramos en la tabla IV, los detalles de algunos de los ensayos en marcha, registrados en ClinicalTrials.gov con las siguientes palabras de búsqueda: cancer recurrence and anesthesia.
Los resultados tardarán entre 3 y 5 años en ser publicados, dado el obligado largo seguimiento que precisan los estudios de supervivencia oncológica.
Medidas perioperatorias inmunoprotectoras
A la vista de los resultados controvertidos, se plantean algunas preguntas pendientes de resolver.
Es importante evaluar la relevancia clínica de las potenciales diferencias de supervivencia que puede aportar una u otra técnica anestésica. Esta es una pregunta frecuente en oncología, no sólo en términos de tiempo, sino también en calidad de vida.
Dado que la inmunosupresión perioperatoria es un fenómeno transitorio, se produce una ventana terapéutica (9) que no está bien definida. No sabemos cuál sería el mejor momento de actuación, preoperatorio, intra o postoperatorio.
Tampoco está definido el tiempo mínimo de exposición a un anestésico o a una analgesia regional para que sean valorables los resultados.
Dada la complejidad de la respuesta inmunitaria perioperatoria, es difícil definir las dianas terapéuticas prioritarias. Parece ser que la inmunidad celular (17) y la actividad de todas las diversas estirpes de células citotóxicas (56) son los factores inmunoprotectores más importantes.
Una dificultad añadida al campo de investigación perioperatoria es la interacción farmacológica. Es imposible estudiar los efectos independientes de los fármacos en el entorno clínico quirúrgico. Por ello los estudios deberán tener en cuenta las posibles interacciones que puedan alterar sus resultados.
El futuro de las terapias inmunomoduladoras es prometedor. Se está estudiando la administración de inmunoestimulantes (15), como la IL-12 y la IL-2.
El papel de los antagonistas de los receptores opioides µ (MOR) en la terapia antitumoral es un área de investigación clínica en desarrollo. La metilnaltrexona bloquea la acción inmunosupresora de los opioides (19). Además, se ha demostrado una acción potenciadora de los quimioterápicos (21,57) independiente de la presencia de opioides.
Se está ensayando en estudios con animales el potencial efecto inmunoprotector de los bloqueantes del VEGF (57).
Están planteadas una batería de medidas potencialmente inmunoprotectoras (1,30), pendientes de que se demuestre su efectividad y su relevancia clínica. Entre ellas destacamos las siguientes: minimizar la respuesta al estrés, la premedicación, mantener la normotermia, la anestesia-analgesia regional, el uso de propofol, minimizar la administración de opioides y anestésicos inhalatorios, la prevención de la anemia y el ahorro de transfusiones, la administración de tramadol, AINE, β-bloqueantes y estatinas, la neoadyuvancia y las técnicas quirúrgicas mínimamente invasivas.
Estas medidas podrían formar parte de un Plan Anestésico Inmunoprotector, tal como proponen algunos autores (12,13). Neeman y cols. (58) plantean la posibilidad de un doble bloqueo farmacológico inmunoprotector con β-bloqueantes y antiCOX2, en un ensayo (NCT00888797), cuyos resultados se esperan en enero de 2017.
Conclusiones
Quedan muchas preguntas pendientes en el campo de las técnicas anestésicas y la inmunomodulación, a la espera de ensayos prospectivos que acabarán dentro de 3 a 7 años. Los nuevos abordajes laparoscópicos, la cirugía mínimamente invasiva y la neoadyuvancia han cambiado radicalmente el grado de agresión quirúrgica y probablemente también el impacto de las técnicas anestésicas inmunoprotectoras en la recurrencia quirúrgica.
En la actualidad no hay evidencia que apoye una técnica anestésica sobre otra en la supervivencia oncológica.
Bibliografía
1. Gottschalk A, Sharma S, Ford J, Durieux ME, Tiouririne M. The role of the perioperative period in recurrence after cancer surgery. Anesth Analg 2010;110:1636-43. [ Links ]
2. Shakhar G, Ben-Eliyahu S. Potential prophylactic measures against postoperative immunosuppression: Could they reduce recurrence rates in oncological patients? Ann Surg Oncol 2003;10:972-92. [ Links ]
3. Bar-Yosef S, Melamed R, Page GG, Shakhar G, Shakhar K, Ben-Eliyahu S. Attenuation of the tumor-promoting effect of surgery by spinal blockade in rats. Anesthesiology 2001;94:1066-73. [ Links ]
4. Gomez-Flores R, Weber RJ. Differential effects of buprenorphine and morphine on immune and neuroendocrine functions following acute administration in the rat mesencephalon periaqueductal gray. Immunopharmacology 2000;48:145-56. [ Links ]
5. Melamed R, Bar-Yosef S, Shakhar G, Shakhar K, Ben-Eliyahu S. Suppression of natural killer cell activity and promotion of tumor metastasis by ketamine, thiopental, and halothane, but not by propofol: Mediating mechanisms and prophylactic measures. Anesth Analg 2003;97:1331-9. [ Links ]
6. Inada T, Yamanouchi Y, Jomura S, Sakamoto S, Takahashi M, Kambara T, et al. Effect of propofol and isoflurane anaesthesia on the immune response to surgery. Anaesthesia 2004;59:954-9. [ Links ]
7. Melamed R, Rosenne E, Shakhar K, Schwartz Y, Abudarham N, Ben-Eliyahu S. Marginating pulmonary-NK activity and resistance to experimental tumor metastasis: Suppression by surgery and the prophylactic use of a beta-adrenergic antagonist and a prostaglandin synthesis inhibitor. Brain Behav Immun 2005;19:114-26. [ Links ]
8. Snyder GL, Greenberg S. Effect of anaesthetic technique and other perioperative factors on cancer recurrence. Br J Anaesth 2010;105(2):106-15. [ Links ]
9. Yeager MP, Rosenkranz KM. Cancer recurrence after surgery a role for regional anesthesia? Regional Anesthesia and Pain Medicine 2010;35(6):483-4. [ Links ]
10. Sacerdote P, Bianchi M, Gaspani L, Manfredi B, Maucione A, Terno G, et al. The effects of tramadol and morphine on immune responses and pain after surgery in cancer patients. Anesth Analg 2000;90:1411-4. [ Links ]
11. Poynter JN, Gruber SB, Higgins PD, Almog R, Bonner JD, Rennert HS, et al. Statins and the risk of colorectal cancer. N Engl J Med 2005;352:2184-92. [ Links ]
12. Heaney A, Buggy DJ. Can anaesthetic and analgesic techniques affect cancer recurrence or metastasis? Br J Anaesth 2012;109(Supl. 1):i17-i28. [ Links ]
13. Tavare AN, Perry NJ, Benzonana LL, Takata M, Ma D. Cancer recurrence after surgery: direct and indirect effects of anesthetic agents. Int J Cancer 2012;130(6):1237-50. [ Links ]
14. Moselli NM, Baricocchi E, Ribero D, Sottile A, Suita L, Debernardi F. Intraoperative epidural analgesia prevents the early proinflammatory response to surgical trauma. Results from a prospective randomized clinical trial of intraoperative epidural versus general analgesia. Ann Surg Oncol 2011;18(10):2722-31. [ Links ]
15. Hogan BV, Peter MB, Shenoy HG, Horgan K, Hughes TA. Surgery induced immunosuppression. Surgeon 2011;9(1):38-43. [ Links ]
16. Liljefors M, Nilsson B, Hjelm Skog AL, Ragnhammar P, Mellstedt H, Frodin JE. Natural killer (NK) cell function is a strong prognostic factor in colorectal carcinoma patients treated with the monoclonal antibody 17-1A. Int J Cancer 2003;105:717-23. [ Links ]
17. Neeman, E., Ben-Eliyahu, S. Surgery and stress promote cancer metastasis: New outlooks on perioperative mediating mechanisms and immune involvement. Brain Behav Immun 2012. Available at: http://dx.doi.org/10.1016/j.bbi.2012.03.006. [ Links ]
18. Langley RR, Fidler IJ. The seed and soil hypothesis revisited -the role of tumor-stroma interactions in metastasis to different organs. Int J Cancer 2011;128:2527-35. [ Links ]
19. Afsharimani B, Cabot PJ, Parat MO. Morphine use in cancer surgery. Front Pharmacol 2011;2:46. [ Links ]
20. Afsharimani B, Cabot PJ, Parat MO. Morphine and tumor growth and metastasis. Cancer Metastasis Rev 2011;30:225-38. [ Links ]
21. Mathew B, Lennon FE, Siegler J, Mirzapoiazova T, Mambetsariev N, Sammani S, et al. The novel role of the mu opioid receptor in lung cancer progression: A laboratory investigation. Anesth Analg 2011;112(3):558-67. [ Links ]
22. Lin L, Liu C, Tan H, Ouyang H, Zhang Y, Zeng W. Anaesthetic technique may affect prognosis for ovarian serous adenocarcinoma: A retrospective analysis. Br J Anaesth 2011;106(6):814-22. [ Links ]
23. de Oliveira GS Jr, Ahmad S, Schink JC, Singh DK, Fitzgerald PC, McCarthy RJ. Intraoperative neuraxial anesthesia but not postoperative neuraxial analgesia is associated with increased relapse-free survival in ovarian cancer patients after primary cytoreductive surgery. Reg Anesth Pain Med 2011;36(3):271-7. [ Links ]
24. Capmas P, Billard V, Gouy S, Lhommé C, Pautier P, Morice P, et al. Impact of epidural analgesia on survival in patients undergoing complete cytoreductive surgery for ovarian cancer. Anticancer Res 2012;32(4):1537-42. [ Links ]
25. Dong H, Zhang Y, Xi H. The effects of epidural anaesthesia and analgesia on natural killer cell cytotoxicity and cytokine response in patients with epithelial ovarian cancer undergoing radical resection. J Int Med Res 2012;40(5):1822-9. [ Links ]
26. Lai R, Peng Z, Chen D, Wang X, Xing W, Zeng W, et al. The effects of anesthetic technique on cancer recurrence in percutaneous radiofrequency ablation of small hepatocellular carcinoma. Anesth Analg 2012;114(2):290-6. [ Links ]
27. Ismail H, Ho KM, Narayan K, Kondalsamy-Chennakesavan S. Effect of neuraxial anaesthesia on tumour progression in cervical cancer patients treated with brachytherapy: A retrospective cohort study. Br J Anaesth 2010;105:145-9. [ Links ]
28. Gottschalk A, Ford JG, Regelin CC, You J, Mascha EJ, Sessler DI, et al. Association between epidural analgesia and cancer recurrence after colorectal cancer surgery. Anesthesiology 2010;113:27-34. [ Links ]
29. Gupta A, Björnsson A, Fredriksson M, Hallböök O, Eintrei C. Reduction in mortality after epidural anaesthesia and analgesia in patients undergoing rectal but not colonic cancer surgery: A retrospective analysis of data from 655 patients in Central Sweden. Br J Anaesth 2011; 107(2):164-70. [ Links ]
30. Cummings KC III, Xu F, Cummings LC, Cooper GS. A comparison of epidural analgesia and traditional pain management effects on survival and cancer recurrence after colectomy: A population based study. Anesthesiology 2012;116: 797-806. [ Links ]
31. Moselli NM, Baricocchi E, Ribero D, Sottile A, Suita L, Debernardi F. Intraoperative epidural analgesia prevents the early proinflammatory response to surgical trauma. Results from a prospective randomized clinical trial of intraoperative epidural versus general analgesia. Ann Surg Oncol 2011;18(10):2722-31. [ Links ]
32. Day A, Smith R, Jourdan I, Fawcett W, Scott M, Rockall T. Retrospective analysis of the effect of postoperative analgesia on survival in patients after laparoscopic resection of colorectal cancer. Br J Anaesth 2012;109(2):185-90. [ Links ]
33. Christopherson R. Long-term survival after colon cancer surgery: A variation associated with choice of anesthesia. Anesth Analg 2008;107(1):325-32. [ Links ]
34. Myles PS, Peyton P, Silbert B, Hunt J, Rigg JR, Sessler DI; ANZCA Trials Group Investigators. Perioperative epidural analgesia for major abdominal surgery for cancer and recurrence-free survival: Randomised trial. BMJ 2011;342. [ Links ]
35. Peyton PJ, Myles PS, Silbert BS, Rigg JRA, Jamrozik K, Parsons RW, et al. Perioperative epidural analgesia and outcome after major abdominal surgery in high risk patients. Anesth Analg 2003;96:548-54. [ Links ]
36. Biki B, Mascha E, Moriarty DC, Fitzpatrick JM, Sessler DI, Buggy DJ. Anesthetic technique for radical prostatectomy surgery affects cancer recurrence: A retrospective analysis. Anesthesiology 2008;109:180-7. [ Links ]
37. Wuethrich PY, Hsu Schmitz SF, Kessler TM, Thalmann GN, Studer UE, Stueber F, et al. Potential influence of the anesthetic technique used during open radical prostatectomy on prostate cancer-related outcome: A retrospective study. Anesthesiology 2010;113:570-6. [ Links ]
38. Forget P, Tombal B, Scholtès JL, Nzimbala J, Meulders C, Legrand C, et al. Do intraoperative analgesics influence oncological outcomes after radical prostatectomy for prostate cancer? Eur J Anaesthesiol 2011;28(12):830-5. [ Links ]
39. Tsui BC, Rashiq S, Schopflocher D, Murtha A, Broemling S, Pillay J, et al. Epidural anesthesia and cancer recurrence rates after radical prostatectomy. Can J Anaesth 2010;57(2):107-12. [ Links ]
40. Schlagenhauff B, Ellwanger U, Breuninger H, Stroebel W, Rassner G, Garbe C. Prognostic impact of the type of anaesthesia used during the excision of primary cutaneous melanoma. Melanoma Res 2000;10:165-9. [ Links ]
41. Gottschalk A, Brodner G, Van Aken HK, Ellger B, Althaus S, Schulze HJ. Can regional anaesthesia for lymph-node dissection improve the prognosis in malignant melanoma? British Journal of Anaesthesia 2012;109(2):253-9. [ Links ]
42. Exadaktylos AK. Can anesthetic technique for primary breast cancer surgery affect recurrence or metastasis? Anesthesiology 2006;105(4):660-4. [ Links ]
43. Looney M, Doran P, Buggy D. Effect of anesthetic technique on serum vascular endothelial growth factor c and transforming growth factor in women undergoing anesthesia and surgery for breast cancer. Anesthesiology 2010;113:1118-25. [ Links ]
44. Beloeil H, Nouette-Gaulain K. The perioperative period in cancer surgery: A critical moment! Is there a role for regional anesthesia in preventing cancer recurrence? Ann Fr Anesth Reanim 2012;31(6):528-36. [ Links ]
45. Esteve N, Rosario E, Gimenez I, Montero F, Baena M, Ferrer A. Seguridad y efectividad del tratamiento del dolor agudo postoperatorio: seguimiento de 3670 pacientes. Rev Esp Anestesiol Reanim 2008;55:541-7. [ Links ]
46. Tsui BC, Green JS. Type of anaesthesia during cancer surgery and cancer recurrence. BMJ 2011;342:d1605. [ Links ]
47. Esteve N, Valdivia J, Ferrer A, Ribera H, Garrido P. ¿Influyen las técnicas anestésicas en los resultados postoperatorios? Parte II Rev Esp Anestesiol Reanim 2013;60(2):93-102. [ Links ]
48. Sessler D, Devereaux OJ. Emerging trends in clinical trial design. Anesth Analg 2013;116-1:258-61. [ Links ]
49. Tjandra JJ, Chan MKY. Systematic review on the short-term outcome of laparoscopic resection for colon and rectosigmoid cancer. Colorectal Disease 2006;8:375-88. [ Links ]
50. Abraham NS, Byrne CM, Young JM, Solomon MJ. Meta-analysis of non-randomized comparative studies of the short-term outcomes of laparoscopic resection for colorectal cancer. ANZ J Surg 2007;77(7):508-16. [ Links ]
51. Niranjan N, Bolton T, Berry C. Enhanced recovery after surgery - current trends in perioperative care. Update in Anaesthesia 2010. Available at: www.anaesthesiologists.org. [ Links ]
52. Vlug MS, Wind J, Hollmann MW, Ubbink DT, Cense HA, Engel AF, et al.; LAFA Study Group. Laparoscopy in combination with fast track multimodal management is the best perioperative strategy in patients undergoing colonic surgery: A randomized clinical trial (LAFA-study). Ann Surg 2011;254(6):868-75. [ Links ]
53. Wichmann MW, Hüttl TP, Winter H, Spelsberg F, Angele MK, Heiss MM, et al. Immunological effects of laparoscopic vs open colorectal surgery: a prospective clinical study. Arch Surg 2005;140(7):692-7. [ Links ]
54. Veenhof AA, Vlug MS, van der Pas MH, Sietses C, van der Peet DL, de Lange-de Klerk ES, et al. Surgical stress response and postoperative immune function after laparoscopy or open surgery with fast track or standard perioperative care: A randomized trial. Ann Surg 2012;255(2):216-21. [ Links ]
55. Goldfarb M, Brower S, Schwaitzberg SD. Minimally invasive surgery and cancer: controversies part 1. Surg Endosc 2010;24:304-34. [ Links ]
56. Orozco HD, Garutti I, Moraga FJ, Sánchez-Pedrosa G. Perioperative tumour dissemination. 1. Influence of perioperative factors. Rev Esp Anestesiol Reanim 2012;59(5):259-66. [ Links ]
57. Singleton PA, Moss J. Effect of perioperative opioids on cancer recurrence: A hypothesis. Future Oncol 2010;6(8):1237-42. [ Links ]
58. Neeman E, Zmora O, Ben-Eliyahu S. A New approach to reducing postsurgical cancer recurrence: Perioperative targeting of catecholamines and prostaglandins. Clin Cancer Res 2012;18(18);4895-902. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Neus Esteve Pérez
Servicio de Anestesiología, Reanimación y Terapia del Dolor
Hospital Universitario Son Espases
Servei de Salut - Govern de les Illes Balears
Crta. de Valldemossa, 79
07010 Palma de Mallorca, Illes Balears
e-mail: neus.esteve@ssib.es
Recibido: 20-03-13.
Aceptado: 30-06-13.