INTRODUCCIÓN
El dolor crónico afecta alrededor del 30 % de la población en países desarrollados 1. La neuroestimulación medular (NM) es una forma de tratamiento del dolor crónico que ha demostrado su efectividad en pacientes que han respondido mal a otras terapias. La NM consiste en la implantación de uno o varios electrodos epidurales en las columnas posteriores de la médula espinal al nivel de los dermatomas en los que se quiere conseguir el efecto analgésico2.
En 1959, el neurocirujano Willem Noordenbos informó que la señal transportada a lo largo de las fibras gruesas para tacto, presión y vibración podría inhibir la señal de dolor transportada por fibras más finas3. Sería en 1965 cuando Melzack y Wall introducirían la clásica teoría de la compuerta. Ellos propusieron que los estímulos dolorosos son transmitidos a la segunda neurona de la vía del dolor en el cuerno posterior de la médula espinal, lugar en el que convergen múltiples neuronas periféricas a una única neurona. De acuerdo con su teoría, la estimulación de las fibras Aß, mileniziadas y no nociceptivas, inhiben la transmisión del dolor por parte de las fibras Aδ y C4.
El desarrollo de los dispositivos de estimulación de la médula espinal fue una de las consecuencias de la introducción de la teoría de la compuerta, dando sus primeros pasos en 1967 con la implantación de electrodos por primera vez en un paciente humano por parte de Shealy y cols. (4. El primer dispositivo completamente implantable se desarrolló en 1970 y los primeros ensayos clínicos sobre pacientes con dolor crónico intratable se llevaron a cabo a principios de los años 704. Los dispositivos han evolucionado con el paso de los años, existiendo a día de hoy gran variedad de sistemas que incluyen electrodos monopolares, bipolares, cilíndricos; además de terapias de estimulación convencional, alta frecuencia o ráfagas (burst, entre otros5,6. A pesar de que la mayor evidencia se refiere a la terapia convencional, cada vez más estudios se orientan a dar evidencia a los nuevos modos de terapia para poder discernir las mejores indicaciones en cada caso. Han pasado 50 años desde el implante del primer neuroestimulador, implantándose a día de hoy más de 50.000 neuroestimuladores al año 7 en el mundo.
Las indicaciones actuales para los dispositivos de NM son muy variadas. La International Neuromodulation Society (INS) establece unas recomendaciones 6 en las que puede estar indicada la terapia mediante NM en el dolor crónico común incluyendo: 1) el dolor axial por síndrome de cirugía fallida de espalda o por dolor radicular; 2) dolor neuropático incluyendo la neuropatía diabética, neuropatía por VIH, síndrome de dolor regional complejo (SDRC), neuralgia postherpética, neuralgia intercostal, dolor de miembro fantasma, neuropatía compresiva, dolor pélvico y lesión medular; 3) el dolor vascular que engloba la angina crónica refractaria, insuficiencia cardiaca, dolor isquémico por vasculopatía periférica y el síndrome de Raynaud.
La mejoría que proporciona la NM puede ser muy variable en función de la terapia y del origen del dolor. El dolor crónico lumbar es una de las principales indicaciones de implante de dispositivos. Podemos diferenciar estos pacientes en dos grupos en función de si tiene o no cirugía espinal previa. El tratamiento con NM ha mostrado mejorar el dolor en ambos grupos entre el 48-55 % 8, alcanzando hasta el 80 % 8,9 con terapia de alta frecuencia. Otras entidades, como el síndrome de dolor regional complejo (SDRC), experimentan una mejoría superior al 50 % en el 73 % de los pacientes sometidos a esta terapia 10. Respecto al tratamiento de la patología vascular (tanto periférica como anginosa), los estudios muestran una mejoría de más del 50 % del dolor entre el 85-88 % de los pacientes, además de aumentar el flujo sanguíneo y reducir el número de amputaciones 11.
El objetivo de nuestro estudio es analizar las indicaciones diagnósticas de la terapia con NM durante los últimos 5 años en nuestro hospital, conocer cuáles son las causas de dolor más frecuentes para la indicación del implante del dispositivo, así como estudiar la relación con el género y la edad. Además, objetivos secundarios del estudio son analizar la mejoría descrita por los pacientes tras el implante del neuroestimulador y describir la relación que esta tiene con el resto de variables.
MATERIAL Y MÉTODOS
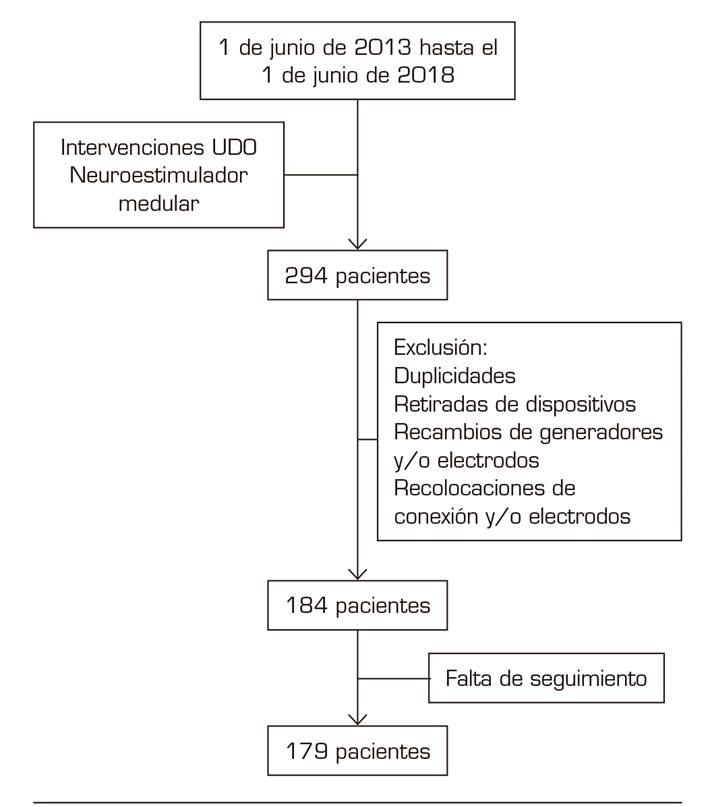
Se trata de un estudio observacional, descriptivo y retrospectivo. Los pacientes fueron identificados desde el registro de actividad quirúrgica de la Unidad del Dolor del Hospital General de Valencia. El estudio fue aprobado por el comité de ética del hospital. Se incluyeron los pacientes sometidos a cirugía de implante de neuroestimulador medular definitivo. Tras un primer tiempo los pacientes se sometieron a un periodo de prueba con un generador externo. La indicación del implante definitivo se basó en una mejoría mayor o igual al 50 %. El periodo de inclusión fue desde el 1 de junio de 2013 hasta el 1 de junio de 2018. Se identificaron 294 pacientes. Se excluyeron del análisis las duplicidades por 2 tiempos de cirugía, las retiradas de dispositivos, recambios de generadores y/o electrodos y las recolocaciones de conexión y/o electrodos. Posteriormente se eliminaron del estudio 5 pacientes por falta de seguimiento. El número final de pacientes incluidos fue de 179 (Figura 1). Se configuró una base de datos incluyendo como variables la intervención realizada, fecha de la intervención, sexo y edad del paciente, mejoría descrita por el paciente en forma de porcentaje a los 6 meses del implante del dispositivo y diagnóstico por el que se realiza la terapia. Los diagnósticos se dividieron en grupos: síndrome de cirugía fallida de espalda (SCFE), síndrome de dolor regional complejo (SDRC), dolor lumbar sin cirugía espinal previa o "espalda virgen" (que incluye síndrome facetario, lumbociatalgia o estenosis de canal), neuralgia/dolor neuropático, úlceras, dolor pélvico, cefalea, vasculopatía, cervicalgia y otros. El grupo "otros" incluye diagnósticos con una incidencia inferior al 1 % (hemiplejia, síndrome del miembro fantasma, angina no revascularizable y enfermedad de Raynaud.
Realizamos la estadística descriptiva de las variables clínico epidemiológicas. Para las variables cualitativas se calcularon las frecuencias absolutas en número y relativas en porcentaje sobre el total de casos y para las variables cuantitativas se describieron sus valores medios y desviaciones estándar. El análisis entre variables cuantitativas se realizó mediante el índice de correlación de Pearson. Para el análisis de variables cuantitativas con variables cualitativas se realizó la prueba T de Student. Se consideró una diferencia estadísticamente significativa a un valor p inferior a 0,05.
RESULTADOS
Los diagnósticos para indicar el implante de un neuroestimulador se muestran en la Tabla 1. El SCFE fue la indicación diagnóstica en 112 pacientes (62,57 %). El dolor lumbar sin cirugía espinal previa fue la indicación diagnóstica en 18 pacientes (10,05 %). El SDRC fue la indicación diagnóstica en 14 pacientes (7,82 %). La neuralgia o el dolor neuropático fue la indicación diagnóstica en 11 pacientes (6,15 %). La cervicalgia fue la indicación diagnóstica en 7 pacientes (3,91 %). El dolor pélvico fue la indicación diagnóstica en 5 pacientes (2,79 %). La vasculopatía periférica fue la indicación diagnóstica en 3 pacientes (1,68 %). El dolor por úlcera fue la indicación diagnóstica en 3 pacientes (1,68 %). La cefalea fue la indicación diagnóstica en 2 pacientes (1,12 %). Otros diagnósticos supusieron la indicación en 4 pacientes (2,23 %). El 55,86 % fueron mujeres (100 pacientes) frente al 44,14 %, que fueron varones (79 pacientes). La edad media de los pacientes sometidos a implante de neuroestimulador fue de53,6 ± 11 años. La Figura 2 muestra la distribución de las edades por año. La edad media de los pacientes con SCFE de la muestra fue 53,37 años, similar a la del grupo con diagnósticos distintos que fue de 53,65 años. La media del porcentaje de mejoría descrita por los pacientes fue de 47,99 ± 27,3 % a los 6 meses del implante del NM. El porcentaje de mejoría no está determinado por la edad de los pacientes, siendo el índice de correlación de Pearson de -0,014 (Figura 3). Respecto al género, tampoco se observaron diferencias en la mejoría (Figura 4) siendo la media para mujeres del 46,9 ± 28 % y para hombres 49,3 ± 26,4 %. T de Student 0,57 (valor P 0,568). Tampoco se detectaron diferencias en la mejoría en función de la indicación diagnóstica, siendo para el SCFE del 49,02 ± 25,89 % y para el conjunto del resto de indicaciones 46,23 ± 29,71 %, con un valor p de 0,514.
Tabla I.

SCFE: síndrome de cirugía fallida de espalda. SDRC: síndrome de dolor regional complejo. No PQ: no postquirúrgico.
DISCUSIÓN
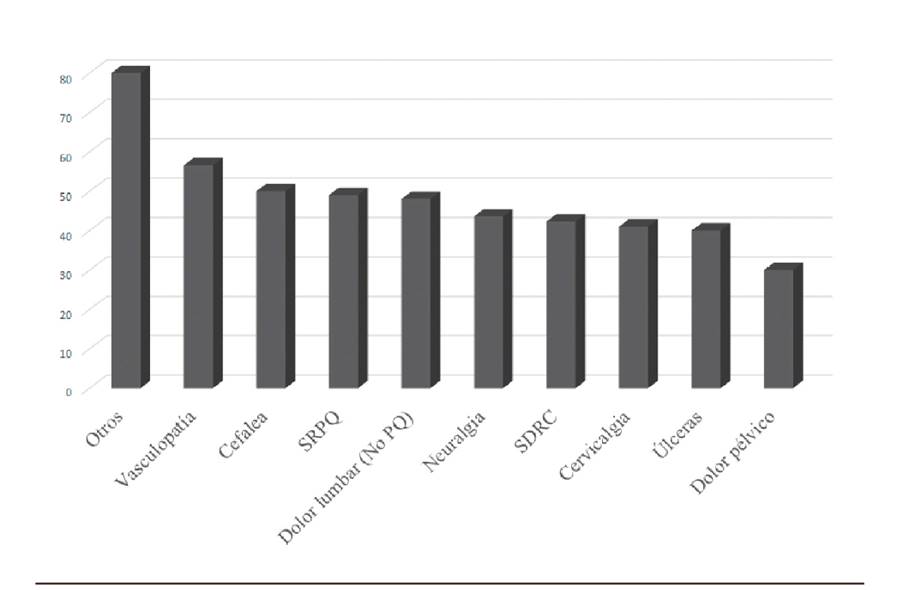
La neuroestimulación de la médula espinal es una terapia para el tratamiento del dolor crónico con elevada evidencia 6 que, unido a los resultados favorables demostrados en análisis coste-efectividad a largo plazo 5,6, hace que sea un tratamiento indicado en muchas situaciones. En nuestro estudio hemos observado hasta 15 indicaciones diagnósticas diferentes para la implantación de este dispositivo. A pesar de la variabilidad de diagnósticos en los que puede estar indicada esta terapia, es destacable que en más de la mitad de los casos (62 %) la indicación es por SCFE. La incidencia de esta entidad tras una cirugía de columna es de 5-40 % y la eficacia de la neuroestimulación en el control del dolor está demostrada 8,9,12. En el análisis de la edad no se observó variabilidad en relación con el diagnóstico ni con la evolución en el tiempo. El porcentaje de mejoría medio fue cercano al 50 % (47,99 %). Esta variable expresada en porcentaje nos aporta mucho valor en la clínica. Si bien es cierto que el empleo de una escala numérica sería más apropiada en la investigación, se ha visto que el porcentaje de mejoría o la impresión global de cambio por parte de los pacientes guardan una buena relación con las escalas numéricas en el tratamiento del dolor crónico 13 14-15. La mejoría de los pacientes no está influenciada por la edad ni por el género en nuestro estudio. La mejoría respecto a la indicación diagnóstica se muestra en la Figura 5. Esta mejoría presenta una importante variabilidad en función del diagnóstico por el que fue indicado el implante, sin que se detectaran diferencias significativas entre la indicación mayoritaria respecto al resto. La enfermedad vascular (ya sea coronaria o periférica) es una de las indicaciones que presentó mayor índice de mejoría, como ya se ha demostrado en diversos estudios 6,16,17. No obstante, y pese a la evidencia al respecto, llama la atención el bajo número de pacientes referidos desde estos servicios a nuestra unidad para considerar la terapia con NM. La mejoría que presentaron los pacientes con dolor crónico lumbar (tanto si presentaban cirugía previa como si no) se sitúa en torno al 50 %, siendo similar a la mejoría reportada en otros estudios8,9. No obstante, si analizamos por subgrupos la etiología del dolor lumbar, llama la atención el bajo porcentaje de mejoría en pacientes con síndrome facetario (27,5 %) respecto al resto de pacientes con dolor lumbar (53,88 %). Se estima que el síndrome facetario representa el 27-40 % del dolor lumbar crónico 18. Hay muchas terapias disponibles que han demostrado alta efectividad para tratar este síndrome, sin embargo en nuestro estudio hemos visto que el implante del neuroestimulador no proporciona una mejoría importante en los pacientes.
A pesar de que varios estudios16 muestran porcentajes de mejoría superiores al nuestro, debe tenerse en cuenta que influyen muchos factores (tratamiento analgésico, condición psicológica, tipo de terapia) que no han sido analizados en este estudio, pudiendo suponer una limitación del mismo.











 text in
text in