INTRODUCCIÓN
La neuropatía ciática es una patología que ocasiona disfunciones motoras, reflejas y sensoriales en la extremidad afectada, especialmente en la zona distal1. Algunos síntomas frecuentes son debilidad, parestesias, el llamado pie caído (una alteración neuromuscular que afecta a varios movimientos del pie, dificultando la marcha) y contracturas y deformaciones como los dedos en garra. Entre las causas de la neuropatía se encuentran los traumas, las intervenciones quirúrgicas2 y la inyección intramuscular de fármacos en la región glútea3-6.
El tratamiento de los dedos en garra suele ser conservador (suelas ortopédicas, fisioterapia) y, en casos resistentes, la cirugía7, siendo una técnica frecuente la inmovilización interna percutánea mediante agujas de Kirschner7,8. Una de las principales desventajas de esta técnica es el riesgo de infección, con tasas de prevalencia que se sitúan entre el 0,5% y el 18%7,9,10.
La infección de la herida quirúrgica (IHQ) es un fenómeno con una prevalencia global en España de entre el 1% y el 11%, según el tipo de cirugía considerada y la patología previa del paciente11. El informe EPINE 201612 aporta una prevalencia del 2,01% de IHQ en cirugías limpias. En un estudio multicéntrico reciente13, las curas de heridas quirúrgicas representaron un 43,3% del tiempo total dedicado a curas en la consulta de enfermería de atención primaria (AP) en un área urbana española. Las curas, en conjunto, suponen un 12,5% de los motivos de consulta14 y en torno a un 39% del tiempo total de la consulta de enfermería13.
HISTORIA CLÍNICA
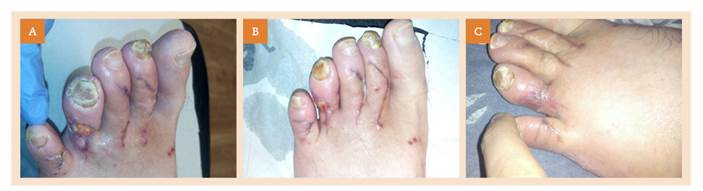
Se presenta el caso de un paciente de 26 años afectado de neuropatía ciática en la pierna izquierda. Padece el síndrome del pie caído, con síntomas de hipoestesia y parestesias distales. Refiere un origen iatrogénico de la neuropatía, por administración de una vacuna en la zona glútea en su infancia. Se ha sometido a lo largo de los años a varias cirugías en la extremidad afectada; la más reciente, a finales de junio de 2017 por dedos en garra. Unos 20 días después de esta intervención, en revisión con cirugía, se retiran las agujas de Kirschner implantadas en los dedos segundo a quinto del pie (fig. 1 A) y se pauta cura diaria a realizar por el propio paciente en domicilio mediante inmersión del pie en agua con povidona yodada.
Cuatro días más tarde, el paciente acude al centro de salud por evolución tórpida de las heridas quirúrgicas y es derivado a la consulta de enfermería.
EXPLORACIÓN Y DIAGNÓSTICO
La valoración enfermera por patrones funcionales de Gordon muestra a un paciente joven con buen estado general, somatometría en rango y buenos hábitos dietéticos, sin alteraciones de interés más allá de las reflejadas en el plan de cuidados (tabla 1).
En la exploración física se aprecia edema leve sin fóvea en el tercio distal de la extremidad izquierda asociado a una ligera dermatitis descamativa, sin otros cambios tróficos ni signos de insuficiencia venosa. Se descarta insuficiencia arterial mediante realización de índice tobillo-brazo con ecógrafo Doppler.
El pie afectado muestra heridas de diversa gravedad en la cara dorsal de los dedos 2.º a 5.º, coincidentes con dehiscencia en las zonas de incisión quirúrgica. La herida más extensa y profunda se encuentra en la cara dorsolateral externa del cuarto dedo (fig. 1 B), con presencia de abundante tejido necrótico y signos de infección local (eritema, mal olor, rubor). El dolor no es valorable por la hipoestesia asociada a la patología de base del paciente. Aparecen también lesiones por humedad en varios espacios interdigitales y hematomas en la punta de los dedos 2.º a 5.º que coinciden con las zonas de inserción de las agujas de Kirschner. No se aprecia fiebre, celulitis ni otros signos de progresión a infección sistémica.
El paciente no refiere dolor ni antes ni durante el tratamiento, no precisando analgesia para curas o desbridamiento. Verbaliza, sin embargo, sentimientos de desesperanza por la evolución de las lesiones y por una posible amputación del cuarto dedo.
TRATAMIENTO Y EVOLUCIÓN
El tratamiento del caso se realizó durante 8 semanas en verano de 2016. Se planteó como objetivo el cierre de las heridas por segunda intención y la recuperación de la funcionalidad basal de la zona.
Comenzamos el tratamiento abordando la infección. En valoración conjunta con la médica de familia, se decide iniciar pauta de antibioticoterapia empírica (amoxicilina/ácido clavulánico 875 mg/125 mg, 10 días por vía oral) y ante la clínica dudosa se deriva para radiografía, sin encontrarse signos de osteomielitis. Se realiza desbridamiento cortante de tejido necrótico, previa antisepsia con clorhexidina, en dos sesiones hasta descubrir lecho de granulación (fig. 1 C). Se estableció una frecuencia diaria de curas, con alginato de plata como apósito primario, gasa de algodón como apósito secundario y protección de bordes con película barrera no irritante (PBNI). Se pacta con el paciente que guarde reposo relativo, realice elevación del miembro afectado en domicilio e hidratación de piel perilesional cada 12 horas sin manipular la cura.
Transcurridos 10 días, ante la lenta evolución de la herida principal en el 4.º dedo (fig. 2 A) y el aumento de tejido esfacelar en lecho se decide abordar la posible colonización crítica añadiendo a la cura fomentos con solución de polihexametileno biguanida con betaína (PHMB). Se deriva también al podólogo habitual del paciente para valorar la colocación de ortesis en 4.º dedo, pero este rechaza esta opción hasta la curación de la herida, por lo que se decide corregir la posición del 4.º dedo con la aplicación de un soporte textil (fig. 2 B) y el exceso de humedad con la aplicación de gasas interdigitales. Tras una semana se aprecia mejoría en la evolución de las heridas (fig. 2 C) y resolución de úlceras interdigitales. Comenzamos entonces a aplicar hidrocoloide extrafino en heridas de dorso de 2.º, 3.er y 5.º dedo, con apósito de alginato cálcico como primario si era preciso y cambio de apósitos en función del exudado. Se cambió la frecuencia de curas a cada 48 horas. El paciente deja progresivamente de verbalizar miedo a la amputación y comienza a mostrarse esperanzado con la posibilidad de curación completa.
Tras 3 semanas de tratamiento (fig. 2 D), la herida en 4.º dedo está granulada y epitelizada en un 75%, con presencia aún leve de esfacelo en lecho, y el resto de las heridas han culminado epitelización. Se inicia desbridamiento autolítico en 4.º dedo con alginato de plata e hidrocoloide extrafino, lográndose la desaparición del esfacelo (fig. 3 A) y granulación y epitelización progresivas (fig. 3 B).
En la última fase se retira el alginato de plata y se introduce colágeno en polvo para favorecer la granulación, espaciando la frecuencia de curas a una vez cada 72 horas. Transcurridas 6 semanas desde el inicio del tratamiento, el paciente solicita el alta por tener que regresar a su país de residencia, y ante el buen estado de la herida se pactan curas diarias autoadministradas (clorhexidina al 1% tras la ducha/baño). Dos semanas después, el paciente informa de epitelización completa (fig. 3 C).
DISCUSIÓN
En la bibliografía consultada sobre el abordaje de lesiones como las de nuestro caso encontramos multitud de artículos en revistas de cirugía y ortopedia en los que se recomienda antibioticoterapia oral en caso de infección7,15,16 y la aplicación de PHMB17 o clorhexidina al 2%18-22 para prevenir la IHQ, así como el desbridamiento cortante/quirúrgico en caso de infección de tejidos profundos. Respecto al tratamiento de la herida, nuestra estrategia se ha basado en recomendaciones de abordaje de IHQ como las publicadas por el Servicio Gallego de Salud23 y la World Union of Wound Healing Societies (WUWHS)24, donde se indica la antibioticoterapia oral en caso de infección y la aplicación de cura húmeda una vez resuelta esta, contemplando la opción de usar antimicrobianos tópicos (como apósitos de plata) en heridas con cierre por segunda intención y la descontaminación del lecho con PHMB. Otros documentos de referencia apoyan igualmente el uso de la cura húmeda25,26, apósitos de plata si hay signos claros de infección en heridas con lecho abierto26-28 y la aplicación de PHMB ante la sospecha de colonización crítica29.
En conclusión, consideramos que este caso evidencia la importancia de una prevención adecuada de la IHQ teniendo en cuenta las particularidades de cada paciente (como el riesgo de detección tardía de IHQ u otras complicaciones por hipoalgesia) y del abordaje holístico del tratamiento, considerando no solo factores clave para la buena evolución de la herida (desbridamiento, abordaje de colonización crítica, cura húmeda) sino sobre todo la propia vivencia del paciente, atendiendo sus preocupaciones y preferencias y favoreciendo la relación terapéutica que mejorará su adherencia y colaboración en la resolución de la herida.