My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.28 suppl.1 Pamplona 2005
Asma ocupacional
Occupational asthma
P. Cebollero1, E. Echegoyen2, M.A. Santolaria1
| RESUMEN Asma ocupacional es aquella entidad que se desarrolla por causas o condiciones derivadas de un determinado medio laboral y no por estímulos que se encuentran fuera del trabajo. El asma ocupacional constituye hoy en día la enfermedad respiratoria ocupacional más frecuente en la mayoría de los países industrializados y se calcula que la proporción de nuevos casos de asma atribuibles a la exposición laboral se sitúa en torno al 10-15%. Palabras clave. Asma. Enfermedades ocupacionales. Exposición laboral. | ABSTRACT Occupational asthma is an entity caused by conditions deriving from a certain work milieu and not from stimuli found outside the workplace. Nowadays, occupational asthma is the most frequent respiratory occupational disease in the majority of the industrialised countries and it is estimated that the proportion of new cases of asthma that can be attributed to exposure at work is around 10-15%. Key words. Asthma. Occupational diseases. Occupational exposure. |
| 1. Sección de Neumología. Hospital Virgen del Camino. Pamplona. 2. Sección de Alergología. Hospital Virgen del Camino. Pamplona. | Correspondencia: |
INTRODUCCIÓN
Se han establecido a lo largo del tiempo numerosas definiciones de asma ocupacional (AO). Atendiendo a sus implicaciones clínicas y medicolegales, esta entidad debería incluir sólo a los casos en los que pueda establecerse la relación de causalidad con la exposición a un lugar de trabajo o a una sustancia presente en el mismo. Quizás la más aceptada es la que adoptan Bernstein y col1,2 que definen el AO como la presencia de una limitación variable al flujo aéreo y de hiperreactividad bronquial atribuible a causas o condiciones derivadas de un determinado medio laboral y no a estímulos que se encuentran fuera del trabajo.
En el ambiente laboral podemos encontrar tanto agentes inductores como incitadores, siendo los primeros capaces de producir además de la instrucción bronquial, hiperreactividad inespecífica e inflamación, mientras que los segundos sólo producen obstrucción a menos que la exposición sea a altas dosis, produciéndose entonces un síndrome de disfunción reactiva de la vía aérea (RADS) y que es considerado por muchos autores parte del AO al no presentar siempre una reversibilidad completa del cuadro obstructivo.
Según los síntomas, aparezcan o no tras un período de latencia, se distinguen dos tipos de AO:
1) Inmunológico: tras período de latencia. Incluye dos subgrupos:
• Mediados por IgE: agentes de alto peso molecular (APM) y algunos de bajo peso molecular (BPM).
• No mediados por IgE: la mayoría de BPM.2) No inmunológico: sin período de latencia. RADS y de forma más amplia asma por irritantes.
El AO debe distinguirse del asma preexistente exacerbada por la exposición laboral que es aquella que empeora por la exposición a concentraciones no tóxicas de irritantes o por estímulos físicos ya que las consecuencias clinicopatológicas y el tratamiento médico y preventivo son diferentes3. Hay además una serie de síndromes o variantes que se relacionan con la actividad laboral.
Todas estas entidades podrían encuadrarse dentro del término "asma relacionado con el trabajo", cuyos rasgos diferenciales vienen esquematizados en la Tabla 1, tomada de Vandeplas y Malo2.
EPIDEMIOLOGÍA
Prevalencia
En los últimos años, a medida que otras patologías como la neumoconiosis han ido decreciendo, el AO ha ido aumentando4. Se ha convertido en la enfermedad respiratoria ocupacional más frecuente en la mayoría de los países industrializados. En distintos estudios se ha constatado que la proporción de nuevos casos de asma atribuible a la exposición laboral es alta y se sitúa en torno al 10-15%5. Se han hecho estudios en empresas concretas en determinados grupos de trabajo y también sobre la población general. La prevalencia estimada varía según la definición de AO, los elementos diagnósticos empleados, la obligatoriedad de la declaración o el objeto del estudio. Los realizados con cuestionario de síntomas a la población general tienden a sobrestimar la prevalencia, resultando muy sensibles pero poco específicos. Los estudios de prevalencia son útiles para analizar las poblaciones expuestas a nuevos agentes y en los países en donde el AO no está bien reconocida, no obstante se hace necesario unificar criterios de definición y de herramientas diagnósticas que permitan comparar resultados6.
Incidencia
Hay pocos estudios prospectivos. Destacan los realizados en trabajadores expuestos a enzimas7, sobre trabajadores de laboratorio, panaderos8 en los que se detectó una incidencia acumulada de sensibilización a harina y alfaamilasa del 10,1% y de síntomas respiratorios en el 9%. Gautrín y col9 estudiando trabajadores expuestos a animales de laboratorio encontraron que la tasa de sensibilización y la rinoconjuntivitis fue más alta en los 2 primeros años, si bien los síntomas respiratorios aparecieron sobre el tercer año. La incidencia de AO probable fue 2,7%. Los registros médicolegales son menos fiables pues buena parte de los pacientes no declaran la enfermedad por existir un mal sistema compensatorio en algunos casos o por temor al despido en otros. Uno de los mejores registros de este tipo es el finlandés, que es obligatorio y se acompaña de un buen sistema de compensación. La incidencia reflejada en el mismo es de 17,4/100.000 que es alta especialmente entre granjeros. Otros registros son los llamados centinelas en los que las declaraciones son de carácter voluntario. Dos de los más significativos son el SWORD10 realizado en el Reino Unido, y el SENSOR en 6 estados de EEUU, este último orientado a identificar casos centinela de agentes potencialmente peligrosos para así poder iniciar las medidas necesarias. Su objetivo, por tanto no es medir la incidencia11.
De todos estos estudios epidemiológicos en ocasiones se han derivado intervenciones que han permitido modificar la incidencia en diversos lugares de trabajo, como el realizado en la industria del detergente7, que demostró la drástica disminución de nuevos casos diagnosticados al excluir a trabajadores atópicos e instaurar un buen control ambiental. Se demostró también la efectividad de un programa de control combinado sobre el personal y la exposición a isocianatos en Ontario, Canadá12.
PATOGENIA
La aparición, incluso las características de cada tipo de asma ocupacional, pueden variar en función de la interacción de los agentes ambientales y la susceptibilidad individual. Respecto a los primeros actúan de diferente forma dependiendo de sus propias características, de la concentración y del tipo de fuente de exposición en el puesto de trabajo.
Tipos de agentes
1. Sustancias de alto peso molecular (APM). La mayoría son proteínas animales o vegetales. Parece que los que presentan actividad enzimática podrían potenciar la alergenicidad al facilitar el paso transepitelial del alérgeno13 aunque hay otras con actividad inhibitoria enzimática que pueden resultar también potentes alergenos. Estos agentes originan reacciones mediadas por IgE. Hay algunas sustancias de bajo peso molecular que unidos a proteínas transportadoras también pueden originar una reacción mediada por IgE.
2. Sustancias de bajo peso molecular (BPM). Son antígenos incompletos. Los que son capaces de producir AO tienen componentes electrofílicos altamente reactivos que son capaces de combinarse con grupos hidróxido, amino o tilo en las proteínas de la vía aérea14. Diversos estudios apuntan a que los isocianatos se conjugarían con la Keratina 1815 y con el glutation intracelular16.
Nivel de exposición
Estudios epidemiológicos ha demostrado que el nivel de exposición es un factor importante en el desarrollo del AO, de lo que se deduce que la prevención, controlando niveles es una medida altamente efectiva. Se sabe por ejemplo que la sensibilización IgE mediada de los trabajadores expuestos a harina es difícil que aparezca con concentraciones inferiores a 0,5 mg/mm3 17. Por el contrario parece que la exposición masiva al antígeno podría tener un efecto protector al modificar la respuesta Th2, como ocurre por ejemplo con los niños expuestos a mascotas.
Modo de exposición
Un mismo agente puede producir distintas sensibilizaciones dependiendo de la forma de inhalación18 como ocurre con la exposición a soja en las epidemias (sensibilización a alergenos de la cáscara) o en los panaderos (sensibilización por la harina).
Factores ambientales concomitantes como el tabaquismo se ha visto que pueden aumentar el riesgo de sensibilización; el ejemplo más claro es el aumento que produce entre los trabajadores con sales de platino19, en los que se observó un riesgo relativo del 5% para la positivación de las pruebas cutáneas entre los trabajadores fumadores frente a los trabajadores no fumadores. Experimentos hechos con primates parecen sugerir que la exposición a ozono puede potenciar la sensibilización a hexacloroplatino20.
Factores genéticos
Hay diversos estudios en los que se han encontrado marcadores genéticos que marcarían la susceptibilidad a padecer asma ocupacional como el haplotipo DQB10302 para el cedro rojo, y los HLA DRI y DR4 en el látex. Se ha encontrado también relación entre el asma por TDI y la presencia de variaciones en alelos de la glutation-S- transferasa21.
FISIOPATOLOGÍA
Mecanismo inmunológico
Mecanismo IgE medidado
Las sustancias de APM o los de BPM que se combinan con proteínas transportadoras al inhalarse se unen a la IgE específica de la superficie de las mastocitos y de los basófilos, desencadenando la cascada inflamatoria característica del asma.
Mecanismo no IgE mediado
Es el que producen la mayoría de las sustancias de BPM. Se trata con toda probabilidad de un mecanismo igualmente inmunitario en este caso probablemente de tipo celular. Los CD4 actuarían como células proinflamatorias secretoras de interleukinas, entre ellas la IL5, capaz de activar los eosinófilos (responsable de la respuesta tardía). El hallazgo de IgE específica a isocianato se ha asociado con asma de evolución más severa en un estudio de seguimiento durante 5 años en pacientes con AO por TDI22.
Mecanismo no inmunológico
Los isocianatos pueden producir deprivación del glutation intracelular lo que induce la producción de RANTES, así como la elevación del peróxido intracelular. Todo ello puede producir o potenciar la adhesión y la infiltración de las células inflamatorias en el sitio de exposición de los isocianatos23. Además del incremento en el número de eosinófilos en el lavado broncoalveolar (BAL) se han descrito recuentos de predominio neutrofílico y con más frecuencia entre los pacientes sensibilizados a sustancias de BPM, especialmente a isocianatos. Dentro de los sensibilizados a éstos pueden distinguirse dos grupos (variante eosinofílica y no eosinofílica) aunque en los dos haya aumento de los neutrófilos24.
Las principales sustancias y profesiones implicadas en el AO se reflejan en las tablas 2 y 3.
HISTORIA NATURAL
El período de latencia, es decir el tiempo que transcurre entre el inicio de la exposición a la sustancia potencialmente sensibilizante y la aparición de síntomas de asma, es muy variable si bien la mayoría de los pacientes desarrolla la mima en los dos primeros años. Parece que la sensibilización a sustancias da BPM se produce en menos tiempo. Cuando un individuo comienza a trabajar en una industria de riesgo el desarrollo de la enfermedad dependerá de los factores de exposición (intensidad, tipo de sustancia, duración de la exposición etc.) y de la predisposición individual. La atopia es un factor de riesgo para la sensibilización a sustancias de APM. El tabaquismo como ya hemos comentado lo es para las sales de platino entre otras sustancias25. A pesar de que cabría esperar que el cese de la exposición produjera la desaparición del AO sólo ocurre en un porcentaje reducido de casos, en la mayoría persiste HRBI y en otros persisten los síntomas.
En la figura 1 se representa un esquema de la historia natural del AO26.
DIAGNÓSTICO
Diagnóstico funcional
Cuando tengamos un paciente con sospecha de asma bronquial relacionada con el trabajo el primer paso es demostrar que tiene obstrucción bronquial reversible o hiperreactividad bronquial mediante la realización de una espirometría y un test broncodilatador. De resultar éste negativo se realizará un test de provocación bronquial inespecífica con metacolina o histamina cuando el paciente esté trabajando ya que puede normalizarse tras un período sin exposición. Una vez demostrada, hay que determinar la asociación que el deterioro funcional y clínico guarda con la exposición laboral. El método más sencillo es el registro de Peak-Flow o del FEV1, al menos cuatro veces al día durante dos semanas trabajando y otras dos fuera del trabajo. Dado que la prueba es esfuerzo-dependiente es necesaria una adecuada supervisión. Para evitar la manipulación de los datos se pueden utilizar dispositivos de medición de PEF o FEV1 electrónicos que almacenan la información registrada27. La mejor forma de interpretar los registros es el análisis global por un clínico experimentado. El hallazgo más claro es la presencia de variabilidad diurna superior al 20% durante los días de exposición y no durante los días de baja laboral o vacaciones (Fig. 2). Si el paciente ha desarrollado asma crónica esta diferencia puede no ser tan patente y se haría necesario un análisis de la hiperreactividad no específica el último día de trabajo, repitiéndose dos o tres semanas después de abandonarlo28.
Diagnóstico inmunológico
Pruebas cutáneas
Las pruebas cutáneas de hipersensibilidad inmediata constituyen un método sencillo y asequible que detecta la existencia de sensibilización frente a un determinado antígeno. El asma ocupacional es más frecuente en pacientes atópicos, por lo que en todo paciente deberán realizarse pruebas cutáneas con los aeroalergenos habituales, para definir el estado atópico.
Las pruebas cutáneas de punción (Prick test), consisten en colocar una gota del extracto antigénico sobre la piel del paciente (habitualmente en el antebrazo) y puncionar con una lanceta, posteriormente transcurridos unos15-20 minutos se procede a la lectura, considerando positivas las pápulas superiores a los 3 mm. Cuando la técnica del Prick sea negativa, se procederá a realizar una inyección intradérmica de 0,02 a 0,05 del extracto antigénico, siempre con controles positivos (histamina) y negativos (suero salino al 0,9%), con concentraciones entre 100-1000 veces menor que la utilizada en el Prick. La intradermorreacción (ID) al ser una técnica más sensible, puede asociarse a reacciones sistémicas. La ID es más sensible y menos específica que el Prick, su interpretación es más difícil y presenta más falsos positivos, lo que condiciona un peor valor predictivo positivo.
Aun utilizando una técnica correcta, aparecerán resultados positivos y negativos por utilizar material inadecuado (siendo más frecuente en el caso de asma ocupacional, porque la mayoría de los extractos no están estandarizados). No obstante, una prueba positiva únicamente significa que ha existido una exposición sensibilizante previa, no siendo sinónimo de enfermedad alérgica29.
La mayoría de sustancias de PMB se comportan inmunológicamente como haptenos, siendo necesaria la unión a un transportador proteico, habitualmente la albúmina sérica humana HSA. Esto hace que en estas sustancias las pruebas cutáneas tengan menos valor.
Métodos de laboratorio
Una IgE total elevada sugiere la posibilidad de otra enfermedad pulmonar o la sensibilización a un antígeno no detectado. Actualmente se dispone de diferentes técnicas para determinar la IgE específica; RAST, CAP, ELISA, REIA, PTRI o la técnica de liberación histamina de los basófilos. Aunque las técnicas del laboratorio tienen buena especificidad y presentan buena correlación con las pruebas cutáneas, generalmente son menos sensibles30.
Son de gran utilidad; cuando no se pueden retirar medicamentos que interfieren con las pruebas cutáneas, bien ante la presencia de una reactividad cutánea inespecífica, o bien cuando se trate de un extracto irritante o tóxico.
Provocación bronquial específica
La prueba de provocación bronquial específica consiste en la inhalación del agente sospechoso en dosis bajas y progresivamente crecientes, sin sobrepasar la concentración irritativa. De esta forma se reproducen los síntomas en el órgano diana en condiciones de control, permitiendo determinar la relación causa-efecto entre el alergeno y la respuesta bronquial.
Se considera la prueba de referencia para confirmar un asma ocupacional31 . Está especialmente indicada en aquellos casos con sospecha de sensibilización, en los cuales la historia clínica y el estudio complementario no son concluyentes. Así como cuando existan razones de interés médico-legal y para el estudio de nuevos agentes sensibilizantes. También se puede utilizar para determinar la causa concreta de asma ocupacional en un paciente expuesto a un ambiente laboral complejo donde hayan varios agentes potencialmente implicados.
Las PBE deben realizarse en centros especializados, con personal entrenado en su realización y con todos los medios disponibles para tratar las posibles reacciones adversas graves. Los pacientes deben estar asintomático, con una función pulmonar estable, no deben presentar una fluctuación espontanea del FEV1 superior de 10% y su valor basal debe ser mayor de 70%. Esta contraindicado realizar durante el embarazo, en pacientes con accidentes cerebrovasculares y cardíacos recientes, así como la hipertensión arterial no controlada.
Diferentes factores pueden influir en la respuesta bronquial; exposición alergénica previa, infecciones respiratorias y vacunación antigripal en las últimas semanas. El tipo de nebulizador y el tamaño de partícula influyen en el depósito bronquial así como el patrón respiratorio de inhalación. Deben ser eliminados todos aquellos fármacos que puedan alterar el resultado (Tabla 4).
Antes de exponer al sujeto al agente específico se debe realizar una exposición con un placebo y monitorizar la función pulmonar durante 24 h, de esta forma detectaremos fluctuaciones del FEV1. Utilizaremos diferente placebo dependiendo de la característica del agente a estudiar. Habitualmente se utilizan como placebo; lactosa para polvos, serrín de pino para maderas, guantes de vinilo para el látex o componentes de poliol para disocianatos.
El objetivo de una prueba inhalativa bronquial es reproducir la actividad laboral de forma controlada en cabinas. Por lo que dependiendo de la sustancia deberán elegirse distintos métodos de exposición:
Cuando la sustancia sea hidrosolubles de peso molecular bajo o alto:
Se realiza un extracto acuoso con el agente sospechoso a una concentración entre 10 y 20 mg/ml p/vol. La concentración de inicio se determina con una titulación a punto final (que corresponde a la dilución que haya provocado una pápula de 3 mm en la prueba Prick o un habón superior a 5mm en el test intradermo).
Existen 2 métodos de nebulización, volumen corriente o con dosímetro.
En la nebulización continua32, el paciente mediante una máscara facial, respira a volumen corriente durante 2 minutos y a intervalos de 30 minutos, concentraciones crecientes del alergeno. Previamente inhala solución fisiológica. El FEV1 se evalúa después de cada inhalación y cada 10 minutos. Si el descenso es >20% respecto al control, el test es positivo. En los resultados se expresan la concentración (mg/ml) de la sustancia que provoca un descenso del FEV1 del 20% (PC20).
Mediante el dosímetro33, se controla la cantidad inhalada, ya que el paciente inhala sólo cuando inspira. Los resultados se expresan en función de la dosis administrada que produce un descenso del FEV1 del 20%, o PD 20, en µmol o µg, en las ocasiones en que tengamos polvo no hidrosoluble.
El tamaño de la partícula, así como el patrón de respiración determinan el lugar de depósito y la cantidad de partículas retenidas en el pulmón. Hay varios sistemas, actualmente el que más se usa, es la "cámara para inhalación de polvo de circuito cerrado" donde el paciente respira a través de un adaptador nasal o una mascarilla facial, y por medio de un medidor se conoce la concentración de polvo en mg/m3.
Mediante esta técnica se inhalan las siguientes sustancias en polvo: polvos de madera, (que también pueden ser nebulizados tras realizar extractos acuosos31), sales complejos de platino (aluminio, cobalto, medicamentos, látex).
Para generar una concentración conocida de gases o vapores tienen dos sistemas; estáticos y dinámicos. En los sistemas estáticos se mezcla una cantidad conocida de gas con una cantidad conocida de aire en una cámara donde el paciente se conecta mediante un tubo y mascarilla, e inhala a través de él.
En los sistemas dinámicos el flujo de aire y el índice de gas se controlan para producir una dilución conocida. Estos sistemas ofrecen un flujo continuo y permiten un cambio rápido de concentración. Estas cámaras se utilizan para nebulizar las siguientes sustancias:
– Diisocianatos, precursores de los poliuretanos, que se utilizan como espumas rígidas (lacas, elastómeros e insecticidas).
– Aminoetiletanolamiana, sustancia que se desprende al soldar aluminio.
– Colofonía, deriva de las resinas de los pinos y se utiliza para evitar la oxidación de los metales al calentarse.
– Formaldehído.
– Glutaraldehído.
Las concentraciones inhaladas durante la provocación se deben medir y mantenerlos siempre por debajo de los valores máximos de exposición de corta duración para evitar exposiciones a concentraciones irritantes e inducir reacciones no específicas.
El FEV1 es el parámetro más fiable y reproductible para medir la obstrucción pulmonar. Se mide en la primera hora cada 10 minutos y en las siguientes 8 h cada hora. Posteriormente en el domicilio se mide el PEF durante las próximas 24-48 horas. El PEF es menos sensible, siendo más dependiente del esfuerzo. Se considera una respuesta positiva un descenso del FEV1 superior o igual a 20% o un descenso del 25% en caso del PEF, así como reducciones del FEV1 del 15%, asociado a síntomas respiratorios.
Es importante realizar una provocación bronquial inespecífica antes y después de la específica. Una HBP confirma la específidad de la PBE. Sin embargo una PBE negativa, con una metacolina positiva no excluye el diagnóstico de asma ocupacional, debemos sospechar que el paciente ha perdido de forma parcial su capacidad de respuesta al agente causal y debemos realizar una nueva prueba de provocación específica. Tendremos diferentes patrones de respuesta bronquial.
La fase inmediata alcanza su máxima intensidad a los 10-20 minutos con una recuperación espontánea a la 1 ó 2 h. Es una respuesta broncoespástica y no inflamatoria, por lo que revierte rápidamente con B2 agonistas y puede ser inhibida por el cromoglicato bisódico.
La fase tardía comienza a las 3-4 horas después de la exposición al alergeno, alcanzando su máxima intensidad a las 4-8 horas y puede persistir más de 12 h. Algunos autores creen que la respuesta tardía estaría relacionada con la dosis de antígeno administrada34. Sin embargo, los estudios experimentales y el lavado broncoalveolar apoyan la hipótesis de que sea inflamatoria35. Respuesta dual, es una respuesta doble, con un descenso inicial y otro a las 3-8 h.
Como en todas las pruebas se obtendrán falsos positivos, por reacciones irritativas, o por la presencia de un asma inestable.
Se tendrán falsos negativos cuando se utilice dosis insuficiente o un agente inadecuado. También cuando el paciente se haya desensibilizado por falta de evitación. En este caso si se detecta hiperreactividad a la metacolina postprovocación deberá repetirse la PBE. El asma ocupacional está causado por un agente externo que se encuentra en el medio laboral, por lo tanto las medidas de control ambiental serán fundamentales para la prevención de esta enfermedad. Deberemos reducir la concentración ambiental de las sustancias sensibilizantes a niveles no perjudicales para la salud (evitando la sensibilización y síntomas en pacientes sensibilizados) y adoptar medidas de protección personal (mascarillas o respiradores).
Existen diferentes métodos para determinar la concentración ambiental:
– El recuento de partículas identificadas, dependiendo de sus características morfológicas.
– El cultivo de hongos y bacterias recogidas en el ambiente.
– El análisis de productos químicos específicos suspendidos en el ambiente
– El estudio inmunoquímico de los aeroalergenos obtenidos del ambiente. Esta técnica consiste en analizar un determinado volumen de aire. Tras filtrarse y detectar los alergenos se cuantifica la actividad alergénica mediante diferentes técnicas inmunoenzimáticas.
Es fundamental detectar un asma precoz para disminuir su gravedad. Una vez que se ha detectado el agente causal del asma ocupacional, el paciente deberá evitar por completo la exposición a la misma, incluso a mínimas concentraciones.
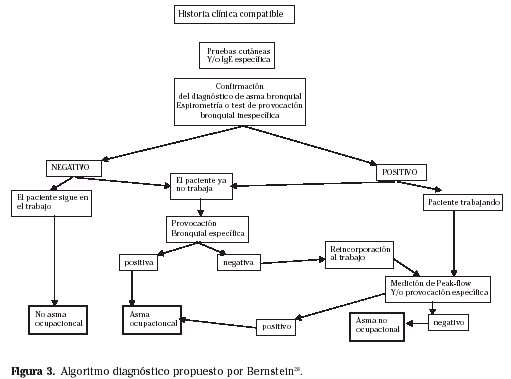
Ha sido propuesto un esquema diagnóstico (Fig. 3)28 para ayudar en la práctica diaria.
PRONÓSTICO
Los pacientes diagnosticados de AO deben ser revisados periódicamente aún habiendo cambiado de puesto de trabajo. Aproximadamente en el 25% de ellos se observa una recuperación completa de su función pulmonar, en un alto porcentaje persiste la hiperreactividad bronquial.
TRATAMIENTO
La primera medida a tomar es el cese de la exposición a la sustancia responsable. El paciente debe ser reubicado en un puesto de trabajo diferente dentro de la empresa o si esto es imposible precisará un cambio de trabajo.
Debe de seguir el tratamiento convencional recomendado por las guías y protocolos para el grado de severidad de su asma y se le debe aconsejar encarecidamente que abandone el hábito tabáquico.
PREVENCIÓN
Primaria: medidas de control ambiental e higiene industrial para reducir la exposición.
Secundaria: detección precoz del asma. Cuestionarios y controles clínicos y funcionales periódicos entre los trabajadores.
Terciaria: medidas terapéuticas y ambientales suficientes para controlar la evolución de los pacientes ya diagnosticados.
BIBLIOGRAFÍA
1. Bernstein IL, Bernstein DI, Chan-yeung M, Malo JL. Definition and clasification of asthma. En: Asthma in the workplace, second edition. Bernstein IL, Chan-yeung M, Malo JL, Bernstein DI, Eds New York, Marcel Dekker, INC. 1999: 1-4. [ Links ]
2. Vandenplas O, Malo JL. Definitions and types of work-related asthma: a nosological approach. Eur Respir J 2003; 21: 706-712. [ Links ]
3. Chan-yeung M. Asessment of asthma in the workplace. ACCP consensus statemente American College of chest Physicians. Chest 1995; 108: 1084-1117. [ Links ]
4. Meredith S, Mc Donald J. Work reated repiratory disease in United Kingdom, 1989-1992: Report on the SWORD project. Occup Med 1994; 44: 183-189. [ Links ]
5. Xu X, Christiani D. Occupational exposures and physician diagnosed asthma. Chest 1993; 104: 1364-1370. [ Links ]
6. Gautrin D, Newman-Taylor AJ, Norman H, Malo J. Controversies in epidemiology of occupational asthma. Eur Respir J 203; 22: 551-559. [ Links ]
7. Juniper C, How M, Goodiwin B. Bacillus subtilis encimes: a seven year clinical, epidemiological and immunologiacal study of an industrial allergen. J Soc Occup Med 1977; 27: 3-12. [ Links ]
8. De Zotti RD, Bovenzi M. Prospective study of work related repiratory symtoms in trainne bakers. Occup Environ Med 2000; 57: 58-61. [ Links ]
9. Gautrin D, Ghezzo H, Infante-Rivard C, Malo JL. Natural history of sensitization, syntoms and diseases in aprendices exposed to laboratory animals. Eur Respir J 2001; 17: 904-908. [ Links ]
10. McDonald J, Keynes H, Meredith S. Reported incidence of occupational asthma in the United Kingdom, 1989-97. Occup Environ Med 2000; 57: 823-829. [ Links ]
11. Matte T, Hoffman R, Rosenman K, Stanbury M. Surveillance of occupational asthma under SENSOR model. Chest 1990; 98: 173S-178S. [ Links ]
12. Tarlo S, Liss G. Diisocyanate induced asthma: diagnosis, prognosis and effects of medical surveillance measures. Appl Occup Environ Hyg 2002; 17: 902-908. [ Links ]
13. Wan H, Winton HL, Soeller C, Tovey ER, Gruenert DC, Thompson PJ et al. Der p facilitates transepithelial allergen delivery by disruption of tight junctions. J Clin Invest 1999; 104: 123-133. [ Links ]
14. Agius RM, Nee J, McGovern B, Robertson A. Structure activity hypotheses in occupational asthma caused by low molecular weight substances. Ann Occup Hyg 1999; 35: 129-137. [ Links ]
15. Wisnewski AV, Srivastava R, Herick C, Xu L, Remus R, Cain H et al. Identification of human lung and skin proteins conjugated with hexamethylene diisocyanate in vitro and in vivo. Am J Respir Crit Care Med 2000; 162: 2330-2336. [ Links ]
16. Lantz RC, Lemus R, Lange RW, Karol MH. Rapid reduction of intracellular glutathione in human bronchial epithelial cells exposed to occupational levels of toluene diisocyanate. Toxicol Sci 2001; 60: 348-355. [ Links ]
17. Heederik D, Houba R. An exploratory quuantitative risk assessment for high molecular weight sesitizers: wheat flour. Ann Occup Hyg 2001; 45: 175-185. [ Links ]
18. Sastre J, Quirce S. Patología respiratoria alérgica ocupacional. Madrid. Editado por Emisa 2003. ISBN 84-86917-58-1. [ Links ]
19. Venables KM. Prevention of occupational asthma. Eur Respir J 1994; 7: 768-778. [ Links ]
20. Biagini RE, Moorman WJ, Lewis TR, ernstein IL. Ozone enhacement of platinum asthma in a primate model. Am Rev Respir Dis 1986; 134: 719-725. [ Links ]
21. Mapp CE. The role of genetic factors in occupational asthma. Eur Respir J 2003; 22: 173-178. [ Links ]
22. Park HS, Lee SK, Kim HY, Nahm DH, Kim SS. Specific immunoglobulin E and immunoglobuline G antibodies to toluene diisocyanate-human serum albumin conjugate: useful markers for predicting long term prognosis in toluenne dissocyanate-induced asthma. Clin Exp Allergy 2002; 32: 551-555. [ Links ]
23. Elms J, Beckett PN, Griffin P, Curran AD. Mechanisms of isocyanate sensitisation. An in vitro approach. Toxicol In vitro 2001; 15: 631-634. [ Links ]
24. Lemiere C, Romeo P, Chabolillez S, Tremblay C, Malo JL. Airway inflamation and functional changes after exposure to different concentrations of isocyanates. J Allergy Clin Immunol 2002; 110: 641-646. [ Links ]
25. Venables KM, Doly MB, Jun AJ, Stevens JF, Stephens R, Farrer N et al. Smoking and accupational allergy in workers in a platinum refinery. Br Med J 1989; 299: 939-942. [ Links ]
26. Chan-Yenng M, Malo JL. Natural history of occupational asthma. En: Asthma in the workplace second edition. Bernstein IL, Chan-yeung M, Malo JL, Bernstein DI, Eds New York, Marcel Dekker, INC 1999: 129-143. [ Links ]
27. Quirce S, Contreras G, Dybuncio A, Chan-Yeung M. Peak expiratory flow monitoring is not a reliable meted establishing the diagnosis of occupational asthma. Am J Respir Crit Care Med 1995; 152: 1100-1102. [ Links ]
28. Bernstein DI. Clinical assessment and management of occupational asthma. En: Asthma in the workplace, second edition. Bernstein IL, Chan-yeung M, Malo JL, Bernstein DI, Eds New York, Marcel Dekker, INC. 1999; 1-4. [ Links ]
29. Chan-Yeung M, Brooks S, Albert M. Assesment of asthma in the workplace. Chest 1995; 108: 1084-1117. [ Links ]
30. Baldo BA, Wrigley CW. IgE antibodies to wheat flour components. Clin Allergy 1978; 8: 109-124. [ Links ]
31. Cartier A, Malo JL. Occupational challenges tests, En: Asthma in the workplace, Bernstein IL, Chan-Yeung M, Malo JL, Bernstein DI ed, Marcel Decker NewYork 1999; 2221-223. [ Links ]
32. Cockroft DW, Killian DN, Mellon JJA, Hargreave FE. Bronchial reactivity to inhaled histamine: a method and clinical survey. Clin Allergy 1977; 7: 235-243. [ Links ]
33. Chai H, Farr R, Froehlich LA, Mathison DA, McLean JA, Rosenthal RR et al. Standarditazion of bronchial inhalation challenge procedures. J Allergy Clin Immunol 1975; 56: 323-327. [ Links ]
34. Quirce S, Ferrer A, Fernández-Caldas E, Hinojosa, Marañon F, Sastre J. Identification of obeche wood allergens causing occupatinal asthma. J Allergy Clin Immunol 2000; 106: 400-401. [ Links ]
35. Boschetto P, Fabbri LM, Zocca E, Milani G, Pivorotto F et al. Prednisone inhibits late asthmatic reactions and airway inflammation induced by toluene diisocyanatein sensitized subjects. J Allergy Clin Immunol 1987; 80: 261-267. [ Links ]