My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.29 n.3 Pamplona Sep./Dec. 2006
ARTÍCULOS ORIGINALES
Modulación en la expresión de biomarcadores (RE, RP y C-erbB2) en cáncer de mama tras tratamiento neoadyuvante
Modulation of biomarkers expression (OR, PR and C-erbB2) in breast cancer following neoadjuvant treatment
A. Córdoba1, M. Ederra2, I. Ariceta3, M.L. Gómez1, M.A. Arrechea1, P. De Llano1 y J.M. Martínez-Peñuela1
1. Servicio de Anatomía Patológica. Hospital de Navarra. Pamplona.
2. Instituto de Salud Pública de Navarra. Pamplona.
3. Servicio de Cirugía General. Hospital de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
Introducción: El tratamiento oncológico pre y postoperatorio en pacientes con carcinoma de mama está condicionado entre otros factores, por el resultado del estudio inmunohistoquímico de los receptores hormonales y por la expresión de c-erbB2. El objetivo del estudio es determinar la influencia del tratamiento neoadyuvante en la expresión de receptores de estrógeno (RE), progesterona (PR) y c-erbB2.
Material y métodos. Estudiamos 53 pacientes con cáncer de mama diagnosticadas mediante biopsia trucut. Las pacientes con carcinoma localmente avanzado (20) se someten a quimioterapia preoperatoria. Se realiza extirpación quirúrgica en todos los casos. Comparamos la expresión de receptores de estrógeno (RE), receptores de progesterona (PR) y c-erbB2, en la biopsiatrucut y en la pieza quirúrgica.
Resultados. Encontramos diferencias significativas en la expresión de RE, RP entre biopsia/pieza quirúrgica, comparando el grupo de pacientes sometidas a tratamiento neoadyuvante frente al grupo de pacientes sin tratamiento oncológico prequirúrgico.
Encontramos diferencias de signo (positivización y negativización) entre un 10 y un 40% de casos en la expresión inmunohistoquímica para RE, RP y c-erbB2 entre la biopsiatrucut y la resección quirúrgica en las pacientes tratadas con neoadyuvancia. Estas diferencias de signo no tienen significación estadística.
Palabras clave. Receptores de estrógeno. Receptores de progesterona. C-erbB2. Neoadyuvancia.
ABSTRACT
Introducción: Pre and post-operative oncological therapy in patients with breast cancer is determined, amongst other factors, by hormone receptor status and by c-erbB2 expression. The aim of this study is to determine the influence of neoadjuvant therapy on the expression of oestrogen receptor (OR), progesterone receptor (PR) and c-erbB2.
Methods. Fifty-three patients with breast cancer diagnosed by tru-cut biopsy were studied. Patients with locally advanced carcinoma (20) had preoperative treatment. All patients underwent surgical resection. Expression of OR, PR and c-erbB2 in both the tru-cut biopsy and the gross specimen was compared.
Results: We found significant differences in OR, PR expression in both biopsy and gross specimen, between the group of patients who underwent neoadjuvant treatment and the group without pre-surgical treatment.
Changes in PR, OR and c-erbB2 status were found between the tru-cut biopsy and the gross specimen, in about 10 to 40% of the cases who received neoadjuvant therapy. These changes had no statistical significance.
Key words. Oestrogen receptors. Progesterone receptors. C-erbB2. Neoadjuvant therapy.
Introducción
Se utiliza la quimioterapia preoperatoria en el tratamiento del cáncer de mama porque ha demostrado su efectividad para producir una regresión tumoral que permita realizar cirugía conservadora y especialmente en pacientes con enfermedad localmente avanzada1-3. Otra ventaja que ofrece este tipo de tratamiento es que permite valorar la respuesta al tratamiento como marcador de la sensibilidad para el tratamiento postoperatorio1,2.
Hasta el momento la quimioterapia preoperatoria no ha demostrado mejoras en tiempo libre de enfermedad, ni en la supervivencia2. Para mejorar la efectividad de la quimioterapia se estudian nuevos fármacos y estrategias para determinar el efecto de estas terapias, asociado a la respuesta o resistencia del tumor2.
El tratamiento oncológico pre y postoperatorio en pacientes con carcinoma de mama está condicionado, entre otros factores, por el resultado del estudio inmunohistoquímico de los receptores hormonales y por la expresión de C-erbB2. La expresión de estos biomarcadores está implicada también en la respuesta al tratamiento neoadyuvante preoperatorio, y son factores pronósticos independientes1-5.
En varios trabajos se hace referencia a los cambios morfológicos que se producen en las células tumorales, y que producen modificación en la valoración del grado tumoral y otras variables con implicación pronóstica4.
La terapia neoadyuvante se diseña atendiendo a un diagnóstico realizado mediante biopsia trucut y sobre el perfil inmunohistoquímico de esa muestra. Tras el tratamiento médico se practica la resección quirúrgica y se estudia de nuevo el tumor cuya extensión y fenotipo pueden haber variado. Los cambios debidos a la quimioterapia neoadyuvante pueden ser tan acusados que se alcanza incluso la regresión patológica completa (15-25% de casos) y no habrá tumor viable para ser estudiado4-9.
De la misma forma que se producen cambios morfológicos, se han observado cambios en la intensidad de la expresión inmunohistoquímica de varios marcadores5-10. Si constatamos una variación de la expresión inmunohistoquímica tras el tratamiento, este perfil fenotípico será el definitivo que realmente se deba considerar a la hora de plantear el tratamiento post-quirúrgico y hacer una evaluación pronóstica10.
Nosotros hemos seleccionado los tests inmunohistoquímicos que tienen implicación pronóstica, de respuesta al tratamiento y terapéutica como son los receptores hormonales y el c-erbB2 para comparar el perfil de los tumores antes y después del tratamiento neoadyuvante. Se ha comparado la variabilidad entre este grupo y un grupo de casos control que han sido estudiados en las mismas condiciones pero sin tratamiento prequirúrgico.
Material y métodos
Se han seleccionado 20 pacientes que han sido diagnosticadas de carcinoma de mama mediante biopsia trucut con aguja gruesa (14G). Por tratarse de tumores localmente avanzados (mayores de 5 cm) se propone tratamiento neoadyuvante preoperatorio. En 19 pacientes se tratan con quimioterapia consistente en varios ciclos (en general 6 ciclos) de fluorouracil-epirubicina y ciclofosfamida/epi-docetaxel; en dos casos se asoció el taxol con trastruzumab. En un caso se asocia la quimioterapia con radioterapia. Posteriormente se realiza extirpación quirúrgica.
De la misma forma se seleccionan 33 pacientes que durante el mismo periodo de tiempo que han sido diagnosticadas de carcinoma de mama mediante biopsia y posteriormente intervenidas para la resección del tumor, sin mediar entre ambos procedimientos tratamiento oncológico.
La biopsia trucut se incluye en parafina tras un periodo de fijación en formol tamponado al 10% entre 6 y 24 horas. Se realizan cortes de 4 micras sobre portas-pretatratados. Se desparafina e hidrata. Se realiza inmunotinción para receptores de estrógeno (Atom Prediluido, Clon: 6F11) y receptores de progesterona (Atom prediluido, Clon: 1ª6), cuyo proceso de tinción se lleva a cabo en el teñidor automático Ventana. La tinción para c-erbB2 se realiza tras recuperación antigénica mediante calor (70ºC durante 4 minutos) y luego se utiliza el anticuerpo primario de Atom diluido a 1/50 (Clon: CB11).
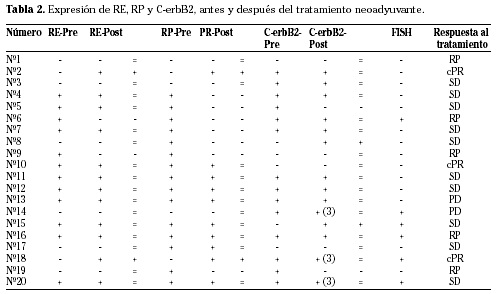
Se han estudiado la expresión de receptores hormonales y c-erbB2, en el material de biopsia y sobre la pieza de extirpación quirúrgica después del tratamiento neoadyuvante. Se realiza una valoración semicuantitativa de la intensidad de tinción para los receptores hormonales: menos del 10% de las células teñidas se considera negativo, entre 10 y 25 % se puntúa: positivo (1+), entre 25-75% de las células: positivo (2+) y más de 75 % se considera 3+. Para el C-erbB2 se puntúa la tinción como 0, 1+, 2+ y 3+, según la información del fabricante. Se valora el cambio de signo (positivización o negativización).
Para todos los casos con expresión inmunohistoquímica de C-erbB2 se realiza estudio de amplificación del gen ERBB-2 en secciones de tejido incluido en parafina mediante la técnica de hibridación in situ con fluorescencia (FISH). Se evalúa considerando la media del número de copias del gen y la del número de copias de CEP 17 (sonda centromérica). Se considera amplificación cuando se detecta un cociente medio mayor o igual a 2.
Se ha estudiado también la respuesta al tratamiento. Para ello se valora la reducción en el tamaño del tumor y seguimos los criterios de Fisher, Pohl3,4,9. La respuesta patológica completa (CPR) se define como ausencia total de carcinoma infiltrante. Si la reducción es del 50% se denomina respuesta parcial (RP). Se define como enfermedad estable (SD) si la reducción es menor del 50% y/o el aumento del diámetro es menor del 25%. Cuando el diámetro del tumor aumenta más de un 25% hablamos de progreso de la enfermedad (PD) (Tabla 1).
El tratamiento estadístico para la variación en la expresión de receptores hormonales y C-erbB2 antes y después de tratamiento neoadyuvante se ha realizado mediante la prueba binomial de comparación de desproporciones para datos apareados.
Se ha utilizado el test exacto de Fisher para establecer las comparaciones entre el grupo sometido a tratamiento neoadyuvante y el grupo control. En todos los casos se han aplicado pruebas de significación p bilaterales.
Se ha analizado además la evolución de las pacientes con un periodo de seguimiento entre 4 meses y 4 años.
Resultados
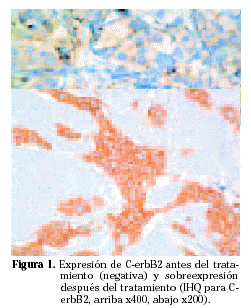
En las 20 pacientes sometidas a tratamiento neoadyuvante se valora el cambio de expresión entre la biopsia y la pieza quirúrgica tras el tratamiento. Se aprecia positivización en RE en dos casos, dos para PR y dos para c-erbB2 (Fig. 1). La negativización se produce en 2 casos para RE y c-erbB2; mientras que para progesterona se detecta en 7 casos. Se mantienen sin cambios 16 casos para receptores de estrógeno y C-erbB2, y sólo 11 para progesterona (Tabla 2 y 3).
Estudiamos la expresión inmunohistoquímica para RE, PR y c-erbB2 en 33 pacientes con cáncer de mama. Comparamos la biopsia con los resultados sobre la pieza quirúrgica sin que medie ningún otro tratamiento y obtenemos los siguientes resultados: para los RE no se evidencia ningún cambio de signo y los 33 casos se mantienen sin cambios, y para los PR se producen dos casos de positivización y 2 de negativización. Los cambios más destacados se producen en la expresión de c-erbB2, con una positivización y 7 de negativización (Tabla 4).
Además de los cambios descritos se observan otras variaciones en la intensidad de la tinción inmunohistoquímica, sin que se llegue a producir un cambio de signo. Como estas modificaciones tienen menor repercusión clínica no se refieren en este trabajo.
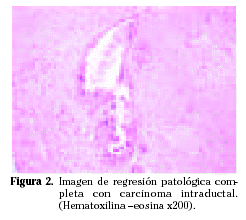
En cuanto a la respuesta al tratamiento en los casos sometidos a neoadyuvancia, se aprecia respuesta patológica completa en 3 casos (Fig. 2), respuesta parcial en 5 casos, enfermedad estable en 10 casos y progresión de la enfermedad en 2 casos. Para los casos con respuesta patológica completa la evaluación de la expresión inmunohistoquímica se realiza sobre el tumor residual en forma de carcinoma intraductal.
Hemos valorado también la relación entre la respuesta al tratamiento y la expresión de RE, puesto que varios autores apuntan que los casos con RE negativos son más sensibles al tratamiento2,7-11. Así se observa que 2 de los 3 casos con respuesta patológica completa son negativos para RE.
Resultado estadístico. Estudiados los cambios en la expresión de los receptores hormonales (estrógeno y progesterona) y de c-erbB2, antes/después de tratamiento neoadyuvante, no se han encontrado diferencias estadísticamente significativas en ninguno de ellos (p>0,05).
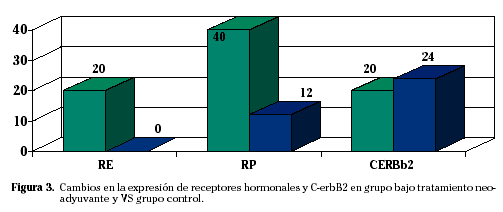
En lo que respecta a los cambios en la expresión de receptores hormonales y c-erbB2 en el grupo bajo tratamiento neoadyuvante y comparando con el grupo control; se observa que existen diferencias estadísticamente significativas (p=0,016) para los RE en cuanto a la variación en su expresión del grupo tratado con neoadyuvancia respecto al grupo no tratado. Existen también diferencias estadísticamente significativas (p=0,010) en cuanto a la variación de RP en su expresión del grupo tratado con neoadyuvancia respecto al no tratado (Fig. 3).
Por el contrario no hemos detectado diferencias estadísticamente significativas (p=1) en cuanto a la variación de expresión de c-erbB2 del grupo tratado con neoadyuvancia respecto al no tratado.
Resultado clínico. El tiempo medio de evolución es de 25,7 meses (máximo de 53,4 y mínimo de 1,2). De entre las pacientes tratadas con neoadyuvancia 13 viven sanas, 3 con enfermedad (1 metástasis ósea, 1 metástasis axilar contralateral y 1 mediastínica) y 4 han fallecido (1 metástasis ósea, 1 axilar contralateral, 1 cerebral y 1 pulmonar). La media del intervalo libre de enfermedad en las 7 pacientes que han presentado metástasis en su evolución fue de 11,57 meses.
La media de supervivencia de las 4 pacientes fallecidas fue de 26,75 meses (máximo de 32,7 y mínimo de 21,43 meses) con una desviación estandar de 4,9.
Discusión
Las mujeres con un cáncer localmente avanzado son sometidas a tratamiento neoadyuvante para reducir el tumor y optar a la cirugía conservadora. La determinación de los receptores hormonales y el c-erbB2 es importante porque influye en el tipo de tratamiento y en la sensibilidad al mismo. La determinación del estatus hormonal y de c-erbB2 es también un importante factor pronóstico1,8-11.
El efecto de la neodyuvancia sobre la expresión de RE, PR y c-erbB2 es un hecho controvertido2,6-14. Se han estudiado los cambios de expresión tras tratamiento con quimioterapia en tumores primarios y sobre las recidivas o metástasis15.
Algunos autores observan cambios de expresión con porcentajes que oscilan entre 9 y 56%2,10,12. Otros autores han observado que no existen diferencias significativas en la expresión de los receptores hormonales entre la biopsia y la pieza quirúrgica tras tratamiento10,12,16,17, con lo cual estos autores proponen que el estudio de la expresión de los receptores sobre la biopsia pretratamiento puede ser suficiente.
Nosotros hemos encontrado un cambio de signo en la expresión de RE en un 10% de casos, PR en un 45%, y c-erbB2 en 10%; pero las diferencias no resultan significativas dentro de este grupo16-21.
En otras series se evidencia modulación con diferencia significativa para algunas moléculas reguladoras del ciclo celular como p27, p21, p53 y ciclina D310, y marcadores de proliferación7, pero un resultado similar al nuestro en referencia a los receptores hormonales.
En nuestra serie hemos observado cambios de signo (de positivo a negativo y al contrario) de tipo bidireccional, con lo cual el número final de casos positivos y negativos es igual; este hecho condiciona la ausencia de diferencias significativas dentro del grupo de pacientes sometidos a tratamiento20, 21.
Por el contrario, para cada paciente estos cambios de signo en la expresión immunohistoquímica pueden determinar la aplicación de terapias ineficientes. Así los tumores que dejan de expresar RE o RP, no son sensibles a terapia hormonal. Los casos que resulten negativos en la pieza quirúrgica para c-erbB2 tampoco serán sensibles al tratamiento específico. Por el contrario los casos que resulten positivos tras el tratamiento serán susceptibles de terapia20,21.
Si la neoadyuvancia produce cambios en la expresión de los RE, PR y c-erbB2, será muy importante reevaluar su expresión tras el tratamiento. El perfil inmunohistoquímico será definitivo para tratar a partir de la cirugía15,20,21.
Se proponen varios factores que condicionen los cambios observados entre la biopsia y la pieza de resección quirúrgica tras tratamiento. Por un lado se considera la heterogeneicidad dentro del desarrollo neoplásico como una causa que justifique esta variabilidad12,17,20. Otros factores pueden ser la fijación óptima en la biopsia por su tamaño menor. Tampoco se puede olvidar la variabilidad debida exclusivamente a la técnica inmunohistoquímica pues la tinción se realiza con mínimas diferencias por que no se realizan en la misma fecha.
Todos estos factores influyen de igual manera sobre el grupo con tratamiento y sobre el grupo sin tratamiento. Como observamos diferencias significativas entre ambos grupos debemos descartar estas causas como justificación de la diferencia.
En el estudio realizado resulta evidente la gran variabilidad en la expresión de RE y RP entre el grupo sometido a tratamiento neoadyuvante frente al grupo control Para tratar de justificar la diferencia significativa halladas entre el grupo con tratamiento vs grupo sin tratamiento para los RE y RP, consideramos que el tratamiento neoadyuvante es el único factor que puede valorarse como causa de dichas diferencias9,20.
Concluimos, que es evidente que se producen cambios en la expresión de RE, RP y c-erbB2 después del tratamiento neoadyuvante. Estos cambios pueden provocar la necesidad de modificación terapéutica6,7,12,15,20,21. Por ello, recomendamos que se realice el estudio completo de marcadores biológicos antes y después del tratamiento neoadyuvante. Nuevos estudios de los cambios en los marcadores biológicos inducidos por la quimioterapia nos conducirá a una mejor comprensión del cáncer de mama.
Bibliografía
1.Fisher B, Bryant J, Wolmark N, Mamounos E, Brown A, Fisher R et al. Effect of preoperative chemotherapy on the outcome of women with operable breast cancer. J Clin Oncol 1998; 16: 2672-2685. [ Links ]
2.Colleoni M, Viale G, Zabrich D, Pruneri G, Gentilini O, Veronesi P et al. Chemotherapy is more effective in patients with breast cancer not expressing steroid hormone receptors: a study of preoperative treatment. Clin Cancer Res 2004; 10: 6622-6628. [ Links ]
3.Fisher B, Brown A, Mamounas E, Wieand S, Robidoux A, Margolese RG et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from national surgical adjuvant breast and bowel project B-18. J Clin Oncol 1997; 15: 2483-2493. [ Links ]
4.Frierson HF, Fechner RE. Histologic grade of locally advanced infiltrating ductal carcinoma after treatment with induction chemotherapy. Am J Clin Pathol 1994; 102: 154-157. [ Links ]
5.Aktepe F, Kapucuoglu N, Pak I. The effects of chemotherapy on breast cancer tissue in locally advanced breast cancer. Histopathol 1996; 29: 63-67. [ Links ]
6.Lee SH, Chung MA, Quddus MR, Steinhoff MM, Cady B. The effect of neoadyuvant chemotherapy on estrogen and progesterone receptor expression and hormone receptor status in breast cancer. Am J Surg 2003; 186: 348-350. [ Links ]
7.Sharma S, Saboorian MH, Frawley WH, Frenkel EP, Haley BB, Ashfaq R. MIB1 labeling index as an indicator of chemoresponse in carcinoma of the breast. Appl Immunohistochem Mol Morphol 2004; 12: 290-295. [ Links ]
8.Pu TP, Schott AF, Sturtz DE, Griffith KA, Kleer CG. Pathologic features of breast cancer associated with complete response to neoadjuvant chemotherapy. Importance of tumor necrosis. Am J Surg Pathol 2005; 29: 354-358. [ Links ]
9.Rouzier R, Perou CM, SymmansWF, Ibrahim N, Cristofanilli M, Anderson K et al. Breast cancer cancer molecular subtypes respond differently to preoperative chemotherapy. Clin Cancer Res 2005; 15: 5678-5685. [ Links ]
10.Pohl G, Rudas M, Taucher S, Stranzl T, Steger GG, Jakesz R et al. Expression of cell cycle regulatory proteins in breast carcinomas before and after preoperative chemotherapy. Breast Cancer Res Treat 2003; 78: 97-103. [ Links ]
11.Diéras V, Fumoleau P, Romieu G, Tubiana-Hulin M, Namer M, Mauriac L et al. Randomized parallel study of doxorubicin plus paclitaxel and doxorubicin plus cyclophosphamide as noeadjuvant treatment of patients with breast cancer. J Clin Oncol 2004; 22: 4958-4965. [ Links ]
12.Taucher S, Rudas M, Gnant M, Thomanek K, Dubsky P, Roka S et al. Sequential steroid hormone receptor measurement in primary breast cancer with and without intervening primary chemotherapy. Endocrine-related Cancer 2003; 10: 91-98. [ Links ]
13.Daidone MG, Silvestrini R, Luisi A, Mastore M, Benini E, Veneroni S et al. Changes in biological markers after primary chemotherapy for breast cancer. Int J Cancer 1995; 61: 301-305. [ Links ]
14.Colleoni E, Orvieto E, Orlando L, Minchella I, Viale G, Peruzzotti G et al. Prediction of response to primary chemotherapy for operable breast cancer. Eur J Cancer 1999; 35: 574-579. [ Links ]
15.Lower EE, Glass EL, Bradley DA, Blau R, Heffelfinger S. Impact of metastatic estrogen receptor and progesterone receptor status on survival. Breast Cancer Res Treat 2005; 90: 65-70. [ Links ]
16.Raido M, Nordling S, Krogerus L, Sioris T, von-Smitten K. Preoperative assessment of proliferative activity and hormone receptor status in breast carcinoma. Diag Cytopathol 1996; 15: 205-210. [ Links ]
17.Puglisi F, Scalone S, Bazzocchi M, Fabris C, Cacitti V, Beltrami CA et al. Image-guided core biopsy: a suitable method for preoperative biological characterization of small (pT1) breast carcinomas. Cancer Lett 1998; 133: 223-229. [ Links ]
18.Makris A, Powles TJ, Allred DC, Ashey SE, Trott PA, Ormerod MG et al. Quantitative changes in cytological molecular markers during primary medical treatment of breast cancer: a pilot study. Breast Cancer Res Treat 1999; 53: 51-59. [ Links ]
19.Lower EE, Glass EL, Bradley DA, Blau R, Heffelfinger S. Impact of metastatic estrogen receptor and progesterone receptor status on survival. Breast Cancer Res Treat 2005; 90: 65-70. [ Links ]
20.Quddus RM, Sung JC, Zhang C, Pasqueriello T, Eklund M, Steinhoff MM. HER-2/neu Expression in locally advanced breast carcinomas: pre-and post-neoadjuvant chemotherapy. Breast Cancer 2005; 12: 294-298. [ Links ]
21.Zhao J, Wu YL, Wang YD, Zhao GR Wang J. Effects of neoadjuvant chemotherapy on estrogen and progesterone receptors and HER-2 in breast cancer. Di-Yi-Jun-Yi-Da-Xue-Xue-Bao 2004; 24: 1437-1439. [ Links ]
![]() Dirección para correspondencia
Dirección para correspondencia
Alicia Córdoba Iturriagagoitia
Servicio de Anatomía Patológica
C/ Irunlarrea, 4
31008 Pamplona
Tfno. 848-42 24 51
e-mail: acordobi@cfnavarra.es
Aceptado: 30 de junio de 2006.