My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.30 n.3 Pamplona Sep./Dec. 2007
Principios básicos de resonancia magnética cardiovascular (RMC): secuencias, planos de adquisición y protocolo de estudio
Basic principles of cardiovascular magnetic resonance (CMR): sequences, acquisition planes and study protocol
C. Hernández1, B. Zudaire1, S. Castaño2, P. Azcárate2, A. Villanueva1, G. Bastarrika1
1. Servicio de Radiología. Clínica Universitaria. Universidad de Navarra. Pamplona.
2. Departamento de Cardiología y Cirugía Cardiovascular. Clínica Universitaria. Universidad de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
El estudio de la patología del sistema cardiovascular por resonancia magnética (RMC) es una de las aplicaciones más actuales de esta técnica diagnóstica, ya que permite estudiar la anatomía y función del corazón y grandes vasos de forma exacta y reproducible. La complejidad de la técnica viene dada por la localización y orientación anatómica de las estructuras cardiovasculares, las secuencias específicas que se deben emplear y la ausencia de familiarización por parte de los radiólogos con la patología cardiovascular. En este trabajo se describen los principios básicos de la RMC. Se exponen la utilidad clínica de las secuencias anatómicas, funcionales y secuencias de flujo, se describen los planos de adquisición en un estudio de RMC convencional y se propone un protocolo de estudio sencillo.
Palabras clave. Enfermedad cardiovascular. Resonancia magnética. Corazón.
RESUMEN
Evaluation of the cardiovascular system with magnetic resonance (CMR) has become one of the most relevant and up-to-the-minute clinical applications of this diagnostic technique, as CMR makes possible an exact and reproducible study of the anatomy and function of the heart and great vessels. The complexity of this technique is mainly due to the anatomical location and orientation of the cardiovascular structures, the specific CMR sequences that have to be used and a lack of familiarity amongst radiologists regarding cardiovascular pathology. In this report the most basic principles of CMR are described. The clinical usefulness of anatomical, functional, and flow quantification sequences are discussed, conventional CMR acquisition planes are described, and an easy CMR study protocol is proposed.
Key words. Cardiovascular diseases. Magnetic resonance imaging. Heart.
Introducción
La resonancia magnética (RM) se encuentra en continuo desarrollo. Inicialmente empleada para estudiar el sistema nervioso central y el sistema musculoesquelético, se ha demostrado que es una técnica útil para valorar prácticamente cualquier órgano y patología del organismo. Hoy en día son muy numerosas y diversas las aplicaciones clínicas de esta técnica diagnóstica no invasiva. El estudio de la patología del sistema cardiovascular es una de las aplicaciones más actuales y complejas1,2. La RM cardiovascular (RMC) es la técnica de primera elección para estudiar determinadas enfermedades3. Por ejemplo, la RMC se ha convertido en el estándar de referencia para evaluar la anatomía y función cardiaca, al tratarse de la técnica más exacta y reproducible4-7.
El estudio de la patología cardiovascular por resonancia magnética requiere conocer muy bien la anatomía y la función cardiaca; variables complejas interrelacionadas con las que los radiólogos, en general, no se encuentran familiarizados. Para este propósito se han de conocer aspectos como la localización anatómica y orientación de las estructuras cardiovasculares, la adquisición de los planos de estudio y los tipos de secuencia que se deben emplear de acuerdo con la patología cardiovascular estudiada8,9. La orientación del corazón en el tórax condiciona su exploración mediante RMC, ya que su eje intrínseco se localiza en un plano distinto a los ortogonales (axial, coronal y sagital) habitualmente empleados para estudiar el resto de los órganos. En RMC, los planos ortogonales son de gran utilidad para valorar las cardiopatías congénitas, estudiar las masas cardíacas y extracardiacas y evaluar la patología pericárdica. Los planos cardiacos (cuatro cámaras, dos cámaras o eje largo vertical, eje corto, tres cámaras) se emplean para estudiar la patología cardiaca propiamente dicha. La estandarización de los planos de adquisición y de las secuencias anatómicas y funcionales permitirá estimar adecuadamente la evolución de cualquier modificación anatómica o funcional con respecto a estudios previos4.
En este trabajo se describen los aspectos más básicos de la RMC. Se expone la utilidad clínica de las secuencias anatómicas, funcionales y secuencias de flujo, se describen los planos de adquisición en un estudio de RMC convencional y se propone un protocolo de estudio básico.
Secuencias en RMC básica: principios generales
Las secuencias que habitualmente se utilizan en la práctica clínica en los estudios de RMC se dividen en secuencias de pulso (anatómicas), secuencias eco de gradiente (anatómicas y cine), secuencias de flujo y secuencias eco de gradiente 3D. La indicación clínica y las anomalías detectadas durante el estudio de RMC serán las que indiquen qué tipo de secuencia se debe emplear. En una única exploración la RMC permite obtener información anatómica y funcional con mayor resolución espacial, exactitud y reproducibilidad que otras técnicas utilizadas habitualmente para el diagnóstico de las cardiopatías como son la ecocardiografía y las pruebas de medicina nuclear (SPECT, PET)3,10.
Las secuencias de pulso que se emplean en los estudios de RMC se pueden dividir en secuencias de sangre negra (dark-blood) y secuencias de sangre blanca (bright-blood). En las secuencias de sangre negra la sangre que circula con flujo elevado presenta intensidad de señal baja (es hipointensa con respecto al miocardio normal). Este grupo incluye las secuencias spin-eco convencionales (SE), las secuencias spin-eco rápidas (turbo-spin-echo-TSE) y las secuencias spin-eco con doble pulso de inversión recuperación (HASTE). Las secuencias de sangre negra se utilizan para obtener información anatómica del corazón y grandes vasos11. Las secuencias de sangre blanca son secuencias eco de gradiente (gradient-echo-sequences-GRE); la sangre circulante es hiperintensa con respecto al miocardio normal. Mediante este tipo de secuencias se puede obtener información anatómica y funcional. Ejemplos de secuencias GRE son: FLASH, TurboFLASH, SSFP, etc12. Este grupo de secuencias también incluye las secuencias eco de gradiente con pulso de inversión recuperación (IR- TurboFLASH, IR-SSFP): secuencias que generalmente se utilizan tras la administración de contraste intravenoso para caracterizar el tejido y determinar la viabilidad del miocardio en la cardiopatía isquémica, por ejemplo13,14. Las secuencias de contraste de fase (phase contrast – PC) se utilizan para visualizar y cuantificar el flujo. Dicha cuantificación se puede realizar en el plano de la dirección del flujo (in plane) y/o en un plano perpendicular al flujo (through plane)15, obteniéndose parámetros de velocidad y flujo; también se puede estimar el gradiente de presión según la ecuación de Bernouilli modificada (ΔP= 4·vmax2). Mediante este tipo de secuencias se puede calcular, por ejemplo, el grado de insuficiencia valvular, la magnitud y dirección de los cortocircuitos, la velocidad pico de una estenosis valvular aórtica, la magnitud de una coartación de aorta, etc. Además, mediante el cálculo de la relación del flujo pulmonar con respecto al flujo sistémico (Qp/Qs) se podrá estimar de forma indirecta la magnitud de cortocircuitos intra y extracardiacos16. Las secuencias eco de gradiente 3D potenciadas en T1 tras la administración de contraste (Gadolinio, Gd-DTPA) se utilizan para los estudios de angiografía por RM17. Existen otras secuencias con las que se pueden visualizar los vasos según el flujo, sin necesidad de emplear contraste (time of flight-TOF, phase contrast-PC), pero son secuencias con muchas limitaciones18.
Sincronización ECG y colocación del paciente
La proyección de los vectores eléctricos cardiacos en la superficie corporal depende de la orientación del corazón. En RMC es preciso sincronizar el estudio con el electrocardiograma (ECG) para optimizar la calidad de las imágenes obtenidas. Los electrodos ECG se deben colocar cuidadosamente para obtener intervalos QRS amplios con ondas R picudas y ondas T de baja amplitud, ya que la adquisición de las imágenes de RMC se basa en una correcta identificación de las ondas R (trigger)19. Esta señal se puede obtener si los electrodos se colocan en la proximidad del corazón, evitando en la medida de lo posible estructuras que dificulten la obtención de una señal clara como la mama y el esternón. Debido a que la señal que se origina en el corazón es débil, se debe intentar evitar cualquier interposición entre los electrodos y la señal: se recomienda depilar el pecho y secar bien la piel. En ocasiones, el empleo de un gel de contacto también ayuda a obtener una señal de buena calidad. No se debe utilizar alcohol, ya que retira electrolitos de la piel. Si a pesar de los intentos la calidad de la señal continúa siendo subóptima, se deben emplear nuevas pegatinas y recolocar los electrodos en distintos lugares. Es muy importante emplear todo el tiempo necesario para obtener el mejor registro ECG posible ya que la calidad del estudio depende del mismo. Los electrodos también se pueden colocar sobre la espalda. En esta localización la señal es menos sensible a los movimientos del paciente pero se debe tener en cuenta que la distancia al corazón es mayor y, por tanto, la amplitud de la señal que se obtiene, menor. La corriente eléctrica detectada es amplificada y transmitida a lo largo de un cable de fibra óptica a una caja amplificadora colocada fuera del imán donde es reconvertida a corriente eléctrica. Debido a la mínima distancia que existe entre los electrodos y el amplificador, se pueden producir interferencias con las modificaciones del campo magnético y éste puede afectar a la señal ECG (efecto dehidroparamagnético). La comprobación de la señal ECG se debe realizar tanto fuera como dentro del imán, ya que, como se ha descrito, en esta última posición la señal puede sufrir modificaciones por la interacción con el campo magnético. El registro del ECG se utiliza para sincronizar la adquisición de las imágenes de RMC y en ningún caso se debe utilizar como ECG diagnóstico. La exploración se realiza con el paciente en decúbito supino con los brazos extendidos a lo largo del cuerpo.
Adquisición de planos
Localización del corazón - Planos localizadores
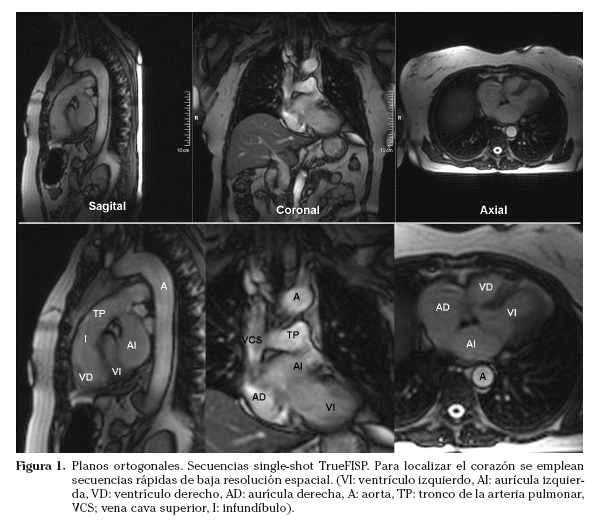
El tórax se estudia mediante planos transversales, coronales y sagitales estrictos. Los ejes cardiacos no son paralelos a los ejes del cuerpo; el eje largo del corazón se encuentra unos 45º con respecto al plano mediosagital de la columna dorsal. Por tanto, el corazón se debe estudiar empleando planos específicos; los mismos planos que se utilizan en otras modalidades de imagen cardiaca, como la ecocardiografía. Inicialmente, para localizar el corazón se suelen emplear secuencias single-shot. En este tipo de secuencia la resolución espacial y temporal se sacrifican para obtener imágenes de forma rápida. Para evitar artefactos de latido las imágenes se suelen adquirir en diástole. Los localizadores iniciales se obtienen con un protocolo multiplanar multicorte (multi-slice) (una imagen por intervalo R-R) en los planos ortogonales estrictos (axial, coronal y sagital) (Fig. 1). Es conveniente adquirir estos localizadores multiplanares en apnea, tras inspiración o espiración. Se prefiere la espiración, ya que la posición del corazón es más reproducible.
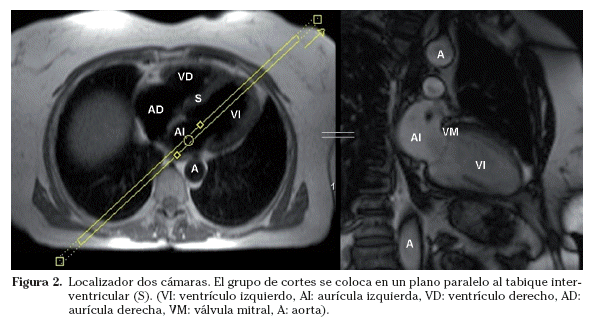
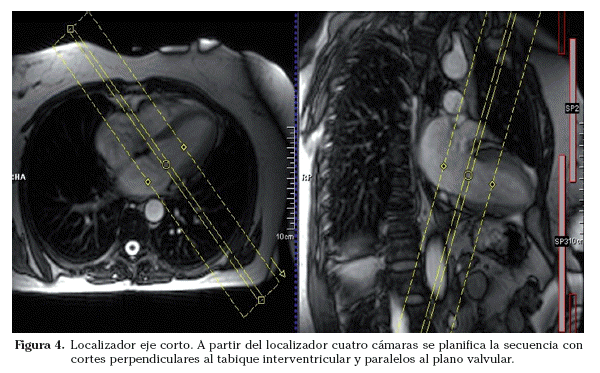
Sobre los localizadores multiplanares se planifican los localizadores cardiacos específicos19,20. Los planos de adquisición se deben adaptar a la orientación de cada corazón estudiado. Aunque la anatomía cardiaca es prácticamente similar en todos los sujetos (exceptuando las cardiopatías congénitas), pequeñas oblicuidades en la adquisición de los planos pueden suponer variaciones significativas en las imágenes resultantes. Las imágenes axiales puras muestran un corte oblicuo de los ventrículos derecho e izquierdo. La orientación del grupo de imágenes en un plano paralelo al tabique interventricular y que pase por el centro de la válvula mitral permite obtener un localizador dos cámaras (Fig. 2). Las imágenes parasagitales muestran el ventrículo izquierdo y la aurícula izquierda. A partir del localizador dos cámaras se planifica un corte transversal a nivel medioventricular. Combinando el localizador dos cámaras y este corte transversal se obtiene el localizador cuatro cámaras (Fig. 3). El corte debe incluir el ápex cardiaco y el centro de la válvula mitral. La orientación es doble-oblicua con respecto al eje del cuerpo. Para el localizador eje corto se utiliza el localizador cuatro cámaras; se planifica la secuencia con los cortes perpendiculares al tabique interventricular y paralelos al plano valvular (Fig. 4) y se utiliza el localizador dos cámaras para comprobar el posicionamiento de los cortes. El localizador eje corto debe incluir al menos un corte por encima del plano valvular (incluir el tracto de salida del ventrículo izquierdo) y distalmente, los músculos papilares. Los cortes en el eje corto son los que se emplean para planificar las secuencias cine de funcionales.
Estudio anatómico -- Planos ortogonales
Las secuencias anatómicas permiten estudiar el tórax, conocer la repercusión de la patología cardiaca sobre el parénquima pulmonar y valorar signos de insuficiencia cardiaca. Además, también se pueden valorar hallazgos incidentales no necesariamente asociados a problemas cardiacos como lesiones mediastínicas o pulmonares. Las secuencias anatómicas HASTE (sangre negra) son las secuencias más útiles, ya que permiten estudiar la anatomía torácica en respiración libre en un tiempo de exploración corto (treinta segundos). Esta secuencia se planifica en los planos ortogonales estrictos. Es aconsejable estudiar el tórax en al menos dos planos perpendiculares (axial-coronal, axial-sagital). Además de valorar el tórax, estas secuencias anatómicas también permiten realizar un análisis segmentario del corazón; análisis relevante para reconocer las cardiopatías congénitas (identificar aurículas y ventrículos y conocer la relación aurículoventricular, ventrículoarterial y la relación de los grandes vasos)21.
Estudio funcional del corazón
Las secuencias cine se utilizan para valorar y cuantificar la anatomía, función y contractilidad cardiaca. Inicialmente se emplearon secuencias fast-low-angle-shot (FLASH); hoy en día se prefieren las secuencias denominadas steady-state free precession (SSFP), ya que poseen mayor resolución espacial y temporal y mejor contraste entre la sangre circulante y el miocardio22,23. En las secuencias cine las imágenes obtenidas se visualizan secuencialmente a lo largo del ciclo cardiaco. Se deben utilizar planos de estudio estándares para que el estudio sea reproducible. Los ejes intrínsecos del corazón que se deben estudiar en cualquier exploración de RMC son: cuatro cámaras, dos cámaras (eje largo del ventrículo izquierdo), eje corto, tres cámaras (tracto de salida del ventrículo izquierdo) y tracto de salida del ventrículo derecho.
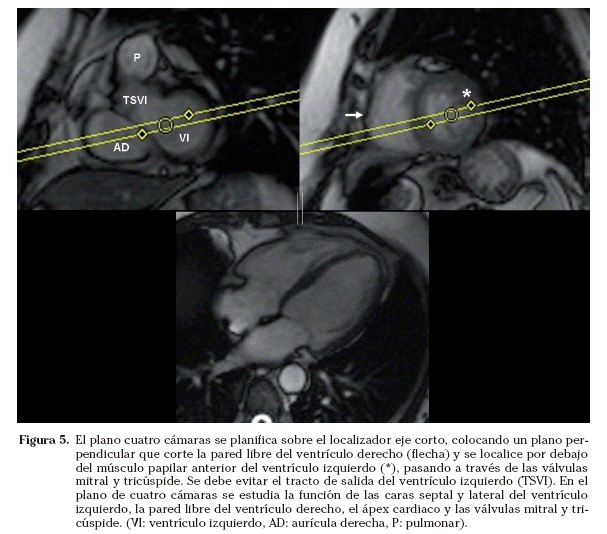
Cuatro cámaras. El plano cuatro cámaras se puede planificar en el localizador eje corto. Se coloca un plano perpendicular que corte la pared libre del ventrículo derecho y se localice por debajo del músculo papilar anterior del ventrículo izquierdo. El plano debe pasar por la mitad de las válvulas mitral y tricúspide. En el localizador dos cámaras, se angula el plano para que pase por el ápex cardiaco (Fig. 5). En este plano se visualizan las cuatro cámaras cardiacas y se estudian las caras septal y lateral del ventrículo izquierdo, la pared libre del ventrículo derecho, el ápex cardiaco y las válvulas mitral y tricúspide.
Dos cámaras (eje largo vertical). El plano de dos cámaras se obtiene trazando un eje paralelo al tabique interventricular o paralelo a los puntos de unión interventricular anterior e inferior sobre la imagen axial que demuestre el mayor diámetro del ventrículo izquierdo. Este eje se alinea en el plano de cuatro cámaras, pasando por el centro de la válvula mitral y el ápex cardiaco. Esta línea define el plano que contiene el verdadero eje largo del ventrículo izquierdo. Las imágenes obtenidas paralelas a este plano son imágenes orientadas según un plano sagital oblicuo anterior derecho (Fig. 6). El plano del eje largo vertical generalmente se emplea para estudiar las cavidades izquierdas del corazón y aporta información acerca de las relaciones anatómicas superoinferiores y anteroposteriores del mismo. La secuencias cine en este plano permiten analizar la apertura de la válvula mitral y la función de las caras anterior e inferior (diafragmática) del ventrículo izquierdo y del ápex cardiaco. La misma orientación paralela, desplazada al eje largo del ventrículo derecho (válvula tricúspide y ápex cardiaco) sirve para estudiar el eje largo del ventrículo derecho. En la misma imagen, dada su orientación anatómica, con frecuencia se incluye la válvula pulmonar. El ápex del ventrículo derecho es muy trabeculado.
Tres cámaras – tracto de salida del ventrículo izquierdo. Este plano se obtiene a través del tracto de salida de la aorta y del ápex del ventrículo izquierdo. Se incluyen las válvulas aórtica y mitral. También se conoce como plano de cinco cámaras porque con frecuencia incluye los dos ventrículos, las dos aurículas y la aorta ascendente. Se debe rotar la posición de la imagen a lo largo del eje longitudinal del ventrículo izquierdo, pasando por el centro del mismo, perpendicular al eje corto, utilizando la imagen del localizador que muestre el tracto de salida del ventrículo izquierdo (aorta ascendente) (Fig. 7). El plano tres cámaras es útil para valorar la porción anterior del tabique interventricular, la pared posterolateral del ventrículo izquierdo y el ápex cardiaco. Se visualiza el tracto de salida del ventrículo izquierdo. Se pueden valorar estenosis propias del tracto de salida, estenosis valvulares y estenosis subvalvulares.
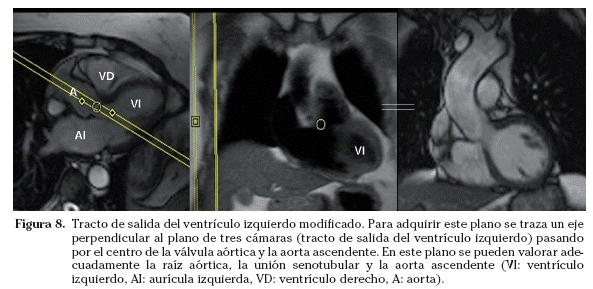
Tracto de salida del ventrículo izquierdo modificado. Este plano, opcional, se puede realizar cuando se requiera estudiar el tracto de salida del ventrículo izquierdo en un plano adicional. En este plano se pueden valorar adecuadamente la raíz aórtica, la unión senotubular y la aorta ascendente. Para adquirir este plano se traza un eje perpendicular al plano de tres cámaras pasando por el centro de la válvula aórtica y la aorta ascendente (Fig. 8). El plano que se obtiene es coronal oblicuo con respecto al eje del cuerpo.
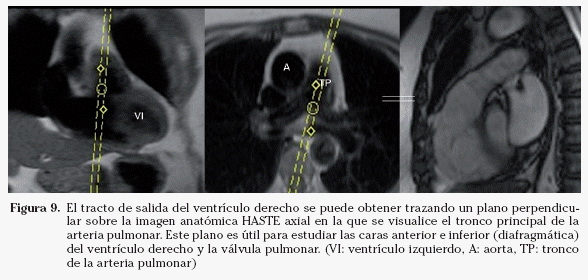
Tracto de salida del ventrículo derecho. En la imagen anatómica HASTE en que se visualice el tronco principal de la arteria pulmonar se traza un eje perpendicular al mismo. En la imagen coronal se debe angular el plano para evitar el ventrículo izquierdo (Fig. 9). El plano resultante es el tracto de salida del ventrículo derecho, que permite estudiar las caras anterior e inferior (diafragmática) de este ventrículo y la válvula pulmonar.
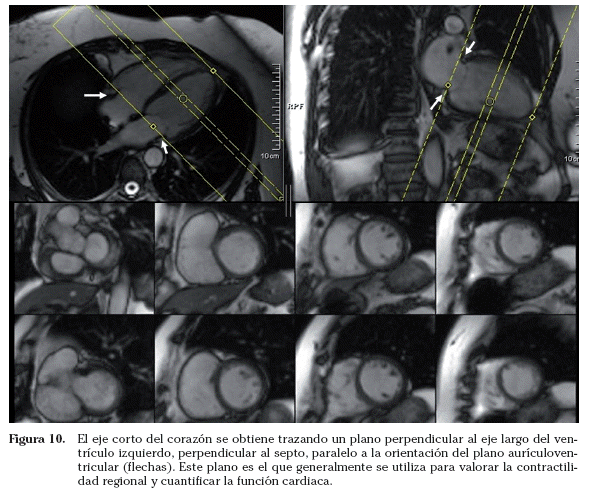
Eje corto. El eje corto del corazón se obtiene tras trazar un plano perpendicular al eje largo del ventrículo izquierdo (perpendicular al septo, paralelo a la orientación del plano aurículoventricular). En este plano el corazón adquiere una disposición anular. El eje corto es el plano que generalmente se emplea para valorar la contractilidad regional y cuantificar la función cardiaca (engrosamiento sistólico del ventrículo izquierdo, masa miocárdica, volúmenes cardiacos, fracción de eyección, etc.) (Fig. 10)24-26, mediante planimetría del endocardio y epicardio. Multiplicando el área obtenida por el grosor de corte, se calcula el volumen. Para cuantificar parámetros de función cardiaca se debe incluir todo el ventrículo, desde el plano valvular al ápex. El estudio se debe realizar de la manera más estándar posible para evitar la variabilidad inter e intraobservador. Se recomienda emplear una imagen telediastólica en el plano cuatro cámaras o eje largo horizontal y trazar una línea perpendicular, paralela al plano valvular, a través del surco aurículoventricular27. Posteriormente se incluirá todo el ventrículo realizando cortes paralelos al primero.
Protocolo de estudio
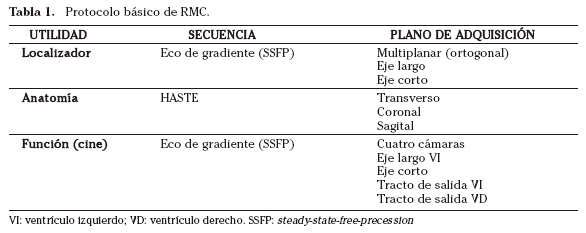
Se propone un protocolo sencillo de RMC (Tabla 1):
1.Localizadores multiplanares.
2.Secuencias anatómicas en los planos ortogonales en respiración libre con secuencias de sangre negra (HASTE) en al menos dos planos (axial-coronal, axial-sagital). Se realizan unos treinta cortes paralelos incluyendo el cayado aórtico y el diafragma. Estas secuencias anatómicas permiten realizar el análisis segmentario del corazón y grandes vasos, conocer la repercusión pulmonar y pleural de la patología cardiaca y estudiar el parénquima pulmonar, mediastino y pared torácica.
3.Localizadores dos cámaras y eje corto: un corte como localizador dos cámaras y al menos cinco cortes para el eje corto, incluyendo parte de la aurícula y el tracto de salida del ventrículo izquierdo.
4.Secuencias cine en los planos intrínsecos del corazón para conocer la función cardiaca, valorar la contractilidad regional y cuantificar volúmenes cardíacos y masa miocárdica. Se deben adquirir, al menos, los siguientes planos:
a. Cuatro cámaras
b. Dos cámaras
c. Tracto de salida del ventrículo izquierdo
d. Tracto de salida del ventrículo derecho
e. Eje corto
El protocolo básico que se propone se puede realizar en menos de veinte minutos. Con las secuencias empleadas se puede obtener una estimación exacta de la función cardiaca. Existen otros tipos de secuencias y planos que se pueden utilizar de acuerdo con la patología cardiaca de interés: secuencias cine en planos valvulares, secuencias anatómicas (TSE) para mostrar la anatomía concreta de las cardiopatías y realizar determinadas mediciones (grosor miocárdico, cuantificación de estenosis, etc.), secuencias de contraste de fase para visualizar y cuantificar el flujo, tanto en el plano de la dirección del flujo (in plane) como en un plano perpendicular al mismo (through plane), etc. Las secuencias de contraste de fase son útiles para calcular la magnitud de la insuficiencia valvular y los cortocircuitos (comunicación interauricular, comunicación interventricular, etc.). También se puede cuantificar, mediante secuencias de flujo, el volumen latido (función ventricular) y la relación del flujo pulmonar con respecto al flujo sistémico (Qp/Qs), parámetro útil en las cardiopatías congénitas. La angiografía 3D-RM permite valorar los grandes vasos y sus relaciones anatómicas. Las secuencias con pulso de inversión recuperación son útiles para estudiar el realce tardío del miocardio y determinar, en función del patrón de captación de contraste, la naturaleza de la cardiopatía (isquémica, miocardiopatía, etc.). Este tipo de secuencias y la técnica de realce tardío permiten detectar in vivo áreas de necrosis o fibrosis miocárdica, lo que ha supuesto un gran avance en el diagnóstico y pronóstico de los pacientes con enfermedades cardiacas, especialmente, de los pacientes con cardiopatía isquémica. La RMC aporta diferentes datos morfológicos y funcionales indicativos de viabilidad miocárdica que permiten mejorar la selección de los pacientes con cardiopatía isquémica y disfunción ventricular izquierda subsidiarios de procedimientos de revascularización. Entre estos datos se incluyen el grosor de la pared28 y el adelgazamiento localizado del ventrículo izquierdo que se da en casos de áreas de necrosis que han sufrido remodelado29,30, la hipointensidad de señal de la pared ventricular, lo que indica la presencia de cicatriz fibrosa y la respuesta a dosis bajas de dobutamina, lo que permite evaluar la reserva contráctil del miocardio disfuncionante28,31. La técnica de realce tardío ha supuesto la aportación más importante de la RMC para detectar y estudiar la extensión del infarto de miocardio. Dada la resolución espacial de la RMC se pueden detectar los segmentos sanos o necróticos y determinar la extensión transmural del infarto. Existe buena correlación entre las zonas de miocardio que captan contraste tardíamente y el área de necrosis determinada histológicamente32. Estudios clínicos demuestran una asociación clara entre el tamaño del infarto de miocardio determinado por RMC y los parámetros habitualmente empleados en la práctica clínica para establecer su extensión (enzimas, ECG, ecocardiografía)33,34. Además, el tamaño del infarto de miocardio establecido por RMC predice la recuperación funcional tras el procedimiento de revascularización30,33,35: la proporción de segmentos que mejora la contractilidad se relaciona inversamente con la extensión transmural del realce tardío de gadolinio36-38. Por otra parte, la extensión transmural del infarto agudo de miocardio predice la mejoría a largo plazo de la función contráctil37. En el caso de las miocardiopatías, la técnica de realce tardío es una herramienta útil para su diagnóstico diferencial y en muchos casos, permite conocer su etiología39. El realce tardío de gadolinio (indica fibrosis miocárdica) es especialmente útil en el caso de la miocardiopatía hipertrófica. Se ha descrito que el patrón de captación puede tener un significado pronóstico en este grupo de pacientes40.
En conclusión, las aplicaciones clínicas de la RMC son cada vez más numerosas. Un protocolo de estudio sencillo permite valorar la anatomía cardiovascular y la función cardiaca en un período corto de tiempo. El conocimiento de los principios básicos como son la utilidad de las secuencias habitualmente empleadas y la adquisición de los planos de estudio son el primer paso para realizar estudios de RMC; exploraciones que poseen gran implicación clínica para el manejo de los pacientes en la práctica clínica diaria.
Bibliografía
1.Boxerman JL, Mosher TJ, McVeigh ER, Atalar E, Lima JA, Bluemke DA. Advanced MR imaging techniques for evaluation of the heart and great vessels. Radiographics 1998; 18: 543-564. [ Links ]
2.Boxt LM. Primer on cardiac magnetic resonance imaging: how to perform the examination. Top Magn Reson Imaging 2000; 11: 331-347. [ Links ]
3.Pennell DJ, Sechtem UP, Higgins CB, Manning WJ, Pohost GM, Rademakers FE et al. Clinical indications for cardiovascular magnetic resonance (CMR): Consensus Panel report. Eur Heart J 2004; 25: 1940-1965. [ Links ]
4.Bellenger NG, Davies LC, Francis JM, Coats AJ, Pennell DJ. Reduction in sample size for studies of remodeling in heart failure by the use of cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2000; 2: 271-278. [ Links ]
5.Bellenger NG, Grothues F, Smith GC, Pennell DJ. Quantification of right and left ventricular function by cardiovascular magnetic resonance. Herz 2000; 25: 392-399. [ Links ]
6.Grothues F, Moon JC, Bellenger NG, Smith GS, Klein HU, Pennell DJ. Interstudy reproducibility of right ventricular volumes, function, and mass with cardiovascular magnetic resonance. Am Heart J 2004; 147: 218-223. [ Links ]
7.Grothues F, Smith GC, Moon JC, Bellenger NG, Collins P, Klein HU et al. Comparison of interstudy reproducibility of cardiovascular magnetic resonance with two-dimensional echocardiography in normal subjects and in patients with heart failure or left ventricular hypertrophy. Am J Cardiol 2002; 90: 29-34. [ Links ]
8.Boxt LM. How to perform cardiac MR imaging. Magn Reson Imaging Clin N Am 1996; 4: 191-216. [ Links ]
9.Bastarrika G, Sprengel U, Sáenz de Buruaga J, Romero C, Alegría E, Benito A et al. Resonancia magnética cardiaca: aplicaciones clínicas. An Sist Sanit Navar 2005; 28: 49-58. [ Links ]
10.Bastarrika G, Cano D, Becker CR, Wintersperger BJ, Reiser MF. TC multicorte (TCMC) cardiaca: aplicaciones clínicas. An Sist Sanit Navar 2004; 27: 63-72. [ Links ]
11.Finn JP, Edelman RR. Black-blood and segmented k-space magnetic resonance angiography. Magn Reson Imaging Clin N Am 1993; 1: 349-357. [ Links ]
12.Pereles FS, Kapoor V, Carr JC, Simonetti OP, Krupinski EA, Baskaran V et al. Usefulness of segmented trueFISP cardiac pulse sequence in evaluation of congenital and acquired adult cardiac abnormalities. AJR Am J Roentgenol 2001; 177: 1155-1160. [ Links ]
13.Haase A, Matthaei D, Bartkowski R, Duhmke E, Leibfritz D. Inversion recovery snapshot FLASH MR imaging. J Comput Assist Tomogr 1989; 13: 1036-1040. [ Links ]
14.Fritz-Hansen T, Rostrup E, Ring PB, Larsson HB. Quantification of gadolinium-DTPA concentrations for different inversion times using an IR-turbo flash pulse sequence: a study on optimizing multislice perfusion imaging. Magn Reson Imaging 1998; 16: 893-899. [ Links ]
15.Lotz J, Meier C, Leppert A, Galanski M. Cardiovascular flow measurement with phase-contrast MR imaging: basic facts and implementation. Radiographics 2002; 22: 651-671. [ Links ]
16.Chai P, Mohiaddin R. How we perform cardiovascular magnetic resonance flow assessment using phase-contrast velocity mapping. J Cardiovasc Magn Reson 2005; 7: 705-716. [ Links ]
17.Prince MR. Body MR angiography with gadolinium contrast agents. Magn Reson Imaging Clin N Am 1996; 4: 11-24. [ Links ]
18.Debatin JF, Hany TF. MR-based assessment of vascular morphology and function. Eur Radiol 1998; 8: 528-539. [ Links ]
19.Poustchi-Amin M, Gutierrez FR, Brown JJ, Mirowitz SA, Narra VR, Takahashi N et al. Performing cardiac MR imaging: an overview. Magn Reson Imaging Clin N Am 2003; 11: 1-18. [ Links ]
20.Poustchi-Amin M, Gutierrez FR, Brown JJ, Mirowitz SA, Narra VR, Takahashi N et al. How to plan and perform a cardiac MR imaging examination. Radiol Clin North Am 2004; 42: 497-514. [ Links ]
21.Yoo SJ, Lee YH, Cho KS, Kim DY. Sequential segmental approach to fetal congenital heart disease. Cardiol Young 1999; 9: 430-444. [ Links ]
22.Barkhausen J, Ruehm SG, Goyen M, Buck T, Laub G, Debatin JF. MR evaluation of ventricular function: true fast imaging with steady-state precession versus fast low-angle shot cine MR imaging: feasibility study. Radiology 2001; 219: 264-269. [ Links ]
23.Alfakih K, Thiele H, Plein S, Bainbridge GJ, Ridgway JP, Sivananthan MU. Comparison of right ventricular volume measurement between segmented k-space gradient-echo and steady-state free precession magnetic resonance imaging. J Magn Reson Imaging 2002; 16: 253-258. [ Links ]
24.Alfakih K, Plein S, Thiele H, Jones T, Ridgway JP, Sivananthan MU. Normal human left and right ventricular dimensions for MRI as assessed by turbo gradient echo and steady-state free precession imaging sequences. J Magn Reson Imaging 2003; 17: 323-329. [ Links ]
25.Hudsmith LE, Petersen SE, Francis JM, Robson MD, Neubauer S. Normal human left and right ventricular and left atrial dimensions using steady state free precession magnetic resonance imaging. J Cardiovasc Magn Reson 2005; 7: 775-782. [ Links ]
26.Van der Geest RJ, Lelieveldt BP, Reiber JH. Quantification of global and regional ventricular function in cardiac magnetic resonance imaging. Top Magn Reson Imaging 2000; 11: 348-358. [ Links ]
27.Alfakih K, Reid S, Jones T, Sivananthan M. Assessment of ventricular function and mass by cardiac magnetic resonance imaging. Eur Radiol 2004; 14: 1813-1822. [ Links ]
28.Baer FM, Voth E, Schneider CA, Theissen P, Schicha H, Sechtem U. Comparison of low-dose dobutamine-gradient-echo magnetic resonance imaging and positron emission tomography with [18F]fluorodeoxyglucose in patients with chronic coronary artery disease. A functional and morphological approach to the detection of residual myocardial viability. Circulation 1995; 91:1006-1015. [ Links ]
29.Wu KC, Lima JA. Noninvasive imaging of myocardial viability: current techniques and future developments. Circ Res 2003; 93: 1146-1158. [ Links ]
30.Sandstede JJ. Assessment of myocardial viability by MR imaging. Eur Radiol 2003;13: 52-61. [ Links ]
31.Baer FM, Theissen P, Schneider CA, Voth E, Sechtem U, Schicha H et al. Dobutamine magnetic resonance imaging predicts contractile recovery of chronically dysfunctional myocardium after successful revascularization. J Am Coll Cardiol 1998; 31: 1040-1048. [ Links ]
32.Kim RJ, Fieno DS, Parrish TB, Harris K, Chen EL, Simonetti O et al. Relationship of MRI delayed contrast enhancement to irreversible injury, infarct age, and contractile function. Circulation 1999; 100: 1992-2002. [ Links ]
33.Gibbons RJ, Valeti US, Araoz PA, Jaffe AS. The quantification of infarct size. J Am Coll Cardiol 2004; 44: 1533-1542. [ Links ]
34.Haase J, Bayar R, Hackenbroch M, Storger H, Hofmann M, Schwarz CE et al. Relationship between size of myocardial infarctions assessed by delayed contrast-enhanced MRI after primary PCI, biochemical markers, and time to intervention. J Interv Cardiol 2004; 17: 367-373. [ Links ]
35.Shan K, Constantine G, Sivananthan M, Flamm SD. Role of cardiac magnetic resonance imaging in the assessment of myocardial viability. Circulation 2004; 109: 1328-1334. [ Links ]
36.Kim RJ, Wu E, Rafael A, Chen EL, Parker MA, Simonetti O et al. The use of contrast-enhanced magnetic resonance imaging to identify reversible myocardial dysfunction. N Engl J Med 2000; 343: 1445-1453. [ Links ]
37.Choi KM, Kim RJ, Gubernikoff G, Vargas JD, Parker M, Judd RM. Transmural extent of acute myocardial infarction predicts long-term improvement in contractile function. Circulation 2001; 104: 1101-1107. [ Links ]
38.Kuhl HP, Beek AM, van der Weerdt AP, Hofman MB, Visser CA, Lammertsma AA et al. Myocardial viability in chronic ischemic heart disease: comparison of contrast-enhanced magnetic resonance imaging with (18)F-fluorodeoxyglucose positron emission tomography. J Am Coll Cardiol 2003; 41: 1341-1348. [ Links ]
39.Mahrholdt H, Wagner A, Judd RM, Sechtem U, Kim RJ. Delayed enhancement cardiovascular magnetic resonance assessment of non-ischaemic cardiomyopathies. Eur Heart J 2005; 26: 1461-1474. [ Links ]
40.Moon JC, McKenna WJ, McCrohon JA, Elliott PM, Smith GC, Pennell DJ. Toward clinical risk assessment in hypertrophic cardiomyopathy with gadolinium cardiovascular magnetic resonance. J Am Coll Cardiol 2003; 41: 1561-1567. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Gorka Bastarrika
Servicio de Radiología. Clínica Universitaria
Universidad de Navarra
Avenida Pío XII, 36
31008 Pamplona
Tfno. 948 255400
Fax: 948 296500
E-mail: bastarrika@unav.es
Fecha de recepción el 7 de marzo de 2007
Aceptado para su publicación el 25 de mayo de 2007
Aceptación definitiva para su publicación el 6 de junio de 2007