My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.32 n.3 Pamplona Sep./Dec. 2009
Ganglio centinela en cáncer de mama: biopsia selectiva comparada con linfadenectomía axilar. Seguimiento a largo plazo
Sentinel ganglion in breast cancer: selective biopsy compared with axillary lymphadectomy
E. Goñi1, M.E. Martínez Lozano1, C. Estébanez1, A. Camarero1. F. Vicente2, M.A. Sanz de Pablo3, J.L. Martínez Rodríguez1
1. Servicio de Medicina Nuclear. Hospital de Navarra. Pamplona
2. Servicio de Cirugía General. Hospital de Navarra. Pamplona.
3. Servicio de Cirugía General. Hospital Virgen del Camino. Pamplona.
Dirección para correspondencia
RESUMEN
Fundamento. La biopsia selectiva del ganglio centinela (BSGC) ha reemplazado a la linfadenectomía axilar (LA), como procedimiento de elección, en el estadiaje del cáncer de mama en estadios iniciales y axila clínicamente negativa. El objetivo de este trabajo es comparar la supervivencia global y libre de eventos de aquellas pacientes a las que se realizó, en el periodo de validación de la técnica, BSGC seguida de LA respecto a las que se practicó BSGC y LA si el ganglio centinela (GC) presentaba metástasis.
Material y métodos. Se han incluido 148 pacientes, 81 pertenecientes al periodo de validación y 67 al grupo de aplicación clínica. El radiocoloide se administró intra-peritumoralmente, obteniéndose imágenes hasta la visualización del GC, posteriormente en la intervención quirúrgica se procedió a su identificación y extirpación.
Resultados. En el grupo de validación, la eficacia de la técnica ha sido del 92,5%, la sensibilidad del 95,6% y la tasa de falsos negativos del 4%. De las 81 pacientes, 75 se encuentran libres de enfermedad (92,6%). De las 67 pacientes pertenecientes al grupo de aplicación clínica, 63 (94%) viven libres de enfermedad. Ninguna paciente ha presentado recurrencia ganglionar axilar.
Conclusiones. En la validación de la técnica hemos obtenido unos valores que se hallan dentro de las exigencias de calidad generalmente aceptadas. Con una media de seguimiento de 6 años no hemos observado recurrencia axilar en ninguno de los dos grupos. No existe diferencia estadísticamente significativa en la supervivencia global y libre de eventos entre ambos grupos.
Palabras clave. Ganglio centinela. Cáncer de mama. Linfogammagrafía. Supervivencia global. Supervivencia libre de enfermedad.
ABSTRACT
Background. Selective biopsy of the sentinel ganglion (SBSG) has replaced axillary lymphadectomy (AL) as the procedure of choice in staging breast cancer in its initial stages and in clinically negative axilla. The aim of this study is to compare global event-free survival of those patients subjected to SBSG followed by AL, during the period of validation of the technique, with respect to those subjected to SBSG and AL if the sentinel ganglion (SG) showed metastasis.
Methods. One hundred and forty-eight patients were included, 81 belonging to the period of validation and 67 to the clinical application group. Radiocoloid was administered intraperitumorally, obtaining images up until the visualisation of the SG; its identification and extirpation were carried out subsequently in the surgical intervention.
Results. The efficacy of the technique in the validation group was 92.5%, sensitivity was 95.6% and the rate of false negatives was 4%. Of the 81 patients, 75 are free of disease (92.6%). Of the 67 patients belonging to the clinical application group, 63 (94%) are free of disease. No patient has presented axillary ganglion recurrence.
Conclusion. In the validation of the technique we obtained values that fall within the demands of generally accepted quality. With an average follow up of 6 years we did not observe axillary ganglion recurrence in any of the two groups. There is no statistically significant difference in global and event free survival between the two groups.
Key words. Sentinel ganglion. Breast cancer. Lympho-gammagraphy. Global survival. Disease free survival.
Introducción
El diagnóstico del estado de los ganglios linfáticos regionales de las pacientes con cáncer de mama en estadios iniciales, se ha visto revolucionado por el desarrollo de la biopsia selectiva del ganglio centinela (BSGC), ya que desde su introducción por Krag1 y Giuliano2 es posible detectar los ganglios linfáticos con metástasis ocultas, mediante un procedimiento mínimamente invasivo.
El ganglio centinela se define como el primer ganglio que recibe el drenaje directamente desde el tumor primario3. Si éste es negativo en el estudio anatomopatológico, puede evitarse una linfadenectomía innecesaria.
Diversas organizaciones como la Sociedad Americana de Oncología Clínica4, el National Comprehensive Cancer Network o consensos como el de Philadelphia5 o Saint Gallen6 han señalado que la BSGC es una alternativa válida a la disección axilar, en pacientes con cáncer de mama en estadios precoces, sin adenopatías axilares palpables y ecográficamente negativas. Sin embargo, los datos de seguimiento a largo plazo en estudios aleatorizados que incluyan un número elevado de pacientes no son todavía muy amplios7,8.
La técnica de la BSGC tiene algo más de una década de existencia y ha conocido una expansión sin precedentes en estos años. Una vez completada la fase de validación, en la que se realiza tanto la extirpación del ganglio centinela (GC) como la linfadenectomía axilar (LA), puede pasarse a su aplicación asistencial, siendo el procedimiento de elección en pacientes con cáncer de mama en estadios tempranos con axila clínicamente negativa9.
En el presente trabajo nos proponemos reflejar nuestros resultados, estableciendo la comparación en cuanto a supervivencia global y libre de enfermedad, entre dos grupos de pacientes: el primero, está constituido por aquellas pacientes que forman parte de la fase de validación de la técnica, en las que se realizó BSGC y LA reglada niveles I, II y III, y el segundo está formado por aquellas pertenecientes a la fase de aplicación clínica de la BSGC, en las que se realizó linfadenectomía axilar únicamente si el GC era positivo.
Material y métodos
Han formado parte de este estudio las pacientes remitidas al Servicio de Medicina Nuclear del Hospital de Navarra desde enero de 2001 hasta diciembre de 2003 para realización de linfogammagrafía y BSGC, que cumplían los criterios de inclusión recogidos en los protocolos de los comités de Patología Mamaria del Hospital Virgen del Camino y del Hospital de Navarra10 y en la Reunión de Consenso 200111, esto es T1-2 (≤ 3cm) y Tis extenso o de alto grado, sin afectación clínica axilar. Fueron criterios de exclusión la existencia de radioterapia axilar previa o quimioterapia neoadyuvante, adenopatías axilares clínica o ecográficamente sospechosas, gestación o no obtención del consentimiento informado.
Se han estudiado 148 pacientes: 81 pertenecientes al periodo de validación de la técnica en 2001-2002, en las que se llevó a cabo BSGC seguida de LA y 67 a la fase de aplicación clínica, iniciada en 2003, en las que se realizó BSGC y únicamente en los casos en que el GC fue positivo para metástasis se hizo LA.
Se utilizó como radiotrazador el sulfuro de renio coloidal marcado con 99mTc (Nanocis® Iba Molecular) con un tamaño de partícula de diámetro medio de 100 nm. Para el marcaje se siguió en cada caso el Procedimiento Normalizado de Trabajo de Radiofarmacia del Servicio de Medicina Nuclear del Hospital de Navarra, realizándose en todos los viales control de calidad radioquímico mediante cromatografía en papel (fase estacionaria Whatman 3mm; fase móvil acetona), admitiéndose únicamente aquellos cuyo resultado fue ≥95%.
La vía de administración fue intra-peritumoral, guiada por control ecográfico o mamográfico cuando el tumor no era palpable y cuando lo fue por palpación. Se administraron dosis de 55-74 MBq (1,5-2 mCi), en volúmenes de suero fisiológico de 0,5 a 1,5 ml.
En todas las pacientes se realizó una linfogammagrafía prequirúrgica (Fig. 1) con el fin de obtener un patrón de drenaje linfático en cada caso. Se obtuvieron imágenes, en proyecciones anterior y lateral, precoces (10-30 minutos), tardías (2-3 horas) y en el caso de realizarse la intervención a las 24 horas, previamente a ésta, utilizando para ello una gammacámara de campo amplio, colimador de baja energía y alta resolución (Skylight Philips y Dstxl GE®).
Con la ayuda de un lápiz de 57Co identificamos externamente la situación de los GC y la señalamos con tinta indeleble sobre la piel.
Para la localización intraoperatoria de GC post-tumorectomía se utilizó sonda gammadetectora Navigator® o Neoprobe®. Se consideró como GC aquel que presentó una mayor tasa de contaje (cuentas por segundo) y que estaba en la zona donde aparecía en la linfogammagrafía. Una vez extraído se rastreó el lecho quirúrgico y se extirparon también los ganglios, que presentaron una tasa de contaje superior al 10% de las cuentas del GC.
El análisis anatomopatológico se realizó mediante tinción con hematoxilina-eosina e inmunohistoquímica con queratinas de alto y bajo peso molecular12. En los casos en que los resultados del estudio anatomopatológico del ganglio centinela fueron positivos para metástasis se realizó linfadenectomía axilar, en el mismo tiempo quirúrgico o en una segunda intervención cuando el diagnóstico fue en estudio histológico diferido.
El seguimiento de estas pacientes ha sido realizado por los servicios de Cirugía del Hospital de Navarra y Hospital Virgen del Camino y Oncología del Hospital de Navarra incluyendo mamografía, analítica con marcadores tumorales, ecografía axilar en los casos en los que no se realizó LA y radiología simple tórax anual. Han recibido el tratamiento radio, quimio u hormonoterápico según estadio y protocolo de las Unidades de Patología Mamaria del Hospital de Navarra y Hospital Virgen del Camino.
Retrospectivamente, se ha analizado la evolución de estas pacientes desde la realización de la linfogammagrafía y BSGC hasta marzo de 2009, o sea, durante un periodo de 98 meses.
Para realizar el análisis estadístico se ha utilizado SPSS versión 17.0 (SPSS Inc, Chicago, IL), empleándose test parámetricos y no paramétricos para estudiar las diferencias entre ambos grupos, considerándose significativos valores de p <0,5. Para la realización del análisis de supervivencia de Kaplan-Meier se han definido como eventos la recurrencia axilar ganglionar, aparición de cáncer de mama contralateral o ipsilateral o el desarrollo de metástasis hematógenas.
Resultados
Las características de los dos grupos a comparar se presentan en la tabla 1.
Las pacientes pertenecientes al grupo de validación (n=81) tenían una edad media de 56,47±9,85 años, rango 36-80, de la cuales, 3 contaban con el antecedente de neoplasia mamaria previa, una presentaba cáncer papilar de tiroides, una era portadora de una mutación BRCA2 y 4 habían sufrido una histerectomía. La media del tamaño del tumor fue de 1,38 cm, con un intervalo de confianza del 95% (1,24-1,53).
Siguiendo la clasificación del tamaño tumoral de la 6a Revisión de la AJCC13 el grupo más numeroso, 43 (53,1%) pacientes (54,2%), pertenecían a un estadio T1C (tumor >1 cm, pero ≤2 cm). El tumor se hallaba situado en 43 pacientes en mama izquierda y en 38 en derecha. Por cuadrantes, el más frecuente fue el superior externo 32 pacientes (39,8%), seguido de intersección de cuadrantes superiores 14 (16,9%) e inferior interno 9 (12%). Se realizó cirugía conservadora en 72 de ellas y mastectomía en 9.
El tipo histológico del tumor más frecuente fue el carcinoma ductal infiltrante 61 pacientes (75,3%), seguido del lobulillar 9 (10,8%) y ductal in situ 6 (7,42%) pacientes, de las cuales 5 presentaban microinfiltración.
En la linfogammagrafía se apreció migración del radiotrazador a ganglios axilares en 59 pacientes, a región axilar y mamaria interna en 17, en una a zona axilar, mamaria interna e infraclavicular y otra únicamente a región infraclavicular.
En la BSGC se obtuvo una media de 1,7 ganglios centinelas (1 a 7) y realizada linfadenectomía axilar se extrajeron una media de 15,8 ganglios axilares (5 a 31).
La eficacia de la técnica de la BSGC fue del 92,5%, dado que en 6 de las 81 pacientes no se obtuvo GC. En tres no se observó migración del radiocoloide, en otra el material remitido a Anatomía Patológica fue insuficiente y en las dos restantes no fue posible su localización en el momento quirúrgico. A todas ellas se les practicó LA, siendo negativa en 5 y positiva en una; en la actualidad se encuentran libres de enfermedad.
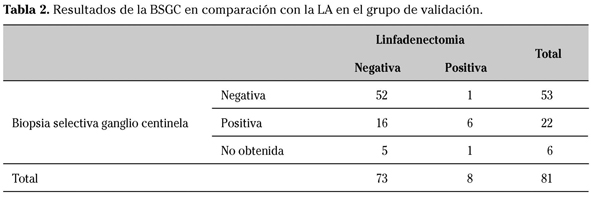
En 52 pacientes en las que la BSGC fue negativa, la LA también resultó negativa. En una paciente el GC fue negativo mientras que la LA fue positiva, por tanto la tasa de falsos negativos (FN) fue del 4%. En 22 (29,3%) pacientes la BSGC fue positiva, 16 de las cuales el GC era el único afectado y en 6 en la linfadenectomía se hallaron otros ganglios axilares afectos. La sensibilidad de técnica de la BSGC fue del 95,6%, el valor predictivo negativo (VPN) fue 98% (Tabla 2).
En el periodo de seguimiento realizado (34-98 meses, media 83,50±11,4) observamos que de las 81 pacientes pertenecientes al grupo de validación, 75 (92,6%) viven libres de enfermedad y 2 habían fallecido a los 34 y 43 meses como consecuencia de la diseminación hematógena del cáncer de mama, en una de las cuales la BSGC fue positiva y en otra negativa. Otras 2 pacientes fallecieron a causa de cáncer de pulmón y colangiocarcinoma, por tanto la supervivencia global fue del 95,1%.
En otros dos casos las pacientes presentan enfermedad activa; una de ellas con metástasis ósea en L2 (si bien esta paciente contaba con el antecedente de neoplasia en mama contralateral dos años antes) y la otra presentó una recidiva local en forma de cáncer de mama inflamatorio ipsilateral y posteriormente derrame pleural. En ambas pacientes la BSGC fue positiva (Fig. 2).
Durante el seguimiento, a 7 pacientes se les detectó de nuevo cáncer de mama; 5 en la mama contralateral, en un periodo de 48 meses de media (28-79) y 2 ipsilateral a los 49 y 61 meses. Una de las pacientes que presentó neoplasia en la mama contralateral corresponde a la previamente mencionada que falleció por cáncer de pulmón y una de las que presentó recurrencia ipsilateral desarrolló como se ha mencionado metástasis hematógena, mientras que el resto viven libres de enfermedad.
Una paciente de este grupo, en la que tanto los dos GC axilares como los 21 del vaciamiento axilar fueron negativos, presentó a los 41 meses, metástasis en dos ganglios cervicales ipsilaterales. Se extrajeron quirúrgicamente, recibiendo posteriormente radio y quimioterapia, sin que actualmente se evidencie patología oncológica. Por otra parte, tres pacientes presentaron adenopatías inespecíficas (2 axilares y una cervical), dos nódulos benignos en mama y una nódulo benigno en la cicatriz (Tabla 3).
Las pacientes pertenecientes al grupo de aplicación clínica de la técnica de la BSGC (n=67) tenían una edad media de 57,1 ± 7,91. Cuatro pacientes de este grupo contaban con el antecedente de neoplasia mamaria previa y una de tumor bordeline de ovario. El tamaño medio del tumor fue de 1,17 cm, intervalo de confianza 95% (0,99-1,35), correspondiendo 27 pacientes a un estadio T1B y 25 T1C (40,3% y 37,3% respectivamente). El carcinoma ductal infiltrante fue el tipo histológico más frecuente con 37 pacientes, es decir el 55,2% de la muestra, porcentaje muy inferior al hallado en el grupo de validación, siendo esta diferencia estadísticamente significativa. El segundo en frecuencia fue carcinoma ductal in situ con 17 (25,4%), de ellos 7 eran de alto grado y 5 con microinfiltración, y en tercer lugar el carcinoma lobulillar que se diagnosticó en 5 pacientes (7,5%).
En la linfogammagrafía hallamos migración del radiocoloide a ganglios axilares en 48 casos, 4 a mamaria interna, 15 a ambas regiones; en dos casos detectamos además ganglios intramamarios.
En 58 pacientes se realizó cirugía conservadora y en 9 mastectomía. En la BSGC se obtuvieron 1,9 ganglios, rango 1-6. El estudio anatomopatológico de los mismos resultó negativo en 55 pacientes (82,1%) y positivo en 12 (17,9%). De estos 12 casos se realizó vaciamiento axilar en 11 pacientes, hallándose que en 5 el GC era el único afectado y en las 6 restantes había otros ganglios axilares metastatizados. En una el ganglio centinela solo tenía células tumorales aisladas y no se realizó linfadenectomía.
En el seguimiento de estas 67 pacientes, que osciló entre 14 a 90 meses (media 68,22±10,9), se encontraron 3 fallecimientos, siendo por tanto la supervivencia global del 95,6%; 63 viven libres de enfermedad (94%) y una vive enferma a causa del cáncer de mama. De las pacientes que han fallecido, en dos se ha debido a metástasis hematógenas del cáncer de mama, una, que contaba con el antecedente de cáncer de mama a los 17 meses de la cirugía y la otra a los 55 meses. En la primera el resultado de la BSGC fue negativo y en la segunda positivo para metástasis. La tercera paciente falleció a causa de un cáncer de pulmón. La paciente que vive con enfermedad activa, presentó metástasis hepáticas a los 48 meses de la BSGC, cuyo resultado fue negativo. Esta paciente tenía una neoplasia de la mama contralateral diagnosticada 17 años antes de la actual (Fig. 3).
Así mismo, una paciente de este grupo desarrolló un nuevo cáncer en la mama contralateral a los 8 meses, aunque actualmente vive libre de enfermedad. Ninguna de las pacientes de este grupo ha presentado recurrencia ganglionar axilar; se detectaron adenopatías axilares, que resultaron benignas en dos pacientes y en otro caso un nódulo en mama también de características benignas.
En el periodo de seguimiento realizado a las 148 pacientes que ha oscilado entre 14 y 98 meses, con una media de 76,5 ± 13,5 meses (6,3 ± 1,1 años), no se ha hallado diferencia significativa en la supervivencia global entre los dos grupos y, así mismo, en el análisis de supervivencia de Kaplan-Meier, como muestran las figuras 4 y 5, tampoco se ha hallado diferencia significativa (log-rank 0,20) en la aparición de eventos entre las pacientes en las que se ha realizado LA y aquellas a las que se ha practicado BSGC.
Discusión
La seguridad diagnóstica del ganglio centinela ha sido validada en gran número de estudios que comparan la BSGC con la tradicional disección axilar en el mismo paciente14-16. En un metaanálisis llevado a cabo por Miltenburg y col17 se concluye que la BSGC refleja con exactitud el estado de los ganglios axilares en un 97% de casos y presenta un 5% de falsos negativos. Las cifras de resultados FN varían en la literatura entre un 5-10%, así por ejemplo autores como Harlow y col18 obtienen un 6,7%, durante el periodo de aprendizaje de la técnica previo a la inclusión de los participantes en el ensayo clínico NSABP B-32.
El porcentaje de resultados falsamente negativos está en relación con el tamaño del tumor primario, siendo significativamente superior en T3 que en T1-T2 y con el número de GC obtenidos en la BSGC, de forma que disminuye cuando se obtienen tres o más GC19.
En la Reunión Nacional de Consenso de Salamanca11, uno de los puntos acordados fue que antes de abandonar la LA sistemática se deben obtener unos resultados de la BSGC mayores de un 90% de localización y FN menores o iguales a 5% en un número de 50 casos. En nuestro caso, como queda expuesto en el apartado anterior, en las 81 pacientes que integran el grupo de validación de la técnica, hemos tenido un 92,8% de eficacia de la técnica y una tasa de FN del 4%.
Habiéndose aceptado la BSGC como procedimiento de elección para estadiaje axilar en el cáncer de mama con ganglios clínicamente negativos, todavía quedan cuestiones por resolver relativas a la seguridad a largo plazo, especialmente en el control local de los ganglios axilares, que permanecen sin respuesta definitiva. Para que la BSGC reemplace a la LA, es necesario que el control local de la axila sea al menos comparable al obtenido con la LA.
Estudios observacionales a partir de largas series de pacientes muestran unos porcentajes de recurrencia axilar muy bajos, es el caso de Veronesi y col20 que en 3.548 pacientes con BSGC negativa a las que no se realizó LA, encuentran 31 metástasis axilares (0,9%), con un seguimiento de medio de 48 meses. Canavese y col21 en un grupo más reducido de pacientes (n=79), con un seguimiento medio de 5,5 años no hallan recurrencia axilar. Naik y col22, en 2340 pacientes, encuentran 3 casos de recurrencia axilar (0,12%) y concluyen que es comparable a la LA. Así mismo, el metaanálisis realizado por van Der Ploeg y col23 señala un 0,3% de recurrencia axilar, al que podemos añadir varios trabajos24-26 que señalan que en pacientes sin LA tras BSGC negativa la recurrencia axilar es mucho más baja de lo que cabría esperar en base a los resultados de ganglios centinelas falsos negativos.
En este punto, en la muestra analizada no hemos hallado ningún caso de recurrencia axilar, aunque este estudio presenta la limitación del escaso número de pacientes estudiadas. Esto es debido a que nuestro objetivo era comparar, en los dos grupos de pacientes, no sólo la recurrencia axilar, sino todos los eventos relacionados con el cáncer de mama con una media de seguimiento superior a 5 años.
Recientemente se están publicando en la literatura científica trabajos que indican que la BSGC tiene resultados, en términos de supervivencia global y libre de enfermedad, similares a la LA en pacientes con ganglios negativos27 o incluso mejores28, mientras que otros autores consideran que se necesitan estudios aleatorizados más amplios29. En nuestro caso, la supervivencia global de las pacientes de un grupo respecto al otro no ha mostrado diferencia significativa. Así mismo, no se ha observado diferencia en la aparición de recurrencia locorregional y metástasis a distancia entre las pacientes que fueron sometidas a LA frente a las que se realizó BSGC, siendo esta última menos invasiva, de tal modo que la supervivencia libre de enfermedad ha sido del 92,4% en el grupo de validación y más elevado, 94%, en el grupo de aplicación clínica. Estos buenos resultados pueden verse influenciados porque existen diferencias significativas en el tamaño e histología del tumor primario, así como en el número de BSGC positivas entre estos dos grupos de pacientes; de tal forma que las pertenecientes al grupo de aplicación clínica han presentado un menor tamaño del tumor primario (1,17 vs 1,39), un menor número de carcinomas ductales infiltrante (55,2% vs 75,3%) y un porcentaje de positividad de la BSGC del 17,9% frente a 29,3% del grupo de validación.
Puede concluirse que en la validación de la técnica hemos obtenido unos valores que se hallan dentro de las exigencias de calidad generalmente aceptadas.
Por otra parte, a pesar de lo limitado de la muestra, la BSGC en el grupo de pacientes aquí estudiado, no ha presentado resultados en cuanto a supervivencia libre de enfermedad e incidencia de eventos inferior a la LA.
En nuestra opinión para poder evaluar los resultados obtenidos con la aplicación de la BSGC se debe realizar, necesariamente, un seguimiento a largo plazo de las pacientes, porque si bien es cierto que la mayoría de recurrencias ocurren en la primera década, particularmente entre 2 y 5 años, pueden ocurrir mucho más tarde, principalmente en tumores con receptores positivos30,31.
Así mismo, el tamaño de la muestra debería ampliarse, en cuanto al seguimiento de las pacientes sometidas a BSGC se refiere, para poder extraer conclusiones significativas. Estas nos permitirían, a su vez, evaluar los resultados obtenidos con la aplicación de la misma.
Agradecimientos
A los doctores Gregorio Tiberio, Javier Lafita, Fernando Domínguez y José Juan Illarramendi por sus valiosas aportaciones.
Bibliografía
1. Krag DN, Weaver DL, Alex JD, Fairbank JT. Surgical resection and radiolocalization of sentinel lymph node in breast cancer using a gamma probe. Surg Oncol 1993; 2: 335-349. [ Links ]
2. Giuliano AE, Dirgan DM, Guenther M, Morton DL. Lymphatic mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994; 220: 391-401. [ Links ]
3. Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992; 127: 392-399. [ Links ]
4. Lyman GH, Giuliano AE, Somerfield MR, Benson III AB, Bodurka DC, Burstein HJ et al. American society of clinical oncology guideline. Recommendations for sentinel node biopsy in early-stage breast cancer. J Clin Oncol 2005; 23: 7703-7720. [ Links ]
5. Schwartz GF, Giuliano AE, Veronesi U and the Consensus Conference Committee. Proceedings of the consensus conference on the role of sentinel lymph node biopsy in carcinoma of the breast, April 19-22, 2001, Philadelphia, Pennsylvania. Cancer 2002; 94: 2542-2551. [ Links ]
6. Senn HJ, Thurlimann B, Goldhirsch, Wood WC, Gelber RD, Coates AS. Comments on the St. Gallen Consensus 2003 on the primary therapy of early breast cancer. Breast 2003; 12: 569-582. [ Links ]
7. Mabry H, Giuliano AE. Sentinel node mapping for breast cancer: progress to date and prospects for the future. Surg Oncol Clin N Am 2007; 16: 55-70. [ Links ]
8. Fant JS, Grant MD, Knox SM, Livingston SA, Ridl K, Jones RC et al. Preliminary outcome analysis in patients with breast cancer and positive sentinel lymph node who declined axillary dissection. Ann Surg Oncol 2003; 10: 126-130. [ Links ]
9. Mansel RE, Fallowfield L, Kissin M, Goyal A, Newcombe RG, Dixon JM et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC trial. J Natl Cancer Inst 2006; 98: 599-609. [ Links ]
10. Vicente F, Miranda MC, Martínez-Peñuela JM, Martínez E, Lera JM. Ganglio centinela en carcinoma de mama: situación actual. Criterios de actuación en el Hospital de Navarra. An Sist Sanit Navar 2001; 24: 363-367. [ Links ]
11. Ganglio centinela y cáncer de mama. Reunión Nacional de Consenso de Salamanca. Rev Esp Med Nuclear 2002; 21: 77-79. [ Links ]
12. Córdoba A, Ederra M, Amat I, Beloqui R, Miranda C, Zozaya E et al. Ganglio centinela en cáncer de mama. Estudio histológico de 67 casos. An Sist Sanit Navar 2004; 27: 191-200. [ Links ]
13. Singletary SE, Allred C, Ashley P, Bassett LW, Berry D, Bland KL et al. Revision of the American joint committee on cancer staging system for breast cancer. J Clin Oncol 2002; 20: 3628-3636. [ Links ]
14. Guiliano AE, Jones RC, Brennan M, Statman R. Sentinel lymphadenectomy in breast cancer. J Clin Oncol 1997; 15: 2345-2350. [ Links ]
15. Krag D, Weaver D, Ashikaga T, Moffat F, Klimberg VS, Shriver C et al. The sentinel node in breast cancer. A multicenter validation study. N Engl J Med 1998; 339: 941-946. [ Links ]
16. Veronesi U, Paganelli G, Viale G, Galimberti V, Luini A, Zurrida S et al. Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series. J Natl Cancer Inst 1999; 91: 368-373. [ Links ]
17. Miltenburg DM, Miller C, Karamlou TB, Brunicardi FC. Meta-analysis of sentinel lymph node biopsy in breast cancer. J Surg Res 1999; 84: 138-142. [ Links ]
18. Harlow SP, Krag DN, Julian TB, Ashikaga T, Weaver DL, Feldman SA et al. Prerandomization surgical training for the national adjuvant breast and bowel proyect (NSABP). A randomized phase III clinical trial to compare sentinel node resection to conventional axillary dissection in clinical node negative breast cancer. Ann Surg 2005; 241: 48-54. [ Links ]
19. Goyal A, Newcombe RG, Chhabra A, Mansel RE, ALMANAC Trialists group. Factors affecting failed localization and false-negative rates of sentinel node biopsy in breats cancer-results of the ALMANAC validation phase. Breast Cancer Res Treat 2006; 99: 203-208. [ Links ]
20. Veronesi U, Galimberti V, Paganelli G, Maisonneuve P, Viale G, Orecchia R et al. Axillary metastases in breast cancer patients with negative sentinell nodes: a follow-up of 3548 cases. Eur J Cancer 2009; 45: 1381-1388. [ Links ]
21. Canavese G, Catturich A, Vecchio C, Tomei D, Gippone M, Villa G et al. Sentinel node biopsy compared with complete axillary dissection for staging early breast cancer with clinically negative lymph nodes: results of randomized trial. Ann Oncol 2009; 20: 1001-1007. [ Links ]
22. Naik AM, Fey J, Gemignani M, Heerot A, Montgomery L, Petrek J et al. Risk of axilary relapse after sentinel lymph node biopsy for breast cancer is comparable with that of axillary lymph node dissection. A follow-up of 4008 procedures. Ann Surg 2004; 240:462-471. [ Links ]
23. Van der ploeg IM, Nieweg OE, Van rijk MC, Valdés Olmos RA, Kroon BB. Axillary recurence after a tumor-negative sentinel node biopsy in breast cancer patients: a systematic review and meta-analysis of the literature. Eur J Surg Oncol 2008; 34: 1277-1284. [ Links ]
24. Torrenga H, Fabry H, Van der sijp JR, Van Diest PJ, Pijpers R, Meijer S. Omitting axillary lymph node dissection in sentinel node negative breast cancer patients is safe: a long term follow-up analysis. J Surg Oncol 2004; 88: 4-7. [ Links ]
25. Smidt ML, Janssen CM, Kuster DM, Bruggink Ed, Strobbe LJ. Axillary recurrence after a negative sentinel node biopsy for breast cancer: incidence and clinical significance. Ann Surg Oncol 2005; 12: 29-33. [ Links ]
26. Langer I, Marti WR, Guller U, Moch H, Harder F, Oertli D et al. Axillary recurrence rate in breast cancer patients with negative sentinel lymph node (SLN) or SLN micrometatases: prospective analysis of 150 patients after SLN biopsy. Ann Surg 2005; 241: 152-158. [ Links ]
27. Kuijt GP, Van de poll-franse LV, Voogd AC, Nieuwenhuijzen GA, Roumen RM. Survival after negative sentinel lymph node biopsy in breast cancer at least equivalent to after extensive axillary dissection. Eur J Surg Oncol 2007; 33: 832-837. [ Links ]
28. Langer I, Guller U, Hsu-schmitz SF, Ladewig A, Viehl CT, Moch H et al. Sentinel lymphnode biopsy is associated with improved survival compared to level I y II axillary lymph node dissection in node negative breast cancer patients. Eur J Surg Oncol 2009; 35: 805-813. [ Links ]
29. Zavagno G, De salvo GL, Scalco G, Bozza F, Barutta L, Del Bianco P et al. A randomized clinical trial on sentinel lymph node biopsy versus axillary node dissection in breast cancer. Results of the sentinella/GIVOM trial. Ann Surg 2008; 247: 207-213. [ Links ]
30. Early Breast Cancer Trialists´ Collaborative Group. Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomized trials. Lancet 2005; 365: 1687-1717. [ Links ]
31. Saphner T, Tormey DC Gray R. Annual hazard rates of recurrence for breast cancer after primary therapy. J Clin Oncol 1996; 14: 2738-2746. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Elena Goñi Gironés
Servicio de Medicina Nuclear
Hospital de Navarra
Tfno. 848422151
E-mail: egonigir@cfnavarra.es
Recepción: 16 de julio de 2009
Aceptación provisional: 1 de septiembre de 2009
Aceptación definitiva: 28 de septiembre de 2009