Introducción
Las infecciones relacionadas con la asistencia sanitaria afectan en torno al 8% de todos los pacientes hospitalizados1 y constituyen la segunda causa de efectos adversos producidos por la atención médica en España2, solo superada por los errores de medicación.
La infección de sitio quirúrgico (ISQ) se define como aquella infección que, no estando presente ni en periodo de incubación ni con sintomatología en el periodo previo a la cirugía, aparece en la incisión quirúrgica o en los tejidos de su vecindad en un periodo de 30 días tras la intervención, o 90 días en caso de implantes o prótesis3. Este tipo de infecciones suponen la primera causa de infección de origen nosocomial en España, donde un 25% del total de infecciones han sido debidas a ISQ en el último año1, lo que contribuye al aumento de la estancia hospitalaria y de la morbimortalidad de los pacientes que las sufren, además del incremento del coste sanitario. Los pacientes que desarrollan una ISQ tienen un 60% más de probabilidad de ingresar en una unidad de cuidados intensivos, cinco veces más de reingresar en el hospital y el doble de posibilidades de fallecer que los pacientes sin infección4.
Numerosos estudios estiman que hasta un 60% de las infecciones de origen hospitalario son prevenibles2 5 6. Una de las medidas más conocidas y eficaces para ello es la profilaxis antibiótica, que consiste en la administración de antibióticos previos a la intervención, con el objetivo de mantener concentraciones bactericidas del mismo en la incisión quirúrgica y zonas adyacentes. La profilaxis antibiótica está indicada en las cirugías contaminadas, limpias-contaminadas, y en algunos casos especiales de cirugías limpias (implantes, inmunosupresión, neurocirugía y cirugía cardíaca).
La cirugía de mama es un procedimiento cada vez más frecuente en nuestro medio, aproximadamente 60.000 mujeres al año son sometidas a alguna intervención de mama en España. En el año 2011 la tasa de ISQ en cirugía de mama en la Comunidad de Madrid fue del 3,9%7, siendo dicha tasa mayor de lo esperable en cirugía limpia (2%), debido al uso de implantes y la frecuente malignidad de las lesiones intervenidas, que constituyen factores de riesgo conocidos para el desarrollo de infección6. El coste medio para el sistema sanitario de un paciente con infección quirúrgica de mama es casi tres veces superior a la de aquel que no la presenta8.
El objetivo del presente estudio fue evaluar el porcentaje de adecuación de la profilaxis antibiótica en cirugía de mama, así como el efecto de su inadecuación sobre la ISQ.
Material y métodos
Se realizó un estudio de cohortes prospectivo para conocer la incidencia de ISQ en el Hospital Universitario Fundación Alcorcón (HUFA) de la Comunidad de Madrid para evaluar la adecuación de la profilaxis antibiótica en cirugía de mama. Se incluyó a todas las pacientes del Servicio de Ginecología y Obstetricia a las que se hubiera realizado alguna intervención mediante alguno de los procedimientos del epígrafe mama (BREAST) del NHSN (National Healthcare Safety Network), entre julio de 2008 y julio de 2018. Se excluyeron las pacientes con una infección clínica activa en el momento de la operación, así como los hombres intervenidos.
Se realizó un seguimiento diario de las pacientes desde su ingreso hasta el alta, tomando datos de la evolución y los posibles signos o síntomas de infección. También se valoraron sus revisiones en los 30 días posteriores a la operación (90 en caso de implantes o prótesis) o si tuvieron un reingreso. Se calculó la incidencia de ISQ siguiendo los criterios de los CDC (Centers for Disease Control and Prevention) y se diferenció según su profundidad en superficial, profunda y de órgano-espacio9.
El tamaño muestral fue calculado para una estimación de la incidencia de infección quirúrgica del 3% con un nivel de confianza del 95% y una precisión del 1%; asumiendo un 5% de posibles pérdidas durante el seguimiento, se obtuvo como necesaria la inclusión de 1.177 pacientes en el estudio, la cual se realizó de manera consecutiva. El estudio fue aprobado por el Comité de Ética de la Investigación Clínica del HUFA.
Se diseñó una ficha específica para la recogida de datos. La evolución y seguimiento fue realizada por el personal de la Unidad de Medicina Preventiva, quienes acudieron a ver a las pacientes diariamente desde su ingreso. La información se obtuvo de la historia clínica electrónica, el contacto directo con la paciente y su equipo médico, y los resultados de laboratorio. Todos los datos recogidos se registraron en la aplicación INCLIMECC (Indicadores Clínicos de Mejora Continua de la Calidad).
Las variables estudiadas fueron edad, sexo, comorbilidades, fecha de ingreso y de alta, fecha de la intervención, código del procedimiento quirúrgico -según la Clasificación Internacional de Enfermedades (CIE)-, duración de la intervención, riesgo anestésico ASA, grado de contaminación de la cirugía, infección de la herida, profundidad de la infección, microorganismo implicado en la misma y cumplimiento de la profilaxis. Se consideró una profilaxis antibiótica incorrecta cuando al menos uno de los cinco ítems estudiados (elección del antibiótico, vía de administración, tiempo de inicio, dosis y duración) no estaba registrado o no se efectuó de acuerdo al protocolo del centro, siendo la pauta estándar 2 gramos de cefazolina intravenosa en los 30-60 minutos previos a la cirugía o 1 gramo de vancomicina intravenosa, en pacientes con alergia a beta-lactámicos, entre 60 y 90 minutos antes de la intervención.
Las variables cualitativas se describieron con su frecuencia y porcentaje y se compararon mediante la prueba χ² de Pearson. Las variables cuantitativas se describieron con la media y desviación estándar (DE), o con la mediana y rango intercuartílico (RIC) si su distribución no era normal; el criterio de normalidad se evaluó mediante la prueba de Kolmogorov-Smirnov. Las variables cuantitativas de dos categorías se compararon con la prueba t de Student, o con la prueba no paramétrica U de Mann-Whitney en caso de que la distribución no fuera normal. Se calculó la incidencia de ISQ durante el periodo de seguimiento. La relación entre la adecuación al protocolo de profilaxis antibiótica y la incidencia de infección quirúrgica se estimó con el riesgo relativo (RR) y su intervalo de confianza al 95% (IC95%), considerándose diferencias estadísticamente significativas aquellas con p<0,05. El análisis estadístico se realizó con el programa SPSS v21.0 y el tamaño muestral se calculó mediante el programa epidemiológico Epidat 4.2.
Resultados
Se incluyeron 1.212 pacientes en el estudio, con edad media de 57,4 años (DE=15,5). El número total de intervenciones fue de 1.328 y no hubo pérdidas durante el seguimiento. Las comorbilidades más frecuentes en la cohorte fueron neoplasia (78%), diabetes mellitus (5,1%) y obesidad (3,2%).
El tipo de cirugía más habitual fue la resección de cuadrante de mama (48,3%), seguida de la mastectomía simple unilateral (18,9%) y la mastectomía simple ampliada unilateral (mastectomía radical modificada), con un 16,9%. Los diferentes procedimientos estudiados y su frecuencia se muestran en la tabla 1.
Tabla 1. Procedimientos quirúrgicos estudiados (CIE-9-MC) para cirugía de mama
| Código | Intervención | Frecuencia (%) |
|---|---|---|
| 85.22 | Resección de cuadrante de mama | 641 (48,3) |
| 85.41 | Mastectomía simple unilateral | 251 (18,9) |
| 85.43 | Mastectomía simple ampliada unilateral | 224 (16,9) |
| 85.33 | Mastectomía subcutánea unilateral con implantación simultánea | 76 (5,7) |
| 85.21 | Extirpación local de lesión de mama | 40 (3,0) |
| 85.35 | Mastectomía subcutánea bilateral con implantación simultánea | 35 (2,6) |
| 85.23 | Mastectomía subtotal | 14 (1,1) |
| 85.44 | Mastectomía simple ampliada bilateral | 14 (1,1) |
| 85.42 | Mastectomía simple bilateral | 13 (1,0) |
| 85.45 | Mastectomía radical unilateral | 5 (0,4) |
| 85.47 | Mastectomía radical ampliada unilateral | 4 (0,3) |
| 85.94 | Extracción de implante de mama | 3 (0,2) |
| 85.34 | Otra mastectomía subcutánea unilateral | 2 (0,2) |
| 85.93 | Revisión de implante de mama | 2 (0,2) |
| 85.12 | Biopsia abierta de mama | 1 (0,1) |
| 85.48 | Mastectomía radical ampliada bilateral | 1 (0,1) |
| 85.95 | Inserción de expansor del tejido mamario | 1 (0,1) |
| 85.96 | Extracción de expansores de tejido mamario | 1 (0,1) |
CIE-9-MC: Clasifcación Internacional de Enfermedades, 9ª revisión, Modifcación Clínica.
La duración media de las intervenciones fue de 93 minutos (DE=53,8). Un 52,9% de las pacientes presentaron un riesgo anestésico ASA II, y un 33,6% un ASA III. Respecto al grado de contaminación de la cirugía, 1.313 intervenciones (98,9%) fueron cirugías limpias, 12 limpias-contaminadas (0,9%) y 3 sucias (0,2%). La mediana de la estancia hospitalaria se situó en 2 días (RIC=0-5).
En 22 cirugías hubo presencia de ISQ (1,7%), de las que 18 se catalogaron como infección superficial (81,8%) y 4 como infección profunda (18,2%). No hubo infecciones de órgano-espacio.
Se identificó al microorganismo causante de la infección en 17 de los 22 casos (77,3%), siendo cuatro de ellos (23,5%) de origen polimicrobiano. Las principales bacterias encontradas en las ISQ fueron Staphylococcus aureus (47,1%), seguido de Enterobacter cloacae (17,6%). En la figura 1 se puede apreciar el conjunto de patógenos productores de las infecciones quirúrgicas.
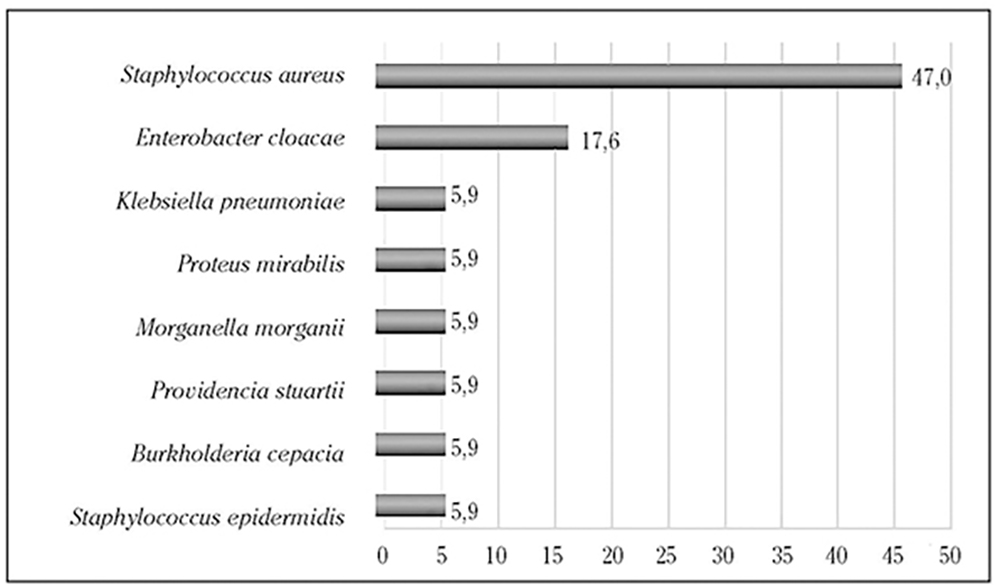
Figura 1. Frecuencia de la etiología (porcentaje) de las infecciones de sitio quirúrgico en cirugía de mama
La profilaxis antibiótica estaba indicada en 760 intervenciones (57,2%) y fue adecuada en 1.266 (95,3%), incluyendo las 568 cirugías donde no se administró porque no estaba indicada. En 62 casos fue inadecuada (4,7%) debido principalmente al tiempo de inicio de la profilaxis (46,8%) y a la elección del antibiótico (40,3%). Los ocho casos restantes fueron debidos a la duración del tratamiento (cuatro), a la vía de administración (dos) y a la dosis (dos).
Se encontró una frecuencia significativamente mayor de ISQ en cirugías con profilaxis antibiótica inadecuada (n=5, 8,1%) que en aquellas con profilaxis adecuada (n=17, 1,3%), de las cuales 15 ocurrieron en pacientes a quienes se administró la profilaxis (2%) y dos en pacientes que no requirieron su aplicación (0,4%). La inadecuación de la profilaxis incrementó el riesgo de ISQ de manera estadísticamente significativa (RR=6,5; IC95 2,3-18,1; p=0,003).
Las pacientes sin infección quirúrgica fueron más jóvenes (57,3 años, DE=15,4 vs 64 años, DE=14,8; p=0,042) y tuvieron una estancia hospitalaria menor (2 días, RIC=0-5 vs 6 días, RIC=3,3-11,5; p=0,031) que aquellas con ISQ.
Discusión
El objetivo principal de la vigilancia de las infecciones nosocomiales es disminuir la tasa de infección10. La vigilancia de la infección quirúrgica en las cirugías limpias es un importante indicador de seguridad del paciente y de calidad asistencial, debiéndose mantener la incidencia de infección en niveles bajos. La profilaxis antibiótica, dentro de las medidas preventivas para el control de la ISQ, reduce hasta en un 56% las infecciones quirúrgicas cuando se realiza de forma adecuada11.
La tasa de ISQ en cirugía de mama del presente estudio ha mostrado ser inferior a la de otros estudios similares, donde se llega a alcanzar el 16%8 12 13, incluso fue de menos de la mitad que la observada en un estudio multicéntrico realizado en nuestro medio (1,7 vs 3,9%)5. Parte de estas diferencias pueden ser explicadas por el alto grado de cumplimiento de la profilaxis antibiótica, así como por el menor tiempo de duración de la cirugía (el P75 fue 40 minutos inferior en nuestro caso: 125 vs 165 minutos)5, consecuencia de que la intervención más frecuentemente realizada en nuestro hospital fue la resección de cuadrante de mama (48,3%, duración media 62 minutos, DE=30,5) y no otros procedimientos de mayor duración, como la mastectomía radical modificada5.
En nuestro estudio se observó una diferencia estadísticamente significativa en cuanto a la edad de las pacientes infectadas y no infectadas (64 vs 57,3 años), en consonancia con otros trabajos que muestran que la edad avanzada supone un factor de riesgo para la ISQ en cirugía de mama14-15.
La mediana de la estancia hospitalaria se triplicó en pacientes con infección quirúrgica, y coincide con otros estudios donde se observa una prolongación de la permanencia debido a la infección16-17.
El microorganismo causante de ISQ más frecuente descrito en cirugía de mama fue Staphylococcus aureus15 18-19, al igual que en nuestra serie (47,1%), seguido de Enterobacter cloacae, por lo que la elección de antibiótico para la profilaxis quirúrgica en cirugía de mama debe cubrir a los microorganismos más comunes en esa área quirúrgica, tanto Gram positivos como negativos15.
La profilaxis antibiótica está indicada en casos especiales de cirugías limpias (como en el caso de cirugía de mama con implantes, material protésico o expansores) o en pacientes que presenten edad mayor de 65 años, estado nutricional deficiente, obesidad, diabetes mellitus o inmunosupresión. Por último, también se indica profilaxis antibiótica preoperatoria si la cirugía es contaminada.
La adecuación global de la profilaxis antibiótica fue del 95,3%, superior a la media nacional5 y a otros estudios internacionales20, pero inferior a la observada en otros procedimientos realizados en nuestro hospital, como la cirugía de colon y recto6 21, por lo que aún existe margen de mejora. Esta alta adecuación de la profilaxis antibiótica en el HUFA puede contribuir a explicar la menor tasa de infección en nuestro centro al compararla con otros hospitales españoles5 7 22.
El tiempo de inicio de la profilaxis supuso casi la mitad de los casos de inadecuación, lo que coincide con la literatura consultada5 22 23-24. Algunos trabajos no han mostrado relación entre la adecuación de la profilaxis antibiótica y la reducción de ISQ en cirugía de mama5 12 ni en otras cirugías limpias24, aunque cabe destacar que contaron con un tamaño muestral limitado y los porcentajes de cumplimiento en estos estudios fueron pobres. En un metaanálisis realizado con nueve estudios y 2.260 pacientes se concluyó a favor de la recomendación de la profilaxis antibiótica como método para reducir la infección quirúrgica en cirugía de mama20, hecho señalado también en múltiples estudios15 16 25.
La profilaxis antibiótica supone la mitad de los antibióticos empleados en el hospital16 y diferentes estudios han mostrado gran disparidad a la hora de su correcta aplicación13 26-27, por lo que es imprescindible la formación de los profesionales sanitarios sobre su correcto uso. A su vez, también es necesario el cumplimiento adecuado de las checklists y protocolos de cada centro, dejando constancia de su correcta realización. Si el antibiótico utilizado es lo suficientemente activo contra los microorganismos potencialmente contaminantes y mantiene niveles de concentración elevados durante todo el procedimiento quirúrgico la profilaxis, generalmente, resultará eficaz28.
La principal comorbilidad en nuestro estudio fue la neoplasia, lo cual es lógico ya que se trata de una de las principales indicaciones para la cirugía de mama, y además puede contribuir a aumentar el riesgo de infección por la naturaleza de la enfermedad y el tratamiento, dificultando la curación de la herida29. Esta misma asociación también se describe en otras cirugías con elevada incidencia de cáncer30.
La realización de estudios de cohortes prospectivos es lo ideal para evaluar la incidencia de ISQ, ya que los registros retrospectivos conllevan limitaciones metodológicas y una mayor probabilidad de errores y sesgos. El diseño de este trabajo es, por tanto, de alta evidencia científica, siendo destacable tanto el periodo evaluado (diez años) como el número de casos, siendo una de las mayores series de cirugía de mama a nivel nacional. Los profesionales del Servicio de Ginecología y Obstetricia no fueron avisados de la realización del control de adecuación, por lo que no se produjo un sesgo de Hawthorne. La posible pérdida de información de las pacientes fue minimizada gracias a la historia clínica electrónica y al seguimiento tras el alta realizado con la aplicación informática Horus, por lo que los sesgos de selección e información pudieron ser controlados. Para evitar sesgos por pérdidas en el seguimiento se calculó un porcentaje de posibles pérdidas durante el periodo evaluado, aunque finalmente no se produjo ninguna.
Como limitación del estudio podría considerarse el no haber contabilizado las infecciones leves tras el alta hospitalaria que no requirieron reingreso y que no fueron atendidas en ningún centro sanitario, y aquellas posteriores a los 30 días de seguimiento tras la intervención (o 90 días en caso de implantes o prótesis). No obstante, el objetivo del trabajo fue la evaluación de las tasas de adherencia y adecuación al protocolo de profilaxis antibiótica, que no dependen del seguimiento temporal por lo que consideramos nuestros resultados precisos y no sesgados.
En conclusión, la relación observada entre inadecuación de la profilaxis antibiótica e infección quirúrgica sugiere que se trata de un procedimiento útil para la prevención de la ISQ, en concordancia con otros estudios de tamaño muestral representativo. La adecuación global de la profilaxis fue muy elevada y la ISQ en cirugía de mama en nuestro centro fue bastante baja, aun así, al tratarse de una cirugía programada en la mayoría de los casos, cabe la posibilidad de mejora. Para ello se hace necesario la existencia de protocolos actualizados, así como el incremento en su adherencia y exhaustividad de registro, lo que a su vez permita la evaluación de manera continuada y multidisciplinar de la adecuación de la profilaxis antibiótica y la incidencia de infección quirúrgica. Podría ser también de utilidad llevar a cabo futuras sesiones formativas teórico-prácticas conjuntas entre la Unidad de Medicina Preventiva y el Servicio de Ginecología y Obstetricia, que profundicen específicamente en la correcta realización de la profilaxis en los diversos procedimientos quirúrgicos de la mama que se realizan actualmente en nuestro hospital.














