INTRODUCCIÓN
El cáncer colorrectal (CCR) es el segundo cáncer más frecuente en el mundo, con aproximadamente 1 millón de nuevos casos diagnosticados al año. En España, es el cáncer con mayor incidencia, estimada en 32.240 pacientes al año, y el segundo cáncer en mortalidad, siendo responsable de 14.700 fallecimientos al año.
Aproximadamente, el 30% de los pacientes con CCR presentan enfermedad metastásica al diagnóstico y alrededor del 50% de los pacientes con enfermedad localizada desarrollarán metástasis durante la evolución de la enfermedad1.
El tratamiento del cáncer colorrectal metastásico (CCRm) ha ido evolucionando a lo largo de los años. La terapia antineoplásica de esta enfermedad comenzó con el desarrollo del 5-fluorouracilo (5-FU) en 1957. Veinte años más tarde, se observó la potenciación de su actividad al administrarse junto con leucovorin (5-FU/LV). En el año 2000, se introducen irinotecán y oxaliplatino, usados en combinación con 5-FU/LV. En los últimos años se han incluido en el tratamiento agentes biológicos dirigidos: antiVEGF (bevacizumab, aflibercept, ramucirumab), anti-EGFR (cetuximab, panitumumab), inhibidores multiquinasa (regorafenib) y trifluridina/tipiracil1,2.
En el manejo del CCRm se deben tener en cuenta diversos factores, como son las características del paciente (estado general y enfermedades concomitantes), caracterización molecular del tumor y el perfil de toxicidad del tratamiento.
Panitumumab es un anticuerpo monoclonal Ig G2 completamente humano, cuya diana es el receptor del factor de crecimiento epidérmico (EGFR). El EGFR es una glicoproteína transmembrana que se encuentra sobreexpresada en más del 80% de los tumores metastásicos. Cuando el factor de crecimiento epidérmico se une al EGFR, activa múltiples cascadas de señalización intracelular, incluyendo las vías RAS/RAF/MAPK y PI3K. Esto se traduce en un aumento de la proliferación celular, diferenciación, angiogénesis, metástasis y disminución de la apoptosis. La vía EGFR juega un papel crítico en la carcinogénesis, por lo tanto, el bloqueo de esta vía es una estrategia terapéutica interesante.
Panitumumab se une al dominio extracelular de EGFR, bloqueando el sitio de unión del ligando a su receptor. De esta forma, impide la dimerización del mismo y la fosforilación de la proteína tirosina quinasa del receptor3.
La presencia de mutaciones en la familia de genes RAS (KRAS y NRAS) producen una activación constitutiva de la cascada de señalización, independientemente de la unión del ligando (EGF) a su receptor4,5. Actualmente, la determinación del estado de mutación RAS es un requisito para considerar la inclusión de estos fármacos como parte del tratamiento antineoplásico6,7.
La “Food and Drug Administration” (FDA) aprobó en septiembre de 2006 el uso de panitumumab en monoterapia para el tratamiento de CCRm en progresión tras la administración de regímenes de quimioterapia con fluoropirimidina, oxaliplatino y/o irinotecán8. En diciembre de 2007, la “European Medicines Agency” (EMA) realizó una autorización de comercialización condicional para la misma indicación9. En septiembre de 2011, se amplió su autorización, estando actualmente indicado para el tratamiento de pacientes adultos con CCRm, RAS WT (“wild type” o estado nativo), en primera línea (en combinación con FOLFOX), en segunda línea (junto a FOLFIRI), o bien en monoterapia.
El objetivo principal del estudio es evaluar la efectividad y seguridad de panitumumab en los pacientes con CCRm.
Los objetivos secundarios son: comparar la efectividad observada en la práctica clínica con la eficacia obtenida en los ensayos clínicos publicados, así como comparar el perfil de seguridad del fármaco.
MATERIAL Y MÉTODOS
Es un estudio observacional, de seguimiento retrospectivo, unicéntrico, diseñado para determinar el beneficio clínico de panitumumab en los pacientes con CCRm, tratados en monoterapia o en combinación con esquemas de quimioterapia.
Para la realización del estudio se han cumplido las normas éticas del Comité de Investigación y de la Declaración de Helsinki de 1975. El estudio obtuvo el dictamen favorable del Comité Ético de Investigación Clínica del hospital y de la Agencia Española de Medicamentos y Productos sanitarios para su realización.
La fuente principal de información para la obtención de datos analíticos, clínicos, histológicos y farmacológicos fue la Historia Clínica Informatizada del Hospital. Como fuente secundaria se utilizó el programa FarHo®, en el que se detalla el historial farmacológico de cada paciente.
En el estudio se incluyeron pacientes de cualquier sexo y raza, mayores de 18 años, con diagnóstico confirmado de adenocarcinoma de colon y/o recto, estadio IV (M1a o M1b) confirmado según el sistema de estadificación TNM (T: tumor; N: ganglios: M: metástasis), ECOG PS (Eastern Cooperative Oncology Group) 0-2 al inicio del tratamiento, determinación y confirmación de RAS WT, pacientes tratados con panitumumab en cualquier línea de tratamiento desde junio de 2010 hasta septiembre de 2017.
La respuesta al tratamiento fue evaluada mediante técnicas de imagen (principalmente TAC: tomografía axial computerizada). Para su evaluación se emplearon los criterios RECIST10. Según los mismos, se definieron: respuesta completa (RC: desaparición de todas las lesiones), respuesta parcial (RP: la suma del diámetro máximo de todas las lesiones disminuyó ≥30% y no hubo nuevas lesiones), enfermedad estable (EE: la suma de las lesiones disminuyó <30%, ausencia de progresión de las lesiones existentes y no hubo lesiones de nueva aparición), enfermedad en progresión (EP: la suma del diámetro máximo de las lesiones aumentó >20% o aparición de una nueva lesión), respuesta no evaluable(NE: no se dispuso de criterios suficientes para la evaluación de la respuesta al tratamiento).
Otras variables de eficacia recogidas fueron: tasa de respuesta global (TRG: porcentaje de pacientes que experimentaron regresión tumoral tras el tratamiento) supervivencia global (SG: tiempo trascurrido entre el inicio del tratamiento y la muerte), supervivencia libre de progresión (SLP: tiempo entre el inicio del tratamiento y la progresión de la enfermedad), tiempo hasta primera respuesta (tiempo entre el inicio del tratamiento y la primera respuesta), duración de la respuesta (tiempo entre la primera respuesta obtenida hasta la progresión de la enfermedad).
La toxicidad fue clasificada según los criterios de Instituto Nacional del Cáncer (NCI): CTCAE (Common Terminology Criteria for Adverse Events) versión 5.011. Se recogió la información de la entrevista clínica del paciente en la consulta y los resultados analíticos realizados durante el tratamiento.
El tratamiento estadístico de los datos se realizó con el programa IBM SPSS Statistics® versión 25. Los análisis descriptivos se realizaron calculando las medidas de tendencia central y dispersión de las variables cuantitativas y las frecuencias para las variables cualitativas. Las medianas de SLP y SG se calcularon mediante el análisis de supervivencia de Kaplan-Meier. El test de Breslow se utilizó para la comparación de las curvas y el modelo de regresión de Cox para la obtención de los hazard ratios (HR) junto con los intervalos de confianza (IC). El nivel de confianza fijado en las comparaciones fue del 95%, aceptándose como significativas las diferencias encontradas para valores p<0,05.
RESULTADOS
Un total de 85 pacientes fueron incluidos en el estudio, el 71% (n=60) eran varones. La media de edad al diagnóstico de los pacientes estudiados fue de 62 años (DE=10, rango 31-88).
Un 20% (n=17) de los pacientes tenía antecedentes familiares (padres, abuelos y/o hermanos) de CCR. El 14% (n=12) presentaban antecedentes personales de cáncer en otras localizaciones.
En cuanto al diagnóstico del tumor primario: 55% (n=47) cáncer de colon, 32% (n=27) cáncer de recto y el 13% (n=11) cáncer colorrectal.
Respecto a los signos y síntomas presentados al diagnóstico: 43% (n=37) alteración del ritmo intestinal (diarreas y/o estreñimiento), 41% (n=35) rectorragia, 38% (n= 32) disminución de peso, 18% (n=15) astenia, 13% (n=11) tenesmo, 13% (n=11) anemia (hemoglobina <10 g/dL), 11% (n=9) dolor epigástrico, 7% (n=6) vómitos y/o náuseas y 6% (n=5) hiporexia. Seis pacientes fueron diagnosticados gracias al programa de cribado de cáncer colorrectal, mediante la realización del test de sangre oculta en heces y posterior estudio mediante colonoscopia.
El estadio de la enfermedad al diagnóstico se determinó mediante el sistema TNM. El 62% (n=53) de los pacientes fueron diagnosticados en estadio IV, el 33% (n=28) estadio III y el 5% (n=4) estadio II.
Los pacientes diagnosticados en estadios no avanzados de la enfermedad (estadios II y III) sufrieron recidiva de la misma, pasando a estadio IV. La mediana de tiempo entre el diagnóstico primario y la recidiva de la enfermedad fue de 21 meses (RIC=11,2-35,5 meses).
Las características demográficas y clínicas de los pacientes evaluados se detallan en la tabla 1.
El ECOG PS de los pacientes al inicio de panitumumab fue de 1 en 56 pacientes (66%) y de 2 en 29 pacientes (34%).
El 85% (n=72) de los pacientes presentaban metástasis en una (44%, n=37) o dos localizaciones (41%, n=35), mientras que el resto (15%, n=13) tenían metástasis en tres localizaciones diferentes.
La localización de las metástasis fue: 74% (n=63) hepática, 40% (n=34) pulmonar, 31% (n=26) ganglionar y el resto otras localizaciones (15% peritoneal, 8% ósea, 3% cerebral y 2% esplénica).
La resecabilidad de dichas metástasis fue posible en 12 pacientes (14%), todas ellas de localización hepática. El tratamiento de las metástasis hepáticas a nivel local fue: cuatro pacientes quimioembolización hepática y dos pacientes ablación por radiofrecuencia.
Panitumumab se utilizó en distintos esquemas de tratamiento:
FOLFOX (5-fluorouracilo 400 mg/m2en bolus días 1 y 2 + 5-fluorouracilo 600 mg/m2 en 22 horas días 1 y 2 + leucovorin 200 mg/m2 días 1 y 2 + oxaliplatino 85 mg/m2 día 1) + panitumumab 6 mg/kg cada 14 días
FOLFIRI (5-fluorouracilo 400 mg/m2 en bolus días 1 y 2 + 5-fluorouracilo 600 mg/m2 en 22 horas días 1 y 2 + leucovorin 200 mg/m2 días 1 y 2 + irinotecán 180 mg/m2 día 1) + panitumumab 6 mg/kg cada 14 días.
Irinotecán 180 mg/m2 + panitumumab 6 mg/kg cada 14 días.
Panitumumab monoterapia: 6 mg/kg cada 14 días, o bien, 9 mg/kg cada 21 días.
La distribución de los pacientes según el esquema de tratamiento utilizado fue: FOLFOX + panitumumab 26% (n=22), FOLFIRI + panitumumab 14% (n=12), irinotecán + panitumumab 25% (n=21) y panitumumab en monoterapia 35% (n=30).
El 95,5% y 83,4% de los pacientes que recibieron el esquema FOLFOX + panitumumab y FOLFIRI + panitumumab respectivamente tenían ECOG PS 1. En el caso de irinotecán + panitumumab y panitumumab en monoterapia el 57,1%y 56,6% respectivamente tenían ECOG PS 2.
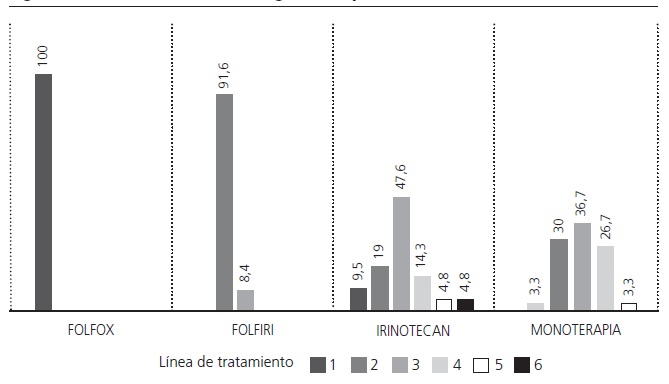
Panitumumab fue administrado como tratamiento de primera línea en el 30% de los pacientes (n=25), segunda línea en el 28% (n=24), tercera línea 26% (n=22), cuarta línea 13% (n=11), quinta línea 2% (n=2) y sexta línea 1% (n=1). En la figura 1 se detalla la línea en la que fue utilizado el fármaco con cada esquema de tratamiento.
Los pacientes recibieron una mediana de 8 ciclos (RIC= 4-12 ciclos). La mediana de tiempo en tratamiento con panitumumab fue de 4 meses (RIC=1-6 meses).
El tratamiento finalizó por diversas causas: progresión de la enfermedad (61%, n=52), fin de ciclos previstos (10%, n=8), exitus (8%, n=7), decisión del paciente (2%, n=2), reacción de hipersensibilidad (1%, n=1) y toxicidad del fármaco (1%, n=1).
La tasa de respuesta global fue de 17,8% (n= 15), de las cuales el 15,3% (n=13) fueron respuestas parciales. El 14% (n=12) presentaron estabilización de la enfermedad y el 51,8% (n=44) progresión de la misma.
A continuación, se detallan los tipos de respuesta obtenidas en función del esquema de tratamiento utilizado (tabla 2).
Tabla 2. Tipo de respuesta obtenida según el esquema de tratamiento utilizado.
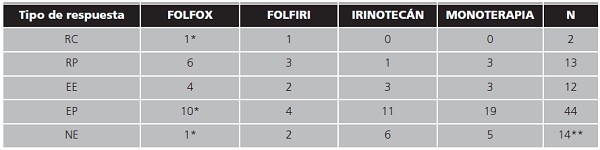
RC: respuesta completa; RP: respuesta parcial; EE: enfermedad estable; EP: enfermedad en progresión; NE: no evaluable;
*:pacientes con tratamiento de conversión;
**:han recibido 1-3 ciclos panitumumab.
En tres pacientes la administración de FOLFOX + panitumumab posibilitó la resección quirúrgica de las metástasis hepáticas, gracias a la reducción del tamaño de las mismas (tratamiento de conversión). Tras la cirugía, continuaron con el mismo esquema de tratamiento, obteniéndose para cada uno de ellos los siguientes tipos de respuesta: enfermedad en progresión(tras 12 ciclos), respuesta completa (tras 6 ciclos) y respuesta no evaluable (3 ciclos recibidos).
La mediana de tiempo hasta alcanzar la primera respuesta fue de 11 semanas (RIC=9-13 semanas). La mediana de duración de la respuesta al tratamiento fue de 13 semanas (RIC=0-28 semanas).
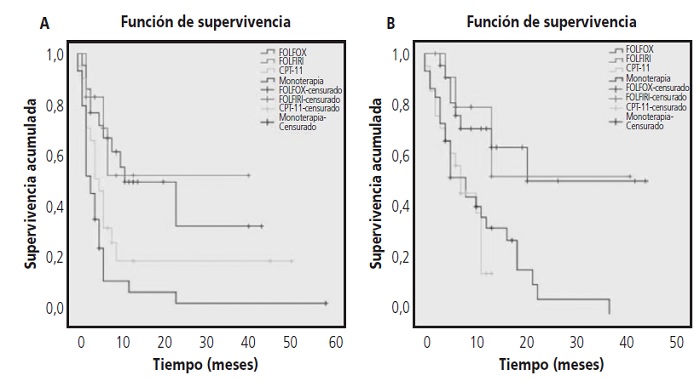
La progresión de la enfermedad se produjo en el 68% (n=58) de los pacientes. La mediana de SLP fue de 6 meses (IC 95% 4,7-6,2). Los pacientes que recibieron FOLFOX + panitumumab obtuvieron una mediana de SLP de 23 meses (IC 95% 5,2-40,7), con FOLFIRI + panitumumab no se alcanzó la mediana, con irinotecán + panitumumab 5 meses (IC 95% 3-6,9) y panitumumab en monoterapia 3 meses (IC 95% 1,7-4,2).
El 60% (n=51) de los pacientes incluidos en el estudio fallecieron. La mediana de SG fue de 11 meses (IC 95% 7,114,8). Para cada esquema de tratamiento las medianas de supervivencia global fueron: FOLFOX + panitumumab y FOLFIRI + panitumumab no se alcanzaron las medianas de SG, irinotecán + panitumumab 7 meses (IC 95% 2,2-11,7 meses) y panitumumab en monoterapia 8 meses (IC 95% 3,6-12,3 meses).
Estos datos de SLP y SG se pueden observar en las curvas de supervivencia Kaplan Meier a nivel global (figura 2) y en función del esquema de tratamiento recibido (figura 3).
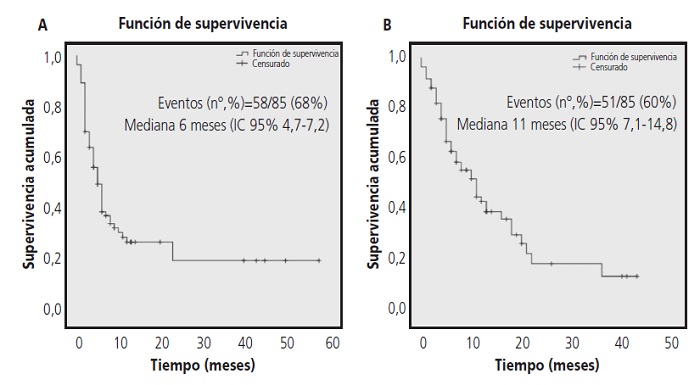
Figura 2. Curvas de supervivencia: (A) Supervivencia libre de progresión y (B) Supervivencia global.
El test de Breslow, utilizado para comparar las curvas de supervivencia, observó diferencias estadísticamente significativas entre los grupos tanto en la SLP(χ2=17,42; p=0,001) como en la SG (χ2=11,07; p=0,001). En SLP las diferencias se encontraron entre los esquemas: FOLFOX vs irinotecán (χ2=4,18;p=0,04), FOLFOX vs panitumumaben monoterapia (χ2=11,6;p=0,001) y FOLFIRI vs panitumumaben monoterapia (χ2=8,02;p=0,005). En SG las diferencias se observaron entre: FOLFOX vs irinotecán (χ2=6,33; p=0,012),FOLFOX vs panitumumab en monoterapia (χ2=6,75; p=0,009),FOLFIRI vs irinotecán (χ2=3,96;p=0,047) y FOLFIRI vs panitumumaben monoterapia (χ2=4,04;p=0,044).
Las variables que influyeron significativamente en la SLP fueron: sexo, 4 y 6 meses para mujeres y hombres respectivamente (p=0,02), HR 2,07 (IC 95% 1,12-3,82); 23 y 5 meses en pacientes tratados con el esquema FOLFOX + panitumumaby el resto de esquemas respectivamente (p=0,02), HR0,17 (IC 95% 0,058-0,53).
En cuanto a la SG, las variables que influyeron significativamente en la misma fueron: ECOG PS al inicio del tratamiento de 1 y 2 con medianas de 16 y 5 meses respectivamente (p=0,03), HR 2,18 (IC 95% 1,08-4,42); no alcanzada la mediana y 7 meses en pacientes con resección o no de metástasis hepáticas respectivamente (p=0,014), HR 0,16 (IC 95% 0,04-0,691).
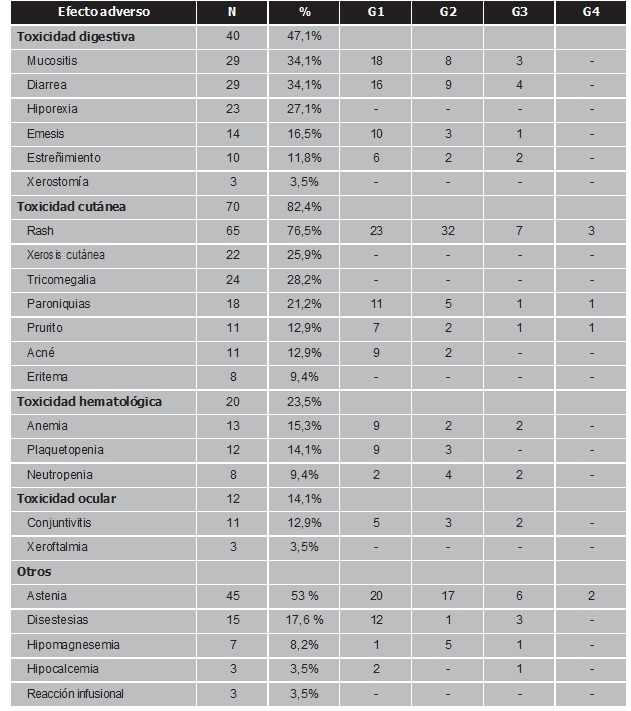
Las toxicidades fueron en general leves y bien controladas. La tabla 3 muestra la incidencia y el grado de las mismas.
El 82,4% (n=70) de los pacientes presentaron toxicidad cutánea, siendo ésta la más frecuente. El rash fue la reacción adversa de mayor incidencia (n=65, 76,5%). El 61% de los pacientes que presentaron esta reacción cutánea precisaron tratamiento basado en doxiciclina y pliazon® (n=24, 37%), a estos agentes se les añadió un corticosteroide tópico en un 18% de los pacientes. En cuatro pacientes (6%) fue necesario el uso de corticosteroides vía oral debido a la mayor gravedad del rash. Un paciente suspendió el tratamiento debido a la toxicodermia por panitumumab.
Debido a la toxicidad, la dosis del fármaco se redujo en 13 pacientes (15%), siendo el porcentaje medio de reducción de dosis de 18,8% (DE=7,9, rango 10-40). Se produjeron retrasos en la administración de algún ciclo en el 32% (n=27) de los pacientes. El número medio de ciclos retrasados fue de 1,6 ciclos (DE=0,88, rango 1-4). Durante el tratamiento con el fármaco un 29,4% (n=25) de los pacientes requirieron ser atendidos en urgencias o precisaron ingreso hospitalario.
DISCUSIÓN
Las características demográficas de los pacientes y la relación de la localización tumoral colon/recto fueron similares a las referidas en otros estudios publicados12-14, y se encuentran en consonancia con la epidemiología propia de la enfermedad2.
La tasa de respuesta global del estudio fue inferior a las de los ensayos PRIME12 (55%) y PICCOLO14 (34%), sin embargo, fue similar a la obtenida en el ensayo de Amado et al.13 (17%). En el caso del estudio PICCOLO esta diferencia puede ser debida a las distintas características de los pacientes en cuanto al ECOG PS y a las líneas previas recibidas.
La mediana de SLP del estudio para el esquema FOLFOX fue muy superior, 23 meses, al compararlo con los 9,6 meses del estudio PRIME12. En el estudio de Peeters15 la mediana obtenida fue de 5,9 meses, dato muy similar a los 6 meses obtenidos en este estudio de mediana de SLP a nivel global. Con el esquema irinotecan + panitumumab la mediana fue 5 meses, muy similar a la del estudio PICCOLO14 (5,7 meses). Panitumumab en monoterapia obtuvo una mediana de 3 meses, siendo esta la más baja de las obtenidas, dato que coincide con la obtenida en el estudio de Amado et al.13 (12,3 semanas).
En las curvas de supervivencia (SLP y SG) obtenidas para cada esquema de tratamiento se observaron dos grupos diferenciados: por un lado, los esquemas FOLFOX y FOLFIRI y por otro lado irinotecán y panitumumab en monoterapia. El meta-análisis realizado por Ruo-feng Liang et al.16 concluye también que la adición de panitumumab a esquemas de quimioterapia mejora significativamente la SLP y que ésta varía en función del esquema utilizado.
La principal limitación de este estudio es su diseño retrospectivo, lo que puede introducir sesgos de información. Los datos retrospectivos están a menudo incompletos y hacen más compleja la evaluación del curso clínico de los pacientes.
El estudio aporta datos sobre el uso de panitumumab en la práctica clínica real, lo que resulta esencial para poder comparar y seleccionar la combinación del fármaco más efectiva, con la finalidad de alcanzar el máximo beneficio clínico en los pacientes.
CONCLUSIONES
Panitumumab constituye una terapia con una efectividad aceptable en el tratamiento del CCRm en la población KRAS WT, utilizado en primera o segunda línea en combinación con quimioterapia y en monoterapia en los casos refractarios a la misma. La combinación del fármaco con esquemas de quimioterapia, FOLFOX y FOLFIRI, produce una mejora significativa en la SLP de los pacientes frente a esquemas menos agresivos, como irinotecán o el uso del fármaco como agente único que producen un beneficio más discreto.
En cuanto al perfil de seguridad de panitumumab, es un fármaco que presenta, en general, una buena tolerancia. La toxicidad más frecuente, característica de la familia de inhibidores del EGFR, es la dermatológica. Los efectos adversos cutáneos presentan una elevada incidencia y suponen importantes consecuencias en la salud psicosocial y física de los pacientes.
Las futuras directrices del tratamiento del CCRm deberán establecer una secuencia óptima del uso de las terapias disponibles con la finalidad de alcanzar el mayor beneficio clínico en los pacientes.