My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Escritos de Psicología (Internet)
On-line version ISSN 1989-3809Print version ISSN 1138-2635
Escritos de Psicología vol.2 n.1 Málaga Dec. 2008
Valoración del daño axonal difuso en los traumatismos cráneo-encefálicos
Evaluation of diffuse axonal injury in traumatic brain injury
Carme Junqué
Departament de Psiquiatria i Psicobiologia Clínica (Universitat de Barcelona)
RESUMEN
El daño axonal difuso (DAD) en los traumatismos cráneo-encefálicos (TCE) se produce como consecuencia de daño axonal primario y secundario. Es el responsable de la mayoría de las alteraciones de atención, memoria, velocidad de procesamiento y alteraciones ejecutivas en los TCE moderados y graves. Las técnicas de resonancia magnética clínicas permiten visualizar las microhemorragias en secuencias de T2*clásicas y permiten evaluarlo de forma indirecta mediante las medidas de volumen del sistema ventricular y de superficie del cuerpo calloso. Las imágenes de tensor de difusión (ITD) son las idóneas para identificar y cuantificar el DAD. Los valores de anisotropía fraccional (AF) han demostrado ser sensibles incluso en TCE leves y a partir de las pocas horas tras el TCE y correlacionan con parámetros de gravedad tales como la escala de coma de Glasgow o la amnesia postraumática. Los decrementos de AF evolucionan con el tiempo pero parecen permanecer como secuelas definitivas de los TCE graves incluso en niños. Las correlaciones de la ITD con los trastornos neuropsicológicos han mostrado que en especial los valores de AF en el cuerpo calloso y las medidas globales de AF de todo el cerebro reflejan las secuelas clásicas de los TCE difusos.
Palabras clave: Traumatismo cráneo-encefálico, daño axonal difuso, resonancia magnética, imágenes de tensor de difusión.
ABSTRACT
Diffuse axonal injury (DAI) in traumatic brain injury (TBI) is produced by primary and secondary mechanisms of axonal damage. DAI is the responsible of neuropsychological impairments associated to moderate and diffuse TBI such as deficits in attention, memory, speed of mental processing and executive functions. Clinical magnetic resonance imaging allows to identify traumatic microbleeds using T2* and to quantify indirect signs of DAI such as the ventricular volumes of corpus callosum surface. Diffusion tensor imaging (DTI) is the most suitable technique to identify and to quantify DAI in TBI patients. The fractional anisotropy (FA) values have been found sensitive to DAI even in mild TBI and correlate with severity parameters such as Glasgow coma scale and post-traumatic amnesia. FA values changes over time but it remains as a permanent TBI sequel even in children. The mean whole brain FA and corpus callosum measures have shown significant correlations with the classical neuropsychological deficits seen in TBI patients with DAI.
Keywords: Traumatic brain injury, diffuse axonal injury, magnetic resonance imaging, diffuse tensor imaging.
Introducción
Los traumatismos cráneo-encefálicos (TCE) son la principal causa de discapacidad entre los adultos jóvenes (Mc Kenzie, 2000) y las secuelas neuropsicológicas de estos TCE son las que mayor impacto tienen en la calidad de vida del paciente y de su familia ya que afectan su reintegración académica, laboral y social (Junqué et al., 1999).
El daño cerebral después de un TCE es el resultado de las lesiones estructurales iniciales y de las complicaciones secundarias (Adams et al., 1991). Las contusiones, laceraciones, hemorragias intracraneales y la lesión axonal difusa constituyen lesiones primarias, ya que ocurren en el mismo momento del impacto. Son debidas a los mecanismos de aceleración y desaceleración. Las lesiones secundarias se producen por complicaciones de los procesos que se inician en el momento de la lesión, pero no son directamente atribuibles al impacto. Entre ellas destacan patologías vasculares como la isquemia, la formación de hematomas y el edema cerebral. La patología vascular se puede producir por la reducción en el flujo sanguíneo cerebral global debido a un incremento en la presión intracraneal o bien por la reducción del flujo sanguíneo regional debido a vasoespasmos o a herniación cerebral (Sahuquillo et al., 2001). El término "lesiones terciarias" hace referencia a las alteraciones celulares inducidas por el TCE. Incluyen alteraciones en los neurotransmisores, en la integridad de la membrana, en la homeostasis iónica, en la síntesis inducida de proteínas, disfunciones de los canales iónicos y anomalías en diferentes vías metabólicas (Pitts y McIntosh, 1990).
Identificación y cuantificación de las lesiones en los TCE
Las lesiones cerebrales focales macroscópicas que se producen por contusiones y laceraciones o por ruptura o isquemia de grandes vasos son fácilmente identificables mediante técnicas de tomografía computarizada (TC) o imágenes de resonancia magnética (IRM) clínicas estándar. Éstas lesiones tienen los correlatos neuropsicológicos conocidos como los síndromes neuropsicológicos (afasia, alexia, acalculia, síndrome disejecutivo, etc). Las lesiones difusas que implican la sustancia blanca, el hipocampo y los ganglios basales son de más difícil identificación requieren el uso de IRM de características más específicas. Para obtener correlatos neuropsicológicos en estos casos es necesario disponer de medidas cuantitativas (Junqué, 2004).
Las medidas cuantitativas de más interés neuropsicológico son la superficie del cuerpo calloso, el volumen del hipocampo, de los ganglios basales y del sistema ventricular. Todas ellas reflejan daño cerebral difuso y correlacionan con las correspondientes pérdidas cognitivas que afectan principalmente la atención, la capacidad de aprendizaje y la velocidad de procesamiento mental. La cuantificación de la atrofia de las estructuras puede tener interés diagnóstico e interés para la neuropsicología forense en los TCE ya que aporta información objetiva sobre el daño cerebral adquirido.
Daño axonal difuso
El daño axonal difuso (DAD) se caracteriza por lesiones multifocales, consecuencia de daño primario y secundario. El componente mecánico del traumatismo produce estiramiento, torsión y rupturas de los axones y de capilares cerebrales provocando microhemorragias (Maxwell et al., 1997). Las tres áreas cerebrales más frecuentemente afectadas por el DAD son la sustancia blanca subcortical, el cuerpo calloso y el mesencéfalo (Arfanakis et al; 2002; Gennarelli y Graham 1998), Histológicamente, el DAD se ha asociado con alteraciones citoesqueléticas y/o con cambios en la permeabilidad de la membrana del axón, dependiendo de la gravedad de la lesión (Adams et al., 1991). En los TCE moderados y graves, el cambio en la permeabilidad del axón consiste en la primera evidencia de la lesión. Horas más tarde, se observa una acumulación de neurofilamentos, que causan inflamación local y ruptura del axón (Arfanakis et al., 2002).
Aunque el DAD, tal y como se ha demostrado en el modelo animal del traumatismo, (Gennarelli y Graham, 1998) se producen en el momento del impacto, posteriormente se producen también retracciones y axotomía secundaria y degeneración walleriana de los axones y sus vainas de mielina. Esta degeneración, se produce en cuatro fases diferenciadas: en la primera, los cambios físicos de la degeneración se observan en ausencia de cambios bioquímicos de la mielina y, por tanto, no es fácilmente detectables mediante técnicas convencionales de neuroimagen. En la segunda fase, a partir de la cuarta semana, se producen cambios en las proteínas de la mielina y se altera la relación lipídico-proteica. La tercera fase, entre las 6 y 8 semanas tras TCE, se caracteriza por el incremento del edema y de la ruptura lipídica. En esta fase, la degradación de la mielina se puede ya observar en las RM. Finalmente, meses después de la lesión, se observa una clara atrofia cerebral que se evidencia por la pérdida de volumen cerebral global (Bigler, 2003).
El DAD es la causa más común de estado vegetativo persistente y de discapacidad grave después de un TCE (Graham, 1996). Desde el punto de vista clínico, el DAD produce confusión, pérdida de conciencia o coma según la gravedad del TCE debido a la interrupción de las fibras ascendentes (Gennarelli y Graham, 1998). El grado de desconexión marca la gravedad y duración del coma y la presencia y duración de la amnesia postraumática
Neuropsicológicamente, el daño axonal difuso deja como secuelas la disminución de la capacidad de realizar nuevos aprendizajes y alteraciones de la atención, de la velocidad de procesamiento de la información y de las funciones ejecutivas. La alteración de las funciones frontales es una constante y se explica por el hecho de que las funciones frontales requieren la integridad de todos los circuitos córtico-corticales y córtico-subcorticales, circuitos que están afectados por el DAD (Scheid et al., 2006; Wallesch et al. 2001).
Indicadores indirectos de daño axonal difuso mediante técnicas de neuroimagen
Las microhemorragías que se producen en el DAD se pueden visualizar en resonancia magnética en secuencias potenciadas en T2*, especialmente con adquisiciones mediante máquinas de 3 Tesla (Scheid et al., 2007).
Durante muchos años, la dilatación ventricular observable en las tomografías computarizadas era el único parámetro que reflejaba las secuelas del daño axonal difuso. En la fase aguda tras el TCE, la TC muestra signos de compresión cerebral que consisten en la reducción del tamaño ventricular y cambios en la densidad del tejido que reflejan el edema y se observan también microhemorragias. Según los hallazgos en la imagen de resonancia magnética (IRM), la lesión axonal difusa puede clasificarse en 3 grados. El grado I del DAD afecta la convexidad de la unión de la sustancia blanca y sustancia gris, en el grado II se observan además lesiones focales en el cuerpo calloso y en el grado III hay evidencia de daño cerebral adicional en el tronco cerebral.
En fase subaguda o crónica el conjunto del daño cerebral difuso primario y secundario en los TCE se refleja de forma indirecta en la TC y la IRM por la progresiva dilatación ventricular, denominada hidrocefalia ex vacuo, porque se trata de un incremento del líquido cefalorraquídeo por ocupación de un espacio que ha quedado vacío debido a la pérdida de masa encefálica (sustancia blanca y sustancia gris). Esta dilatación ventricular va aumentando conforme se van produciendo procesos de fagocitosis que siguen a las degeneraciones anterógradas, retrógradas y transneuronales (Bigler, 2003).
Las medidas cuantitativas de más interés neuropsicológico son el volumen del sistema ventricular, la superficie del cuerpo calloso, el volumen del hipocampo y el de los ganglios basales. Todas ellas reflejan daño cerebral difuso. Las dos primeras son indicadores indirectos del DAD y las otras dos (hipocampo y ganglios basales) reflejan la pérdida neuronal difusa de estructuras cerebrales altamente vulnerables a los efectos de la hipoxia y de mecanismos de neurodegeneración mediados por el glutamato. El tamaño (superficie o volumen) de estas estructuras correlaciona con las pérdidas cognitivas más frecuentes en los TCE: atención, la capacidad de aprendizaje y la velocidad de procesamiento mental (para revisión ver Levine, 2006). La cuantificación de la atrofia de las estructuras puede tener interés diagnóstico e interés para la neuropsicología forense en los TCE ya que aporta información objetiva sobre el daño cerebral adquirido.
La resonancia magnética supone un avance respecto a la TC en la facilidad de obtener medidas volumétricas de dilatación ventricular en lugar de las medidas planimétricas tales como el índice de Evans o medidas de superficie, habitualmente usadas para relacionar la atrofia cerebral con las secuelas cognitivas (Mataro et al., 2001). Los cambios en el volumen cerebral total son claramente indicativos de la gravedad del TCE, y son sensibles incluso a TCE leves (Levine et al., 2008).
En las investigaciones de correlatos anatomo-funcionales en los TCE, la dilatación ventricular correlaciona de forma significativa con el rendimiento cognitivo de los pacientes en diversos dominios (Blatter et al., 1997; Mataró et al., 2001; Narberhaus et al., 2003 Verger et al., 2001), lo cual indica su inespecificidad. El incremento del volumen de los ventrículos laterales, correlaciona también con la afectación del rendimiento en pruebas de memoria (Anderson y Bigler, 1995; Bigler 2001; Salmond et al., 2005; Serra-Grabulosa et al., 2005). Esta correlación indica por un lado que la gravedad del TCE a la vez produce dilatación ventricular y disminución de la capacidad de aprendizaje.
El avance más notable de la IRM sobre la TC consiste en identificar las lesiones y reducciones del cuerpo calloso. El cuerpo calloso es muy vulnerable al TCE por varias razones: se producen lesiones hemorrágicas directas en el mismo, se produce una afectación por degeneración retrógrada en el caso de lesiones cerebrales focales en áreas asociativas de un hemisferio y se daña por sí mismo por el efecto de rotura por estiramiento debido al efecto de velocidad (mecanismos de aceleración-desaceleración) en el momento del impacto; finalmente también adelgaza por razón de pérdida neural difusa en ambos hemisferios. Todo ello sumado hace que el estado del cuerpo calloso sea un buen indicativo de las alteraciones neuropsicológicas de los pacientes (Levin et al., 2000; Narberhaus et al. 2003; Tomaiuolo et al., 2004; Verger et al., 2001)
En los TCE el hipocampo está también reducido por lesiones hemorrágicas que se producen directamente, pero también lo está por efectos de la hipoxia y de mecanismos de neurodegeneración. Como es de esperar el hipocampo es la estructura cerebral más directamente relacionada con la pérdida de memoria declarativa. (Serra-Grabulosa et al., 2005, Ariza et al., 2006). El fórnix es el fascículo de mayor relevancia para la memoria ya que es una vía de entradas y salidas del hipocampo y es la vía de mayor conectividad del hipocampo con el lóbulo frontal. La degeneración del fórnix se ha relacionado también con el trastorno de memoria (Gale et al., 1993, Gale et al., 1995; Tamaiouli et al., 2004)
Morfología basada en el vóxel
La morfología basada en el vóxel (VBM del inglés voxel-based morphometry) es una técnica de análisis de neuroimagen que puede caracterizar las alteraciones regionales en la composición del tejido cerebral tanto de la sustancia blanca como de la sustancia gris. Esta técnica analiza la información de la densidad o concentración tisular a partir de los datos de RM con adquisición continua de cortes de 1 o 1,5 mm de grosor que permite una reconstrucción tridimensional de cada cerebro y su normalización para poder comparar las densidades o volúmenes de dos o más grupos de estudio. Las comparaciones se llevan a cabo mediante pruebas t o mediante análisis de la varianza.
Desde el año 2000, la VBM se ha aplicado en diversas patologías neurológicas y psiquiátricas que suponen cambios cerebrales no evidenciables por la neurorradiología clínica estándar. En los TCE Gale et al., (2005) hallan diferencias significativas en la sustancia gris en el córtex frontal, temporal, cingulado y en regiones subcorticales y cerebrales, en nueve pacientes comparados con controles. Algunos de estas regiones correlacionaron con la ejecución en test de atención y en la escala de coma de Glasgow (GCS). Wilde et al., (2005) halló una reducción de la sustancia gris en el córtex prefrontal, cingulado, temporal y parietal. Esta reducción correlaciona con el rendimiento en memoria y velocidad de procesamiento en pacientes con daño axonal difuso. Asimismo, los pacientes con TCE presentan una reducción del volumen de la sustancia blanca (Wilde et al., 2005; Thatcher et al., 1997), específicamente en el córtex prefrontal y en el hipocampo (Serra-Grabulosa et al., 2005). Tomaiuolo et al., (2005) hallaron reducciones en el cuerpo calloso, fórnix, brazo anterior de la cápsula interna, circunvolución frontal superior, giro parahipocampal, radiación óptica y quiasma.
La técnica de la VBM, además del análisis global de la sustancia gris o blanca de todo el cerebro, se puede utilizar también identificando una o varias regiones de interés (ROI). Por ejemplo, el hipocampo y los ganglios basales son regiones de interés en el TCE. En el TCE grave, a menudo coexisten lesiones focales y difusas por lo que la aproximación de la VBM global es poco adecuada. En estos casos es preferible el uso de técnicas de regiones de interés localizadas en áreas en las que no se observen lesiones macroscópicas. Esto es debido a que una de las limitaciones más importantes en el uso de la VBM en pacientes con TCE es la dificultad en segmentar adecuadamente. El TCE produce una clara reducción de la diferenciación entre SB y SG y esta reducción está relacionada con la gravedad del TCE (Tatcher et al., 1997).
En estudios longitudinales (entre 8 y 12 semanas tras TCE) se ha observado que la VBM es sensible a pérdidas progresivas tanto la sustancia blanca como la sustancia gris, lo que sugiere que es una técnica sensible a procesos de fagocitosis (Bendlin et al., 2008)
Imágenes de Tensor de Difusión: Técnica idónea para valorar el daño axonal difuso
Las imágenes de resonancia magnética por tensor de difusión (ITD) pueden sin lugar a dudas proporcionar mucha información en los TCE ya que de forma no invasiva permiten detectar el grado de integridad de las fibras en enfermedades que afectan básicamente la sustancia blanca. La técnica se fundamenta en el movimiento del agua en los tejidos. Las moléculas de agua se mueven de forma más rápida en paralelo a las fibras nerviosas que en perpendicular. El curso del movimiento del agua en el SNC se puede interrumpir por las estructuras tisulares como las membranas celulares, las vainas de mielina, los microtúbulos intracelulares y las proteínas asociadas. El movimiento paralelo a los axones o las fibras mielinizadas se inhibe en menor grado que el movimiento de tipo perpendicular, este fenómeno se denomina anisotropía de difusión. Una de las variables que se analiza en los estudios es la anisotropía fraccional (AF) que se mueve entre los valores de 0 a 1, en las que el valor máximo supone mayor integridad de las fibras de la sustancia blanca (Mori et al., 2005). Otro valor muy utilizado es la difusión media (DM) o coeficiente de difusión aparente (CDA) que se refiere a la media de los tres eigenvalores que cuantifican la difusión en tres direcciones ortogonales. En los TCE los valores de AF están en general disminuidos y al mismo tiempo los de DM están incrementados o son normales (Huisman et al. 2006; Xu et al., 2007) (ver figura 1). Finalmente, otra medida usada para valorar las alteraciones de la sustancia blanca es la denominada carga lesional de sustancia blanca global. Este valor se obtiene midiendo la proporción de vóxeles que caen por debajo de un valor critico de anisotropía fraccional (AF) identificado a partir de los valores del grupo control (Newcome et al., 2007).
En las lesiones de la sustancia blanca en los TCE coexisten los daños axonales y la pérdida de mielina cada uno de ellos puede tener una implicación distinta en la afectación funcional de los pacientes y también en su pronóstico. Song et al (2002) usando el modelo animal in vivo de ratones caracterizados por una incompleta o nula mielinización del SNC, pudieron distinguir el significado de los parámetros de ITD. Observaron que en estos animales la difusión perpendicular estaba incrementada pero no la paralela. Estos datos indican pues que la difusión paralela no está reflejando alteración de la mielinización y que en la ITD es importante examinar la dirección de la difusión.
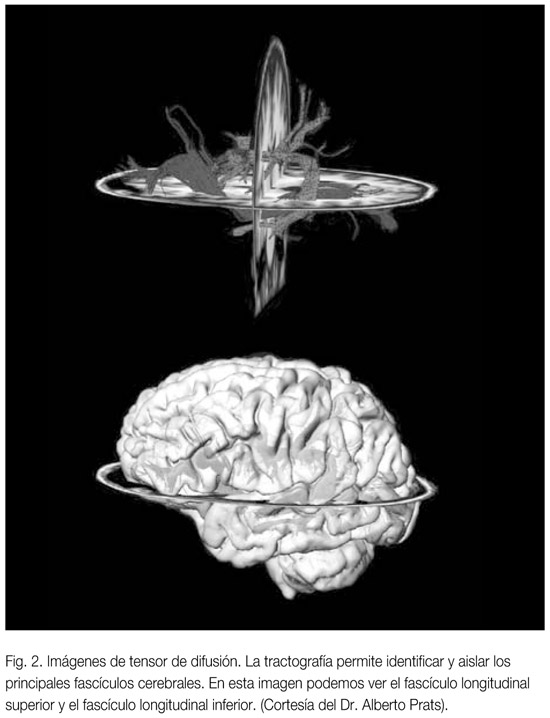
La evolución en la adquisición de ITD y su posterior análisis ha permitidito la denominada tractografía (ver figura 1) que consiste en la reconstrucción tridimensional de los tractos de sustancia blanca. La ITD se ha usado para identificar las fibras comisurales del cuerpo calloso, las fibras de asociación largas y prominentes tales como los fascículos longitudinales superior e inferior, los fascículos occipito -frontales inferior y superior, el fascículo uncinado y el cingulum. Los haces de fibras más pequeñas como las del tronco y fibras de proyección tales como las fibras cortico-talámicas y las del tracto corticoespinal también se pueden visualizar. Ello hace que sea una técnica idónea para explorar las alteraciones de la conectividad cerebral en los TCE. Mori et al. (2005) han publicado un atlas de ITD que permite identificar las fibras alteradas en los distintos cortes de RM.
La ITD es la técnica más potente para detectar precozmente las lesiones cerebrales tras TCE, esto supone un enorme potencial para monitorizar las terapias neuroprotectoras en los TCE que tiene como objetivo detener la cascada de neurodegeneración producida por el daño cerebral secundario y terciario. Las técnicas inmunohistoquímicas han demostrado que ya existen cambios en la morfología axonal pocas horas tras el TCE. Newcombe et al., (2007) examinaron una muestra de 33 pacientes con TCE moderado o grave en fase aguda (media de 32 horas tras TCE) y encontraron una disminución de AF, incremento de DC y también de la carga lesional global de sustancia blanca.
En opinión de Huisman et al., (2004), la ITD puede ser el biomarcador más potente de la lesión axonal difusa y que mejor refleja la gravedad del TCE. Estos autores encontraron que los valores de AF del esplenium del cuerpo calloso correlacionaban con los valores de la escala de coma de Glasgow (GCS) al ingreso y la escala funcional al alta. Así mismo, los valores medios de AF correlacionan fuertemente con la duración de la amnesia postraumática, incluso con una fuerza mayor a los clásicos valores de la GCS (Benson, et al. 2007). Los valores de AF correlacionan también con la escala de outcome de Glasgow (GOS), tanto en niños como en adultos (Wilde et al., 2006; Yuan et al., 2007).
La relevancia de la ITD en valorar el daño axonal difuso de los TCE queda puesto en evidencia una vez más, al demostrar que los valores de AF están disminuidos incluso en los pacientes con TCE leve, es decir pacientes que no han estado en coma y que hasta hace poco no se disponían de técnicas de neuroimagen suficientemente sensibles para detectar de forma objetiva la existencia de anomalías cerebrales. El TCE leve es el tipo de TCE más frecuente. Los pacientes afectados a menudo tienen quejas subjetivas de baja concentración, disfunciones de memoria, etc. La exploración neuropsicológica a menudo es incapaz de identificar trastornos objetivos que permitan objetivar secuelas. En estos pacientes se observa decremento de la AF en el cuerpo calloso, cingulum y sustancia blanca lobar. No obstante, la tractografía muestra que sólo aproximadamente un 20% de los pacientes con TCE leve muestran discontinuidad en el tracto de las fibras (Rutgers et al., 2008). Aunque en todos los grados de gravedad de los TCE se observan alteraciones en la ITD, las lesiones irreversibles de mielina parecen estar solo presentes en los pacientes moderados-severos. Por el contrario, en los pacientes leves los hallazgos en ITD sugieren lesiones axonales sin afectación de la mielina (Kraus et al, 2007).

La ITD es también un poderoso instrumento para investigar la evolución del daño cerebral y en consecuencia conocer los mecanismos de reorganización cerebral causados por desconexión o enlentecimiento de la conectividad cerebral debido a la desmielinización. Hasta el momento no puede hablarse de un modelo claro de cuál es la evolución de la difusión en los TCE ya que existen solamente dos estudios longitudinales de series recientemente publicados y muestran resultados contradictorios. Sidaros et al. (2008) llevaron a cabo un estudio de seguimiento de 23 pacientes a la entrada de un programa de rehabilitación (tiempo de evolución de los pacientes entre 5 y 11 semanas). Tras evolución (12 meses), se observó un incremento de los valores de AF en la cápsula interna y el centro semioval. Este incremento se debía a la difusividad paralela y no a la perpendicular. La difusividad paralela indica daño axonal y la perpendicular indica desmielinización. Se observó además que los pacientes con outcome favorable (valorado con la escala de coma de Glagow) habían obtenido valores normales en la segunda evaluación en la AF paralela. En los pacientes con outcome desfavorable se objetivó un incremento de los valores tanto paralelos como perpendiculares pero los valores no se habían normalizado. Estos resultados son los esperables ya que una mejoría en la difusión posiblemente está reflejando una mejor conectividad cerebral. Probablemente se produce una recuperación axonal sin remielinización concomitante. Este estudio indica que la ITD puede ser un buen indicativo de pronóstico en los TCE.
No obstante, en un segundo estudio longitudinal en el que se evaluaban los pacientes neuropsicológicamente y con ITD, se observó que a pesar de la clara mejoría que los pacientes mostraban en las funciones cognitivas, se evidenciaba un empeoramiento en los clásicos parámetros de ITD, es decir un decremento de los valores de AF, junto con un incremento de los valores de MD. Los autores sugieren que el incremento de MD puede estar reflejando la degeneración walleriana (Bendlin et al., 2008).
Los estudios con ITD en poblaciones pediátricas tienen especial relevancia dado que esta coincidiendo un periodo de maduración que se refleja habitualmente por un incremento en la mielinización en especial de fibras largas, con una afectación de estas fibras. Yuan et al., (2007) estudiaron una muestra de niños de 6-9 años de edad que habían sufrido el TCE como mínimo un año antes de la exploración y observaron disminuciones de los valores de la AF en varias regiones, entre ellas el cuerpo calloso, lo cual demostraba que las alteraciones de conectividad no eran reversibles. Estos resultados coinciden también con los de Wilde et al., (2006) en el sentido de observar cambios persistentes de la afectación del cuerpo calloso. En un interesante estudio, Ewing-Cobbs et al. (2008), sugieren que los TCE en niños detienen el desarrollo del cuerpo calloso. Estos investigadores estudiaron una extensa muestra de 41 niños y adolescentes con TCE mediante técnicas de cuantificación del cuerpo calloso (macroestructura) y ITD (microestructura) en una subdivisión de 7 regiones. Observaron una reducción en el tamaño y cambios microestructurales en las regiones posteriores que indican una interrupción del neurodesarrollo y una mielinización alteradas.
Respecto a las correlaciones entre los parámetros de ITD y alteraciones neuropsicológicas no han cumplido con las expectativas que se habían puesto en la técnica para identificar el substrato de las secuelas cognitivas postraumáticas.
El estudio de casos aislados ha demostrado una relación entre los datos de ITD y la sintomatología neuropsicológica. Por ejemplo, Le et al., (2005) describieron un caso de desconexión (hemialexia) relacionado con la alteración de la parte posterior inferior del cuerpo calloso visualizada mediante tractografía. Voss et al., (2006) pusieron en evidencia la relación entre los datos de ITD y la evolución favorable de un paciente con estado de mínima conciencia, que tras 19 años en este estado, inicio un mínimo de lenguaje expresivo.
Por lo que respecta a los estudios de muestras, Nakayama et al., (2006) seleccionando 23 pacientes traumáticos con lesiones no macroscópicamente detectables (inferiores a 1.6 cm3) y hallaron una disminución de los valores de AF en los pacientes en el cuerpo calloso (genu, tallo, y esplenium) y en el fórnix. A pesar de usar una batería neuropsicológica que valoraba inteligencia (WAIS), la memoria (WMS) y la atención (PASAT), únicamente encontraron correlaciones significativas entre el MMSE y los valores de AF en el esplenium del cuerpo calloso.
En el estudio de Wilde et al., (2006) en niños, el tiempo de reacción simple y la velocidad de procesamiento en una tarea de inhibición correlacionó con los valores de AF, pero esta correlación se observó tanto en los pacientes con TCE como en los sujetos control y no se observó ninguna interacción en la tarea por grupo. Niogi et al., (2008) encontraron que los pacientes adultos con TCE leve tenían alteraciones en el tiempo de reacción en una tarea cognitiva atencional y una disminución de los valores de AF, pero no obtuvieron correlaciones significativas entre ambas variables. Wozniak et al., (2007) en una muestra que incluía TCE pediátricos con afectación leve y moderada, encontró que los TCE diferían de los controles en velocidad de procesamiento, memoria de trabajo y funciones ejecutivas. Los pacientes mostraban decremento de los valores de AF en tres regiones: inferior frontal, superior frontal y supracallosa. Estos autores obtuvieron correlaciones significativas entre la AF supracallosa, la velocidad de procesamiento, las funciones ejecutivas y las escalas conductuales. Probablemente la variabilidad en afectación cognitiva y de valores de AF de esta muestra favoreció la correlación. También en una población pediátrica, Ewing-Cobs, et al., (2008) encontraron que los valores de AF mostraron más correlaciones con las funciones neuropsicológicas evaluadas. En concreto, el esplenium del cuerpo calloso correlacionó con medidas de cociente de inteligencia, memoria operativa, comprensión lectora, rapidez visuo-motora y velocidad en denominación de letras.
Un problema del análisis de correlaciones entre los valores de AF y las secuelas neuropsicológicas consiste en el número de correlaciones que deben practicarse. Si se lleva a cabo la clásica aproximación de ROI's implicando los fascículos que potencialmente pueden estar alterados en los TCE (aproximadamente entre 12 y 14) y las variables incluidas en los tests neuropsicológicos que son sensibles al daño axonal difuso (aproximadamente entre 12 y 20) muy difícilmente las correlaciones van a sobrevivir a la corrección por múltiples comparaciones. Una posible solución a este problema es usar megazetas para cada dominio cognitivo y usar un valor global de carga lesional de la sustancia blanca. Mediante este procedimiento de agrupación de variables, Kraus et al., (2007) encontraron correlaciones entre el índice global de AF y los dominios de atención, memoria y función ejecutiva. Cabe mencionar pero, que en estas correlaciones los autores mezclaron pacientes moderados-graves, con pacientes leves y grupo control.
Nuevas perspectivas: combinación de técnicas
Aunque la técnica de la tractografía inicialmente parecía muy prometedora para estudiar las alteraciones de la conectividad tras TCE, posteriormente se ha visto que los resultados son a menudo difíciles de interpretar a nivel neurofuncional, ello dificulta su uso para explicar la recuperación funcional de pacientes con TCE. El patrón de activación neurofuncional puede ser más variable aún que la morfología cerebral. Una posibilidad de superar este problema es el de combinar las técnicas de ITD con las de resonancia magnética funcional (RMf). El usar el patrón de activación de un determinado paciente puede ayudar a explicar los hallazgos de desconexión detectados mediante ITD. En esta línea, Cherubini et al. (2007) combinaron ambas técnicas para el estudio individual de redes neurales que intervienen en las áreas motoras de "tapping". Estos autores estudiaron 2 pacientes con TCE que habían recuperado las capacidades motoras y vieron por ejemplo que los datos aislados de RMf mostraban patrones anormales de activación (más bilaterales) para la extremidad afectada, pero que combinando ITD con RMf los pacientes tenían el mismo patrón de conectividad que los sujetos normales. Ello podía explicar la recuperación de la función.
Referencias
Adams., J.H., Graham, D.I., Gennarelli, T.A., Maxwell, W.L. (1991). Diffuse axonal injury in non-missile head injury. J Neurol Neurosurg Psychiatry, 54, 481-483. [ Links ]
Anderson, C.V., Bigler, E.D. (1995). Ventricular dilation, cortical atrophy, and neuropsychological outcome following traumatic brain injury. The Journal of Neuropsychiatry and Clinical Neurosciences, 7, 42-48. [ Links ]
Arfanakis, K., Haughton, V.M.,Carew, J.D., Rogers, B.P., Dempsey, R.J., Meyerand, ME. (2002). Diffusion tensor MHD imaging in diffuse axonal injury. American Journal of Neuroradiology, 23, 794-802. [ Links ]
Ariza, M., Serra-Grabulosa, J.M., Junque, C., Ramirez, B., Mataro, M., Poca, A. (2006). Hippocampal head atrophy after traumatic brain injury. Neuropsychologia, 44, 1956-1961. [ Links ]
Ashburner, J., Friston, K.J. (2000). Voxel-based morphometry--the methods. Neuroimage, 11, 805-821. [ Links ]
Azouvi, P (2000). Neuroimaging correlates of cognitive and functional outcome after traumatic brain injury. Current Opinion in Neurologyl, 13, 665-669. [ Links ]
Bazarian, J.J., Zhong, J., Blyth, B., Zhu, T., Kavcic, V., Peterson, D. (2007). Diffusion tensor imaging detects clinically important axonal damage after mild traumatic brain injury: a pilot study. Journal of Neurotrauma, 24, 1447-1459. [ Links ]
Bendlin, B.B., Ries, M.L, Lazar, M., Alexander, A.L., Dempsey, R.J., Rowley, H.A., Sherman, J.E., Johnson, S.C. (2008). Longitudinal changes in patients with traumatic brain injury assessed with diffusion-tensor and volumetric imaging. Neuroimage, 15, 503-514. [ Links ]
Benson, R.R., Meda, S.A., Vasudevan, S., Kou, Z., Govindarajan, K.A., Hanks, R.A., Millis, S.R., Makki, M., Latif, Z., Coplin, W., Meythaler, J., Haacke, E.M. (2007). Global white matter analysis of diffusion tensor images is predictive of injury severity in traumatic brain injury. Journal of Neurotrauma, 24, 446-459. [ Links ]
Bigler, E.D. (2001). Quantitative magnetic resonance imaging in traumatic brain injury. The Journal of Head Trauma Rehabilitation, 16, 117-134. [ Links ]
Bigler, E.D. (2003). Neurobiology and neuropathology underlie the neuropsychological deficits associated with traumatic brain injury. Archives of clinical neuropsychology: The Official Journal of the National Academy of Neuropsychologis, 18, 595-621. [ Links ]
Bruns, J, Jr., Hauser, W.A. (2003). The epidemiology of traumatic brain injury: a review. Epilepsia 44, Suppl 10, 2-10. [ Links ]
Cherubini, A., Luccichenti, G., Péran, P., Hagberg, G.E., Barba, C., Formisano, R., Sabatini, U. (2007). Multimodal fMRI tractography in normal subjects and in clinically recovered traumatic brain injury patients. Neuroimage, 34; 1331-1341. [ Links ]
Ducreux, D., Huynh, I., Fillard, P., Renoux, J., Petit-Lacour, M.C., Marsot-Dupuch, K., Lasjaunias, P. (2005). Brain MHD diffusion tensor imaging and fibre tracking to differentiate between two diffuse axonal injuries. Neuroradiology, 47, 604-608. [ Links ]
Ewing-Cobbs, L., Prasad, M.R., Swank, P., Kramer, L., Cox, C.S. Jr, Fletcher, J.M., Barnes, M., Zhang, X., Hasan, K.M. (2008). Arrested development and disrupted callosal microstructure following pediatric traumatic brain injury: relation to neurobehavioral outcomes. Neuroimage (On-line) [ Links ]
Gale, S.D., Johnson, S.C., Bigler, E.D., Blatter, D.D. (1995). Nonspecific white matter degeneration following traumatic brain injury. Journal of the International Neuropsychological Society: JINS, 1, 17-28. [ Links ]
Gale, S.D., Baxter, L., Roundy, N., Johnson, S.C. (2005). Traumatic brain injury and grey matter concentration: a preliminary voxel based morphometry study. Journal of Neurology, Neurosurgery, and Psychiatry., 76, 984-988. [ Links ]
Gennarelli, T.A., Graham, D.I. (1998). Neuropathology of the Head Injuries. Semin Clin Neuropsychiatry, 3, 160-175. [ Links ]
Huisman, T. Schwamm L.H., Schaefer, P.W, Koroshetz, W.J., Shety-Alva,N., Ozsunar, Y., Wu,O., Sorensen, A.G. (2004). Diffusion tensor imaging as potential biomarker of white mater injury in diffuse axonal injury. AJNR, 25, 370-376. [ Links ]
Himanen, L., Portin, R., Isoniemi, H., Helenius, H., Kurki, T., Tenovuo, O. (2006). Longitudinal cognitive changes in traumatic brain injury: a 30-year follow-up study. Neurology, 66, 187-192. [ Links ]
Junque, C. (1999). Secuelas neuropsicológicas de los traumatismos craneo-enecfálicos. Revista de Neurología, 28, 423-429. [ Links ]
Junque, C., Bruna, O., Mataró, M. (1999). Traumatismos craneoencefálicos. Un enfoque desde la neuropsicología y la logopedia. Guía práctica para profesionales y familiares. Barcelona: Masson. [ Links ]
Junque, C. (2004). Aplicaciones de la neurorradiología a la neuropsicología. En JM. Mercader (Ed). Neurorradiología diagnóstica y terapéutica. Barcelona: Masson, 529-533. [ Links ]
Kraus, M.F., Susmaras, T., Caughlin, B.P., Walker, C.J., Sweeney, J.A., Little, D.M. (2007). White matter integrity and cognition in chronic traumatic brain injury: a diffusion tensor imaging study. Brain, 130, 2508-2519. [ Links ]
Le, T.H., Mukherjee,P., Henry,R.G., Berman,J.I., Ware, M., Manley, G.T. (2005). Diffusion tensor imaging with three-dimensional fiber tractography of traumatic axonal shearing injury: an imaging correlate for the posterior callosal "disconnection" syndrome: case report. Neurosurgery, 56, 196-201. [ Links ]
Levin, H.S., Benavidez, D.A., Verger-Maestre, K., Perachio, N., Song, J., Mendelsohn DB. (2000). Reduction of corpus callosum growth after severe traumatic brain injury in children. Neurology, 54, 647-653. [ Links ]
Levin, H.S., Gary, H.E., Jr., Eisenberg, H.M., Ruff, R.M., Barth, J.T., Kreutzer, J. (1990). Neurobehavioral outcome 1 year after severe head injury. Experience of the Traumatic Coma Data Bank. Journal of Neurosurgery, 3, 699-709. [ Links ]
Levine, B., Fujiwara, E., O'Connor, C., Richard, N., Kovacevic, N., Mandic, M., et al. (2006). In vivo characterization of traumatic brain injury neuropathology with structural and functional neuroimaging. Journal of Neurotrauma, 23, 1396-411. [ Links ]
Levine, B., Kovacevic, N., Nica,E.I., Cheung, G., Gao, F., Schwartz, M.L. Black, S.E. (2008). The Toronto traumatic brain injury study: injury severity and quantified MRI. Neurology, 70, 771-778. [ Links ]
Maxwell, W.L., Povlishock, J.T. Graham, D.L. (1997). A mechanism analysis of nondisruptive axonal injury: A review. Journal of Neurotrauma, 14, 419-440 [ Links ]
McKenzie, E.J. (2000). Epidemiology of injuries: current trends and future challenges. Epidemiologic reviews, 22,112-119. [ Links ]
Mataro, M., Poca, M.A., Sahuquillo, J., Pedraza, S., Ariza, M., Amoros, S. Junque, C. (2001) Neuropsychological outcome in relation to the traumatic coma data bank classification of computed tomography imaging. Journal of Neurotrauma , 18, 869-879. [ Links ]
Mori, S., Wakana, S., Nagae-Poetscer, L.D., Van Zijl, P.C.M. (2005). MRI Atlas of Human White Matter. Amsterdam: Elsevier. [ Links ]
Nakayama, N., Okumura, A., Shinoda, J., Yasokawa, Y.T., Miwa, K., Yoshimura, S,I., Iwana, T. (2006). Evidence for with matter disruption in traumatic brain injury without macroscopic lesions. Journal of Neurology, Neurosurgery, and Psychiatry, 77, 850-855 [ Links ]
Narberhaus, A., Segarra-Castells, M.D., Verger-Maestre, K., Serra-Grabulosa, J.M., Salgado-Pineda, P., Bartomeus-Jene, F. (2003). Evaluation of diffuse cerebral atrophy in patients with a history of traumatic brain injury and its relation to cognitive deterioration.. Revista de Neurolología 36, 925-929. [ Links ]
Neil, J., Miller,P., Mukherjee,P., Huppi, P.S. (2002). Diffusion tensor imaging of normal and injured developing human brain. A Technical review, NMR in Biomedicine, 15,543-552. [ Links ]
Newcombe, V.F., William, G.B., Nortje, J., Bradley, P.G., Harding, S.G., Smielews, K.I., Coles, J.P., Maia, B., Gillard, J.H., Hutchinson, P.J, Pickard, J.D, Carpenter, T.A., Menon, D.K. (2007) Analysis of acute traumatic axonal injury using diffusion tensor imaging. British Journal of Neurosurger., 21, 340-348. [ Links ]
Niogi, S.N., Mukherjee, P., Ghajar, J., Johnson, C., Kolster, R.A., Sarkar, R., Lee. H., Meeker, M., Zimmerman, R.D., Manley, G.T., McCandliss, B.D. (2008). Extent of microstructural white matter injury in postconcussive syndrome correlates with impaired cognitive reaction time: a 3T diffusion tensor imaging study of mild traumatic brain injury. American Journal of Neuroradiology, 29, 967-973. [ Links ]
Pitts L.H. y McIntosh T.K. (1990). Dynamic changes after brain trauma. In P.J. Vinken, G.W. Bruyn., H.L. Klawans, R. Braakman (Editors). Head Injury. Amsterdam: Elsevier, 65-100. [ Links ]
Rutgers, D.R., Toulgoat, F., Cazejust, J., Fillard, P., Lasjaunias, P., Ducreux, D. (2008). White matter abnormalities in mild traumatic brain injury: a diffusion tensor imaging study. American Journal of Neuroradiology, 29, 514-519. [ Links ]
Salmond, C,H,, Chatfield, D.A., Menon, D.K., Pickard, J.D., Sahakian, B.J.. (2005). Cognitive sequelae of head injury: involvement of basal forebrain and associated structures. Brain, 128, 189-200. [ Links ]
Sahuquillo, J., Poca, M.A., Amoros, S. (2001). Current aspects of pathophysiology and cell dysfunction after severe head injury. Current Pharmaceutical Design, 7, 1475-1503 [ Links ]
Scheid, R., Walther, K., Guthke, T., Preul, C., von Cramon, D.Y. (2006). Cognitive sequelae of diffuse axonal injury. Archives of Neurology, 63, 418-424. [ Links ]
Scheid, R., Ott,D.V., Roth, H., Schoeter, M.L., Cramon, Y,V. (2007). Comparative magnetic resonance imaging at 1.5 and 3 Tesla for the evaluation of traumatic microbleeds. Journal of Neurotrauma, 24, 1811-1816. [ Links ]
Serra-Grabulosa, J.M., Junque, C., Verger, K., Salgado-Pineda, P., Maneru, C., Mercader, J.M. (2005). Cerebral correlates of declarative memory dysfunctions in early traumatic brain injury. Journal of Neurology, Neurosurgery, and Psychiatry, 76, 129-131. [ Links ]
Sidaros, A., Engberg, A.W., Sidaros, K., Liptrot, M.G., Herning, M., Petersen, P., Paulson, O.B., Jernigan, T.L., Rostrup, E. (2008). Diffusion tensor imaging during recovery from severe traumatic brain injury and relation to clinical outcome: a longitudinal study. Brain, 131, 559-572. [ Links ]
Song, S_K., Sun, S.W., Ramsbottom, M.J., Chang, C., Rusell, J., Cross, A.H. (2002). Dysmyelination revealed through MRI as increased radial (but unchanged axial) diffusion of water. Neuroimage, 17, 1429-1436. [ Links ]
Thatcher, R.W., Camacho, M., Salazar, A., Linden, C., Biver, C., Clarke, L. (1997). Quantitative MRI of the gray-white matter distribution in traumatic brain injury. Journal of Neurotrauma, 14,1-14. [ Links ]
Tomaiuolo, F., Carlesimo, G.A., Di Paola, M., Petrides, M., Fera, F,, Bonanni, R. (2004). Gross morphology and morphometric sequelae in the hippocampus, fornix, and corpus callosum of patients with severe non-missile traumatic brain injury without macroscopically detectable lesions: a T1 weighted MRI study.Journal of Neurology, Neurosurgery, and Psychiatry, 75, 1314-1322. [ Links ]
Tomaiuolo, F., Worsley, K.J., Lerch, J., Di Paola, M., Carlesimo, G.A., Bonanni, R. (2005). Changes in white matter in long-term survivors of severe non-missile traumatic brain injury: a computational analysis of magnetic resonance images. Journal of Neurotrauma, 22, 76-82. [ Links ]
Verger, K., Junque, C., Levin, H.S., Jurado, M.A., Perez-Gomez, M., Bartres-Faz, D. (2001). Correlation of atrophy measures on MRI with neuropsychological sequelae in children and adolescents with traumatic brain injury. Brain Injury, 15, 211-21. [ Links ]
Voss, H.U., Ulug, A.M., Dyke, J.P., Watts, R., Kobylarz, E.J., McCandliss, B.C. et al., (2006). Possible axonal regowth in late recovery from the minimally conscious state. The Journal of Clinical Investigation, 116, 2005-2011. [ Links ]
Wallesch, C.W., Curio, N., Galazky,I., Jost,S., Synowitz, H. (2001). The neuropsychology of blunt head injury in the early postacute stage: effects of foca lesions and diffuse axonal injury. Journal of Neurotrauma, 18, 11-20 [ Links ]
Wilde, E.A., Chu, Z., Bigler, E.D., Hunter, J.V., Fearing, M.A., Hanten, T.A., Newsome, M.R., Scheibel, R.S., Li, X., Levin, H.S. (2006). Diffusion tensor imaging in the corpus callosum in children after moderate to severe traumatic brain injury. Journal of Neurotrauma, 23, 1412-1426. [ Links ]
Wilde, E.A., Hunter, J.V., Newsome, M.R., Scheibel, R.S., Bigler, E.D., Johnson, J.L., (2005). Frontal and temporal morphometric findings on MRI in children after moderate to severe traumatic brain injury. Journal of Neurotrauma, 22, 333-344. [ Links ]
Wilde, E.A., McCauley, S.R., Hunter, J.V., Bigler. E.D., Chu, Z., Wang, Z.J., Hanten, G.R,.Troyanskaya, M, Yallampalli, R., Li, X., Levin, H.S. (2008). Diffusion tensor imaging of acute mild traumatic brain injury in adolescents. Neurology, 70, 948-955. [ Links ]
Wilde, E.A., Chu, Z., Bigler, E.D., Hunter, J.V., Fearing, M.A., Hanten, G., Newsome, M.R., Scheibel, R.S., Li, X., Levin, H.S. Diffusion tensor imaging in the corpus callosum in children after moderate to severe traumatic brain injury. Journal of Neurotrauma, 23,1412-1426. [ Links ]
Wozniak, J.R., Krach, L., Ward, E., Mueller, B.A., Muetzel, R., Schnoebelen, S., Kiragu, A.,Lim, K.O. (2007). Neurocognitive and neuroimaging correlates of pediatric traumatic brain injury: a diffusion tensor imaging (DTI) study. Archives of Clinical Neuropsychology: The Official Journal of the National Academy of Neuropsychologists, 22,555-568. [ Links ]
Xu, J., Rasmussen, I.A., Lagopoulos, J., Håberg, A. (2007). Diffuse axonal injury in severe traumatic brain injury visualized using high-resolution diffusion tensor imaging. Journal of Neurotrauma 24, 753-765. [ Links ]
Yuan W, Holland SK, Schmithorst VJ, Walz NC, Cecil KM, Jones BV, Karunanayaka P, Michaud L, Wade SL. (2007). Diffusion tensor MR imaging reveals persistent white matter alteration after traumatic brain injury experienced during early childhood. American Journal of Neuroradiology, 28, 1919-1925. [ Links ]















