Introducción
La característica que define la diabetes mellitus es la hiperglucemia. Las formas más conocidas de diabetes son el tipo 1, en la cual hay un déficit de insulina como consecuencia de la destrucción de la célula beta pancreática y la diabetes tipo 2, en la que se produce una resistencia a la insulina. En el presente trabajo vamos a centrarnos en la segunda principalmente.
La obesidad es un factor de riesgo importante para la diabetes mellitus tipo 2, y está en aumento.
Las complicaciones de la diabetes mellitus afectan a casi todos los tejidos del cuerpo; es una causa fundamental de enfermedades cardiovasculares, ceguera, insuficiencia renal y amputaciones. El diagnóstico en adolescentes y adultos jóvenes se ha vinculado con una forma más agresiva de la enfermedad, con el desarrollo de complicaciones graves de forma prematura (1).
Intervención multifactorial y enfermedad cardiovascular en pacientes con Diabetes Mellitus tipo 2 (estudio STENO2): Este estudio (2) realizado en Dinamarca se pretendía evaluar el efecto de una intervención multifactorial intensiva sobre diversos factores de riesgo modificables en la enfermedad cardiovascular de pacientes diabéticos tipo 2 con microalbuminuria persistente, se asignaron dos grupos de 80 pacientes cada uno de forma aleatoria. Un grupo recibió tratamiento convencional para sus factores de riesgo cardiovascular y el otro recibió una intervención multifactorial intensiva. Tras un seguimiento de 7,8 años, finalizaron el estudio 130 pacientes. Las disminuciones de hemoglobina glicosilada, glucosa, presión arterial, colesterol total y LDL-colesterol, triglicéridos y microalbuminuria fueron más acusadas en el grupo de terapia intensiva. Se observó una reducción del riesgo absoluto de eventos cardiovasculares del 20 por ciento en el grupo de terapia intensiva. Además, tuvieron riesgos inferiores en la incidencia de nefropatía (RR 0.39, p<0.002), pero similar riesgo de neuropatía periférica.
La conclusión principal de este estudio fue que la intervención intensiva dirigida hacia múltiples factores de riesgo en pacientes con diabetes mellitus tipo 2 con microalbuminuria reduce el riesgo de eventos macro y microvasculares en un 50 por ciento.
Este estudio demuestra que la intervención sobre la presión arterial, perfil lipídico y microalbuminuria consigue disminuir las complicaciones micro y macrovasculares de la diabetes mellitus tipo 2 más que un tratamiento convencional. Sin embargo, la terapia no se limitaba a tratamiento farmacológico, sino que también se intervenía sobre el estilo de vida (dieta, ejercicio y consumo de tabaco).
Estudio prospectivo sobre diabetes realizado en el Reino Unido (estudio UKPDS)
El estudio UKPDS(3) ha sido el más prolongado y con mayor número de individuos de cuantos se han realizado sobre esta enfermedad. El objetivo prioritario era comprobar si el tratamiento intensificado a largo plazo producía mejores resultados que el tratamiento convencional.
Participaron 3.867 individuos con diabetes tipo 2 recién diagnosticada con una media de edad de 54 años, seguidos durante un período de 10 años. Después, fueron distribuidos aleatoriamente en dos grupos. Unos se asignaron al grupo convencional, tratados inicialmente con dieta, y otros al grupo de terapia intensificada con sulfonilureas o con insulina.
Las conclusiones principales del estudio UKPDS se agrupan en las siguientes; El control estricto de la glucemia parece tener efectos beneficiosos sobre las complicaciones específicamente relacionadas con la diabetes, pero no sobre la mortalidad. La metformina sería el fármaco de primera elección en obesos y no obesos. El efecto beneficioso sobre el control estricto de la glucemia de las sulfonilureas y de la insulina supera los riesgos teóricos de dichos fármacos. En personas diabéticas tipo 2 e hipertensas el control estricto de la presión arterial consigue una reducción clínicamente importante en las complicaciones micro y macrovasculares.
Bajo estas premisas nos planteamos el objetivo de analizar la relación existente entre la obesidad, la diabetes mellitus tipo 2 y los factores de riesgo cardiovascular.
Materiales y Métodos
Se ha realizado una revisión bibliográfica de la literatura existente sobre el tema siguiendo la metodología existente en la guía PRISMA. El procedimiento de búsqueda ha consistido en una recopilación de artículos.
La información recopilada engloba entre los meses de enero de 2015 hasta enero de 2020 a través de la base de datos Web Of Science, estableciéndose como filtro para refinar la búsqueda, artículos publicados en los últimos cinco años (2015-2020), probados en humanos.
La combinación de palabras clave empleada comprendía los términos de: “Diabetes and obesity”.
Los resultados obtenidos a través de las palabras clave utilizadas se sometieron a criterios de inclusión y exclusión.
Criterios de inclusión y exclusión
Criterios de inclusión
Tras la búsqueda inicial y debido a las numerosas publicaciones sobre el tema propuesto, se decidió incluir en la revisión únicamente aquellos artículos que cumpliesen las siguientes características:
- Publicados en los últimos 5 años.
- Artículos en inglés y español.
- Tipo de diseño: artículos.
- Disponible en Open Access.
- Dominio de investigación: science technology.
- Colección principal de Web of Science.
- Financiados por European Union y American Diabetes Asociation.
- Áreas de investigación: endocrinology metabolism nutrition dietetics.
Criterios de exclusión
Resultados
Inflamación del tejido adiposo en obesidad
La obesidad es una enfermedad altamente compleja y uno de los factores de riesgo más importantes para el desarrollo de resistencia a la insulina y diabetes tipo 2. La causa principal de diabetes tipo 2 impulsada por la obesidad es la resistencia a la insulina en el hígado, el tejido adiposo blanco y el músculo esquelético, añadiendo una deficiente insulinosecrección por las células del tejido pancreático para superar esta resistencia (4).
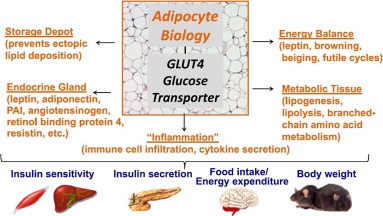
El tejido adiposo es una glándula endocrina, la cual secreta muchas hormonas, citoquinas y sustancias vasoactivas. Además juega un papel en el balance de energía, mediante la secreción de hormonas como la leptina. Lleva a cabo la lipogénesis y lipólisis. Todas estas funciones del adipocito contribuyen a la sensibilidad a la insulina, la secreción de insulina, la ingesta de alimentos y el gasto energético, y en última instancia la regulación del peso corporal (Figura 1) (5). La obesidad se considera la principal causa de resistencia a la insulina y diabetes mellitus tipo 2. Estudios recientes sugieren que uno de los mecanismos que impulsan el desarrollo de la resistencia a la insulina y diabetes tipo 2 es la inflamación inducida por la obesidad, y que esta inflamación está mediada principalmente por las células inmunes en los tejidos locales, el particular el tejido adiposo (6).
Durante el desequilibrio energético positivo, el tejido adiposo se expande para almacenar el excedente, pero esta expansión puede convertirse en disfuncional, favoreciendo la deposición de grasa ectópica en otros tejidos, lo que lleva a la desregulación metabólica, resistencia a la insulina y mayor riesgo de diabetes tipo 2. Esta expansión se logra mediante ampliación de los adipocitos preexistentes por acumulación de lípidos (hipertrofia) o mediante el aumento del número de adipocitos a través del reclutamiento de pre-adipocitos (hiperplasia) (4). El tejido adiposo blanco anormalmente aumentado en la obesidad se asocia con alteraciones metabólicas sistémicas, principalmente hiperglucemia, resistencia a la insulina y dislipemia. Por el contrario, la actividad del tejido adiposo marrón parece proteger contra la hiperglucemia y la hiperlipidemia por el drenaje a la circulación de los sustratos metabólicos de la oxidación (7).
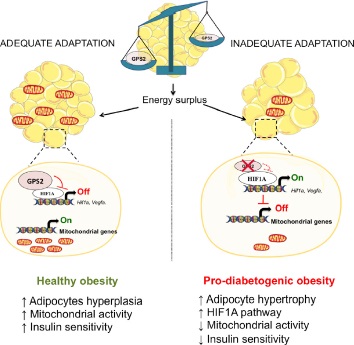
Un factor clave en la etiopatogenia de la obesidad es el tejido adiposo disfuncional, caracterizado por un adipocito hipertrofiado, con aumento de la inflamación, de la fibrosis, de la función y estructura vascular (8). La hipertrofia del tejido adiposo representa un mecanismo de mal adaptación, lo cual se vincula con el riesgo de desarrollar diabetes tipo 2. Esta hipertrofia que sucede en sujetos obesos se desencadena por la pérdida de la GPS2. Por tanto, los factores que relacionan obesidad y diabetes tipo 2 se asocian principalmente con el fenotipo de tejido adiposo hipertrófico en lugar de con la cantidad de grasa en sí (4).
Este tejido se comunica con muchos otros órganos mediante la liberación de moléculas pro y antiinflamatorias, conocidas como adipocinas. La expresión alterada de estas moléculas juega un papel crítico en la alteración de la homeostasis de todo el cuerpo, que contribuye a la progresión de complicaciones metabólicas inducidas por la obesidad (8).
La infiltración del tejido adiposo por células inmunes y su participación en los procesos inflamatorios son importantes para la fisiopatología de la obesidad y en el metabolismo de las alteraciones sistémicas en la obesidad (como por ejemplo la resistencia a la insulina) (7). La inflamación inducida por la obesidad comparte muchas características con la inducida por la infección. Las dos categorías de este sistema (innata y adaptativa) operan en dicha inflamación (6).
Algunos informes indican efectos positivos de agentes antiinflamatorios como salicilatos sobre la actividad del tejido marrón, pero la evidencia es escasa actualmente. Se necesita investigación adicional para determinar si la inhibición del estado de inflamación de los tejidos adiposo blanco y marrón sería una estrategia factible para la mejora del síndrome metabólico asociado con la obesidad (7).
La actividad física se conoce por ejercer un efecto antiinflamatorio que, además de una reducción en el peso corporal y la masa grasa visceral, puede ser debido a un mayor nivel de agentes inmunomoduladores, ejerciendo un efecto directo en el sistema inmune. La IL-6 induce una cascada antiinflamatoria mediante la activación de la liberación de citoquinas antiinflamatorias como la IL-10, IL-1 y el antagonista del receptor TNF soluble. Todo en su conjunto consigue reducir la inflamación sistémica. (9)
Las células del sistema inmune innato que participan en la inflamación relacionada con la obesidad son los macrófagos del tejido adiposo (MTA), neutrófilos y mastocitos, mientras que las células inmunes adaptativas incluyen células T, B y células dentríticas. Los MTA desempeñan un papel central en la producción de los mediadores inflamatorios. En condiciones de obesidad, los MTA aumentan en número y tamaño. La obesidad, además, altera el fenotipo MTA, pasando de un M2 o antiiflamatorio al M1 o proinflamatorio. Este cambio hace que se expresen muchas citoquinas proinflamatorias como el TNFα e IL-1β. Sin embargo, estudios recientes sugieren que la inmunidad adaptativa también juega un papel en el desarrollo de la inflamación inducida por la obesidad. Al eliminar el complejo mayor de histocompatibilidad tipo 2 en adipocitos o células mieloides, paralizando el sistema inmunitario adaptativo, mejora la inflamación inducida por la obesidad y la resistencia a la insulina (6).
Existen células inmunes que juegan un papel en ambos brazos del sistema inmune. Estas células incluyen las células asesinas naturales (NK), células T asesinas naturales invariantes (iNKT) y células linfoides innatas. Las dos primeras tienen memoria, es decir, pueden reconocer un antígeno específico que han visto antes y responder mucho más vigorosamente en el segundo encuentro que en el primero. Estudios recientes indican que los tres tipos de células en el tejido adiposo pueden jugar un papel importante en el desarrollo de la inflamación inducida por la obesidad y la resistencia a la insulina (6).
Las células NK son un subconjunto de linfocitos especializados que comúnmente se identifican como CD3. Su función principal es matar las células tumorales y las células infectadas a través de su actividad citolítica. Otras funciones incluyen producir grandes cantidades de varios mediadores inflamatorios como citoquinas pro y antiinflamatorias, factores de crecimiento para las células inmunes y quimiocinas. La maduración local, activación y proliferación de estas células está regulada por IL-12, IL-15 e IL-18, que se derivan de las células dendríticas o macrófagos. Difieren de los linfocitos T y B más comunes en que no tienen receptores específicos de antígeno, sino que poseen unos receptores inhibitorios y activadores que reconocen lo propio y lo no propio (6).
Las células NK participan en el desarrollo de resistencia a la insulina y DM2, presumiblemente debido a su capacidad para producir grandes cantidades de citoquinas como IFNγ y TNFα. Varios estudios han encontrado que la obesidad y la diabetes se asocian con cambios en el número y actividad de las células NK. Este aumento sólo se observó en la grasa epididimaria. Los pacientes obesos o con DM2 exhiben un mayor número y/o activación de células NK en la circulación o el tejido adiposo que los sujetos control (6).
En el estudio de Beatriz Dal Santo Francisco Bonamichi y Jongsoon Lee se enfocó en demostrar la relación de estas células del sistema inmune con la obesidad y la diabetes. Así, descubrieron que el agotamiento de las células NK con un anticuerpo mejoraba la resistencia a la insulina en condiciones de dieta alta en grasas. Sin embargo, en condiciones de escasez, este agotamiento no cambió los fenotipos metabólicos. También utilizaron el enfoque opuesto, es decir, expandieron las células NK gracias a la inyección de IL-15. Descubrieron que dicha expansión de las células NK empeoraba la resistencia a la insulina inducida por una dieta alta en grasas (6).
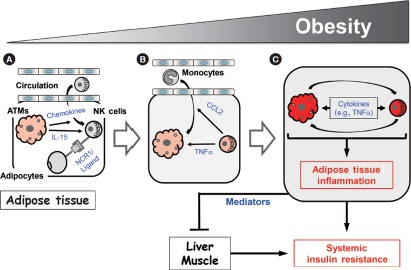
Figura 2. Modelo para la regulación mediada por células asesinas naturales (NK) de la inflamación inducida por la obesidad y la resistencia a la insulina.
A medida que aumenta la obesidad, los macrófagos del tejido adiposo (MTA) se activan y producen quimiocinas que reclutan células NK de la circulación. Esto aumenta el número de células NK en la grasa epididimaria. Además, los macrófagos del tejido adiposo en obesos producen IL-15 y los adipocitos producen un ligando aún desconocido para el receptor 1 desencadenante de citotoxicidad natural (NCR1), que activa las células NK en la grasa epididimaria. Entonces, las células NK activadas inducen aumentos en los números MTA y su activación. Esta activación cruzada de los macrófagos y las células NK induce inflamación del tejido adiposo en la obesidad y, finalmente, resistencia a la insulina del adipocito. La grasa epididimaria también produce mediadores que pueden regular la resistencia a la insulina en el hígado y los músculos, lo que finalmente conduce al desarrollo de resistencia a la insulina sistémica (6).
El tejido adiposo marrón en individuos alimentados con una dieta alta en grasas tiende a mostrar una baja expresión de ARNm de células inmunes, lo que sugiere que este tejido resiste la obesidad inducida por la inflamación. Sin embargo, el tejido adiposo blanco de individuos alimentados de forma sostenida con una dieta obesogénica en última instancia exhibe unos altos niveles de ARNm marcadores de inflamación, incluido TNFa y F4. Aunque el tejido marrón exhibe menos inflamación que el blanco en modelos experimentales de obesidad, se ha demostrado que la inflamación del tejido marrón que se observa tras varios insultos obesogénicos sostenidos tiene efectos deletéreos en la función termogénica del tejido. Esto conlleva una alteración en la absorción de glucosa inducida por la insulina en dicho tejido (7).
La epigenética de la obesidad se ha relacionado con la predisposición a alteraciones metabólicas. Sin embargo, los estudios actuales basados en la asociación de diabetes tipo 2 y obesidad no pueden responder si las alteraciones en el epigenoma son una causa, consecuencia, o ambos, de las alteraciones metabólicas durante la progresión de la enfermedad (4).
La pérdida de GPS2 en los adipocitos predispone al tejido adiposo a una mala adaptación durante el excedente de energía. Para demostrar esto, un estudio comparó dos poblaciones de ratones: aquellos sin GPS2 (ratones GPS2 AKO) y ratones de tipo salvaje (WT) durante 12 semanas. Durante este período no hubo diferencias significativas en cuanto a peso corporal, ingesta de alimentos o gasto energético. Los ratones GPS2 AKO eran más intolerantes a la glucosa que los WT después de éstas 12 semanas. Además, los ratones GPS AKO sufrieron un aumento del tamaño de los adipocitos, que fue corroborada con un deterioro en la sensibilidad a la insulina en el tejido adiposo (4).
La deficiencia de GPS2 en los adipocitos favoreció la disfunción mitocondrial. Esto es gracias al aumento de la actividad de HIF1A en los adipocitos, que restringe la oxidación de ácidos grasos y favorece la hipertrofia de los adipocitos. De hecho, los ratones GPS2 AKO mostraron una significativa baja regulación de los genes implicados en la función mitocondrial y la biogénesis, así como una reducción del ADN mitocondrial en los adipocitos (4).
La inhibición de HIF1A mejoró la tolerancia a la glucosa en un 15% de los ratones WT, en comparación con la mejora del 40% en los ratones GPS2 AKO. En estos últimos el fenotipo pro-diabetógeno se corrigió gracias a la inhibición de HIF1A (4).
La pérdida transcripcional de GPS2 en los adipocitos maduros predispone a una expansión patológica del tejido adiposo blanco. Los ratones con falta de GPS2 mostraron rasgos pro-diabéticos como la resistencia a la insulina del tejido adiposo blanco, la deposición de grasa ectópica y la intolerancia a la glucosa sistémica. Todo esto es consecuencia de la activación incontrolada del factor de transcripción HIF1A. Así, se ha demostrado que la ablación de éste factor de transcripción conduce a mejoras metabólicas en ratones obesos. Es decir, la inhibición farmacológica o genética de HIF1A en ratones GPS2 AKO podría revertir parcialmente el fenotipo pro-diabético. (4)
El tejido adiposo es un tejido capaz de reaccionar ante los estímulos. Así, es capaz de secretar unas u otras adipocinas según la situación metabólica existente. Entre la gran variedad de adipocinas producidas por este tejido destacan: los reactantes de fase aguda, citoquinas, quimiocinas y factores tanto proinflamatorios como antiinflamatorios. La obesidad se asocia con una secreción alterada de adipocinas que, de hecho, se traduce en un aumento del riesgo cardiovascular en pacientes con un exceso de adiposidad disfuncional (8).
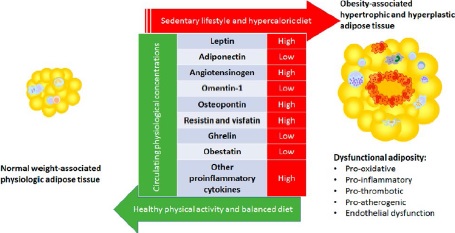
Figura 4. Principales cambios observados en las adipocinas disfuncionales derivadas del tejido adiposo.
El tejido adiposo secreta una hormona denominada leptina. Ésta participa en el control del peso corporal regulando la ingesta de alimentos y gasto energético y, como hormona clave en la homeostasis energética, también regula la función neuroendocrina (8).
La leptina induce un efecto sobre el control de la presión arterial mediante la modulación de la vasoconstricción dependiente de la actividad simpática, la liberación endotelial del óxido nítrico, así como la vasoconstricción dependiente de angiotensina II. Se encarga de disminuir la tensión de la pared y la vasoconstricción inducida por angiotensina II que actúa directamente en las células vasculares del músculo liso (8).
Esta, además, regula la oxidación de ácidos grasos en el músculo mediante la activación del AMPK a los quince minutos de su secreción. Este AMPK inhibe la Acetil-CoA Carboxilasa que resulta en una oxidación de los ácidos grasos. Además, tiene un efecto indirecto a las seis horas mediado por el hipotálamo y el sistema nervioso simpático, que también activa AMPK y la oxidación de ácidos grasos (figura 5) (5).
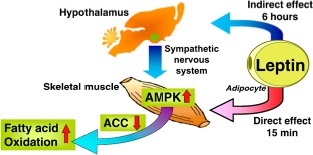
Figura 5. La leptina regula la oxidación de ácidos grasos en el músculo mediante la activación del AMPK.
La leptina también juega un papel importante en la ingesta de alimentos y el peso corporal. Esto se consigue mediante circuitos neuronales que consisten en neuronas especializadas en el núcleo arqueado del hipotálamo, neuronas que se proyectan al hipotálamo paraventricular y también al hipotálamo lateral. La leptina inhibe la AMPK en el núcleo arqueado y en el núcleo paraventricular. Esta inhibición es necesaria para disminuir la ingesta de alimentos en respuesta a la leptina (5).
El suero de unión a la proteína 4 del retinol (RBP4) está elevado en el suero en seres humanos con resistencia a la insulina y con algún componente del síndrome metabólico como la obesidad de tipo visceral, la diabetes tipo 2, la tolerancia alterada a la glucosa, la dislipemia, enfermedad arterial coronaria, hipertensión, enfermedad del ovario poliquístico, esteatosis hepática, y lipodistrofia. Además, se demostró que con cada incremento en componentes del síndrome metabólico, hay un aumento en los niveles séricos de RBP4. Así, muchas terapias que mejoran la sensibilidad a la insulina, tales como la cirugía bariátrica, ejercicio, pérdida de peso o la dieta, disminuyen los niveles de RBP4. La reducción de RBP4 suero es una terapia eficaz para reducir la resistencia a la insulina y prevenir o tratar la diabetes tipo 2. RBP4 es, por tanto, un buen marcador biológico para el síndrome metabólico (5).
Omentin-1 se expresa en las células vasculares del estroma del tejido adiposo visceral. Juega un papel importante como antiinflamatorio, antioxidante y sensibilizador a la insulina. In vitro, omentin-1 estimula la captación de glucosa en adipocitos humanos mediante la activación de vías de señalización. En la obesidad se redujeron sus niveles y se correlacionaban inversamente con el IMC, la circunferencia de la cintura y los marcadores del síndrome metabólico. Tras la pérdida de peso inducida por la dieta o tras la cirugía bariátrica la mayoría de los pacientes presentan un aumento de esta sustancia. Esto fortalece el vínculo entre omentin y la obesidad (8).
La resistina es un polipéptido que es secretada por los macrófagos residentes en el tejido adiposo. Sus niveles se incrementan en la obesidad, debido a que está implicada en la fisiopatología de la resistencia a la insulina inducida por inflamación en seres humanos. Esta asociación ha sido confirmada por estudios de casos y controles prospectivos que han encontrado un mayor riesgo de desarrollar diabetes tipo 2 en sujetos con niveles elevados de la misma. Sus altos niveles, además, se correlacionan con el riesgo de muerte cardiovascular (8).
En línea con lo anteriormente descrito, en septiembre de 2019 se publicó en la revista nutrientes un artículo sobre el aumento de la relación adiponectina/leptina en pacientes con obesidad y diabetes tipo 2 después de un bypass gástrico en Y de Roux (10).
La prevalencia del sobrepeso y la obesidad está en aumento en todo el mundo. Ha alcanzado la proporción suficiente como para ser considerada una epidemia y una emergencia de salud pública. Esta tendencia es alarmante, pues la obesidad afecta a la función de diferentes sistemas y órganos, otorgando un mayor riesgo de afecciones graves como la diabetes tipo 2, enfermedades cardiovasculares, enfermedad del hígado graso no alcohólico y diferentes tipos de cánceres. Las opciones de tratamiento comienzan con intervenciones en el estilo de vida, tales como la restricción calórica, reducción de comportamientos sedentarios y aumento de la actividad física. En segundo plano se encuentra la farmacoterapia y los procedimientos quirúrgicos. Los tratamientos convencionales tienen poca eficacia en la pérdida de peso y son relativamente ineficaces en el tratamiento de la obesidad a largo plazo. La cirugía bariátrica sigue siendo la opción más efectiva para lograr una pérdida de peso suficiente y sostenida a largo plazo, mejorar las comorbilidades relacionadas con la obesidad y reducir la mortalidad (10).
La adiponectina es una adipocina que se expresa casi exclusivamente en el tejido adiposo. Aumenta la sensibilidad a la insulina y ejerce acciones antiinflamatorias (8). Se ha demostrado claramente que sus niveles plasmáticos disminuyen a medida que aumenta el índice de masa corporal (IMC) y se correlaciona de forma opuesta con la resistencia a la insulina (10). La adiponectina de alto peso molecular predice mejor la resistencia a la insulina y el síndrome metabólico (8). Por el contrario, la leptina, otro factor derivado de los adipocitos, está relacionada directamente con el grado de adiposidad y la resistencia a la insulina (10).
La obesidad es una enfermedad compleja que afecta a una amplia gama de mecanismos patogénicos en los que sólo se ha demostrado como relevante el manejo holístico de la misma (8). Sin embargo, después de la cirugía bariátrica, las concentraciones de leptina disminuyen proporcionalmente a la pérdida de peso lograda (10), lo cual está en línea con la mejora del riesgo cardiovascular descrito después de la cirugía (8). El equilibrio entre estas dos hormonas derivadas del tejido adiposo tiene un papel fundamental en la evaluación del resultado metabólico de la cirugía bariátrica. Se ha propuesto recientemente el uso de la relación adiponectina/leptina (Adpn/Lep) como marcador de disfunción e inflamación del tejido adiposo, estando mejor correlacionado con la resistencia a la insulina que la adiponectina o la leptina por separado. Una relación Adpn/Lep superior a 1,0 puede considerarse normal, mientras que una relación inferior a 0,5 puede indicar un aumento del riesgo metabólico (10).
La cirugía bariátrica en Y de Roux se asoció con un aumento en adiponectina junto con una disminución en concentraciones de leptina. La relación Adpn/Lep aumentó significativamente después de la pérdida de peso. Los pacientes con diabetes tipo 2 mostraron un aumento en la relación Adpn/Lep de menos de 0,5 (indicativo de un aumento severo en el riesgo cardiometabólico) a más de 1,0 (considerado como normal). Curiosamente, los cambios en esta relación proporcionan mejores correlaciones con las diferencias en el IMC, la grasa corporal, la circunferencia de la cintura y la relación cintura-cadera, en comparación con las asociaciones de los cambios de concentración de cada adipocina por separado. Sin embargo, no se encontraron diferencias significativas en la relación Adpn/Lep entre los individuos que experimentaron una remisión de la diabetes tipo 2 o no después de la cirugía. Eso significa que la relación no presenta un factor predictivo para la remisión de la diabetes tipo 2 (10).
Resistencia a la insulina en obesos y no obesos
Numerosos estudios han informado de que los obesos con fenotipo metabólicamente sano pueden asociar un mejor perfil de riesgo cardiometabólico y la disminución de la incidencia de diabetes tipo 2 en comparación con el fenotipo metabólicamente alterado.
Se diseñó un estudio de cohortes 11 en el que se estudió a 320 sujetos sanos. En ellos se evaluó la resistencia/sensibilidad a la insulina mediante la técnica del clamp euglucémico o hiperinsulinémico y mediante el modelo de resistencia a la insulina (HOMA-IR). Se estratificaron varios grupos: obesos resistentes a insulina, no obesos resistentes a insulina, insulinosensibles no obesos e insulinosensibles obesos.
La técnica del clamp euglucémico se basa en la colocación de cánulas intravenosas en ambos brazos y la infusión intravenosa de insulina regular durante 180 minutos mientras se mantiene el nivel de glucosa en sangre en 100 mg/dl con una infusión de dextrosa. Gracias a esto se consigue derivar el índice de sensibilidad a la insulina. El HOMA-IR consiste en una estimación de la sensibilidad hepática a la insulina.
Entre los subgrupos de obesos, los sujetos sensibles a insulina tenían valores más bajos de circunferencia de la cintura, la grasa corporal total, la grasa del tronco, los triglicéridos en suero, la secreción de insulina y los niveles de adiponectina mayores, en comparación con los sujetos resistentes a insulina. En los subgrupos de no obesos, los resistentes a insulina tenían valores más altos de circunferencia de la cintura, presión sistólica y diastólica, la grasa corporal total, la grasa del tronco, los triglicéridos en suero y menor adiponectina y colesterol HDL en comparación con los sensibles a insulina.
El objetivo del estudio era predecir la progresión de estos fenotipos a prediabetes y diabetes tipo 2. Para ello se realizó un seguimiento durante 5,5 años. Durante este periodo, 100 de los 320 desarrollaron el estado de prediabetes y 10 participantes adicionales fueron diagnosticados con diabetes tipo 2. En el grupo de obesos, 37 de 76 sujetos resistentes a insulina desarrollaron prediabetes o DM tipo 2 durante el seguimiento (en comparación con 30 de 96 sujetos sensibles a insulina). En el grupo no obeso, 8 de 17 sujetos resistentes a insulina lo desarrollaron (en comparación con 34 de 131 sujetos sensibles a insulina). La incidencia acumulada de prediabetes y diabetes mellitus tipo 2 fue de 48,7% en el grupo de obesos resistentes a insulina y 31,3% en el grupo de obesos sensibles a insulina. Entre el grupo de obesos, los participantes cuya sensibilidad a la insulina, medida con la técnica del clamp euglucémico, estaba por encima del percentil 25 tenían un riesgo de 37% menor de progresión a prediabetes/DM tipo 2.
En el estudio se observó que una gran cantidad de marcadores de riesgo cardiometabólico se alinearon de manera congruente con el estado de sensibilidad a la insulina, con alta fidelidad en los sujetos obesos y no obesos.
El fenotipo sensible a la insulina se ha asociado con menor riesgo de enfermedad cardiovascular, aunque los datos de mortalidad son discordantes. En el grupo de no obesos, los sujetos resistentes a la insulina presentaron un aumento relativo del 80% en incidencia de prediabetes y DM tipo 2 en comparación con los individuos sensibles.
En conclusión, la sensibilidad a la insulina predice una disminución del 40% del riesgo relativo de prediabetes y DM tipo 2 entre las personas obesas, mientras que la resistencia a la insulina predice el 80% del riesgo entre las personas no obesas.
Factores predictores de diabetes tipo 2
El objetivo de un estudio de cohortes realizado por Gallo et al (12) fue identificar los microARNs séricos (miARN) en humanos sanos que se asocian con la aparición futura de diabetes mellitus y enfermedad cardiovascular. Se plantea la hipótesis de que los miARN circulantes podrían reflejar una condición subclínica común de enfermedad cardiometabólica o incluso ser parte de una señalización de órgano a órgano que contribuye al desarrollo de la enfermedad cardiometabólica.
Los miARN son ARN endógeno de 17-23 nucleótidos, no codificantes, que participan en la regulación postranscripcional del ARNm por interacción directa, generalmente en la región no traducida del ARNm. Se ha descubierto que los miARN circulan por la sangre, ya sea contenida en vesículas o asociadas con complejos de proteínas. Recientemente se ha demostrado que median la regulación entre diferentes tipos de células. Se ha constatado que algunos miARNs se expresan claramente en tejidos relevantes de diabetes y enfermedad cardiovascular, lo cual predice su potencial como biomarcadores en sangre de dichas enfermedades.
Se han realizado numerosos estudios para identificar los miARN circulantes que están alterados en la diabetes manifiesta y en enfermedades del corazón. Sin embargo, ningún estudio ha investigado grandes paneles de miARN en muestras no agrupadas en relación con la diabetes incipiente y la enfermedad cardiovascular.
El objetivo de esta cohorte es determinar si los niveles séricos de miARN específicos se expresan de manera diferencial al inicio del estudio en sujetos sanos que posteriormente desarrollaron diabetes y/o enfermedad cardiovascular.
Se seleccionaron cuatro sujetos libres de diabetes y enfermedad cardiovascular, cuatro sujetos que desarrollaron diabetes y cuatro sujetos que desarrollaron enfermedad cardiovascular durante el seguimiento y se perfilaron muestras de suero individuales de estos 12 sujetos para un panel de 753 miARNs humanos. Se detectaron 47 miARNs de forma consistente en las doce muestras piloto. Estos 47 miARNs fueron medidos en otros 553 sujetos. Estos consistían en 259 sujetos de control, 140 casos incidentes de diabetes y 169 casos incidentes de enfermedad cardiovascular.
En el análisis de correlación en los 553 sujetos, hubo una relación positiva significativa entre el nivel basal de miR-483-5p transformado logarítmicamente y el índice de masa corporal, circunferencia de la cintura, concentraciones de insulina y triglicéridos en ayunas. Así mismo, se mostró una correlación negativa significativa entre miR-483-5p transformado logarítmicamente y el colesterol HDL.
Posteriormente, se ajustaron los factores de riesgo de diabetes establecidos (edad, sexo, índice de masa corporal, HDL, concentraciones de insulina y triglicéridos en ayunas) y los factores de riesgo cardiometabólicos (edad, sexo, presión arterial sistólica, tratamiento antihipertensivo, fumador actual, LDL, HDL, diabetes mellitus, índice de masa corporal, insulina en ayunas y concentraciones de triglicéridos). Tras este ajuste la asociación entre miR-483-5p y la diabetes incipiente se atenuó, mientras que la asociación entre miR-483-5p y el incidente cardiovascular se mantuvo significativa.
Curiosamente, la concentración de miR-483-5p se correlacionó de forma transversal con los factores de riesgo metabólico al inicio del estudio, y cuando se ajustaron esos factores, la asociación de miR-483-5p y diabetes se atenuó, mientras que la asociación con la enfermedad cardiovascular se mantuvo sin cambios. Esto sugiere que la asociación entre miR-483-5p y la diabetes podría estar mediada por la obesidad, la resistencia a la insulina y la dislipemia, mientras que su asociación con la enfermedad cardiovascular puede explicarse por otras vías.
MiR-483-5p es un miARN que se coexpresa con su gen huésped IGF-2 (factor de crecimiento similar a la insulina 2) y se dirige a SOCS3 (supresor de señalización de citoquinas-3). Se ha sugerido que IGF-2 y SOCS3 desempeñan un papel en el desarrollo de la obesidad y en la regulación de la resistencia, esto permite especular que los niveles más altos de miR-483-5p pueden interactuar con IGF-2 y/o SOCS3 y, por tanto, contribuir a la obesidad, la resistencia a la insulina y el riesgo de desarrollar diabetes.
En conclusión, este estudio mostró que miR-483-5p se asocia con la obesidad y resistencia a la insulina y además se correlaciona independientemente con la diabetes mellitus de nueva aparición y la enfermedad cardiovascular. La expresión de miR-483-5p en suero es un biomarcador fiable no invasivo por su asociación con enfermedades cardiovascular y diabetes y podría usarse en estudios clínicos.
Discusión
La diabetes mellitus tipo 2 es una de las enfermedades más prevalentes del mundo, su patogenia se basa en la resistencia a la insulina. La obesidad es uno de los principales factores de riesgo de esta patología. Las complicaciones asociadas a esta enfermedad son múltiples. Fundamentalmente se basa en enfermedades cardiovasculares, afectación visual, insuficiencia renal, enfermedad micro y macrovascular.
Tal y como indica el estudio STENO2 2, la intervención sobre la presión arterial, perfil lipídico y la microalbuminuria consigue disminuir estas complicaciones más que un tratamiento convencional. A estas intervenciones farmacológicas hay que sumar las intervenciones en el estilo de vida como la dieta, el ejercicio o el cese del consumo de tabaco.
Además, el estudio UKPDS 3 demostró que el control estricto de la glucemia parecía tener efectos beneficiosos sobre las complicaciones relacionadas específicamente con la diabetes, estableciendo la metformina como fármaco de primera elección.
La obesidad es una enfermedad compleja y también muy prevalente en el mundo desarrollado. Se considera que la causa principal de diabetes tipo 2 impulsada por la obesidad es la resistencia a la insulina en el hígado, el tejido adiposo blanco y el músculo esquelético.
En el presente trabajo, se ha podido comprobar como el tejido adiposo es una glándula endocrina, capaz de actuar ante los estímulos. Entre las funciones más relevantes de este tejido se encuentra la participación en el balance energético, así como su papel como tejido metabólico, inflamatorio y endocrino. En cuanto a su función inflamatoria, estudios recientes sugieren que uno de los mecanismos que impulsan el desarrollo de la resistencia a la insulina y diabetes tipo 2 es la inflamación inducida por la obesidad.
El estudio realizado por Karima Dareni et al (4) sugiere que la deficiencia de GPS2 en los adipocitos es la encargada de desencadenar la hipertrofia de estos. Esta deficiencia predispone al tejido adiposo a una mala adaptación durante el excedente de energía. Esto ocurre mediante la activación incontrolada del factor de transcripción HIF1A. En este estudio se demostró que los ratones con falta de GPS2 mostraron rasgos pro-diabéticos como la resistencia a la insulina del tejido adiposo blanco, la deposición de grasa ectópica y la intolerancia a la glucosa sistémica. Así, se ha comprobado que la ablación del factor de transcripción HIF1A tanto farmacológica como genética podría revertir parcialmente el fenotipo pro-diabético.
La inflamación inducida por la obesidad puede ser tanto de tipo innato como adaptativo. Además, existen células inmunes que juegan un papel en ambos brazos del sistema inmune, como las células NK. En un estudio de Beatriz Dal Santo y Jongsoon Lee (6) se estudió el papel de estas células inmunes en relación con la fisiopatología de la obesidad y la diabetes tipo 2. Demostraron que la obesidad produce una activación de los macrófagos del tejido adiposo y una producción de quimiocinas que reclutan las células NK de la circulación. Esto aumenta el número de células NK en la grasa epididimaria. Se produce en ese momento una activación cruzada de los macrófagos y las células NK que induce la inflamación del tejido adiposo y finalmente, resistencia a la insulina en este tejido.
En un artículo realizado por F. Villarroya et al (7), se demostró la influencia de los dos tipos de tejido adiposo existentes en relación con la diabetes. Se observó que el tejido adiposo blanco está relacionado con el almacenamiento de energía, mientras que el marrón se encarga del gasto energético. Los adipocitos marrones protegen contra la obesidad y los trastornos metabólicos asociados, tales como la hiperglucemia y la hiperlipidemia. En comparación con la grasa blanca, los depósitos de tejido adiposo marrón son menos susceptibles al desarrollo local de la inflamación en respuesta a la obesidad, sin embargo, varios insultos obesogénicos inducen en última instancia un ambiente proinflamatorio en la grasa marrón. Esto altera su actividad termogénica al inferir sobre su mecanismo de gasto de energía y la absorción de la glucosa como sustrato de combustible.
En varias revisiones, como la llevada a cabo por Manuel F. Landecho, Carlota Tuero et al 8 y la realizada por Barbara B. Kahn (5) se estudiaron las diferentes adipocinas en la obesidad que se asocian al riesgo cardiovascular. El tejido adiposo, como ya hemos ido diciendo a lo largo de esta revisión, se considera uno de los mayores órganos endocrinos en el cuerpo, así como un tejido activo que participa en las reacciones celulares y la homeostasis metabólica, en lugar de ser un tejido inerte encargado únicamente al almacenamiento de energía. En el estado de obesidad, la acumulación excesiva de grasa visceral causa disfuncionalidad del tejido adiposo, que contribuye en gran medida a la aparición de comorbilidades relacionadas con la obesidad. Los mecanismos que subyacen a esta disfunción incluyen: hipertrofia e hiperplasia de adipocitos, aumento de la inflamación, alteración de la matriz de remodelación, fibrosis y secreción alterada de adipocinas.
Una de las hormonas más relevantes relacionada con el gasto energético y la función neuroendocrina es la leptina. Esta hormona aumenta sus niveles en estados obesogénicos, está relacionada con el grado de adiposidad y la resistencia a la insulina. Sus funciones son múltiples, entre las que destacan el control de la presión arterial (8), la regulación de la oxidación de ácidos grasos en el músculo, ingesta de alimentos y peso corporal (5).
Otras de las hormonas que fueron relevantes en ambos estudios y que participan en el metabolismo de la insulina es el suero de unión a la proteína 4 del retinol, que se eleva en el suero de personas con resistencia a la insulina y algún componente del síndrome metabólico. Por otra parte, omentin-1 juega un papel importante como antiinflamatorio, antioxidante y sensibilizador a la insulina. En la obesidad se reducen sus niveles y se relacionan inversamente con los marcadores del síndrome metabólico. La resistina se relaciona directamente con la resistencia a la insulina inducida por inflamación, por lo que sus altos niveles en obesidad se correlacionan con el riesgo de muerte cardiovascular (5). La adiponectina se considera que es un buen predictor de la resistencia a la insulina y el síndrome metabólico. (8, 9)
En un artículo de Unamuno, Izaguirre et al (10), se estudió el aumento de la relación adiponectina/leptina en pacientes con obesidad y diabetes tipo 2 después de un bypass gástrico en Y de Roux. Se concluyó que la relación Adpn/Lep podría ser un biomarcador útil del tejido adiposo disfuncional, ya que se relaciona negativamente con los marcadores de inflamación crónica de bajo grado. Esta relación se correlaciona mejor con la resistencia a la insulina que la adiponectina o la leptina por separado.
Como ya se sabe, la obesidad juega un papel trascendente en la predisposición y progresión a diabetes tipo 2. Estudios recientes, como la cohorte realizada por Owei, Umekwe et al(11), han estudiado además el papel de la resistencia y la sensibilidad a la insulina como predictores de prediabetes y diabetes tipo 2. En su estudio midieron la sensibilidad a la insulina mediante la técnica del clamp euglucémico y el HOMA-IR para distinguir su población de estudio en sensibles o resistentes a la insulina y realizar un seguimiento durante 5,5 años. El fenotipo sensible a la insulina se asoció con un perfil cardiometabólico favorable y protector cardiovascular. En los individuos obesos sensibles a la insulina, el hecho de ser sensibles predice una disminución del 40% del riesgo relativo de prediabetes y DM tipo 2. El fenotipo resistente a la insulina en personas no obesas presentó un aumento relativo del 80% de incidencia de prediabetes y DM tipo 2 en comparación con los individuos sensibles, lo cual demuestra que este parámetro predice el 80% del riesgo.
Existen multitud de biomarcadores que predicen la progresión a diabetes tipo 2 y/o enfermedad cardiovascular. Entre los más destacados se encuentran los miARN. En una cohorte realizada por Gallo et al 12 el objetivo fue determinar si los niveles séricos de miARN específicos se expresan de manera diferencial al inicio del estudio en sujetos sanos que posteriormente desarrollaron diabetes y/o enfermedad cardiovascular. Este estudio mostró que miR-483-5p se asocia con la obesidad y resistencia a la insulina y, además, se correlaciona independientemente con la diabetes y enfermedad cardiovascular. Por tanto, se considera como un posible biomarcador fiable y no invasivo que podría usarse en próximos estudios clínicos.
En conclusión, podemos afirmar que la “diabesidad”, es decir, la presencia de diabetes tipo 2 en personas obesas, forma una combinación de dos factores de riesgo cardiovascular muy negativos para la salud y que va incrementándose año a año: cuatro millones de españoles padecen diabetes tipo 2 y la mitad de ellos presenta sobrepeso u obesidad. Por esta razón, es de prioritario actualmente conocer a fondo esta asociación, cómo se relacionan entre sí ambos procesos y cómo se puede actuar de forma preventiva para evitar su progresión y desarrollo.
Tras este exhaustivo estudio podemos destacar las siguientes conclusiones.
- La estrecha relación existente entre diabetes mellitus tipo 2 y obesidad ha propiciado la aparición del término “diabesidad”, pues esa convergencia constituye actualmente la epidemia del siglo XXI.
- Una intervención multifactorial dirigida a los factores de riesgo cardiovascular reduce el riesgo de complicaciones macro y microvasculares de la diabetes tipo 2.
- La inflamación inducida por la obesidad es el mecanismo principal que impulsa el desarrollo de la resistencia a la insulina y la diabetes tipo 2.
- El tejido adiposo se comporta como un órgano endocrino capaz de producir hormonas según los estímulos que recibe.
- Tanto el sistema inmune innato como el adaptativo participan en la inflamación del tejido adiposo.
- El tejido adiposo disfuncional observado en la obesidad se caracteriza por una falta de GPS2, lo cual predispone a un fenotipo pro-diabetógeno.
- Las principales hormonas producidas por el tejido adiposo son la leptina y adiponectina, las cuales tienen acción antagónica.
- Tras cirugía bariátrica, la relación adiponectina/leptina se invierte.
- La sensibilidad o la resistencia a la insulina predice la disminución o aumento, respectivamente, del riesgo de prediabetes y diabetes mellitus tipo 2.
- El miR-483-5p podría ser un factor predictor de diabetes tipo 2.