My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Farmacia Hospitalaria
On-line version ISSN 2171-8695Print version ISSN 1130-6343
Farm Hosp. vol.43 n.2 Toledo Mar./Apr. 2019
https://dx.doi.org/10.7399/fh.11133
REVISIONES
Neuropatía óptica asociada a linezolid: revisión sistemática de casos
1Pharmacy Unit, Hospital Quironsalud Barcelona, Barcelona. Spain.
Introducción
Linezolid es un antibiótico sintético perteneciente a la familia de las oxazolidinonas, con actividad frente a bacterias grampositivas y micobacterias. Su espectro antibacteriano incluye Staphylococcus aureus resistente a meticilina (SARM), Staphylococcus epidermidis resistente a meticilina y Enterococcus resistente a vancomicina1. Está aprobado en neumonía nosocomial, neumonía adquirida en la comunidad e infección de piel y partes blandas y ha demostrado ser eficaz en el tratamiento de infecciones osteoarticulares y de material protésico2. Por otro lado, según la clasificación de la Organización Mundial de la Salud, pertenece al grupo 5 de agentes antituberculosos empleados como segunda línea en tuberculosis multirresistente, causada por Mycobacterium tuberculosis multirresistente (MDR-TB) y Mycobacterium tuberculosis extremadamente resistente (XDR-TB)3.
Linezolid es un antibiótico con buen perfil de seguridad, aunque se han descrito efectos adversos como: diarrea, vómitos, dolor de cabeza, anemia, trombocitopenia, acidosis láctica, neuropatía periférica y óptica. En la práctica clínica, se ha utilizado en infecciones complicadas con necesidad de tratamientos prolongados. Sin embargo, la seguridad en tratamientos superiores a 28 días no ha sido evaluada sistemáticamente en ensayos clínicos controlados. En general, la neuropatía óptica y periférica son efectos secundarios observados en tratamientos prolongados. La neuropatía óptica se define como un síndrome clínico caracterizado por visión borrosa, pérdida de agudeza visual (AV), daño en el haz papilomacular, presencia de escotomas centrales o cetocentrales en el campo visual y alteración de los colores4.
El linezolid actúa inhibiendo la síntesis de proteínas bacterianas mediante la unión específica de la subunidad 50S ribosomal. Este bloqueo apenas afecta a proteínas de mamíferos, pero con tratamientos prolongados puede interferir en la síntesis proteica de la mitocondria, causando disfunción de la misma5. La alteración del metabolismo oxidativo mitocondrial en el nervio óptico es la hipótesis que sostiene la etiología de la neuropatía óptica por linezolid.
Entre otras causas que pueden originar neuropatía óptica, destacan agentes quimioterápicos como etambutol, isoniazida, inhibidores de la fosfodiesterasa, agentes antifactor de necrosis tumoral, agentes tóxicos como el metanol y el mercurio, abuso de alcohol y tabaco, además de carencias nutricionales, como déficit de vitamina B12, tiamina y ácido fólico6.
Los datos de frecuencia de neuropatía óptica asociada a linezolid son limitados. Estudios de cohortes y de series de casos describieron una prevalencia relativamente baja que oscila entre 1,3% y 3,3%7-9. Sin embargo, en un metaanálisis realizado en 2012 se observó un aumento en la prevalencia de 13,2%10 y en otro más reciente de 2015, de 8%11.
El objetivo de la presente revisión fue recoger todos los casos descritos de neuropatía óptica asociada a linezolid publicados en la literatura y analizar las características demográficas, clínicas y oftalmológicas del conjunto de los pacientes.
Métodos
Se realizó una revisión sistemática cualitativa de casos de neuropatía óptica asociada a linezolid, siguiendo las directrices establecidas por PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses). Se incluyeron en el análisis pacientes procedentes de casos clínicos o series de casos de artículos originales. La búsqueda se realizó utilizando las bases de datos PubMed-Medline, Embase y ScienceDirect entre septiembre de 2002 y abril de 2018. Los términos de búsqueda fueron “linezolid” y “optic neuropathy”, realizada para “All field”. La ecuación de búsqueda para Medline fue: (linezolid(MeSH Terms)) AND optic neuropathy(MeSH Terms). Para el proceso de selección se emplearon los títulos y los resúmenes de los artículos. Se analizaron artículos en español, inglés, francés y alemán. En la Figura 1 se muestra el diagrama de flujo de selección de los casos.
Se recogieron y analizaron características demográficas y clínicas de cada paciente: edad, sexo, antecedentes, tratamiento concomitante, tipo de infección y bacteria implicada, dosis diaria de linezolid y dosis total acumulada, tiempo de exposición a linezolid hasta el comienzo de los síntomas y tiempo de exposición hasta la retirada del mismo, tratamiento de la neuropatía óptica y eficacia, presencia de otros efectos adversos atribuidos a linezolid y tiempo de seguimiento desde la retirada del antibiótico. También se recogieron y analizaron características clínicas oftalmológicas: presencia de visión borrosa, tipo de alteración ocular (bilateral o unilateral), presencia de alteración de los colores, AV, tipo de alteración en el fondo de ojo y en el campo visual.
Se realizó un análisis descriptivo mediante el programa SPSS (versión 20.0). Las variables cualitativas fueron expresadas en porcentajes y las variables cuantitativas en media (± desviación estándar).
Resultados
Según los criterios de búsqueda, se obtuvieron un total de 59 estudios. En el proceso de selección, se excluyeron 33 artículos y se incluyeron para el análisis un total de 33 casos de neuropatía óptica asociada a linezolid, procedentes de 26 artículos independientes (Figura 1).
En la Tabla 1 se muestran las características clínicas y demográficas de los 33 casos. En total, 16 de 32 (50%) pacientes fueron mujeres y dos fueron pacientes pediátricos. La media de edad fue de 44,97 ± 21,40 años (rango: 6-79). La duración del tratamiento con linezolid hasta el comienzo de los síntomas fue superior a 28 días, en 29 (90,6%) de 32 casos documentados. El tiempo medio de exposición hasta el comienzo de los síntomas y el tiempo medio de exposición hasta la retirada de linezolid fueron 8,5 ± 8,6 meses (rango: 0,33-50) y 10,1 ± 10,3 meses (rango: 0,53-56), respectivamente. El tiempo medio de seguimiento fue de 5,6 ± 5,0 meses (rango: 1-23). Se documentaron 14 pacientes a dosis de ≤ 600 mg/24 h de linezolid (incluidos los dos pacientes pediátricos), 8 a 600 mg/12 h y dos que iniciaron a 600 mg/12 h y redujeron a 600 mg/24 h. En el resto de los casos no se dispone de la dosis utilizada. La dosis media acumulada fue de 201,6 ± 222,9 g (rango: 18-1.230).
Tabla 1. Características demográficas y clínicas de los 33 casos de neuropatía óptica asociada a linezolid14,16, 18, 19, 22, 23, 24, 26, 27, 31, 32, 33, 34, 36
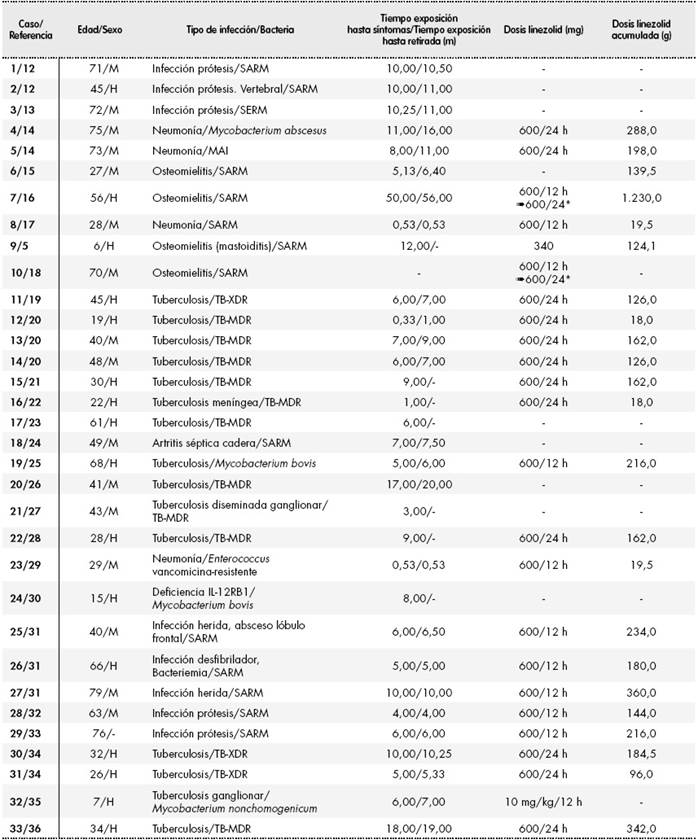
H: hombre; M: mujer; m: meses; MAI: Mycobacterium avium intracellulare; SARM: Staphylococcus aureus resistente a meticilina; SERM: Staphylococcus epidermidis resistente a meticilina; TB-MDR: Mycobacterium tuberculosis multirresistente; TB-XDR: Mycobacterium tuberculosis extremadamente resistente. *Inicio de tratamiento a 1.200 mg/24 h y reducción de dosis a 600 mg/24 h.
En 30 de los 33 (90,9%) pacientes se observó pérdida de la AV; 28 (93,3%) de 30 casos documentados presentaron alteración de la AV bilateral y dos unilateral; y 19 (82,7%) de 23 casos documentados sufrieron alteración de los colores. En cuanto a la exploración de fondo de ojo, se detectaron alteraciones del disco óptico en 23 (79,3%) de 29 casos documentados. En el examen de campo visual recogieron defectos en 22 (95,7%) de 23 pacientes documentados, registrándose: siete escotomas centrales, siete cetocentrales, dos con constricciones periféricas y uno con afección de campo generalizada.
Se retiró el linezolid en todos los casos una vez confirmado el diagnóstico, observándose mejoría clínica en 31 de los 33 (93,9%) pacientes. En un caso hubo empeoramiento de los síntomas y en otro, pérdida total e irreversible de la visión a pesar de discontinuar el linezolid. En un paciente fue reintroducido el linezolid con posterior retirada definitiva, debido a una rápida recaída de la sintomatología.
En cinco pacientes se inició tratamiento con corticoides, de los cuales tres recibieron corticoides sistémicos, uno corticoides tópicos oftálmicos y uno ambos. En dos se observó mejoría clínica con la administración de corticoides una vez retirado el linezolid, mientras que en los otros tres no se alcanzó una respuesta clínica satisfactoria, sino un empeoramiento de la neuropatía previo a la retirada de linezolid, e incluso en uno se produjo una pérdida total e irreversible de la visión, como ya se mencionó.
En 17 (48,5%) casos se observaron síntomas compatibles con neuropatía periférica, mientras que solo en cinco (14,3%) hubo confirmación mediante electrodiagnóstico. Solo en cuatro de 13 (30,8%) casos se documentó recuperación de los síntomas, en uno de ellos de forma parcial y en otro de forma lenta y progresiva.
Dos pacientes sufrieron elevación del ácido láctico y uno de ellos además cursó con encefalopatía hepática, miopatía e insuficiencia renal. En un caso se describió mielosupresión (anemia y neutropenia) secundaria a linezolid.
En cuanto al estado nutricional, un caso tuvo déficit de vitamina B12 en relación con una gastritis crónica y otro déficit leve de ácido fólico.
Por otro lado, tres casos recibieron tratamiento concomitante con etambutol, dos con capreomicina, siete con quinolonas, dos con isoniazida y uno recibió tratamiento previo con vincristina.
Discusión
El incremento en la incidencia de tuberculosis multirresistente en las últimas dos décadas ha supuesto un contratiempo para el control de la epidemia de tuberculosis a nivel mundial, obligando al empleo de antituberculostáticos de segunda línea, como linezolid. La duración del tratamiento ha propiciado el aumento de efectos adversos relacionados con exposiciones prolongadas, como la neuropatía óptica. En nuestra revisión, hemos recopilado y analizado un total de 33 casos de neuropatía óptica asociada a linezolid, cuyas principales infecciones fueron causadas por tuberculosis multirresistente, entre otras.
La neuropatía óptica secundaria a linezolid se asocia a un uso prolongado del mismo. En el metaanálisis de Zhang et al., con 23 neuropatías ópticas y 79 periféricas, la duración del tratamiento con linezolid fue superior a cinco meses11. En otro estudio de una cohorte retrospectiva con cinco casos de neuropatía óptica, el tiempo de administración de linezolid fue superior a los siete meses en todos los casos y el tiempo medio de administración fue de 10 meses37. De acuerdo con los resultados mencionados, en nuestro estudio la media de tratamiento fue de 10 meses. Por otro lado, cabe destacar la presencia de tres casos de neuropatía óptica asociados a tratamientos cortos, inferiores a 28 días17,20,29.
La dosis ≤ 600 mg/24 h en comparación con ≥ 600 mg/24 h, en el metaanálisis de Sotgiu et al., redujo la frecuencia de neuropatía óptica y otros efectos adversos, sin comprometer la eficacia en pacientes con tuberculosis multirresistente10. Posteriormente, en el metaanálisis de Zhang anteriormente comentado, la dosis ≤ 600 mg/24 h no reflejó una reducción de la neuropatía óptica en este tipo de pacientes11. En nuestro estudio, nos encontramos hasta 12 casos de adulto con dosis de inicio de 600 mg/24 h, que experimentaron neuropatía óptica a pesar de la dosis reducida, lo cual indica la necesidad de seguimiento y monitorización oftalmológica de todos los pacientes con tratamientos prolongados, independientemente de la dosis.
La neuropatía óptica relacionada con linezolid es en la mayoría de los casos un proceso reversible, con mejoría de los síntomas una vez retirado el antibiótico. En nuestra revisión, solo un caso sufrió empeoramiento a pesar de discontinuar el linezolid20, y otro caso sufrió pérdida total de la visión17. La neuropatía periférica, en cambio, suele ser un proceso irreversible, donde no se observa un beneficio clínico a pesar de la interrupción del antibiótico38. Solo cuatro casos compatibles con neuropatía periférica experimentaron mejoría en nuestro estudio21,25,28,30.
La eficacia del tratamiento con corticoides es una cuestión controvertida. Mehta et al., en su estudio, observaron una mejoría clínica tanto en los pacientes tratados con corticoides como en los no tratados37. En nuestra revisión, dos casos se beneficiaron de la administración de corticoides12,13, mientras que en otros tres se agravó el cuadro de neuropatía15,17,35. Por lo tanto, se necesitan más estudios con una población más amplia para poder obtener unas conclusiones definitivas sobre el beneficio de los corticoides.
Por último, cabe destacar la baja incidencia de mielotoxicidad (anemia y trombocitopenia) asociada a linezolid en nuestra serie, con solo un paciente documentado. Esto puede explicarse por una diferencia de mecanismo respecto a la inhibición mitocondrial en la neuropatía óptica.
Nuestra revisión está sujeta a algunas limitaciones. En primer lugar, disponemos de un tamaño de muestra pequeño, además de evaluar casos de artículos con un posible sesgo de publicación. En segundo lugar, el nivel de detalle proporcionado en cada caso no fue homogéneo y, por lo tanto, estaba sujeto a un cierto grado de interpretación de datos. A pesar de las limitaciones, creemos que esta revisión proporciona información útil.
En conclusión, la neuropatía óptica es una complicación relacionada con el uso prolongado de linezolid, independientemente de la dosis recibida y reversible en la mayoría de los casos. Con la creciente utilización de linezolid en esquemas para el tratamiento de tuberculosis multirresistente e infecciones complicadas producidas por grampositivos resistentes, la incidencia de neuropatía óptica relacionada con uso prolongado de linezolid está en aumento. Por lo tanto, es importante realizar un seguimiento multidisciplinar en pacientes con regímenes de tratamiento largo superiores a 28 días, especialmente en aquellos con alteraciones visuales. Sería conveniente efectuar una exploración oftalmológica exhaustiva (evaluar AV, campo visual, visión de los colores y realizar fondo de ojo) para diagnosticar de manera precoz la neuropatía óptica y poder retirar el linezolid de manera temprana.
Bibliography
Stalker DJ, Jungbluth GL. Clinical pharmacokinetics of linezolid, a novel oxazolidinona antibacterial. Clin Pharmacokinet. 2003;42:1129-40. [ Links ]
Rao N, Hamilton CW. Efficacy and safety of linezolid for Gram-positive orthopedic infections: a prospective case series. Diagn Microbiol Infect Dis. 2007;59:173-9. [ Links ]
Schecter GF, Scott C, True L, Raftery A, Flood J, Mase S. Linezolid in the treatment of multidrug-resistant tuberculosis. Clin Infect Dis. 2010;50:49-55. [ Links ]
Glaser JS. Nutritional and toxic optic neuropathies. In: Glaser JS, ed. Neuro-Ophthalmology. 3a ed. Philadelphia: Lippincott Williams and Wilkins; 1999. p. 181-6. [ Links ]
Javaheri M, Khurana RN, O’hearn TM, Lai MM, Sadun AA. Linezolid induced optic neuropathy: a mitocondria disorder? Br J Ophthalmol. 2007;91:111-5. [ Links ]
Grzybowski A, Zulsdorff M, Wilhelm H, Tonagel F. Toxic optic neuropathies: An updated review. Acta Ophthalmol. 2015;93(5):402-10. [ Links ]
Schecter GF, Scott C, True L, Raftery A, Flood J, Mase S. Linezolid in the Treatment of Multidrug-Resistant Tuberculosis. Clin Infect Dis. 2010;50(1):49-55. [ Links ]
Udwadia ZF, Sen T, Moharil G. Assessment of linezolid efficacy and safety in MDRand XDR-TB: an Indian perspective. Eur Respir J. 2010;35(4):936-8. [ Links ]
Hughes J, Isaakidis P, Andries A, Mansoor H, Cox V, Meintjes G, et al. Linezolid for multidrug-resistant tuberculosis in HIV-infected and uninfected patients. Eur Respir J. 2015;46(1):271-4. [ Links ]
Sotgiu G, Centis R, D’Ambrosio L, Alffenaar JWC, Anger HA, Caminero JA, et al. Efficacy, safety and tolerability of linezolid containing regimens in treating MDR-TB and XDR-TB: Systematic review and meta-analysis. Eur Respir J. 2012;40(6):1430-42. [ Links ]
Zhang X, Falagas ME, Vardakas KZ, Wang R, Qin R, Wang J, et al. Systematic review and meta-analysis of the efficacy and safety of therapy with linezolid containing regimens in the treatment of multidrug-resistant and extensively drug-resistant tuberculosis. J Thorac Dis. 2015;7(4):603-15. [ Links ]
Lee E, Burger S, Shah J, Melton C, Mullen M, Warren F, et al. Linezolid-associated toxic optic neuropathy: a report of 2 cases. Clin Infect Dis. 2003;37:1389-91. [ Links ]
Frippiat F, Bergiers C, Michel C, Dujardin JP, Derue G. Severe bilateral optic neuritis associated with prolonged linezolid therapy. J Antimicrob Chemother. 2004;53(6):1114-5. [ Links ]
Mckinley S, Foroozan R. Optic Neuropathy Associated with Linezolid Treatment. J Neuroophthalmol. 2005;25:18-21. [ Links ]
Saijo T, Hayashi K, Yamada H, Wakakura M. Linezolid-induced optic neuropathy. Am J Ophthalmol. 2005;139(6):1114-6. [ Links ]
Kulkarni K, Del Priore LV. Linezolid induced toxic optic neuropathy. Br J Ophthalmol. 2005;89(12):1664-5. [ Links ]
Azamfirei L, Copotoiu SM, Branzaniuc K, Szederjesi J, Copotoiu R, Berteanu C. Complete blindness after optic neuropathy induced by short-term linezolid treatment in a patient suffering from muscle dystrophy. Pharmacoepidemiol Drug Saf. 2007 (accessed 5/3/2018);16(4):402-4. Available at: http://dx.doi.org/10.1002/pds.1320 [ Links ]
Kiuchi K, Miyashiro M, Kitagawa C, Wada S. Linezolid-associated optic neuropathy in a patient with ocular sarcoidosis. Jpn J Ophthalmol. 2009;53(4):420-4. [ Links ]
Karuppannasamy D, Raghuram A, Sundar D. Linezolid-induced optic neuropathy. Indian J Ophthalmol. 2014;62:497-500. [ Links ]
Khadilkar SV, Yadav RS, Rajan S. Linezolid Optic Neuropathy: Be Careful and Quick. J Assoc Physicians India. 2013;61(11):866-7. [ Links ]
Chaitali P, Suresh R. Comment on linezolid induced optic neuropathy. Indian J Ophthalmol. 2015;63:75-6. [ Links ]
Agrawal R, Addison P, Saihan Z, Pefkianaki M, Pavesio C. Optic neuropathy secondary to linezolid for multidrug-resistant mycobacterial spinal tuberculosis. Ocul Immunol Inflamm. 2015;23(1):90-2. [ Links ]
Park DH, Park TK, Ohn YH, Park JS, Chang JH. Linezolid induced retinopathy. Doc Ophthalmol. 2015;131(3):237-44. [ Links ]
Ishii N, Kinouchi R, Inoue M, Yoshida A. Linezolid-induced optic neuropathy with a rare pathological change in the inner retina. Int Ophthalmol. 2016;36(6):761-6. [ Links ]
Hernandez Prats C, Llinares Tello F, Climent Grana E, Fernandez Aracil C. Peripheral and optic neuropathy associated to linezolid in multidrug resistant Mycobacterium bovis infection. Med Clin (Barc). 2005;124:797-8. [ Links ]
Han J, Lee K, Rhiu S, Lee JB, Han SH. Linezolid-associated optic neuropathy in a patient with drug-resistant tuberculosis. J Neuroophthalmol. 2013;33:316-8. [ Links ]
Eisenack J, Landau K, Wildberger H, Knecht P. Linezolid-associated optic neuropathy?. Klin Monbl Augenheilkd. 2012;229:433-4. [ Links ]
Xerri O, Lemaire B, Nasser G, Rousseau-Huvey B, Labetoulle M, Rousseau A. Neuropathie optique toxique grave liee au linezolide. J Fr Ophtalmol. 2015;38(3):55-8. [ Links ]
Joshi L, Taylor SRJ, Large O, Yacoub S, Lightman S. A Case of Optic Neuropathy after Short-Term Linezolid Use in a Patient with Acute Lymphocytic Leukemia. Clin Infect Dis (Internet). 2009 (accessed 5/3/2018);48(7):73-4. Available at: https://academic.oup.com/cid/article-lookup/doi/10.1086/597298 [ Links ]
Rosenzweig SD, Yancoski J, Bernasconi A, Krasovec S, Marciano BE, Casimir L, et al. Thirteen years of culture-positive M. bovis-BCG infection in an IL-12Rs1 deficient patient: Treatment and outcome. J Infect. 2006;52(3):10-3. [ Links ]
Rucker JC, Hamilton SR, Bardenstein D, Isada CM, Lee MS. Linezolid associated toxic optic neuropathy. Neurology. 2006;66:595-8. [ Links ]
De Vriese A, Coster R, Smet J, Seneca S, Lowering A, Van Haute LL et al. Linezolid-Induced Inhibition of Mitochondrial Protein Synthesis. Clin Infest Dis. 2006;42:1111-7. [ Links ]
Corallo C, Paull A. Linezolid-induced neuropathy. Med J Aust. 2002;177:332. [ Links ]
Srivastava A, Kshetrimayum S, Gupta SK, Kant S. Linezolid-induced optic neuropathy in XDR pulmonary TB: A case series. Indian J Tuberc (Internet). 2017 (accessed 5/3/2018);64(2):129-33. Available at: http://dx.doi.org/10.1016/j.ijtb.2016.11.010 [ Links ]
Gonzalez Saldana N, Galvis Trujillo DM, Borbolla Pertierra AM, Mondragon Pineda AI, Juarez Olguin H. Linezolid-associated optic neuropathy in a pediatric patient with Mycobacterium nonchromogenicum: A case report. Medicine (Baltimore). 2017 Dec;96(50):e9200. [ Links ]
Kreps EO, Brown L, Rennie IG. Clinical recovery in linezolid-induced optic nerve toxicity. Acta Ophthalmol. 2017;95(4):341-2. [ Links ]
Mehta S, Das M, Laxmeshwar C, Jonckheere S, Thi SS, Isaakidis P. Linezolidassociated optic neuropathy in drug-resistant tuberculosis patients in Mumbai, India. PLoS One (Internet). 2016 (accessed 5/3/2018);11(9):1-12. Available at: http://dx.doi.org/10.1371/journal.pone.0162138 [ Links ]
Bressler AM, Zimmer SM, Gilmore JL, Somani J. Peripheral neuropathy associated with prolonged use of linezolid. Lancet Infect Dis. 2004;4(8):528-31. [ Links ]
Recibido: 25 de Julio de 2018; Aprobado: 25 de Noviembre de 2018











 text in
text in 



