INTRODUCCIÓN
La epigenética es una rama de la biología que pretende explicar por qué los organismos vivos expresan unos genes y silencian otros para conformar así sus características físicas particulares y la susceptibilidad de desarrollar determinadas enfermedades 1.
Existen moléculas en el núcleo celular que tienen la capacidad de modificarse ante estímulos ambientales, nutricionales, químicos y físicos; y que además tienen la capacidad de modificar la expresión genética del genoma humano 2.
El genoma humano es cambiante, dinámico y en constante modificación gracias a la replicación y transcripción descrita en el código genético. La epigenética se refiere a los cambios heredables en el ADN e histonas que no implican alteraciones en la secuencia de nucleótidos y modifican la estructura y condensación de la cromatina, por lo que afectan la expresión génica y el fenotipo 2.
Para entender la función del genoma en relación con la patogénesis de una enfermedad, hay que saber cómo se integra el marco arquitectónico del núcleo de la célula y cómo sus componentes afectan los procesos nucleares incluyendo la expresión genética 3.
Este marco arquitectónico similar a un carreto de hilo se refiere al proceso de empaquetado de ADN, que conserva el espacio dentro del núcleo. Aproximadamente 2 m de ADN se ubican en el núcleo de la célula en unos pocos micrómetros 3.
El ADN presente en la célula forma un complejo con varias proteínas que ayudan a su empaquetado. Este complejo ADN-proteína se llama cromatina 3.
El nucleosoma es la unidad básica de la cromatina, en la que alrededor de 146 polivalentes de ADN bicatenario se envuelve alrededor del octámero de la histona, la compactación del genoma en forma de cromatina limita el acceso de los genes a los factores de transcripción 3.
Para la correcta regulación de la expresión génica deben suceder cambios, llamados remodelación de la cromatina. Esto se consigue a través de complejos tales como SWI/SNF, remodelación de nucleosoma y de enzimas de las familias de las desacetilasas; lo que trae como consecuencia la alteración del acceso a los factores de transcripción del ADN regulador 3.
MECANISMOS EPIGENÉTICOS
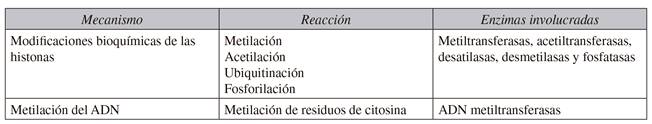
El ADN y la histona también modifican la función y regulación de la estructura de la cromatina. El epigenoma de cada célula está constituido por dos mecanismos epigenéticos implicados en la regulación de la expresión génica: 1) modificaciones bioquímicas de las histonas que incluyen: metilación, acetilación, ubiquitinación y fosforilación; 2) metilación del ADN. Estos mecanismos descritos anteriormente exhiben control sobre la diferenciación, proliferación, pre-mRNA, procesamiento, supervivencia, impresión genómica e inactivación del cromosoma X en la célula 2,3,4. Un mecanismo común de la modificación de la estructura de la cromatina es la adición covalente (o eliminación) de acetilo, metilo, fosforilo y otros restos a los dominios de la cola amino-terminal de las histonas del núcleo, por enzimas específicas 3 (Tabla I).
Los mecanismos epigenéticos involucran enzimas modificadoras de la cromatina y proteínas asociadas, a menudo denominados "escritores", tales como las histonas acetiltransferasas (HAT), histonas metiltransferasas, proteínas arginina metiltransferasas y quinasas, que catalizan la adición de grupos químicos en las colas de las histonas o ADN. Los "lectores" son factores de proteínas que analizan la información génica, como cromodomenos, bromodomenos, dominios de Tudor y dominios ADN metil-unión. Los "borradores" catalizan la eliminación de modificaciones postranscripcionales específicas de la histona, tales como las histonas desacetilasas (HDAC), lisina desmetilasas y fosfatasas 5.
Marcas postraduccionales específicas de histonas o una combinación de marcas y variantes de histonas son reconocidos por los "lectores" que dirigen una transcripción particular 5. La metilación de residuos de citosina en el ADN genómico es otra importante modificación epigenética, que desempeña un papel importante en la impronta genómica y en la inactivación del cromosoma X 6.
Los dinucleótidos CpG forman secuencias que permiten la metilación del ADN por varias ADN metiltransferasas (DNMT). En las células de mamífero, solo los dinucleótidos CpG relativamente pequeños son metilados 7.
La plasticidad celular se logra mediante la integración de cambios ambientales producidos por mecanismos epigenéticos. Para el normal funcionamiento de las células, se requiere una estricta regulación de la actividad de proteínas; la mala regulación de los escritores, lectores y borradores conduce a la transcripción de genes aberrantes y la aparición de enfermedades 7.
EPIGENÉTICA Y DOLOR
Aunque el dolor es un fenómeno protector, su persistencia produce un deterioro considerable de la calidad de vida de los pacientes. El dolor crónico afecta aproximadamente a uno de cada cinco adultos y se asocia a un mayor riesgo de depresión y otros trastornos mentales 7. La búsqueda en PubMed con el término "epigenética y dolor" dio como resultado 353 artículos, de los cuales 132 fueron revisiones. Otra búsqueda con las palabras claves "genética y dolor" resultó en 17.690 y, de estos, 3.083 artículos fueron reseñas, mostrando la escasez de investigaciones sobre el papel de la epigenética en el dolor. A pesar de que una mayor cantidad de información está relacionada con la genética del dolor, el campo de la epigenética proporcionaría una esperanza para la investigación en el área del dolor 8.
Torres y cols. demostraron en animales de experimentación que la fosforilación de la serina 10 (S10) en la histona 3 (H3) produce activación de fibras nerviosas sensitivas primarias nociceptivas, específicamente en un grupo de neuronas superficiales del cuerno dorsal espinal (SSDHN), después de la activación de neuronas sensoriales primarias nociceptivas por lesión tipo quemadura o aplicación de capsaicina 9.
Comprender los mecanismos epigenéticos de diversas enfermedades que están asociados al dolor crónico a nivel molecular es esencial para la comprensión de la aparición y progresión de la enfermedad. La expresión aberrante de las proteínas modificadoras de la cromatina pueden servir como un biomarcador directo en diversas enfermedades asociadas con el dolor y actuar como un indicador para un diagnóstico adecuado. La identificación de la causa de la desregulación genética proporciona oportunidades para el desarrollo de fármacos que se puedan utilizar para identificar la causa, y posiblemente eliminarla 10.
Se han hecho esfuerzos en el descubrimiento de genes que podrían ser responsables de la aparición del dolor. Sin embargo, en lugar de considerar los genes individuales relacionados con el dolor, sería bastante fructífero considerar un enfoque más holístico que tomara en cuenta mecanismos epigenéticos 10.
Existen muy pocos estudios disponibles hasta el momento que demuestren el papel de la metilación del ADN y los niveles de actividad y expresión de DNMTs en el dolor. Liang y cols. demostraron que las mujeres con fibromialgia presentaron diferencias significativas en los patrones de metilación del ADN, en comparación con mujeres sanas. De manera similar, en el mismo estudio se observó la hipometilación en regiones promotoras de genes clave tales como CHI3L1, CASP1, STAT3, MAP3K5, MEFV y WISP3 asociados con artritis reumatoide 11.
EPIGENÉTICA Y ANALGESIA
El fenómeno epigenético es reversible y genera opciones para activar, reactivar y/o silenciar un gen de acuerdo a la patología. Un nuevo concepto en la epigenética y la medicina son las epi-drogas, que son enzimas naturales o sintéticas modificadoras e inhibidoras de histonas y que son actualmente consideradas como posibles candidatos para el alivio del dolor. En investigaciones recientes, científicos han observado cambios en el patrón de acetilación en los promotores de algunos genes relacionados con el dolor, tales como el receptor opioide μ, Kv4.3, Nav1.8, y factor neurotrófico derivado del cerebro. En animales de experimentación, los inhibidores de las HAT como de HDAC muestran efectos antinociceptivos en el dolor neuropático. Los inhibidores de HDAC (MS - 275 y SAHA) producen antinocicepción mediante la regulación positiva en la expresión del receptor mGlu2 en el ganglio de la raíz dorsal. La inyección local de inhibidores de la tricostatina A (TSA) y SAHA en el núcleo de raphe Magnus demostró un efecto analgésico sobre el dolor inflamatorio 11.
También se sabe que TSA reduce el dolor visceral, pero los mecanismos están aún por descifrarse. El dolor espinal neuropático inducido por la ligadura nerviosa fue aliviado por el ácido anacárdico (inhibidor de HAT), el cual ejerce su acción mediante la supresión de la hiperacetilación de la histona H3 en la región promotora de los macrófagos y su receptor quimioquina C-C 11.
La curcumina, un inhibidor de HAT, cuando se administra diariamente junto con la morfina durante 4 días, reduce el desarrollo de efectos adversos de la morfina, tales como hiperalgesia térmica, tolerancia, dependencia física y alodinia mecánica 11.
El inhibidor de la metilación del ADN 5-azacitidina atenúa la constricción crónica inducida lesiones térmicas y mecánicas hipersensibilidad al dolor. La 5-azacitidina intratecal es conocida por bloquear la metilación celular de la médula espinal 11.
EL FUTURO
En los próximos años se espera que científicos desvelen el epigenoma humano; esto implicaría el conocimiento de las alteraciones dirigidas de las marcas de la cromatina genómica en locus específicos, utilizando EpiEfectores 12.
Los EpiEfectores son sustancias que comprenden segmentos de un polipéptido llamados dominios de reconocimiento de ADN, diseñados con dedo de zinc, TAL, o complejo CRISPR/Cas9 modificado (clustered regularly interspaced short palindromic repeats, repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas), es decir, modificaciones recientes de este sistema, que permiten actuar sobre la transcripción de los genes; además de los dominios catalíticos de una enzima modificadora de la cromatina son los necesarios para dirigir eficazmente los mecanismos epigenéticos 12.
Esto pone de manifiesto la importancia de las modificaciones de las histonas y la metilación del ADN en el dolor 12.
Los epifármacos muestran diferentes grados de especificidad y selectividad para las correspondientes enzimas epigenéticas 12.
Es necesario entender el papel de la epigenética antes de la administración de un epi-fármaco adecuado, ya que las Epidrogas, junto con los EpiEfectores, prometen abrir nuevas fronteras en el alivio del dolor crónico 12.