NANOMEDICINA
La aplicación de la nanotecnología a la medicina ha dado lugar al nacimiento de una nueva disciplina: la Nanomedicina, que como podemos imaginar, se trata de un campo multidisciplinar donde caben muchos protagonistas: ingenieros, físicos, químicos, biólogos, médicos e incluso legisladores1. El hecho de que las nanomedicinas sean tan populares hoy en día entre la comunidad científica se debe a una serie de factores, entre los que podemos destacar el control sobre el perfil farmacocinético, la protección de los agentes terapéuticos transportados frente a la posible degradación dentro del organismo, la posibilidad de desarrollar terapias dirigidas hacia tejidos específicos, la posibilidad de incluir diferentes agentes terapéuticos en el mismo transportador e incluso la posible inclusión de agentes de contraste para tener una imagen biomédica útil en el diagnóstico. En este sentido, dentro de los posibles sistemas de liberación de fármacos, las nanopartículas han adquirido un gran protagonismo puesto que presentan una gran versatilidad desde el punto de vista de composición, forma, tamaño, y superficie exterior2.
Esto hace que sean el centro de un gran número de investigaciones biomédicas, ya sea para el tratamiento de ciertas enfermedades, la prevención, el diagnóstico o incluso hasta en ingeniería de tejidos.
NANOPARTÍCULAS MESOPOROSAS DE SÍLICE
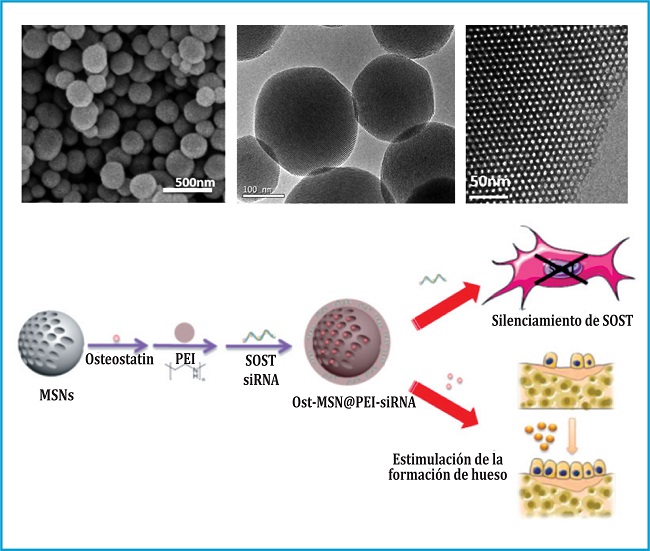
Entre todas las nanopartículas empleadas en el campo de la nanomedicina, ya sean orgánicas o inorgánicas, las nanopartículas mesoporosas de sílice (MSNs, por sus siglas en inglés), están siendo ampliamente investigadas como vectores de transporte de agentes terapéuticos en los últimos años3. La razón de su notoriedad puede encontrarse en su robustez, su elevadísima, capacidad de carga en su sistema poroso, su capacidad de protección de los fármacos frente a una posible degradación, y su facilidad para ser modificadas en su superficie exterior4. La síntesis de estas nanopartículas se basa en una combinación de 3 métodos: el proceso sol‐gel, en el que se produce la hidrólisis y condensación de los precursores de sílice que formarán la red tridimensional de SiO2; el uso de surfactantes como agentes directores de la estructura a modo de plantillas, de forma que la sílice condensa alrededor de las estructuras creadas por estos surfactantes que, tras su eliminación, van a dar lugar a una red de cavidades o estructuras mesoporosas; y el uso de unas condiciones de alta dilución, tal y como propone el método Stöber, que permite conseguir nanopartículas con forma esférica y diámetros muy definidos entre 100 y 150 nm y con unos poros de unos 2 nm disponibles para ser cargados con agentes terapéuticos. En este sentido, el concepto de introducir fármacos en el interior de los poros de los materiales mesoporosos para luego ser liberados en el organismo, fue propuesto por primera vez por la profesora María Vallet‐Regí en 2001 y que ha supuesto la inspiración de muchas investigaciones de diferentes grupos alrededor del mundo5. En este sentido, nuestro grupo de investigación ha trabajado muchísimo durante los últimos años para desarrollar MSNs capaces de acumularse en diferentes tejidos de forma específica y liberar los fármacos cargados en respuesta a diferentes estímulos6 (figura 1).
TRATAMIENTO DE SITUACIONES OSTEOPORÓTICAS
Entre todas las posibles aplicaciones, un ejemplo interesante en el que hemos trabajado durante los últimos años es la utilización de las nanopartículas mesoporosas de sílice para el posible tratamiento de la osteoporosis7,8. En un escenario osteoporótico, la vía de señalización de WNT/β‐catenina, que normalmente participa en la diferenciación de células madre mesenquimales a osteoblastos, está inhibida. Y lo está por la sobre‐expresión de la proteína esclerostina, que está codificada por el gen SOST. La consecuencia de esta inhibición es la reducción de la diferenciación osteoblástica y, como consecuencia, la reducción de la formación de hueso y pérdida de masa ósea característica de la os teoporosis. Nuestra hipótesis de trabajo se basó en la posibilidad de silenciar el gen SOST usando un small interfering RNA (siRNA), para así reducir la expresión de la esclerostina y poder reactivar el ciclo de la WNT/β‐catenina, y así reactivar la diferenciación osteoblástica y, consecuentemente, aumentar la formación de hueso tan importante en situaciones osteoporóticas. Sin embargo, los siRNAs tienen tiempos de vida media muy cortos y una capacidad de penetración en membranas celulares muy pobre, por lo que su mayor problema es la administración, y ahí es donde nuestras nanopartículas adquirieron una gran relevancia. Recubrimos nuestras MSNs con un polímero catiónico capaz de retener el siRNA en la superficie de estas para luego liberarlas, silenciar el gen SOST y provocar el aumento de la formación de hueso.
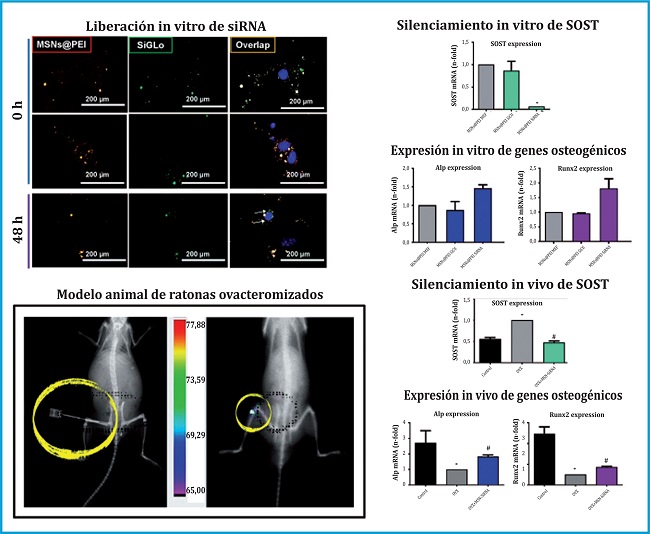
Tras optimizar el sistema en cuanto a su diseño y carga de siRNA, comprobamos que nuestras nanopartículas eran capaces de liberar el siRNA en el interior de las células y que eran capaces de reducir la expresión de SOST in vitro y aumentar la expresión de otros factores osteogénicos, como la fosfatasa alcalina (ALP) y el RUNx2 (figura 2).
También tuvimos resultados muy positivos inyectando nuestras nanopartículas en el interior de la médula ósea del fémur en un modelo animal de ratonas osteoporóticas, observando la reducción de la expresión del gen SOST y el consiguiente aumento en la expresión de ciertos genes osteogénicos.
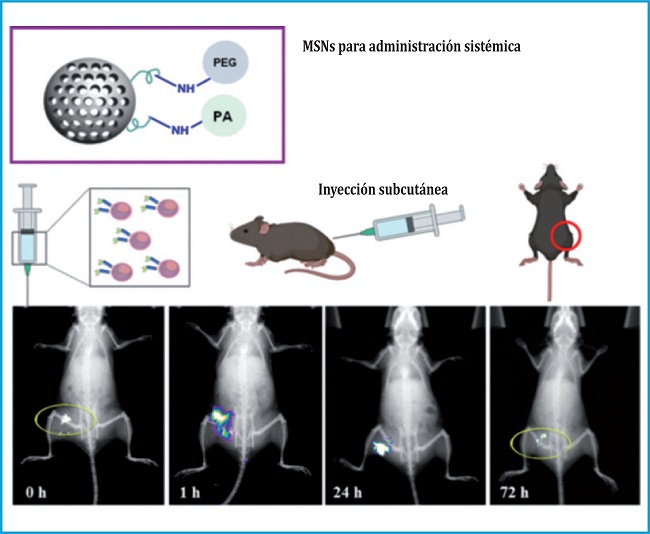
Teniendo en cuenta la dificultad que podría entrañar en una futura aplicación clínica la administración mediante una inyección en el interior de la médula ósea del fémur, nos lanzamos a rediseñar el sistema. Para ello, se desarrollaron MSNs con alta afinidad por el tejido óseo anclando en su superficie bisfosfonatos, que son moléculas con una elevada afinidad por el contenido inorgánico del hueso, para poder administrarlas mediante una inyección subcutánea, mucho más fácil, y que las propias nanopartículas se acumularan preferentemente en tejido óseo. De hecho, observamos que, tras 72 horas de inyección, las nanopartículas seguían en la zona (figura 3).
Tras diferentes tratamientos de 2 y 3 semanas con sucesivas inyecciones subcutáneas cada 72 horas, el análisis con PCR a tiempo real de las diferentes expresiones génicas en el tejido óseo de los animales osteoporóticos, reveló que fuimos capaces, no sólo de silenciar el gen SOST, sino de aumentar la expresión de diversos genes osteogénicos, como es el caso del Runx2, Alp, Osterix y Osteoprotegerina, junto con un aumento del factor de crecimiento endotelial vascular (VEGF) relacionado con un aumento de la vascularización, indicando todo esto la formación de nuevo tejido óseo (figura 4).
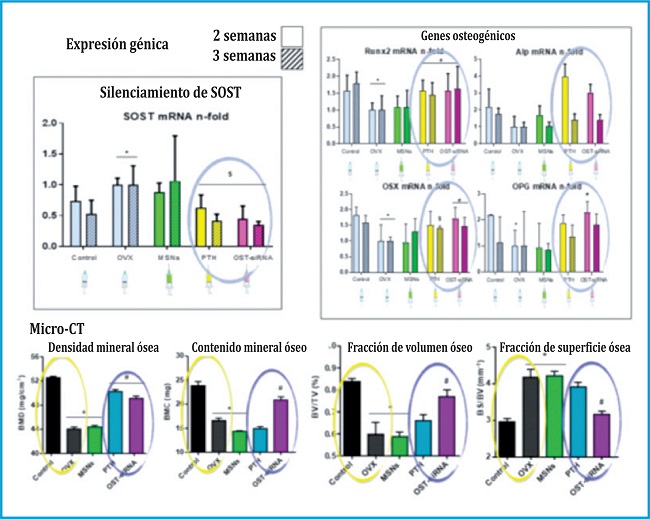
Arriba: Resultados de expresión génica in vivo tras la administración de las nanopartículas. Abajo: resultados de micro‐CT in vivo tras la administración de las nanopartículas.
Figura 4.
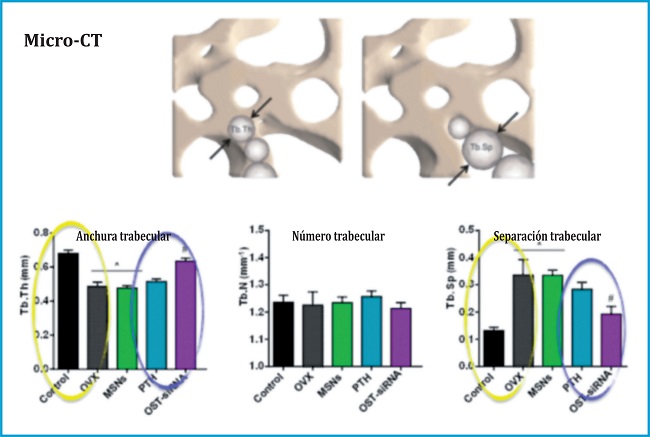
En línea con los resultados obtenidos, los análisis de micro tomografía computerizada nos revelaron importantes aumentos en la densidad mineral ósea y el contenido mineral del hueso, lo que, junto a la calidad del nuevo hueso formado, similar al hueso sano según reveló el espesor trabecular y la separación trabecular, nos ofreció resultados significativos en cuanto a la formación de hueso nuevo y de calidad en un modelo in vivo de ratonas osteoporóticas (figura 5).
De esta forma, esta brillante investigación demostró la capacidad de las nanopartículas mesoporosas de sílice para un posible tratamiento de la osteoporosis, manifestando su capacidad de cargar, transportar, proteger y liberar intracelularmente un tipo particular de ácido nucleico: un siRNA para silenciar un gen específico responsable de un mal funcionamiento del desarrollo del tejido óseo. Estos resultados abren las puertas a que este tipo de MSNs puedan llegar a utilizarse para transportar un gran número de ácidos nucleicos, incluyendo todo tipo de RNAs o DNAs, con una gran variedad de aplicaciones finales dentro de la biomedicina del futuro.











 text in
text in