Introducción
El irinotecán (CPT-11) es un agente antineoplásico empleado en el tratamiento de diversos tipos de cáncer, como el gástrico, pancreático o colorrectal. Se trata de un derivado semisintético de la camptotecina que ejerce su efecto antitumoral mediante la inhibición de la topoisomerasa I, enzima necesaria para separar la doble cadena de ADN en el proceso de replicación celular1. Concretamente, el irinotecán es un profármaco que se hidroliza a su metabolito activo, la 7-etil-10-hidroxi-camptotecina (SN-38), mediante la acción de carboxilesterasas hepáticas. Este metabolito, el SN-38, es el responsable del efecto antineoplásico (inhibición de la topoisomerasa I) y de la toxicidad. Esta última, en muchas ocasiones, aparece de forma limitante, hasta en un tercio de los pacientes, con diarreas y neutropenias potencialmente mortales1.
Para la eliminación del SN-38 es necesaria su conjugación mediante la acción de la uridinadifosfato glucuroniltransferasa (UGT1A1), dando lugar a un nuevo metabolito glucurónido inactivo, el SN-38G, excretado por vía renal o biliar. De esa forma, una disminución en esta capacidad de glucuronidación se correlaciona con una mayor toxicidad al irinotecán, tal y como han mostrado diversos estudios2,3. Se ha demostrado que la disminución en la glucuronidación del irinotecán puede ser debida a la presencia de un polimorfismo en la región promotora del gen UGT1A1 (TA indel, rs8175347), que consiste en una variación en el número de repeticiones del dinucleótido TA y que implica una actividad reducida de la enzima UGT1A1.
En población caucásica, la forma más frecuente (alelo salvaje o nativo) de esta región promotora está constituida por seis repeticiones, A(TA)6TAA, que corresponde a una actividad enzimática normal. Sin embargo, la frecuencia del alelo mutado (UGT1A1 *28), consistente en siete repeticiones (A(TA)7TAA) y que confiere una actividad enzimática disminuida, es del 30-40%4. En concreto, en la población española, la frecuencia del genotipo homocigoto mutado o síndrome de Gilbert (UGT1A1*28/*28) es del 9% aproximadamente, la del genotipo heterocigoto (UGT1A1*1/*28) del 51% y la del genotipo salvaje (UGT1A1 *1/*1) del 40%5.
Diversos trabajos en el ámbito de la farmacogenética han mostrado una correlación entre la presencia del alelo UGT1A1 *28 y la aparición de efectos adversos graves inducidos por irinotecán6-12. En base a estas evidencias, en 2005 la Food and Drug Administration (FDA) informó sobre la utilidad clínica de genotipar el gen UGT1A1 en pacientes candidatos a recibir irinotecán. Sin embargo, en las recomendaciones recogidas en la ficha técnica del fármaco no se establece la recomendación de las dosis de irinotecán para los diferentes esquemas antineoplásicos según los perfiles genéticos de los pacientes13. Además, no se hace mención a lo recogido en otros estudios donde se pone de manifiesto la posibilidad de emplear dosis superiores de irinotecán a las habitualmente empleadas (180 mg/m2) en el esquema FOLFIRI (5-fluorouracilo, ácido folínico e irinotecán) en los pacientes con genotipo UGT1A1 *1/*1 y *1/*2814-17.
El objetivo de la presente revisión sistemática es analizar los datos publicados sobre la eficacia y seguridad de las dosis superiores a los 180 mg/m2 de irinotecán recomendados en la ficha técnica en pacientes con cáncer colorrectal metastásico (CCRm) tratados con el esquema FOLFIRI en función del genotipo de UGT1A1.
Métodos
Búsqueda bibliográfica
Se realizó una revisión sistemática de la literatura sobre la eficacia y seguridad a las dosis altas de irinotecán en pacientes nativos o heterocigo tos para el alelo *28 del gen UGT1A1, mediante una búsqueda bibliográfica de artículos publicados hasta diciembre de 2021. Las bases de datos consultadas fueron Medline y Embase.
Los términos MeSH y Emtree utilizados se resumen en la tabla 1. Los métodos utilizados para este estudio se basaron en los recomendados según Preferred Reporting Items for Systematic Reviews and MetaAnalyses (PRISMA)18, aplicando tanto el listado de comprobación como el flujograma.
Criterios de inclusión
Los criterios para la inclusión de estudios se definieron previamente en base a los dos objetivos secundarios que aborda esta revisión, específicamente:
Analizar la magnitud de la diferencia de la respuesta clínica a irinotecán a dosis altas en comparación con las dosis descritas en la ficha técnica para el esquema FOLFIRI en pacientes con CCRm con el genotipo UGT1A1 *1/*1 o *1/*28.
Estudiar la magnitud de la diferencia de los efectos adversos a irinotecán con dosis altas en comparación con las dosis descritas en la ficha técnica en pacientes con CCRm con el genotipo UGT1A1 *1/*1 o *1/*28.
Los estudios se eligieron según si: a) eran estudios de cohortes observacionales o ensayos clínicos; b) los pacientes con CCRm recibieron irinotecán a dosis más altas que las recomendadas actualmente en la ficha técnica; c) los pacientes fueron genotipados para identificar la presencia del alelo UGT1A1 *28 y se incluían pacientes con el genotipo UGT1A1 *1/*1 (tipo nativo), y d.1) se reflejaba la asociación entre el genotipo UGT1A1 *1/*1, dosis altas de irinotecán y tasa de respuesta objetiva (TRO) (respuesta definida como una respuesta completa o parcial) o d.2) se reflejaba la asociación entre el genotipo UGT1A1 *1/*1, dosis altas de irinotecán y seguridad. Se excluyeron de la revisión los estudios que no se publicaron en inglés o español. Los criterios de inclusión y exclusión se detallan en la tabla 2.
Selección de los artículos
Los cuatro autores evaluaron de forma independiente los resúmenes de los artículos para determinar la elegibilidad de los mismos de acuerdo con los criterios de inclusión/exclusión enumerados en la tabla 2. Se consideraron todos los artículos originales revisados por pares publicados en inglés que evaluaban la relación de eficacia y/o toxicidad de irinotecán a dosis altas (> 180 mg/m2) según el genotipo de la UGT1A1 en pacientes adultos con CCRm. Una vez seleccionados los resúmenes, se recuperaron las versiones de texto completo de todos los artículos potencialmente elegibles y cada uno de los cuatro autores volvió a aplicar de forma independiente los criterios de inclusión/exclusión. Finalmente, también se examinó la lista de referencias de los estudios incluidos para encontrar artículos relevantes potencialmente no identificados por la búsqueda sistemática anterior. Los artículos fueron incluidos en el análisis cuando tres de los cuatro autores estuvieron de acuerdo con los criterios preestablecidos y se calculó el índice de correlación interclase para valorar el grado de concordancia en la selección de los artículos entre los autores.
Extracción de datos
Los revisores crearon, probaron y perfeccionaron un formulario de extracción de datos. Los datos extraídos incluyeron: primer autor y año de publi cación; tipo de estudio y nivel de evidencia; participantes y tipo de cáncer; régimen y posología de irinotecán; genotipo y prevalencia; variables clínicas evaluadas (TRO, supervivencia global [SG] y supervivencia libre de progresión [SLP]); resultados y discusión (Tabla 3).
Tabla 3 Características de los estudios incluidos en relación con la eficacia de irinotecán a dosis altas
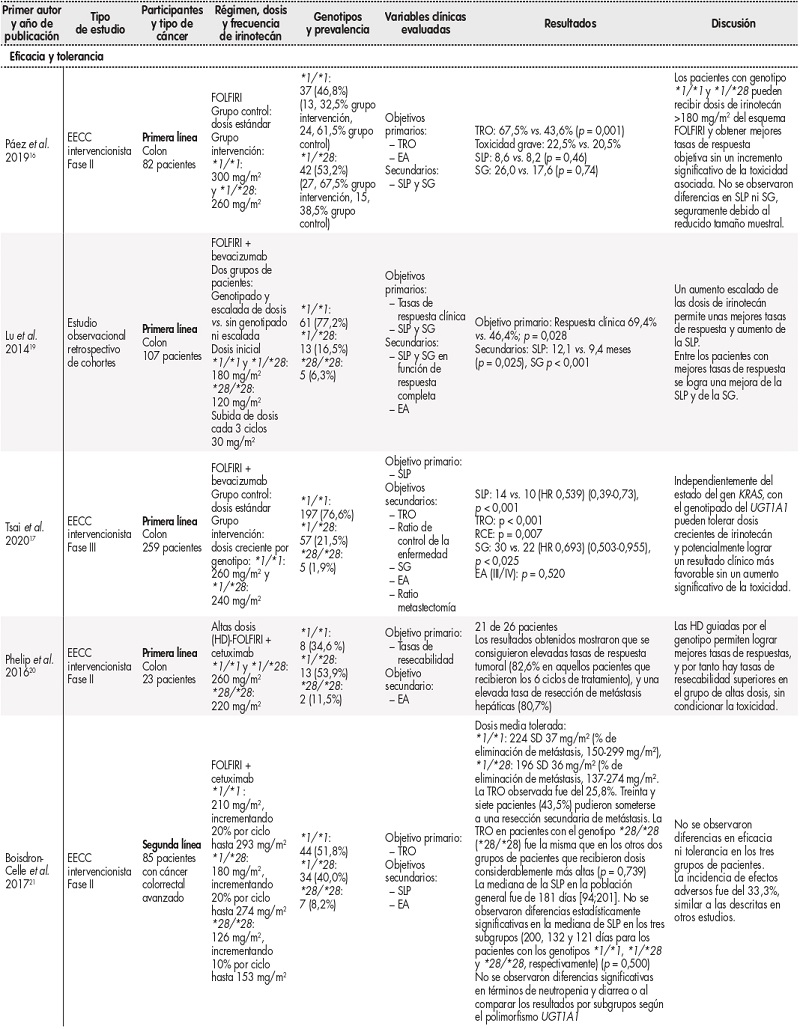
Tabla 3 (cont.) Características de los estudios incluidos en relación con la eficacia de irinotecán a dosis altas

Tabla 3 (cont.) Características de los estudios incluidos en relación con la eficacia de irinotecán a dosis altas

CCR: cáncer colorrectal; DMT: dosis máxima tolerada; EA: efectos adversos; EECC: ensayo clínico; HD: altas dosis; HR: hazard ratio; RCE: ratio de control de la enfermedad; SG: supervivencia global; SLP: supervivencia libre de progresión; TRO: tasa de respuesta objetivo.
La gravedad de los efectos adversos se estableció de acuerdo con los Criterios de toxicidad comunes del Instituto Nacional del Cáncer (ahora Criterios de terminología común para eventos adversos) (CTCAE), cuando estuvieron presentes (Tabla 4)25.
Tabla 4 Criterios de terminología común del Instituto Nacional del Cáncer para eventos adversos25

EA: evento adverso.
Nivel de evidencia
La calidad metodológica de los estudios elegibles se evaluó mediante discusión y consenso entre todos los investigadores del estudio, con un enfoque particular en el uso de criterios de evaluación objetivos y representatividad de la muestra. La calidad de los estudios observacionales incluidos se evaluó de acuerdo con la recomendación de la escala NewcastleOttawa (NOS)26,27. Se seleccionaron ocho elementos para la inclusión del estudio, incluida la selección de pacientes, la comparabilidad entre grupos y factores de exposición. Los estudios con puntuaciones NOS de 0 a 3, de 4 a 6 y de 6 a 9 se consideraron de calidad baja, media y alta, respectivamente.
La calidad metodológica de los ensayos clínicos fue analizada mediante la escala de Jadad, también conocida como puntuación de Jadad o sistema de puntuación de calidad de Oxford, procedimiento para evaluar de manera independiente la calidad metodológica de un ensayo clínico, que confiere una puntuación que clasifica el estudio como de baja calidad si ésta es inferior a 3 puntos, considerando como riguroso un ensayo clínico aleatorizado de 5 puntos28.
Resultados
Selección de los estudios
La estrategia de búsqueda reportó un total de 595 referencias, de las que 13 fueron seleccionadas para el análisis de eficacia y seguridad de dosis altas de irinotecán (> 180 mg/m2) en el esquema FOLFIRI. Concretamente, se incluyeron 11 ensayos clínicos y 2 estudios observacionales. El índice de correlación interclase fue de 0,90 (intervalo de confianza del 95% [IC 95%] 0,84-0,94) teniendo en cuenta el total de estudios incluidos y, específicamente de 1 (IC 95% 1-1) considerando los estudios que hacen referencia a efectividad y de 0,83 (IC 95% 0,71-0,92) los artículos que hacen referencia a seguridad.
En la figura 1 se representa el diagrama de flujo adaptado de PRISMA para el proceso de inclusión de estos 13 estudios, 6 de los cuales evalúan toxicidad, y 7 tanto eficacia como toxicidad, en pacientes en tratamiento con irinotecán a dosis altas para CCRm.
En la tabla 3 se exponen las características descriptivas de los trabajos revisados, incluyendo tipo de estudio, participantes, régimen, dosis y frecuencia de irinotecán, genotipos y prevalencia, variables clínicas evaluadas, resultados y discusión.
Participantes
Se incluyeron un total de 992 pacientes en tratamiento con irinotecán dentro del esquema FOLFIRI para CCRm. En todos los casos, irinotecán se administró como primera línea (12; 92,3%), excepto en un estudio en el que se administró como segunda línea (1; 7,7%).
Nivel de evidencia de los estudios
La evaluación de la calidad de los estudios observacionales se realizó utilizando la escala de NOS, destacando que todos los estudios observacionales tuvieron un alto nivel de calidad (Tabla 5). La evaluación de la calidad de los ensayos clínicos, realizada mediante la escala de Jadad, mostró que los ensayos clínicos fase III y IV incluidos en la presente revisión en relación con la eficacia y/o seguridad de irinotecán a altas dosis son de baja calidad, ya que los 11 (100%) ensayos clínicos obtuvieron una puntuación ≤ 3 y ninguno obtuvo una puntuación ≥ 5 puntos para ser considerado un ensayo clínico “riguroso” (Tabla 6).
Tabla 5 Evaluación de la calidad metodológica con la escala de NOS para estudios observacionales26,27

Tabla 6 Evaluación de la calidad metodológica con la escala de Jadad para ensayos clínicos28

NA: no aplica.
Resultados de los estudios que evalúan la eficacia y seguridad de irinotecán a dosis superiores a 180 mg/m2
En relación con los trabajos que evaluaron resultados de eficacia y seguridad del uso de irinotecán a dosis altas en pacientes no portadores del alelo UGT1A1*28, seis de los siete estudios se mostraron favorables al aumento de dosis (Tabla 3). De entre los favorables, en el estudio llevado a cabo por Páez D et al.16 los pacientes fueron aleatorizados a recibir FOLFIRI a altas dosis (FOLFIRIAD) versusFOLFIRI, recibiendo el brazo experimental 300 mg/m2 en pacientes nativos y 260 mg/m2 en pacientes con genotipo UGT1A1 *1/*28frente a 180 mg/m2 en el grupo control. La respuesta fue evaluada como TRO según criterios RECIST 1.1, SLP y SG, encontrándose tasas de respuesta objetiva superiores en aquellos pacientes que recibieron dosis más altas de irinotecán (67,5% versus43,6%; p = 0,001), sin un incremento significativo de la toxicidad asociada (toxicidad grave: 22,5% versus 20,5%), pero no demostrando superior SLP ni SG.
Por otro lado, en el trabajo realizado por Lu et al.19, se evaluó como objetivo principal la tasa de respuesta clínica (TRC), SLP y SG entre el grupo sin escalada de dosis y el grupo con escalada de dosis. En este caso, se objetivaron diferencias estadísticamente significativas en todas las variables estudiadas (Tabla 3). En dicho trabajo se clasificaron los pacientes en dos grupos: un brazo con pacientes sin escalada de dosis y otro brazo con escalada de dosis; los pacientes con genotipo UGT1A1 *1/*1 y *1/*28 recibieron inicialmente una dosis de 180 mg/m2 de irinotecán y los pacientes con genotipo homocigoto para el alelo *28 recibieron una dosis inicial de 120 mg/m2, y en los del grupo de escalada de dosis se aumentó la dosis de irinotecán 30 mg/m2 cada tres ciclos, observándose que la respuesta clínica fue superior en los pacientes en los que se realizó el aumento (69,4 versus 46,4%; p = 0,028), sin diferencias estadísticamente significativas en relación con los efectos adversos grado 3/4 en los dos grupos (p = 0,189).
Estos resultados van en línea con los encontrados por Tsai et al. 17, que evaluaron, junto con la toxicidad, la eficacia (como TRO) de diferentes dosis de irinotecán en pacientes tratados con el esquema FOLFIRI-bevacizumab en primera línea de tratamiento. Se establecieron dos grupos, uno control y otro experimental. El grupo experimental fue tratado con dosis crecientes de irinotecán según el genotipo (nativo: 260 mg/m2 y heterocigotos: 240 mg/m2) y se estableció como objetivo principal la evaluación de la SLP, y como secundarios la TRO, ratio de control de la enfermedad (RCE) y la SG. Los resultados obtenidos fueron: SLP: 14 versus 10 meses (hazard ratio[HR] 0,539 [0,390,730]; p < 0,001); TRO: p < 0,001; RCE: p = 0,007, y SG: 30 versus 22 meses (HR 0,693 [0,503-0,955]; p < 0,025). Los autores concluyeron que los pacientes con CCRm, independientemente del estatus de KRAS, mediante el genotipado de UGT1A1 pueden llegar a tolerar dosis superiores de irinotecán y lograr así un resultado clínico favorable, sin un aumento significativo de la toxicidad.
Otro de los trabajos que evaluó conjuntamente la eficacia del aumento de dosis de irinotecán según el genotipo de UGT1A1 y la seguridad fue el realizado por Phelip et al. 20; en este estudio se incluyeron pacientes no previamente tratados y que presentaban metástasis hepáticas potencialmente resecables, recibiendo tratamiento con seis ciclos de FOLFIRIAD + cetuximab. Los pacientes con genotipo Wild-type y heterocigotos (*1/*1. *1/*28) recibieron una dosis de irinotecán de 260 mg/m2, mientras que los pacientes con genotipo homocigoto mutado (*28/*28) recibieron 220 mg/m2. Como objetivo principal se estableció la evaluación de las tasas de resecabilidad obtenidas y la seguridad del esquema. Los resultados obtenidos mostraron que se consiguieron elevadas tasas de respuesta tumoral (82,6% en aquellos pacientes que recibieron los seis ciclos de tratamiento), y una elevada tasa de resección de metástasis hepáticas (80,7%), sin toxicidad intolerable.
Por otro lado, Boisdron-Celle et al. 21 llevaron a cabo una evaluación de la eficacia y seguridad del esquema FOLFIRI-cetuximab con altas dosis de irinotecán (*1/*1: 210 mg/m2, incrementando 20% en cada ciclo hasta un máximo de 293 mg/m2; *1/*28: 180 mg/m2, incrementando un 20%/ciclo hasta 274 mg/m2 y *28/*28: 126 mg/m2, incrementando un 10% cada ciclo hasta un máximo de 153 mg/m2) sin grupo control. El objetivo primario de este estudio fue la TRO, objetivándose una respuesta en el 25,8% de los pacientes y permitiendo a un 43,5% de los pacientes someterse a una resección secundaria de las metástasis. Con este escalado de dosis, los autores no observaron diferencias significativas en TRO ni SLP en los tres grupos de pacientes y, a pesar de utilizar un rango muy amplio de dosis de irinotecán, tampoco se observaron diferencias en relación con la seguridad.
En el estudio llevado a cabo por Lu et al.22, en el cual fueron incluidos pacientes con CCRm en primera línea de tratamiento recibiendo el esquema FOLFIRI-bevacizumab, se llevó a cabo la estratificación en dos grupos de pacientes: grupo 1: *1/*1, *1/*28, y grupo 2: *28/*28. En el primer grupo se inició el tratamiento con dosis de irinotecán de 180 mg/m2 para pacientes nativos y heterocigotos y se llevó a cabo una escalada de dosis cada tres ciclos (aumentando en 30 mg/m2, hasta un máximo de 260 mg/m2 para el genotipo nativo y 240 mg/m2 para el heterocigoto). En el grupo 2 se inició el tratamiento con 120 mg/m2 de irinotecán (máxima dosis tras escalada de 210 mg/m2). Como objetivo principal se estableció la TRO y la ratio de control de la enfermedad (RCE), así como la SLP, comparándose el grupo nativo-heterocigoto (grupo 1) con homocigoto mutado (grupo 2) y observándose los siguientes resultados: TRO: 76,9% versus 20,0%; p < 0,001; RCE: 93,8% versus 40,0%; p < 0,001; sin aumentar la incidencia de efectos adversos.
Hebbar et al. 23 estudiaron si una estrategia combinando quimioterapia con FOLFIRI a dosis altas en pacientes con genotipo UGT1A1 *1/*1 o *1/*28, junto con ablación por radiofrecuencia y cirugía, era capaz de aumentar el aclaramiento de metástasis hepáticas y la supervivencia en pacientes con CCRm. Los autores observaron una eliminación completa de las metástasis en un 33,3% de los pacientes sin ningún caso de toxicidad grado 4 ni muerte, así como un aumento de la SG, y concluyeron que el uso de altas dosis de FOLFIRI puede representar una alternativa en pacientes no aptos para terapias dirigidas, aunque el estudio se detuvo por un reclutamiento insuficiente.
Finalmente, y en contraposición con el resto de estudios, en el de Manfredi et al.24, en el que se utilizaron dosis altas de irinotecán (260 mg/m2) en pacientes con genotipo Wild-type y heterocigotos (*1/*1 y *1/*28), se observaron TRO del 45,0% en el grupo *1/*1 y del 56,5% en el grupo *1/*28, las cuales fueron similares a las observadas en otros estudios sin escalada de dosis. En relación con la toxicidad, debido a que los autores inicialmente definieron como criterios para discontinuar el estudio: 1) ≤ 7 pacientes con una respuesta objetiva (OR), y 2) ≥ 3 pacientes con toxicidad severa, y en los análisis provisionales observaron que 2 pacientes del grupo 1: UGT1A1*1/*1 presentaron neutropenia grado 4, 6 (4 en el *1/*1 y 2 en el grupo *1/*28) diarrea grado 3, y 2 del grupo *1/*1 neutropenia febril, el estudio se detuvo, aunque la seguridad fue aceptable al reducir la dosis.
Resultados de los estudios que evalúan la seguridad de irinotecán a dosis superiores a 180 mg/m2
Varios estudios han evaluado la dosis máxima tolerada (DMT) de irinotecán en el esquema FOLFIRI en función del genotipo de UGT1A1. Uno de los primeros estudios fue llevado a cabo en el año 2010 por Toffoli et al.11, y en él describió que los pacientes *1/*1 podían tolerar una DMT de 370 mg/m2 y los *1/*28 de 310 mg/m2. Estos resultados fueron corroborados posteriormente por Marcuello et al.10, que encontraron unas DMT de 390 mg/m2 y 340 mg/m2, respectivamente. Un estudio más reciente, de Kim et al.12, publicado en 2015, describió unas DMT de 330 mg/m2 y 300 mg/m2, respectivamente. En un estudio posterior publicado en 2017, Toffoli et al.14 determinaron la DMT de irinotecán en pacientes con CCRm tratados en primera línea con FOLFIRI-bevacizumab. La DMT fue de 310 mg/m2 y 260 mg/m2 para los pacientes con genotipos UGT1A1*1/*1 y *1/*28, respectivamente. Además, otro estudio liderado por Kim et al.15 evaluó la DMT en pacientes tratados con el esquema XELIRI (capecitabinairinotecán). En él halló una DMT de 380 mg/m2 para los pacientes nativos y heterocigotos, y de 240 mg/m2 para los homocigotos mutados. Finalmente, Kim et al.12 observaron que la DMT de irinotecán en el esquema FOLFIRI para pacientes no mutados es de 330 mg/m2, para heterocigotos de hasta 300 mg/m2 y para homocigotos de 150 mg/m2.
Discusión
La actividad antineoplásica de irinotecán, así como su toxicidad, dependen de la acción de su metabolito, el SN-38, concretamente de la concentración plasmática del mismo, y ésta no sólo depende de la dosis administrada de irinotecán, sino también de su metabolismo y velocidad de eliminación29. De ese modo, las variantes que disminuyen la transcripción del gen UGT1A1, como el alelo *28, provocan una reducción en la eliminación del SN-38 y, por tanto, un aumento de la toxicidad. Es decir, en función del genotipo del gen UGT1A1 podemos describir dos tipos de pacientes: con un aclaramiento adecuado de irinotecán (*1/*1 y *1/*28) o con un aclaramiento reducido (*28/*28). Sin embargo, esta característica no fue considerada en los ensayos clínicos que evaluaron la eficacia del esquema FOLFIRI en CCRm1. Es probable que una selección de los pacientes en función de este genotipo hubiese permitido el empleo de dosis superiores en los pacientes no mutados, con una potencial mejor respuesta clínica.
A diferencia de lo que sucede con las mutaciones en el gen DPYD, que anulan la actividad de su proteína y cuya frecuencia alélica es baja, la del *28es aproximadamente del 30%4, es decir, alrededor de un 10% de la población es portadora de la mutación en forma homocigota (pacientes con síndrome de Gilbert), siendo éste uno de los motivos por el cual en los ensayos clínicos iniciales de seguridad sobre el irinotecán (fase I) no se pudo aumentar la dosis por encima de 180 mg/m2. Sin embargo, diversos estudios postautorización han analizado la eficacia y seguridad del empleo de dosis altas de irinotecán (> 180 mg/m2) en el esquema FOLFIRI para el tratamiento del CCRm, en función del genotipo de UGT1A1 de los pacientes. Los resultados publicados indican que dosis superiores a 180 mg/m2 son toleradas por los pacientes no homocigotos mutados (*28/*28) para el gen UGT1A1, y que estos pacientes no sólo toleran dosis más altas, sino que con el empleo de éstas logran mejores resultados de eficacia, tanto en términos de TRO16,19-21 como de SLP17,19,23 e incluso, en algún caso, en SG19,23. Únicamente uno de los estudios incluidos en la presente revisión no mostró diferencias con el empleo de dosis mayores de irinotecán en pacientes no mutados en UGT1A124. No obstante, este estudio presenta algunas limitaciones, como que no hubo grupo comparador que no recibiese altas dosis de irinotecán y que el estudio no se pudo completar por cumplir uno de los dos criterios de discontinuación definidos antes de iniciar el estudio (en relación con la toxicidad), siendo, como definieron los mismos autores, unos criterios muy estrictos y no adaptados a la práctica clínica. El resto de los trabajos referenciados, a pesar de existir cierta variabilidad en su diseño, permiten establecer que, en términos generales, el aumento de dosis de irinotecán hasta un máximo de 260 mg/m2 (en pacientes nativoso heterocigotos para UGT1A1) logra mayor TRO16,19-21, control de la enfermedad17,22, resecabilidad de metástasis hepáticas20,23 o SLP17,19,23 e incluso SG19,23.
Este aumento de eficacia, además, no se ve condicionado por una mayor toxicidad. La DMT de irinotecán en el esquema FOLFIRI depende del genotipo de UGT1A1. Los pacientes *1/*1 y *1/*28 pueden tolerar dosis de hasta 310-390 mg/m210-12,14,15,24.
Por lo tanto, todo parece indicar que los pacientes no mutados de forma homocigota (es decir, el 90% de los mismos), podrían estar siendo infradosificados con el esquema FOLFIRI. Respecto a los pacientes *28/*28, varios estudios han demostrado que este subgrupo es el que presenta un mayor riesgo de toxicidad grave6,7,9,17,28. Así lo explicita también la ficha técnica de la FDA19. Además, los estudios liderados por Marcuello y Kim sugieren que estos pacientes presentan una DMT < 180 mg/m2.
Esta revisión sistemática presenta algunas limitaciones. Primero, sólo se incluyeron 11 ensayos clínicos aleatorizados y 2 estudios observacionales debido a la falta de datos publicados. Segundo, la evidencia revisada es heterogénea, ya que incluye diferentes tipos de estrategias de ajuste de dosis según genotipo, diferentes combinaciones de quimioterapia y diferentes variables de estudio. Tercero, no fue posible realizar un análisis estadístico para comparar los datos, limitado por la heterogeneidad, debida probablemente, de nuevo, a la escasa evidencia disponible. Cuarto, según la escala de Jadad et al., la mayoría de los ensayos clínicos obtuvieron una puntuación ≤ 3, lo que corrobora la falta de estudios bien diseñados para abordar este tema e insta a investigar en este campo. Finalmente, nuestros resultados deben interpretarse teniendo en cuenta el sesgo de publicación asociado a la posible retención de resultados negativos. Como consecuencia de estas limitaciones, las conclusiones deben confirmarse mediante estudios aleatorizados centrados, principalmente, en el estudio de la eficacia de dosis superiores de irinotecán a las recomendadas en ficha técnica en pacientes con CCRm tratados con el esquema FOLFIRI en función del genotipo de UGT1A.
En conclusión, la presente revisión sistemática constata la conveniencia de considerar establecer las dosis altas de irinotecán dentro del esquema FOLFIRI en función de los polimorfismos del gen UGT1A1, aumentando así las probabilidades de una correcta respuesta clínica.

















