INTRODUCCIÓN
El SM es un conjunto de factores metabólicos que incluyen hipertensión arterial (HTA), diabetes mellitus (DM), obesidad abdominal (OA) y dislipemia, entre otros (1,2). La prevalencia del SM aumenta con la edad y varía de acuerdo con factores tales como el género, la edad y la etnia, presentándose entre el 15 % y el 40 % de la población mundial (3,4). En México, la prevalencia del SM en la población es del 24 % a los 20 años, del 30 % o más en las personas mayores de 50 años y superior al 40 % en los adultos mayores de 60 años.
La existencia de un metabolismo disfuncional en el organismo conduce a un desequilibrio de las citocinas que disminuye la adiponectina y aumenta la liberación de leptina, IL-6 y TNF-α, contribuyendo de manera significativa a la presencia de estado inflamatorio, dislipemia, HTA y DM, entre otros (5). Estas condiciones se encuentran asociadas al desarrollo de obesidad, una enfermedad considerada el principal factor de riesgo para el desarrollo de padecimientos crónicos degenerativos. En México, el sobrepeso y la obesidad han ido en aumento en las últimas tres décadas, reportándose en 2016 una prevalencia del 72,5 % en los adultos de 20 o más años de edad (6). La prevalencia en mujeres y hombres es del 82,8 % y 64,5 %, respectivamente, siendo menor en las personas de 20 a 29 años (53,3 %) que en los adultos mayores de 40 años (80 %) (3).
La HTA se presenta cuando se mantiene una presión arterial (PA) sistólica/diastólica superior a 120/80 mmHg, respectivamente (7). En México, actualmente afecta aproximadamente al 25,5 % de la población adulta, con una mayor prevalencia en mujeres que en hombres (70,5 % vs. 48,6 %), y disminuyó un 7,8 % entre 2012 y 2016 (8). La HTA es una comorbilidad extremadamente frecuente en los diabéticos, afectando del 20 % al 60 % de la población con DM. La prevalencia de la hipertensión en la población diabética es 1,5- 3 veces mayor que en las personas sin diabetes (9).
La DM se caracteriza por hiperglucemia causada por defectos en la secreción de insulina por el páncreas, en la acción de la insulina sobre los tejidos o en ambas cosas (10). La prevalencia de la diabetes en México fue del 9,4 % en 2016, siendo mayor en mujeres (10,3 %) que en hombres (8,4 %) y manteniéndose dicha tendencia tanto en las localidades rurales (9,5 % en mujeres y 8,9 % en hombres) como en las urbanas (10,5 % en mujeres y 8,2 % en hombres) (8).
Los medicamentos se producen en la actualidad por medio de síntesis química y suelen presentar efectos adversos asociados a sus indicaciones terapéuticas, como acidosis láctica, sabor metálico, deficiencia de vitamina B12, etc. (11,12). Debido estos efectos secundarios no deseados, actualmente existe una demanda de nuevos compuestos a base de plantas medicinales para el tratamiento de las enfermedades relacionadas con el SM (13).
S. rebaudiana, descubierta por Bertoni en 1887, es una planta originaria del sudeste de Paraguay, conocida como “hoja dulce”. Es un arbusto perenne que alcanza una altura de entre 65 y 80 cm. Sus hojas son lanceoladas, de 5 cm de longitud por 2 cm de ancho, aproximadamente; no contienen calorías y pueden utilizarse en su estado natural debido a su gran poder edulcorante. Han sido utilizadas por la tribu indígena guaraní desde tiempos precolombinos para endulzar alimentos, consumiéndose las hojas secas y molidas o cocidas en forma de té (14).
En la mayor parte del mundo S. rebaudiana se considera una planta inocua y segura para el consumo humano; además, ha demostrado tener aplicaciones clínicas interesantes por su acción antioxidante, vasodilatadora, antidiabética y antitumoral, entre otras (14,15). S. rebaudiana, variedad criolla INIFAP C01, se ha evaluado para conocer sus características agronómicas, su contenido de compuestos fenólicos y sus glucósidos mayoritarios de esteviol; sin embargo, resulta necesario conocer los efectos biológicos in vivo de sus extractos para considerar su potencial aplicación en el área de la salud. Es por ello que el objetivo del presente estudio fue evaluar el efecto en el control de peso y el efecto antihipertensivo, antihiperglucémico y antioxidante de extractos acuosos y etanólicos de hojas y tallos de S. rebaudiana, variedad criolla INIFAP C01, producida en los municipios de Muna y Mocochá (Yucatán, México).
MATERIAL Y MÉTODOS
OBTENCIÓN DEL MATERIAL VEGETAL
Se obtuvieron muestras de S. rebaudiana, variedad criolla INIFAP C01, en los municipios de Muna (MU) y Mocochá (MO) del estado de Yucatán, México. Las características fenotípicas de esta variedad criolla seleccionada son tallos gruesos y ramificados, y hojas de forma elíptica, dispuestas de manera opuesta. Las muestras se secaron durante tres días, de tres a cuatro horas en periodos de sol-sombra. Concluido el secado se separaron los tallos y las hojas, y ambos materiales se molieron por separado en un molino Cyclotec™ Foss Fisher Scientific 1093 hasta obtener un tamaño de partícula igual o menor a malla 20. Las muestras molidas se almacenaron en bolsas de polietileno dentro de un desecador a temperatura ambiente.
PREPARACIÓN DE EXTRACTOS DE S. REBAUDIANA BERTONI
Se obtuvieron extractos acuosos y etanólicos al 10 % de hojas y tallos molidos de acuerdo con la metodología propuesta por Dutta y cols. (12). La extracción se efectuó en vasos de precipitado de 250 mL, en un baño María VWR® heating circulator modelo 1130-2S a 40 °C, con agitación continua durante 3 h. Concluido el tiempo, los extractos se centrifugaron a 2700 x g por 30 min a 10 °C en una centrífuga Hermle z300k. Se recuperaron los sobrenadantes, se repitió dos veces el procedimiento, y se filtró el producto al vacío. Al extracto etanólico se le eliminó el etanol, por medio de un rotaevaporador marca Buchi Zwitzfrland heating bath B-491, y se le sustituyó por agua; inmediatamente después se congelaron todos los extractos y se introdujeron en una liofilizadora Labconco freezone 4.5 (temperatura -40 °C y 0,045 mbar) durante tres días hasta eliminar totalmente el agua. Posteriormente se almacenaron en un desecador a temperatura ambiente hasta su uso. Se obtuvieron ocho extractos: HAMO (extracto acuoso de hojas de Mocochá), HEMO (extracto etanólico de hojas de Mocochá), HAMU (extracto acuoso de hojas de Muna), HEMU (extracto etanólico de hojas de Muna), TAMO (extracto acuoso de tallos de Mocochá), TEMO (extracto etanólico de tallos de Mocochá), TAMU (extracto acuoso de tallos de Muna) y TEMU (extracto etanólico de hojas de Muna).
INDUCCIÓN DE SM EN RATAS WISTAR
Se emplearon 40 ratas Wistar de dos meses de edad con un peso de 200 a 250 g, que se mantuvieron en una habitación aislada a una temperatura de 22 °C con ciclos de 12 h de luz/oscuridad. Se realizó un proceso de inducción de SM durante ocho semanas, utilizando un modelo de modificación nutrimental en el que se ofreció a las ratas agua con sacarosa al 20 % (p/v) ad libitum y una dieta base de pellets (Laboratory Rodent Diet 5001). Al finalizar el período de inducción, las ratas presentaban tres parámetros del SM: aumento de peso, aumento de los niveles de PA y aumento de la glucosa en sangre.
El experimento realizado fue aprobado por el Comité para el Cuidado y Uso de Animales de Laboratorio (CCUAL-FM-UAEM) y se llevó a cabo de acuerdo con la Norma Oficial Mexicana (NOM-062-ZOO-1999) “Especificaciones Técnicas para el Cuidado y Uso de Animales de Laboratorio”, así como todas las regulaciones federales e institucionales.
DISEÑO EXPERIMENTAL
Las ratas con SM se distribuyeron al azar en diez grupos de cuatro ratas: ocho grupos se utilizaron para suministrar los tratamientos (ocho extractos), un grupo como control positivo con 50 mg de captopril/kg de peso (medicamento antihipertensivo que pertenece al grupo terapéutico de los inhibidores de la enzima convertidora de angiotensina (IECA)) y un grupo como control negativo (agua purificada).
Los extractos se disolvieron en agua destilada y se suministraron oralmente 25 mg de extracto liofilizado/kg de peso corporal a cada rata, directamente al estómago mediante una cánula de acero inoxidable de 2 mm de diámetro para evitar pérdidas de las muestras. Los tratamientos positivo y negativo se suministraron de la misma forma. El experimento tuvo una duración de cuatro semanas (16).
Se utilizó un diseño bifactorial teniendo como factores los tipos de extractos (8) y el tiempo de tratamiento (4 semanas). Las variables de respuesta fueron la variación del peso, la disminución de la presión arterial y los niveles de glucosa en sangre.
EFECTO DE S. REBAUDIANA EN LA VARIACIÓN DE PESO
Durante las cuatro semanas de tratamiento con los distintos extractos liofilizados se registró semanalmente el peso corporal de cada rata utilizando una balanza digital previamente calibrada. Se tomaron los datos de peso para conocer el efecto de S. rebaudiana sobre el control de este parámetro (17).
EFECTO ANTIHIPERTENSIVO DE S. REBAUDIANA
Se midió la PA en la base de la cola de las ratas utilizando un esfigmomanómetro modelo Kent Scientific CODA Standar no invasivo para presión, marca Científica Senna (18). El registro se realizó semanalmente durante las cuatro semanas de tratamiento.
EFECTO ANTIHIPERGLUCEMIANTE DE S. REBAUDIANA
Se determinó el efecto agudo de los extractos de S. rebaudiana por medio de curvas del test de tolerancia oral a la glucosa (TTOG) los días 1 y 30 del experimento. Las ratas se sometieron a un ayuno de ocho horas y posteriormente recibieron 25 mg/kg del extracto correspondiente y 1 g/kg de almidón como fuente de glucosa; al grupo de control positivo se le administraon 0,5 mg/kg de acarbosa y 1 g/kg de almidón. Se evaluó la variación de los niveles de glucosa a los 15, 30, 45, 60 y 120 min por medio de un glucómetro digital Accu-Chek Active, marca Roche, obteniéndose la sangre por medio de la técnica de la punción de cola (19).
EFECTO ANTIOXIDANTE DE S. REBAUDIANA
A las cuatro semanas de tratamiento las ratas se sacrificaron con 50 mg/kg de pentobarbital sódico por vía intraperitoneal, extrayéndose la sangre por medio de la técnica de la punción cardiaca. Se colocaron las muestras en un tubo “vacutainer” con EDTA como anticoagulante para obtener el plasma. Las muestras se guardaron en un ultracongelador a -70 °C hasta su análisis. Al plasma obtenido se le realizaron las pruebas que se exponen a continuación.
Determinación de peroxidación lipídica
La concentración de malondialdehído (MDA) se determinó utilizando el kit de ensayo OxiSelect™ TBARS Assay Kit MDA Quantitation. Las muestras se hicieron reaccionar con ácido tiobarbitúrico (TBA) a 95 °C y se leyeron en un espectrofotómetro Thermo Scientific Evolution 220 UV-VIS a 532 nm. El contenido de MDA en los extractos se determinó por comparación con la curva estándar de MDA predeterminada.
Determinación de la actividad de superóxido-dismutasa (SOD)
Para la medición de las unidades de SOD se utilizó el kit de ensayo Calbiochem® Superperoxide Dismutase Assay Kit II. Los sueros se hicieron reaccionar con una sal de tetrazolio para la detección de los radicales superóxido generados por la xantina-oxidasa y la hipoxantina, y se leyeron utilizando un espectrofotómetro Thermo Scientific Evolution 220 UV-VIS a 450 nm. Una unidad de SOD se definió como la cantidad de enzima necesaria para exhibir el 50 % de dismutación del radical superóxido.
ANÁLISIS ESTADÍSTICO
Los resultados se procesaron mediante la estadística descriptiva utilizando medidas de tendencia central (media) y dispersión (desviación estándar). Para cada una de las pruebas in vivo (efecto en la variación del peso, antihipertensivo y antihiperglucemiante) se realizó un análisis de la varianza de dos vías y se efectuó una comparación de medias por el método de Duncan para establecer las diferencias entre los tratamientos.
RESULTADOS
EFECTO DE S. REBAUDIANA EN LA VARIACIÓN DE PESO
En la tabla I se presentan los pesos y sus variaciones en los grupos de ratas sometidas a los diferentes tratamientos. Se observó que el grupo de ratas que recibieron los extractos TAMU y HAMO presentaban una reducción de peso del 1,91 % y 1,57 %, respectivamente, desde el inicio del experimento hasta la semana cuatro. Se encontraron diferencias significativas (p < 0,05) entre los tratamientos, siendo el grupo tratado con captopril (control positivo) el que presentó el mayor porcentaje de reducción del peso (3,12 %) al final del tiempo evaluado.
Tabla I. Pesos (g) y porcentajes de variación del peso de ratas con SM tratadas con extractos liofilizados de S. rebaudiana (25 mg/kg) durante cuatro semanas
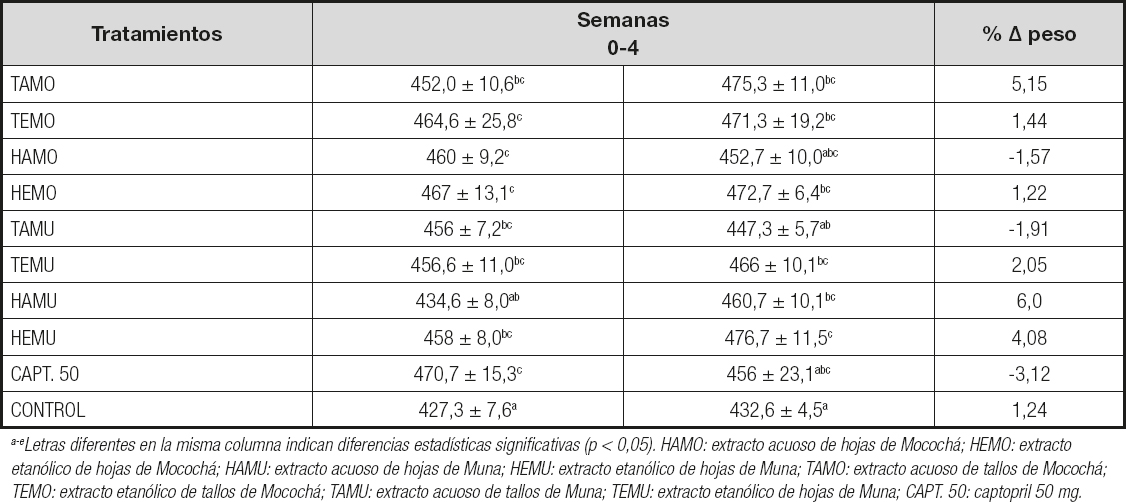
a-eLetras diferentes en la misma columna indican diferencias estadísticas significativas (p < 0,05). HAMO: extracto acuoso de hojas de Mocochá; HEMO: extracto etanólico de hojas de Mocochá; HAMU: extracto acuoso de hojas de Muna; HEMU: extracto etanólico de hojas de Muna; TAMO: extracto acuoso de tallos de Mocochá; TEMO: extracto etanólico de tallos de Mocochá; TAMU: extracto acuoso de tallos de Muna; TEMU: extracto etanólico de hojas de Muna; CAPT. 50: captopril 50 mg.
EFECTO ANTIHIPERTENSIVO DE S. REBAUDIANA
Los porcentajes normalizados del efecto antihipertensivo sobre la PAS de las ratas por consumo de extractos de S. rebaudiana se presentan en la figura 1. Se puede observar que en la primera semana de suministro de los tratamientos, TEMO, TAMU (Fig. 1B) y HEMU mostraron una reducción del 25,50 %, 22,78 % y 17,70 %, respectivamente. No obstante, al finalizar el periodo de cuatro semanas de tratamiento, los extractos HEMU y HAMU fueron los que proporcionaron los mayores efectos antihipertensivos, del 30,47 % y 29,31 %, respectivamente (Fig. 1A).

Figura 1. Porcentajes normalizados de PAS en ratas con SM tratadas con extractos de S. rebaudiana (25 mg/kg) durante cuatro semanas: A. Extracto de hojas. B. Extracto de tallos. Prueba de Duncan (p < 0,05).
Los porcentajes normalizados del efecto antihipertensivo sobre la PAD de las ratas, indicados en la figura 2, señalaron que el extracto TEMO, en la primera semana de suministro del tratamiento, fue el que proporcionó el mayor efecto antihipertensivo, con una reducción de la PAD del 23,48 %. Sin embargo, los extractos HEMU, HAMU (Fig. 2A) y TAMU (Fig. 2B) fueron los tratamientos que mostraron mayores efectos antihipertensivos al finalizar el tiempo de tratamiento, con un 36,98 %, 36,69 % y 34,56 % de reducción, respectivamente.
EFECTO ANTIHIPERGLUCEMIANTE DE S. REBAUDIANA
En la figura 3 se presentan los porcentajes normalizados del TTOG realizado el primer día de tratamiento, observándose que los extractos HAMO (Fig. 3A) y TEMU (Fig. 3B) mostraron un efecto antihiperglucemiante destacable a los 45 y 60 minutos, con una reducción del 8,2 % y 7,17 %, respectivamente. Sin embargo, el extracto HEMU fue el que mostró un mayor efecto, con una reducción total del 10,94 % a los 120 minutos.
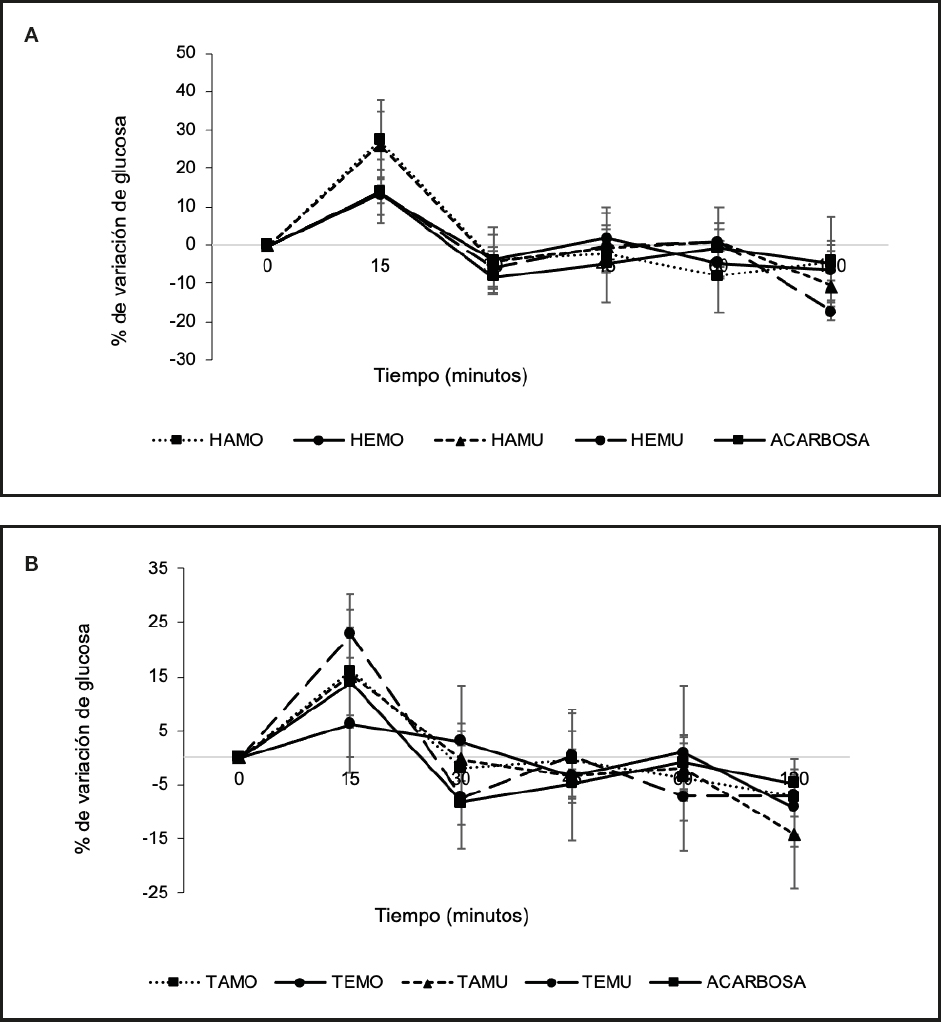
Figura 3. Test de tolerancia oral a la glucosa (TTOG) en ratas con SM. Los valores representan la media ± EEM (n = 4) del porcentaje de variación de la glucosa después de la administración de 1 g/kg de almidón, 0,5 mg/kg de acarbosa y 25 mg/kg de cada extracto liofilizado, evaluado durante 120 min. Día 1: A. Extracto de hojas; B. Extracto de tallos. Prueba de Duncan (p < 0,05).
Los resultados del TTOG realizado después de 30 días de tratamiento (Fig. 4), indicaron que del minuto 30 al 45 de la prueba, los extractos TEMU y HAMU obtuvieron una reducción de los niveles de glucosa del 10,73 % y 9,97 %, respectivamente. Sin embargo, los extractos que presentaron un mayor efecto antihiperglucemiante fueron el HEMU, con una disminución del 14,83 %, y el HAMO, con reducción del 14,40 % a los 45 y 120 minutos, respectivamente (Fig. 4A).

Figura 4. Test de tolerancia oral a la glucosa (TTOG) en ratas con SM. Los valores representan la media ± EEM (n = 4) del porcentaje de variación de la glucosa después de la administración de 1 g/kg de almidón, 0,5 mg/kg de acarbosa y 25 mg/kg de cada extracto. Día 30: A. Extracto de hojas; B. Extracto de tallos. Prueba de Duncan (p < 0,05).
EFECTO ANTIOXIDANTE DE S. REBAUDIANA
Determinación de la peroxidación lipídica
Se observó que los valores de malondialdehído (MDA) del plasma sanguíneo de las ratas del grupo de control negativo (ratas a las que se administró por vía oral agua purificada) fueron mayores, encontrándose diferencias estadísticas significativas (p < 0,05) con los distintos extractos de S. rebaudiana. Los tratamientos que mostraron un menor contenido de MDA fueron TEMO, TAMO y HEMO, con 7,0, 7,3 y 7,9 μM, respectivamente, mientras que los tratamientos con una mayor concentración de MDA fueron los extractos HAMU (17,0 μM) y HAMO (16,5 μM) (Fig. 5).
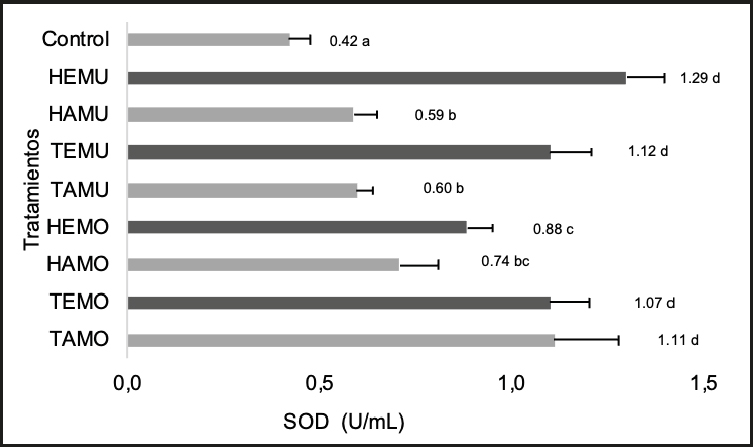
Determinación de la actividad de superóxido-dismutasa (SOD)
En la figura 6 se observa que los tratamientos con mayor contenido de la enzima SOD fueron los extractos TAMO, TEMO, TEMU y HEMU. Estos resultados indicaron una tendencia a un mayor contenido de la enzima en los extractos de los tallos obtenidos por extracción etanólica, y un menor contenido en los extractos de hojas obtenidos por extracción acuosa (HAMO, HEMO, HAMU y TAMU). El grupo de control negativo al que se suministró agua purificada fue el que presentó el menor contenido de la enzima.
DISCUSIÓN
EFECTO DE S. REBAUDIANA EN LA VARIACIÓN DEL PESO
La reducción de peso de las ratas sometidas a los tratamientos fue menor a la reportada por Dutta y cols. (12), que administraron durante 21 días extractos acuosos de S. rebaudiana a ratas diabéticas inducidas con estreptozotocina, obteniendo reducciones del peso del 5,58, 12,16 y 13,20 % con dosis de 2, 5 y 10 mg/kg, respectivamente. Sin embargo, otros estudios han reportado incrementos del peso del 18,75 % en ratones diabéticos inducidos con aloxano al suministrar un extracto metanólico de S. rebaudiana (16).
La diferencia entre los resultados encontrados en el presente estudio y los obtenidos por Dutta y cols. (12) y Singh y cols. (16) probablemente se debió a que el proceso de inducción del SM (aumento de peso, HTA y DM) fue por modificación nutricional y no por inducción farmacológica. Otro factor a considerar y que pudo afectar a la pérdida de peso de las ratas que consumieron los diferentes tratamientos fue que, durante las cuatro semanas del experimento, además del suministro de 25 mg/kg de extracto liofilizado se continuó con el consumo de agua con sacarosa (20 %) para tener un modelo y datos que se asemejaran a los de la realidad de la población, ya que es común que las personas, además de tomar sus medicamentos para controlar trastornos metabólicos, continúen con una dieta generalmente alta en calorías.
Se observa en la tabla I que, a pesar del consumo continuo de sacarosa, las ratas no mostraron un aumento marcado del peso y que incluso, con algunos de los extractos, se obtuvo una disminución del peso, lo que representaría un efecto benéfico por el consumo de S. rebaudiana para las personas con sobrepeso u obesidad.
EFECTO ANTIHIPERTENSIVO DE S. REBAUDIANA
Los metabolitos secundarios, como los flavonoides presentes en los extractos de S. rebaudiana, pudieron contribuir al efecto antihipertensivo encontrado, ya que se ha reportado que son capaces de captar y neutralizar radicales libres y que, además, son potentes antioxidantes e inhibidores de las enzimas dependientes de zinc (20).
Los extractos se obtuvieron de una variedad criolla en cuyas hojas se ha documentado un alto contenido en fitoquímicos, específicamente una elevada concentración de flavonoides (quercetina, apigenina y luteolína) y esteviósido; sin embargo, los tallos no presentaron altas concentraciones de dichos compuestos (21). A estos metabolitos secundarios se les confiere diversas aplicaciones terapéuticas, como la reducción de la HTA (21), por lo que el mayor efecto antihipertensivo que mostraron los extractos de hojas con respecto a los tallos pudo deberse a la mayor concentración de metabolitos secundarios.
Melis (22), en un estudio realizado con ratas Wistar sanas a las que administró 2 mL de extracto acuoso de S. rebaudiana (66,7 g de hojas secas/100 mL de solución) dos veces al día durante 40 días, encontró una reducción de la presión arterial media (PAM) del 18,63 %. Dicho valor fue inferior al obtenido en nuestro estudio ya que, a diferencia del trabajo realizado por dicho autor, en este trabajo se utilizaron ratas con SM inducido por modificación nutrimental, obteniéndose niveles de PA alterados.
Por otro lado, Jeppesen y cols. (23) administraron 0,025 g/kg de esteviósido puro (99,6 %) por vía oral a ratas diabéticas de tipo 2 (Goto-Kakizaki) durante seis semanas, encontrando que el esteviósido obtuvo una reducción de los niveles de PAS y PAD del 6,90 % y 7,5 %, respectivamente, muy por debajo de los niveles de reducción de la PA encontrados en este trabajo, en el cual se administraron a cada rata 25 mg/kg de peso corporal de extractos de S. rebaudiana diariamente. Debido a que S. rebaudiana contiene diversos metabolitos además de los glucósidos, la reducción de la HTA encontrada por el suministro de los extractos pudo deberse no solo a una molécula en particular sino al cúmulo de metabolitos presentes, que pudieron actuar en conjunto y con diversos mecanismos de acción para conseguir un efecto antihipertensivo más eficaz.
Existen diversos mecanismos de acción por los que una molécula puede actuar para producir efectos antihipertensivos. Melis (22) reportó que el extracto de S. rebaudiana induce la diuresis y la natriuresis con un aumento de la tasa de filtración glomerular, encontrando que estos efectos probablemente están relacionados con cambios en la actividad de las prostaglandinas. Lee y cols. (24) reportaron que el esteviósido causa vasorrelajación por medio de la inhibición del flujo de calcio dentro de la célula (calcioantagonista), y Chan y cols. (25) indicaron que el tratamiento crónico de ratas con S. rebaudiana durante 40 y 60 días aumenta de manera significativa la excreción de sodio y agua.
EFECTO ANTIHIPERGLUCEMIANTE DE S. REBAUDIANA
El contenido de flavonoides y glucósidos de esteviol presentes en los extractos de S. rebaudiana (21) pudo contribuir al efecto antihiperglucemiante obtenido, encontrándose un mayor efecto con los extractos etanólicos de hojas.
A pesar del efecto antihiperglucemiante obtenido en este trabajo, los resultados fueron menores que los reportados por otros autores. Chang y cols. (26) administraron a ratas Wistar diabéticas (inducidas con estreptozotocina) y resistentes a la insulina (RI) (inducidas con fructosa al 60 %) dosis orales de 0,5 y 5 mg de esteviósido/kg de peso durante cuatro semanas,0 encontrando una disminución de la glucosa en sangre del 22,6 % al minuto 90 en las ratas con RI alimentadas con fructosa y 5 mg de esteviósido. El mayor efecto antihiperglucemiante encontrado por los autores pudo deberse a que trabajaron con 5 mg de esteviósido puro en comparación con este estudio, en el cual se trabajó con extractos biológicos (19). Los mayores efectos se obtuvieron con los extractos HEMU y HAMO, que aportaron 2,5 y 2,0 mg de esteviósido por cada 25 mg de extracto suministrado, respectivamente.
Se ha reportado que el esteviósido tiene propiedades antihiperglucémicas, estimulando la primera fase de la secreción de insulina y suprimiendo los niveles de glucagón, e induciendo de igual manera los genes de las células β implicados en la glucólisis (23). En otro estudio realizado por Shivanna y cols. (19) con ratas Wistar sanas y alimentadas con una dieta estándar y hojas en polvo de S. rebaudiana (4 %), fibra y polifenoles extraídos de la planta (apigenina-7-O-glucósido, luteolina-7-O-rutinósido, quercetina-3-O-oxilósido y ácido cafeico) durante 30 días, encontraron que el consumo de hojas de S. rebaudiana y polifenoles disminuyó los niveles de glucosa en las ratas en un 36 % y 64 %, respectivamente.
Los resultados encontrados por Shivanna y cols. (19) fueron mayores que los reportados por Chang y cols. (26), quienes administraron esteviósido puro; esto podría deberse a la acción antidiabética de uno o más metabolitos secundarios presentes en las hojas de S. rebaudiana y a los polifenoles extraídos. La diferencia entre los trabajos anteriores y el presente estudio pudo deberse a que la diabetes de las ratas no fue inducida con un fármaco que ocasiona valores elevados de glucosa en sangre sino mediante modificaciones nutricionales e inducción paulatina de la resistencia a la insulina y la DM2, apegándose más a la realidad de esta enfermedad, una problemática clínica que afecta al 95 % de la población.
EFECTO ANTIOXIDANTE DE S. REBAUDIANA
Determinación de la peroxidación lipídica
Los resultados obtenidos en este estudio con los distintos tratamientos fueron mayores a los reportados por Singh y cols. (16), que administraron extracto metanólico de hojas de S. rebaudiana a ratones con diabetes inducida con aloxano, encontrando concentraciones de MDA en los tejidos hepáticos, pancreáticos y renales de 0,1, 0,2 y 0,15 μM, respectivamente; también a los reportados por AbdElwahab y cols. (27), quienes administraron extractos etanólicos de S. rebaudiana a ratas albinas durante seis semanas, obteniendo concentraciones de MDA en el tejido hepático de 0,19, 0,19 y 0,23 μM en los grupos control, el grupo sano con S. rebaudiana y el grupo diabético con S. rebaudiana, respectivamente.
La diferencia entre estos resultados pudo deberse a que en ambos trabajos se administraron dosis orales de S. rebaudiana (200 y 300 mg/kg) mayores que las empleadas en este estudio, en el cual se administraron 25 mg de extracto/kg de peso. Lo anterior puede indicar que a una mayor dosis de administración de S. rebaudiana de manera crónica se produce un mayor efecto protector contra la oxidación lipídica. Otro factor importante que podría estar ocasionando un mayor contenido de MDA en los distintos grupos de ratas utilizadas en el presente estudio fue que, durante las cuatro semanas de administración de los tratamientos de S. rebaudiana, los animales continuaron ingiriendo agua azucarada ad libitum, lo que ocasionó aumento y desequilibrio de la glucosa sanguínea, originando una mayor cantidad de ROS.
Determinación de la actividad de superóxido dismutasa (SOD)
Shivanna y cols. (19) alimentaron ratas Wistar sanas durante 30 días con una dieta de control estándar suplementada con algún producto de S. rebaudiana. Dichos suplementos fueron: hojas en polvo (4 %), fibra y polifenoles (apigenina-7-O-glucósido, luteolina-7-O-rutinósido, quercetina-3-O-oxilósido y ácido cafeico) extraídos previamente de S. rebaudiana, encontrándose contenidos de SOD en el hígado de 2,69, 1,21 y 2,72 U/mL, respectivamente, similar a lo reportado en el presente estudio para HEMU.
Karthik y cols. (28) encontraron concentraciones de SOD de 2,31 U/mg en el suero sanguíneo de grupos de ratas albinas tratadas con extracto acuoso de hojas de S. rebaudiana (100 mg/kg) durante 10 días. Estos resultados indicaron que cuanto mayor es la dosis de S. rebaudiana, antes se puede alcanzar un mayor contenido de esta enzima. Se observó en estudios publicados de Shivanna y cols. (19) y Karthik y cols. (28) que los grupos de control mostraban concentraciones de SOD similares a las de los grupos experimentales; sin embargo, en el presente trabajo, los grupos experimentales mostraron mayor contenido de SOD que el grupo de control. Es bien sabido que, al existir una mayor cantidad de enzima antioxidante en el organismo, existe una mayor protección contra la oxidación y el envejecimiento prematuro, lográndose que las ratas de este estudio, a pesar de continuar su ingestión de agua con sacarosa al 20 % ad libitum durante las cuatro semanas de tratamiento, presentaran un mayor contenido de la enzima en comparación con las ratas del grupo de control.
El mayor contenido de esta enzima en los extractos etanólicos pudo deberse a que el etanol extrajo mayor contenido de metabolitos secundarios que el agua, ya que los flavonoides, como las flavonas y los flavonoles, se extraen mejor con disolventes de menor polaridad. La presencia de estos metabolitos es importante por sus propiedades medicinales, ya que al ser excelentes captadores de radicales libres pueden coadyuvar a lograr el equilibrio metabólico en el organismo y evitar la disminución de la enzima antioxidante natural. Diversos estudios les han atribuido la mejoría de enfermedades tales como úlceras, diabetes, inflamación, cáncer, etc. (29,30).
CONCLUSIÓN
Los extractos etanólicos de hojas de S. rebaudiana mostraron un efecto antihipertensivo y antihiperglucemiante, lo que puede respaldar su uso tradicional para el control de enfermedades crónicas no trasmisibles. Las ratas alimentadas con los distintos extractos mostraron un nivel bajo de MDA y un aumento del contenido de SOD en comparación con las ratas que solo tomaron agua purificada, mostrando defensa y protección frente al daño oxidativo. A pesar de los resultados obtenidos, es importante realizar estudios complementarios para determinar el mecanismo de acción de los efectos de las hojas de S. rebaudiana Bertoni, los constituyentes y las dosis efectivas, con el fin de dilucidar el efecto reductor de la PA y los niveles de glucosa, así como los posibles efectos secundarios. S. rebaudiana podría ayudar a disminuir las cifras de presión arterial y la incidencia de la diabetes, así como a reducir el daño oxidativo, representando una alternativa natural ante el presente conjunto de medicamentos químicos necesarios para combatir el síndrome metabólico.