Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 no.2 Madrid feb. 2005
| TRABAJOS ORIGINALES |
Mortalidad por cáncer colorrectal en Andalucía: aportaciones al cribado poblacional
M. Ruiz-Ramos, A. Escolar Pujolar1 y T. Hermosín Bono2
Registro de Mortalidad de Andalucía. Sevilla. 1Servicio de Medicina Preventiva y Salud Pública. Hospital Universitario Puerta del Mar.
Cádiz. 2Centro de Salud de Camas. Sevilla
RESUMEN
Objetivo: describir la mortalidad por cáncer colorrectal (CCR) en Andalucía desde 1975 a 2001 para ayudar a la toma de decisiones sobre el cribado poblacional.
Diseño: estudio descriptivo de base poblacional. Con los datos de mortalidad por CCR y la población de residentes en Andalucía durante el periodo estudiado, se han calculado los principales indicadores de mortalidad por grupos de edad y sexos y se han estimado las tendencias.
Resultados: se ha producido un aumento de 1,99% anual de la mortalidad en los hombres y un 0,15% en las mujeres en el periodo de estudio. En los hombres debido principalmente al incremento de la mortalidad en los mayores de 65 años y en las mujeres en el grupo de edad de 35 a 64 años fue el que más creció, en los grupos de edad jóvenes se ha producido un descenso de la mortalidad en ambos sexos. Las tendencias de la mortalidad por cáncer de colon fueron positivas en hombres y mujeres y la de recto negativas para las mujeres y ligeramente positiva para los hombres.
Conclusiones: el incremento de la mortalidad por CCR en Andalucía podría plantear mediadas de cribado poblacional que, como ha ocurrido en otros países, cambien el signo de la evolución de la mortalidad.
Palabras clave: Cáncer colorrectal. Mortalidad. Grupos de edad. Cribado poblacional.
INTRODUCCIÓN
El cáncer es uno de los principales problemas de salud pública en los países occidentales. Conocer su magnitud y tendencias en la población debe ser una de las bases de cualquier estrategia de prevención y control.
Los cánceres de colón y recto (CCR) constituyen la segunda causa de muerte por cáncer en las regiones más desarrolladas del mundo. Anualmente se diagnostican unos 940.000 nuevos casos y mueren alrededor de 490.000 personas por esta causa (1). En España el cáncer colorrectal, segundo tumor maligno más frecuente, contabiliza el 11,5% de las defunciones por cáncer en hombres y el 14,9% en mujeres según los datos de 2001, estimándose el número de casos nuevos por año en torno a los 21.000 en ambos sexos frente a unas 12.000 defunciones (2). La mortalidad e incidencia en España son menores que las de los países del norte de Europa, y por debajo de las tasas promedio europeas, pero con una mortalidad en hombres ya superior a la de Francia, Italia y Reino Unido (3).
En países como Estados Unidos (4) e Inglaterra, con tasas altas de incidencia y mortalidad, esta última comenzó a descender hace años, un 50% desde 1950 hasta finales de los años noventa. Igual situación presentan la mayoría de los países de la Unión Europea, excepto Grecia, Portugal y España donde la mortalidad en ambos sexos sigue aumentando (5), en España con un incremento medio en hombres del 2,6% anual sin modificaciones desde 1975 y mucho menor en mujeres, del 0,8%, aunque recientemente se ha observado una tendencia a la estabilización (2).
La existencia de unas marcadas diferencias geográficas en la incidencia y mortalidad del CCR lleva a pensar que además de factores genéticos, no modificables, los factores ambientales juegan un papel fundamental en la patogenía de este proceso. La relación que existe entre cierto tipo de dieta (6,7) rica en carnes rojas, colesterol y grasas animales está siendo cada vez mejor establecida como factor de riesgo y, aunque discutidas, existen evidencias respecto al consumo de tabaco y alcohol (8), específicamente respecto al consumo de cerveza (9), como posibles factores de riesgo. La fibra en el cáncer de colon (10), los agentes antioxidantes, el calcio, el ejercicio, y probablemente los AINE (11,12), poseen un efecto protector frente al desarrollo de adenomas y carcinomas colorrectales.
En cualquier caso, los programas de promoción de la salud encaminados a cambiar hábitos higiénico-dietéticos en la población dan resultados a largo plazo y deben complementarse con actuaciones sanitarias de impacto más inmediato. En este sentido, el tratamiento de los casos con manifestaciones clínicas tiene importantes limitaciones, a pesar de los avances experimentados en las técnicas quirúrgicas y en las terapias adyuvantes. Como es conocido, la extensión de la enfermedad en el momento del diagnóstico es el principal factor pronóstico de su evolución. Por todo ello, parece razonable pensar que actualmente la clave en la reducción de la mortalidad por CCR se encuentra en el diagnóstico precoz de la enfermedad.
El objetivo de este trabajo es describir la mortalidad por cáncer colorrectal (CCR) en Andalucía desde 1975 al 2001, y así contribuir a orientar las decisiones preventivas que se puedan tomar, y específicamente las relacionadas con la posible puesta en marcha de programas poblacionales de detección precoz en nuestro medio.
MATERIAL Y MÉTODOS
Los datos de mortalidad utilizados proceden de los Boletines Estadísticos de Defunción (BED) publicados por el Instituto Nacional de Estadística (INE) para los años de 1975 a 1991 (13), y por el Instituto de Estadística de Andalucía (IEA) (14) para el periodo de 1992 a 2001. Se han incluido los códigos del 152 al 154 de la Clasificación Internacional de Enfermedades (CIE) 8ª revisión y los códigos del 152 al 154 más el 159.0 de la CIE 9ª revisión. La agrupación se ha realizado al observar que con el paso de la 8ª a la 9ª revisión en el año 1980, la parte de tracto intestinal no especificada incluida en colon en la 8ª revisión con el código 153.9, pasa a otros sitios mal definidos dentro de órganos digestivos y peritoneo en la 9ª revisión con el código 159.0, de tal manera que las defunciones incluidas en la rúbrica colon en la CIE 8 han pasado, en su gran mayoría a cánceres inespecíficos con el cambio de clasificación. La décima revisión de la CIE se ha utilizado para el periodo de 1999 a 2001, que clasifica el cáncer de colon y recto con los códigos del C18 al C21. De los datos contenidos en los BED, además de la causa básica de defunción, se han utilizado el del municipio de residencia, año de defunción, sexo y edad en años cumplidos.
Las poblaciones necesarias para el cálculo de indicadores corresponden a las proyecciones realizadas por el INE, agrupadas en grupos quinquenales, excepto para los menores de 1 año, de 1 a 4 años y los mayores de 85 años y más.
Los indicadores calculados han sido: la tasa bruta de mortalidad por 100.000 personas-año; las tasas ajustadas por edad por 100.000 personas-año mediante el método directo de ajuste, utilizando como población de referencia la Población Estándar Europea; las tasas truncadas de 35 a 64 años ajustadas por edad. Este último tipo de tasas ajustadas por edad sólo tienen en cuenta los grupos de edad de 35 a 64 años, eliminando la falta de precisión en los diagnósticos de cáncer sobre todo en las personas mayores, además la probabilidad de morir a las edades de menos de 35 años es muy baja y puede distorsionar los resultados.
También se han calculado las tasas acumuladas (15) de 0 a 74 años, como una aproximación al riesgo de morir por cáncer de colon y recto antes de los 74 años en ausencia de otros riesgos de muerte por otras causas. Puede considerarse una tasa ajustada por el método directo en la que la proporción de individuos sería igual en todos los grupos de edad, es fácil de calcular y al igual que las tasas ajustadas por edad permite realizar comparaciones entre poblaciones con estructuras de edad diferentes.
Por último se han obtenido las tasas ajustadas por edad, mediante el método directo, de años potenciales de vida perdidos (APVP) (16) entre 1 y 70 años, como un indicador de mortalidad prematura. Cada uno de estos indicadores se ha realizado para cada uno de los años de la serie y para hombres y mujeres por separado.
El porcentaje anual de cambio (PAC) se ha estimado con las tasas ajustadas por edad del primer quinquenio (1975-1979) y el último (1997-2001). Para ello, se han calculado los logaritmos neperianos de las tasas, se ha restado al valor del último quinquenio el del primero, la diferencia se ha dividido por los 27 años del periodo estudiado y se ha multiplicado por cien. Las estimaciones se han realizado para los menores de 35 años de edad, de 35 a 64 años, para los mayores de 64 años y para todas las edades en el CCR, y para el cáncer de colon y de recto por separado.
RESULTADOS
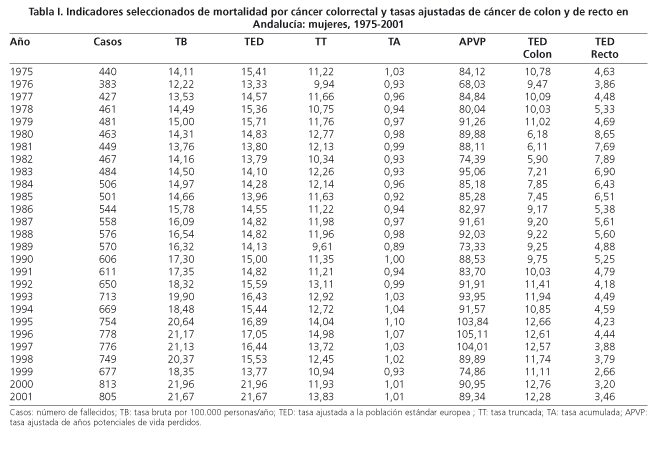
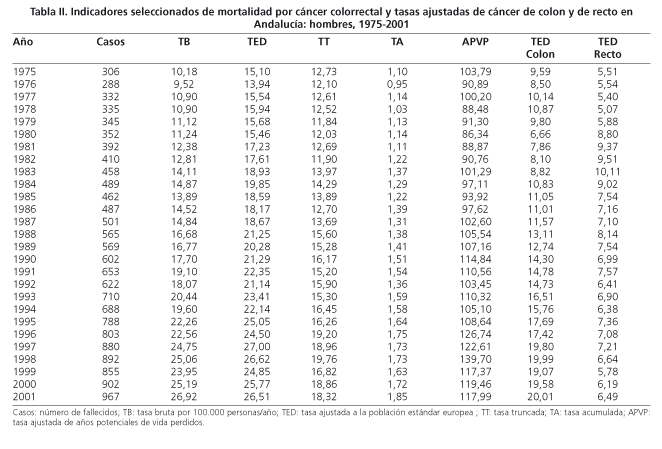
La mortalidad por CCR en Andalucía durante el periodo estudiado ha experimentado un importante aumento en números absolutos (Tablas I y II), pasando de 306 defunciones en1975 a 967 en 2001 en los hombres y de 440 a 805 muertes respectivamente en las mujeres. Las tasas brutas de mortalidad también han sufrido un destacado aumento, pasando en los hombres de 10,18 a 26,92 por 100.000 personas-año y en las mujeres de 14,11 a 21,67 entre 1975 y 2001. Las tasas ajustadas por edad presentaban un comportamiento muy distinto para los hombres y las mujeres. En los hombres se han elevado de un 15,10 a un 26,51 por 100.000 personas-año desde 1975 a 2001, y en las mujeres han pasado de 15,41 a 21,67 por 100.000 personas-año durante el mismo intervalo de tiempo.
Los indicadores de mortalidad prematura han aumentado menos, especialmente en las mujeres. En los hombres los APVP han pasado de una tasa de 103,79 en 1975 a 117,9 por 100.000 personas-año en 2001, y las tasas truncadas entre 35 y 64 años de edad, de una tasa de 12,73 a 18,32 por 100.000 personas-año. En las mujeres la tasa de APVP pasó de 84,12 a 89,34 por 100.000 personas-año en el mismo periodo y la tasa truncada de 11,22 a 13,83 por 100.000 personas-año. La tasa acumulada en los hombres ha aumentado de un 1,10 a un 1,85% entre 1975 y 2001 y en las mujeres ha fluctuado entre los valores máximos de 0,89% en 1989 y 1,04% en 1994.
En la figura 1 se representan las tasas ajustadas por edad. Para el CCR, los hombres han tenido un claro ascenso especialmente llamativo a partir de 1986 y en las mujeres la curva de evolución temporal ha sido mucho más suave. La razón entre hombres y mujeres estaba alrededor de la unidad en el primer quinquenio estudiado, aumentando hasta llegar a ser un 71% superior en los hombres en el año 1998. También se puede observar que la mayor parte de la mortalidad fue debida al cáncer de colon, que llegó a ser el responsable de hasta el 80% de las defunciones en las mujeres y un poco menos en los hombres.
En la figura 2 se representa la curva de mortalidad por cáncer colorrectal por grupos de edad para hombres y mujeres en los quinquenios de 1975 a 1979 y de 1997 a 2001. Tanto para hombres como para mujeres las tasas se incrementan exponencialmente con la edad, llamando la atención el gran aumento de la mortalidad en los hombres de todas las edades en el periodo de 1997 a 2001.
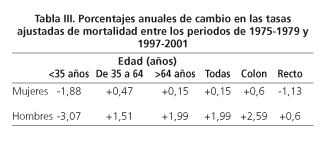
En la tabla III se presenta el porcentaje promedio anual de cambio de las tasas de mortalidad específicas por edad. Para el cáncer colorrectal, en los menores de 35 años, se ha producido una disminución de la mortalidad superior al tres por ciento anual en los hombres y de 1,88% en las mujeres. En el grupo de edad de 35 a 64 se produjo un importante aumento, especialmente en los hombres y menos acusado en las mujeres. Pero sobre todo el gran incremento de la mortalidad se ha producido en los hombres mayores de 65, en las mujeres sin embargo, el incremento anual de la mortalidad en este grupo de edad estaba por debajo del de 35 a 64 años. El cáncer de colon se incrementó tanto en los hombres como en las mujeres, y el de recto descendió en las mujeres y aumentó ligeramente en los hombres.
DISCUSIÓN
Durante el periodo estudiado la tendencia de la mortalidad por cáncer colorrectal ha aumentado en los hombres y en menor medida en las mujeres. Los principales factores que pueden estar implicados en esta evolución son los avances diagnósticos y los cambios en la exposición a los factores de riesgo de esta enfermedad. Esta tendencia es similar a la que presentan otros países del sur de Europa como Grecia y Portugal (5,17) y puede estar causada por cambios en los hábitos dietéticos de la población, como el aumento en el consumo de grasas de origen animal ocurrido en estos países en los últimos veinte años.
La dificultad de garantizar la correcta clasificación de la causa de muerte según sea producida por cáncer de colon o de recto, debido a que en muchos casos se sitúa en la región rectosigmoidea, ha determinado el análisis conjunto de ambas localizaciones. Si bien las características epidemiológicas son similares, presentan particularidades que aconsejan estudiarlos por separado (18). Además, como se observa en los resultados de este trabajo, la tendencia de la mortalidad es diferente en cada uno de ellos.
Numerosos estudios demuestran que la gran mayoría de los CCR derivan de pólipos adenomatosos y que el riesgo se incrementa a medida que aumenta el número de adenomas en un individuo, presentando su forma más extrema en el caso de las poliposis familiares (19). Estos pólipos adenomatosos son muy frecuentes en los países desarrollados, y en especial a partir de los 50 años, siendo su localización superponible a la del CCR (20). El potencial degenerativo de los adenomas aumenta en función del tamaño (> 2 cm), el tipo de histológico (vellosos) y el grado de displasia (severa). El conjunto de transformaciones genéticas y citológicas que suceden en un pólipo adenomatoso que se maligniza se ha dado en llamar secuencia adenoma-carcinoma. Esta secuencia ha sido confirmada reiteradamente por estudios epidemiológicos, histopatológicos, y más recientemente, genéticos.
En cualquier caso, se sabe que el desarrollo de un CCR sobre pólipos adenomatosos tarda unos 2-3 años en alcanzar 1 cm, y al menos 4 años en el intervalo entre pólipo y cáncer (21). Así pues, si se logra la detección y extirpación de la lesión en fase adenomatosa, es posible interrumpir el desarrollo del CCR, tal como ha quedado demostrado en varios estudios (22).
Por estas características clínicas y epidemiológicas, una de las claves en la reducción de la mortalidad por CCR se encuentra en el diagnóstico precoz de la enfermedad. Aunque se mantienen controversias respecto a los programas de detección precoz (23), se han propuesto fundamentalmente dos técnicas para el cribado de este cáncer: la presencia de sangre oculta en heces (PSOH) y la sigmoidoscopia. La primera es relativamente sencilla de realizar y de coste reducido pero tiene una sensibilidad baja, la rehidratación de las muestras puede incrementar la sensibilidad a cambio de reducir la especificidad (24,25). En el caso de la sigmoidoscopia, la sensibilidad es elevada y permite detectar entre el 50 y el 60% de todos los cánceres, sin embargo tiene una mala aceptación por parte de la población sana. La accesibilidad y la disponibilidad de los recursos necesarios, hacen además que el uso efectivo de estas pruebas a nivel poblacional sea bajo entre los adultos, que por su edad (en general a partir de los 50 años) son candidatos (25).
En un futuro no muy lejano, posiblemente los marcadores genéticos supongan una mejora en las técnicas de cribado para el CCR (26). Mientras, tanto la US Preventive Task Force (USPTF) (27) y la Canadian Task Force (28) coinciden en sus informes de recomendaciones que la PSOH y la sigmoidoscopia son eficaces en la reducción de las tasas de mortalidad, por lo que pueden ser utilizadas como pruebas de detección precoz. El revisado Código Europeo Contra el Cáncer sin embargo, establece una recomendación solo referida a la PSOH, a realizar cada 2 años a partir de los 50 años (29).
Antes de recomendar la aplicación sistemática de la PSOH y/o la sigmoidoscopia, y tal como señala el Plan Integral de Oncología de Andalucía (30) es necesario realizar estudios pilotos en aquellas zonas que presentan altas tasas de morbi-mortalidad por cáncer colorrectal, a fin de valorar la aceptación y participación de la población así como la relación coste-efectividad del cribado. La realización de estos estudios no puede demorarse, dadas la magnitud y la tendencia en la mortalidad por este cáncer en nuestro medio.
BIBLIOGRAFÍA
1. Stewart BW, Kleihues P, eds. World Cancer Report. IARCPress. Lyon 2003. [ Links ]
2. López-Abente G, Pollán M, Aragonés N, Pérez-Gomez B. Informe sobre la salud de los españoles. Cáncer. Información disponible a diciembre de 2003. Área de epidemiología ambiental y cáncer. Centro Nacional de Epidemiología. Instituto de Salud Carlos III. Madrid [consulted: 10 June 2004]. Available on: http://193.146.50.130/cancer/salud-cancer-2003.pdf]. [ Links ]
3. Ferlay J, Bray F, Sankila R, Parkin DM. EUCAN: Cancer Incidence, Mortality and Prevalence in the European Union 1998, version 5.0. IARC CancerBase No. 4. Lyon, IARCPress, 1999. [ Links ]
4. Weir HK, Thun MJ, Hankey BF, Ries LA, Howe HL, Wingo PA, et al. Annual report to the nation on the status of cancer, 1975-2000, featuring the uses of surveillance data for cancer prevention and control. J Natl Cancer Inst 2003; 95: 1276-99. [ Links ]
5. Boyle P, d'Onofrio A, Maissonneuve P, et al. Measuring progress against cancer in Europe: has the 15% decline targeted for 2000 come about? Annals Oncology 2003; 14: 1312-25. [ Links ]
6. Berrino F, Krogh V, Riboli E. Epidemiology studies on diet and cancer. Tumori 2003; 89: 581-5. [ Links ]
7. Benito E, Cabeza E. Diet and risk: an overview on Spanish studies. Eur J Cancer Prev 1993; 2: 215-9. [ Links ]
8. Sharpe CR, Siemiatycki J, Rachet B. Effects of alcohol consumption on the risk of colorectal cancer among men, by anatomical subsite (Canada). Cancer Causes Control 2002; 3: 483-91. [ Links ]
9. Ji BT, Dai Q, Gao YT, Hsing AW, McLaughlin JK, Fraumeni JF Jr, et al. Cigarette and alcohol consumption and the risk of colorectal cancer in Shanghai, China. Eur J Cancer Prev 2002; 11: 237-44. [ Links ]
10. Bingham SA, Day NE, Luben R, Ferrari P, et al. Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet 2003; 361: 1496-501. [ Links ]
11. Herbert C. Diet and non-steroidal anti-inflammatory drugs: Role in prevention of colorectal cancer. Gastroenterol Clin Bio 1998; 22 (Supl. 3): S202-17. [ Links ]
12. García-Rodríguez LA, Huerta-Álvarez C. Reduced risk of colorectal cancer among long-term users of aspirin and non-aspirin non-steroidal anti-inflammatory drugs. Epidemiology 2001; 12: 88-93. [ Links ]
13. INE. Movimiento Natural de la Población Española. Defunciones según la causa de muerte. Vol III. Años 1975-1991. Madrid: Instituto Nacional de Estadística. [ Links ]
14. IEA. Movimiento Natural de la Población. Defunciones en Andalucía 1992-1997. Sevilla: Instituto de Estadística de Andalucía. [ Links ]
15. Breslow NE, Day NE. Statistical Methods in Cancer Research. Volume II- The design and analysis of cohort studies. IARC Scientific publications Nº 82. International Agency for Research on Cancer. Lyon 1987. [ Links ]
16. Romeder JM, Mcwinnie JR. Potential years of life lost between ages 1 and 70: an indicator of premature mortality for health planning. Int J Epidemiol 1976; 6: 143-51. [ Links ]
17. La Vecchia C, Lucchini F, Negri E, Boyle P, Maisonneuve P, Levi F. Trends of cancer mortality in Europe, 1955-1989: I, Digestive sites. Eur J Cancer 1992; 28: 132-235. [ Links ]
18. Percy C, Stanek E 3rd, Gloeckler L. Accuracy of cancer death certificates and its effect on cancer mortality statistics. Am J Public Health 1981; 71: 242-50. [ Links ]
19. Muto T, Bussey HTR, Morson BC. The evolution of cancer of the colon and rectum. Cancer 1975; 36: 2251-8. [ Links ]
20. O'Brien NJ, Winawer SJ, and The National Polyp Study. Patient and polyps characteristics associated with high-grade dysplasia in colorectal adenomas. Gastroenterology 1990; 98: 371-80. [ Links ]
21. Fearon ER, Vogelstein B. A genetic model for colorectal tumorogenesis. Cell 1990; 61: 759-67. [ Links ]
22. Winawer SJ, Zauber AG, Ho MN, et al. Prevention of colorectal cancer by colonoscopic polypectomy. N Engl J Med 1993; 329: 1977-81. [ Links ]
23. Boyle P. Faecal occult blood testing (FOBT) as screening for colorectal cancer: the current controversy. Annals Oncology 2002; 13: 16-8. [ Links ]
24. Mandel JS, Bond JH, Timothy R. Reducing mortality from colorectal cancer by screening for faecal occult blood. N Engl J Med 1993; 328: 1365-71. [ Links ]
25. Tárraga López PJ, Marín Nieto E, Celada Rodríguez A, García Molinero MJ, García Olmo D, Solera Albero J. Economic evaluation of colorectal cancer screening with fecal occult blood detection. Rev Esp Enferm Dig 2000; 92: 334-48. [ Links ]
26. Vernon SW. Participation in colorectal cancer screening: a review. J Natl Cancer Inst 1997; 89: 1406-22. [ Links ]
27. Dong SM, Traverso G, Johnson C, Geng L, Favis R, Boynton K, et al. Detecting colorectal cancer in stool with the use of multiple genetic targets. J Natl Cancer Inst 2001; 93: 858-65. [ Links ]
28. Pignone M, Rich M, Teutsch SM, Berg AO, Lohr KN. Screening for colorectal cancer in adults at average risk: a summary of the evidence for the U.S. preventive services task force. Ann Intern Med 2002; 137: 132-41. [ Links ]
29. Recommendation statement from the Canadian Task Force on Preventive Health Care: colorectal cancer screening. CMAJ 2001; 165: 206-8. [ Links ]
30. European Code Against Cancer and scientific justification: third version (2003) [consulted 22/06/2004]. Available on: http://www.cancercode.org/ add_scree01.htm. [ Links ]
31. Consejería de Salud. Plan Integral de Oncología 2002-2006. Junta de Andalucía. [consulted 22/06/2004]. Avalailable on: http://www. csalud.junta-andalucia.es/principal/documentos.asp?pagina=Plan_ Integral_Oncologia. [ Links ]











 texto en
texto en