Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.41 no.1 Toledo ene./feb. 2017
https://dx.doi.org/10.7399/fh.2017.41.1.10142
Originales
Coste-eficacia del pemetrexed en combinación con cisplatino como tratamiento de primera línea en pacientes con cáncer de pulmón avanzado no microcítico ni escamoso en España
1 Pharmacy Unit, Complejo Hospitalario Universitario de Canarias. Spain.
2 Evaluation Department, Canarian Health Service. Spain
3 Oncology Unit, Complejo Hospitalario Universitario de Canarias. Spain.
Introducción:
El cáncer de pulmón es la tercera neoplasia tumo-ral más frecuente en España, con unos 27.000 nuevos casos/ año, de los que el 80-85% son de etiología no microcítica (NS-CLC) y en la mayoría de los casos diagnosticados en estadíos avanzados de la enfermedad, razón por la que es uno de los procesos oncológicos con mayores tasas de mortalidad (super-vivencia media a los 5 años del 21,4%). Los principales esquemas de primera línea utilizados en el tratamiento del NSCLC son: cisplatino/pemetrexed (cis/pem), cisplatino/gemcitabina/ bevacizumab (cis/gem/bev), y carboplatino/paclitaxel/bevacizu-mab (carbo/pac/Bev). El objetivo del presente trabajo consistirá en realizar un análisis para estimar el ratio coste-eficacia de los esquemas antineoplásicos de primera línea en el tratamiento del NSCLC, desde la perspectiva de la gerencia hospitalaria.
Métodos:
Se elaboró un modelo matemático de coste-eficacia basado en un árbol de decisiones. Como variable de eficacia se utilizó la supervivencia libre de progresión, obtenida de los en-sayos clínicos fase III PARAMOUNT, AVAIL y SAIL. El estudio se efectuó desde la perspectiva de la gerencia hospitalaria consi-derando únicamente los costes directos de adquisición de los fármacos. Se realizó un análisis de sensibilidad determinístico para comprobar la robustez de los resultados.
Resultados:
La SLP obtenida en los ensayos clínicos de los tra-tamientos cis/pem, cis/gem/bev y carb/pac/bev fue de: 6,9, 6,7 y 6,2 meses, respectivamente. En base a nuestro modelo, el coste medio del tratamiento por paciente para estos esque-mas fue de 19.942 €, 15.594 € y 36.095 €, respectivamente. La razón coste-eficacia incremenal por mes de SLP adicional entre cis/pem y cis/gem/bev fue de 19.303 €. Estimando una reducción del 30% de los costes de adquisición de pemetrexed (Alimta®Eli Lilly Nederland B.V) ante su próxima incorporación al mercado de medicamentos genéricos, el tratamiento cis/pem se convertiría en la alternativa dominante en el tratamiento de primera línea de los pacientes con NSCLC, al ofrecer los mejo-res resultados en salud a un menor coste.
PALABRAS CLAVE: Cáncer de pulmón no microcítico; Coste-eficacia; Pemetrexed; Bevacizumab
Aportación a la literatura científica
En este trabajo se ha evaluado la eficiencia de usar cisplatino/pemetrexed, cisplatino/gemcitabina/bevacizumab o carboplatino/paclitaxel/bevacizumab como terapia de primera línea en pacientes con cáncer de pulmón no microcitico no escamoso desde la perspectiva de la gerencia hospitalaria. El interés de este trabajo radica en que, hasta donde conocemos, no se ha realizado ninguna evaluación farmacoeconómica que evalúe la eficiencia de usar los tres esquemas principales de tratamiento de primera línea en esta patología teniendo en cuenta además el impacto económica que podría suponer la inminente comercialización de pemetrexed genérico. En momentos como los actuales de coyuntura económica, donde los recursos sanitarios son limitados, este tipo de estudios, se muestran como una herramienta mas a tener en cuenta a la hora de tomar decisiones, al complementar la información de eficacia y seguridad extraída de los ensayos clínicos.
Introducción
Tras el cáncer colorrectal y el cáncer de próstata, el cáncer de pulmón es el más frecuente en España, con unos 27.000 nuevos casos/año (13% del total)1 y de estos, el 80-85% corresponden a cáncer de pulmón no microcítico (NSCLC)2 diagnosticados en su mayoría en estadíos avanzados de la enfermedad3, razón por la que se trata de uno de los procesos oncológicos con mayores tasas de mortalidad mundial (supervivencia media a los 5 años del 21,4%)4.
El tratamiento estándar del NSCLC son esquemas antineoplásicos basados en platino5, y en los últimos años a estos tratamientos se han incorporado nuevos agentes en la enfermedad metastásica, como el pemetrexed y el bevacizumab. También han sido descritos algunos esquemas, basados únicamente en dobletes de quimioterapia para la fase de inducción, y luego el mantenimiento con pemetrexed, pero hoy en día las guías clínicas recomiendan el la incorporación del pemetrexed o bevacizumab desde la fase de inducción6. Ambos fármacos han mostrado mejorías en la esperanza de vida de estos pacientes cuando se utilizan en regímenes que se componen de una fase de inducción, constituidas de platinos junto con pemetrexed o bevacizumab, seguido de una fase de mantenimiento con alguno de estos dos fármacos. Estos esquemas fundamentalmente son: cisplatino/ pemetrexed (Pem/Cis)7, cisplatino/gemcitabina/bevacizumab (Gem/Cis/Bev)8 y carboplatino/paclitaxel/bevacizumab (Pac/Carbo/Bev)9. La mejora en la eficacia que ha supuesto la incorporación de estos dos nuevos fármacos, también ha significado un aumento en el coste de los tratamientos9. Y el hecho de que los resultados de eficacia mostrados por los tres esquemas resulten similares, junto con la ausencia de ensayos comparativos entre ellos, implica que en la actualidad sea difícil conocer cual es el esquema mas eficiente. Por tanto, resulta necesario, especialmente en momentos como los actuales de coyuntura económica, donde los recursos sanitarios son limitados, realizar un análisis de coste-eficacia que sirva de herramienta para la toma de decisiones a la hora de optimizar los recursos disponibles.
De tal forma que el objetivo del presente trabajo consistirá en realizar un análisis económico para calcular el ratio coste-eficacia de los esquemas antineoplásicos de primera línea en el tratamiento del NSCLC, desde la perspectiva de la gerencia hospitalaria.
Material y métodos
Modelo farmacoeconómico
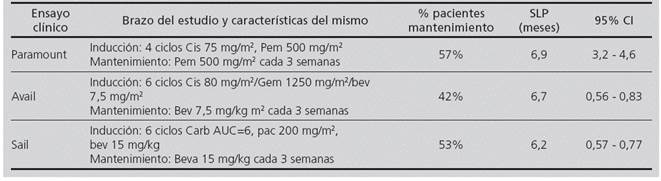
Se elaboró un modelo matemático de coste-eficacia basado en un árbol de decisiones de tres ramas, cada una de ellas correspondiente a los esquemas cis/pem, cis/gem/bev o carbo/pac/bev (Figura 1). Los valores probabilísticos de cada transición fueron obtenidos de los ensayos clínicos Fase III: PARAMOUNT7 (cis/pem); AVAIL8 (cis/gem/bev) y SAIL9 (carbo/pac/bev).
Estos esquemas de tratamiento se basan en una fase de inducción seguida de una fase de mantenimiento en monoterapia que se prolonga hasta progresión de la enfermedad (supervivencia libre de progresión (SLP)) o toxicidad intolerable.
4 ciclos Cis (75 mg/m2)/Pem (500 mg/m2) seguido de pemetrexed (500 mg/m2) en mantenimiento cada 3 semanas.
6 ciclos Gem (1250 mg/m2)/Cis (80 mg/m2)/ Bev (7,5 mg/kg) seguido de bevacizumab (7,5 mg/kg) en mantenimiento cada 3 semanas.
6 ciclos Pac (200 mg/m2)/Carbo (AUC = 6)/Bev (15 mg/ kg) seguido de bevacizumab (15 mg/kg) en mantenimiento cada 3 semanas.
En la Tabla 1 se resumen las características principales de los ensayos PARAMOUNT, SAIL y AVAIL.
El modelo económico fue validado por un panel de expertos, constituidos por oncólogos, con el objetivo de aclarar diferencias y/o contradicciones descritas en la literatura. Para el desarrollo del modelo se utilizó el aplicativo informático Microsoft Excel 2013®. Un diagrama esquemático del análisis de decisión se ilustra en la Figura 1.
Estimación de la eficacia y costes
Como variable de eficacia se utilizó la supervivencia libre de progresión (SLP) descrita en los ensayos clínicos de cada tratamiento. Dado que el estudio AVAIL, los pacientes que superaron la fase de inducción eran aleatorizados a recibir bevacizumab en mantenimiento, a dosis de 7,5 mg/kg o 15 mg/kg y no se observaron diferencias estadísticamente significativas entre ambas dosis de bevacizumab, para la estimación de los costes se utilizó la dosificación de 7,5 mg/kg.
El coste farmacológico se calculó en función del PVL de los medicamentos considerados, resultante de la aplicación de los márgenes comerciales establecidos sobre el PVP-IVA del Catálogo del Consejo General de Colegios Oficiales de Farmacéuticos, y con la correspondiente deducción del 7,5% sobre el PVL establecida por el RD 8/2010 y proporcionada por el Ministerio de Sanidad, Servicios Sociales e Igualdad con fecha Octubre-201210,11 (Tabla 2).
Tabla 2 Costes unitarios utilizados en el modelo farmacoeconómico del tratamiento del NSCLC en 1ª línea (€ de octubre de 2015)

E.F.G Especialidad farmacéutica genérica
* deduccion 7,5% sobre el PVL establecida por el RD 8/201014
Para el cálculo de la dosis, se consideraron las características antropométricas de un paciente estándar representativo de pacientes oncológicos españoles12: 70,15 kg de peso, una superficie corporal de 1,78 m2, y una creatinina plasmática de 0,6 mg/dL. La administración de carboplatino, para obtener el área bajo la curva (ABC) deseada, viene determinada por la tasa de filtración glomerular (TFG). En el presente trabajo se utilizó la fórmula de Calvert para estimar los miligramos de carboplatino necesarios en cada administración13. El coste farmacológico total para cada esquema oncológico se estimó asumiendo un aprovechamiento máximo de los viales. Todos los costes incluidos en el análisis se expresaron en euros (€) del año 2015.
Horizonte temporal, perspectiva del análisis y tasa de descuento
El horizonte temporal considerado fue el tiempo hasta progresión de la primera línea de tratamiento, que correspondió aproximadamente a 1 año de modelización en base a los resultados obtenidos los ensayos clínicos. El estudio se efectuó desde la perspectiva de la gerencia hospitalaria considerando únicamente los costes directos de adquisición de los fármacos. Dada la limitada supervivencia de los pacientes (ninguno de los esquemas oncológicos supero el año de tratamiento), no fue oportuna la aplicación correctora de la tasa de descuento14,15.
Caso base y análisis de sensibilidad
En el caso base del estudio, se consideraron los valores medios de los costes y de la eficacia.
Para comprobar la robustez de los resultados del escenario base y la consistencia de las estimaciones efectuadas, se realizaron varios análisis de sensibilidad determinísticos univariantes considerando los factores siguientes:
Mejora de la eficacia (SLP). Dado que en los ensayos clínicos no se especifica la SLP de los pacientes que superan la fase de inducción, esta se estimo mediante la siguiente fórmula:
El modelo asume que la SLP de los pacientes que progresan durante la fase de inducción es igual a la duración de dicha fase. Esta suposición se basa en el hecho de que, en la práctica clínica, las pruebas de imagen para comprobar el estado de la enfermedad suelen realizarse finalizada la fase de inducción. Por tanto, la SLP estimada para los pacientes que presentaron progresión de la enfermedad durante la fase de inducción fue la siguiente:
2,8 meses para el esquemas cis/pem (4 ciclos de inducción cada 3 semanas).
4,2 meses para el esquema pac/carbo/bev y cis/ gem/bev (6 ciclos de inducción cada 3 semanas).
Se llevo a acabo un análisis de sensibilidad asumiendo una mejoría en el porcentaje de pacientes que superaban la fase de inducción del 20% para cada esquema (Tabla 3), lo que resultaría, aplicando la fórmula anterior en una SLP global para cada esquema de:
cis/pem: 7,69 meses
cis/gem/bev: 7,18 meses
pac/carbo/bev: 6,58 meses
Tabla 3 Razón coste-eficacia incremental y análisis de sensibilidad del análisis de coste-eficacia (€ de octubre de 2015) del tratamiento del NSCLC en 1ª línea

a Razón coste/eficacia incremental por mes de supervivencia libre de progresión adicional
b Una alternativa se dice que es dominada cuando existen opciones con mayor eficacia y menor coste
c Una alternativa se dice que es dominante cuando es la que presenta mayor eficacia a menor coste
3. Modificación de los costes de adquisición de pemetrexed suponiendo una disminución del coste del 30% con la incorporación al mercado de genéricos.
Resultados
Resultado del caso base
El porcentaje de pacientes que pasaron a la fase de mantenimiento durante los ensayos clínicos fue: 57% en el caso del régimen cis/pem, 42% en el caso de los pacientes que recibieron gem/cis/bev y 53% en el esquema carbo/pac/bev. En base a nuestro modelo, el coste medio de tratamiento por paciente para los esquemas de tratamiento gem/cis/bev, cis/pem, y carb/pac/bev serían 15.594,74€, 19.442,01€ y 36.095,17€ respectivamente. El esquema car/pac/bev se trata de la alternativa dominada por tratarse de el esquema de tratamiento mas costoso y con peores resultados en salud. La diferencia de costes entre las estrategias cis/pem y cis/gem/bev es de 3.847,21€, con una razón coste-eficacia incremental (RCEI) por mes de SLP adicional de 19.303€ (Tabla 3).
Análisis de sensibilidad en escenarios alternativos
El resultado fue robusto en el análisis de sensibilidad en todos los escenarios considerando los costes de adquisición de los fármacos actuales. Con una RCEI por mes de SLP adicional de 9.720€ para el régimen cis/pem cuando se considera un aumento de la eficacia del 20% para todos los tratamientos. Sin embargo, con una bajada del precio de pemetrexed del 30%, la alternativa cis/ pem pasaría a convertirse en la alternativa dominante, por ser la que presenta mejores resultados en salud a un coste menor. La mejor razón coste-eficacia incremental para el tratamiento cis/pem se produjo cuando se considero un descuento del 30% para pemetrexed y un aumento de la eficacia del 20% (RCEI = -3.974€/mes de SLP adicional )
El esquema carb/pac/bev fue la alternativa dominada en todos los escenarios contemplados (Tabla 3).
Discusión
De los resultados de nuestro modelo, se deduce, que desde la perspectiva de la gerencia hospitalaria, el esquema carb/pac/bev es la alternativa dominada en el tratamiento de primera línea del NSCLC, al existir regímenes con una eficacia mayor y menor coste, por lo que esta opción quedaría relegada, a nuestro juicio, únicamente a los pacientes que no puedan tolerar los tratamientos que contengan cisplatino, como sucede, por ejemplo, en el caso de pacientes con nefropatías de base. Con el coste de adquisición actual de los fármacos analizados, el tratamiento cis/gemc/bev es más económico que el régimen cis/pem, con una coste incremental de entre 8.217 - 19.303€ por mes de SLP adicional. Habitualmente una terapia se considera coste-efectiva si su RCEI es inferior al umbral de aceptabilidad definido17. En caso de no disponer de umbrales de aceptabilidad explícitos, una terapia puede considerarse coste-efectiva si su RCEI se encuentra en el rango de otras terapias para las que los gestores sanitarios han demostrado disponibilidad a pagar16. Oyagüez y colabores, en un estudio publicado en 2.013 sobre la eficiencia de los tratamientos oncológicos en España, encontraron que los valores de RCEI por mes de SLP adicional se incluyeron en el rango de 5.979,87 y 46.716€17 para las terapias de primera línea, por lo que, de acorde con estos estudios, podría concluirse que el tratamiento cis/pem es una estrategia coste-efectiva.
Además de lo citado con anterioridad, la incorporación al mercado de medicamentos genéricos de pemetrexed (Alimta® Eli Lilly Nederland B.V, fecha autorización septiembre 2004) puede cambiar considerablemente la situación actual. Con una rebaja de los costes de adquisición actuales de pemetrexed del 30%, el tratamiento cis/pem se convertiría en la alternativa dominante (mejores resultados en salud a menor coste) en el tratamiento de 1ª línea de los pacientes con NSCLC. Estos resultados deberían ser tenidos en cuenta a la hora de la toma de decisiones para optimizar los recursos disponibles.
La interpretación de los resultados del presente análisis, debe entenderse como una aproximación a la eficiencia de los esquemas oncológicos y en cualquier caso debe ir acompañada de la consideración de una serie de limitaciones. La principal limitación debe entenderse derivada de la consideración únicamente del coste farmacológico de los esquemas oncológicos, aunque algunas terapias podrían asociarse con costes adicionales para el sistema sanitario como los derivados de su administración, monitorización o manejo de acontecimientos adversos sufridos por el paciente a consecuencia de la medicación. La aproximación elegida para el análisis, considerando solo el coste farmacológico, pretende igualar los resultados de los diferentes esquemas evaluados. Los resultados de este análisis farmacoeconómico deberían por tanto, confirmarse mediante registros de efectividad, en los que se comparase la utilización de recursos sanitarios de las opciones terapéuticas evaluadas en condiciones de práctica clínica habitual. Además, no hay que olvidar que el bevacizumab presenta una serie de limitaciones importantes que suelen ser frecuentes en este tipo de pacientes, ya que está contraindicado en situaciones de hemoptisis o bien si el tumor se encuentra adherido a un gran vaso torácico. Mientras tanto, de acuerdo con los resultados del modelo, puede concluirse que, el tratamiento cis/pem es un tratamiento coste-efectivo y la incorporación al mercado de genéricos de pemetrexed podría convertirla en la alternativa dominante en el tratamiento de 1ª línea de pacientes con NSCLC.
Bibliography
Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC. [ Links ]
D’Addario G, Fruh M, Reck M, Baumann P, Klepetko W, et al. Metastatic non-small-cell lung cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010;21(Suppl. 5):v116-9. [ Links ]
National Cancer Institute. SEER stat fact sheets: lung and bronchus. National Cancer Institute; 2012. Available at: http://seer.cancer.gov/statfacts/html/lungb.html [accessed 01.10.12] [ Links ]
Howlader N, Noone AM, Krapcho M, Garshell J, Neymar N, et al. Cancer statistics review, 1975-2011. Bethesda, MD; 2014. [ Links ]
Rapp E, Pater JL, Willan A, Cormier Y, Murray N, Evans WK, Hodson DI, et al. Chemotherapy can prolong survival in patients with advanced non-small-cell lung cancer-report of a Canadian multicenter randomized trial. J Clin Oncol. 1988 Apr;6(4):633-41. [ Links ]
2016 NCCN Guidelines for Non-Small Cell Lung Cancer. [ Links ]
Paz-Ares L, de Marinis F, Dediu M, Thomas M, Pujol JL, et al. Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non-squamous non-small-cell lung cancer (PARAMOUNT): a double-blind, phase 3, randomised controlled trial. Lancet Oncol. 2012 Mar;13(3):247-55. [ Links ]
Reck M, von Pawel J, Zatloukal P, Ramlau R, Gorbounova V, et al. Phase III trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small-cell lung cancer: AVAil. J Clin Oncol. 2009 Mar 10;27(8):1227-34. [ Links ]
Sandler A, Gray R, Perry MC, Brahmer J, Schiller JH, et al. Paclitaxel carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med. 2006 Dec 14;355(24):2542-50. Erratum in: N Engl J Med. 2007 Jan 18;356(3):318. [ Links ]
Real Decreto-ley 4/2010, de 26 de marzo, de racionalización del gasto farmacéutico con cargo al Sistema Nacional de Salud. BOE de 27 de marzo de 2010;75. Disponible en: http://www.boe.es/boe/dias/2010/03/27/pdfs/BOE-A 2010-5030.pdf [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad. Notas Informativas. Relación informativa de medicamentos afectados por las deducciones establecidas en el Real Decreto Ley 8/2010 de 20 de Mayo por el que se adoptan medidas extraordinarias para la reducción del déficit público. Listado de medicamentos afectados (Octubre 2012). Disponible en: URL: http://www.msc.es/profesionales/farmacia/notasInfor.htm [ Links ]
Ministerio de Sanidad, Servicios Sociales e Igualdad. Atlas de la Sanidad en España. Talla y peso medio según grupo de edad y sexo. Disponible en: http://www.msssi.gob.es/estadEstudios/estadisticas/inforRecopilaciones/atlas/atlasDatos.html [ Links ]
Dooley MJ, Poole SG, Rischin D, Webster LK. Dosificación de carboplatino: sesgo por sexos y estimaciones inexactas del porcentaje de filtración glomerular. European Journal of Cancer (Ed. Española) 2002;2:125-32. [ Links ]
Parsonage M, Neuburger H. Discounting and health benefits. Health Econ. 1992;1(1):71-6. [ Links ]
Hillman AL, Kim MS. Economic decision making in healthcare. A standard approach to discounting health outcomes. Pharmacoeconomics 1995; 7: 198-205. [ Links ]
Foster TS, Miller JD, Boye ME, Blieden MB, Gidwani R, Russell MW. The economic burden of metastatic breast cancer: a systematic review of literature from developed countries. Cancer Treat Rev. 2011;37(6):405-15. [ Links ]
Oyagüez I, Frías C, Seguí MÁ, Gómez-Barrera M, Casado MÁ, Queralt Gorgas M. Efficiency of oncologic treatments for solid tumours in Spain. Farm Hosp. 2013 May-Jun;37(3):240-59 [ Links ]
Recibido: 29 de Octubre de 2015; Aprobado: 29 de Septiembre de 2016











 texto en
texto en