INTRODUCCCIÓN
La prevalencia de los aneurismas de aorta infrarrenal (AAA) en la población general es del 1-1,5%. A pesar de los avances producidos en su tratamiento, sigue siendo una importante causa de morbimortalidad (1 2-3). Esta mortalidad supone un 1-2% de todas las muertes del mundo occidental y la décima causa de muerte de los mayores de 55 años en Estados Unidos (4). Si bien la rotura de los AAA tiene una mortalidad del 85-90%, su tratamiento electivo tiene una mortalidad inferior al 3-5% (5).
Un 75% de los AAA son asintomáticos y su hallazgo es casual en las pruebas de imagen (4). Sin embargo, el cribado del AAA en la población general no resulta coste-efectivo, por lo que se han realizado estudios epidemiológicos para estudiar factores de riesgo de presentar AAA con el objetivo de identificar en qué grupos de personas estaría justificado realizar programas de cribado. En este sentido, en los últimos años algunos estudios de cribado se han mostrado beneficiosos, con un descenso de mortalidad relacionada con la ruptura de AAA (6,7).
Numerosos autores han demostrado que son los varones adultos y con factores de riesgo cardiovascular los más predispuestos a tener un AAA (8 9-10). Entre estos factores destacan el tabaquismo, la hipertensión arterial (HTA), la dislipemia y la enfermedad arterial periférica (EAP). Por ello, en los resultados de los estudios de cribado influyen diversos factores, como el diámetro a partir del cual se considera que la aorta está aneurismática, el área poblacional, la edad, el sexo… (11,12).
Los estudios de cribado de la enfermedad no son abundantes en nuestro país.
En este contexto, los pacientes remitidos a la consulta externa de cirugía vascular para el estudio de EAP suelen presentar uno o varios factores de riesgo cardiovascular, por lo que podría suponerse que un estudio de cribado en esta población podría ser beneficioso.
OBJETIVO
Nuestro objetivo es determinar la prevalencia de AAA en pacientes remitidos a la consulta de cirugía vascular para estudio de EAP. Además, queremos estimar qué factores de riesgo cardiovascular se asocian a mayor prevalencia de AAA.
MATERIAL Y MÉTODOS
Se diseñó un estudio descriptivo observacional, longitudinal y prospectivo, con componente analítico.
Entre febrero de 2012 y diciembre de 2016 se realizó eco Doppler aortoilíaco a los pacientes varones mayores de 50 años con algún factor de riesgo cardiovascular (hipertensión arterial, tabaquismo, cardiopatía isquémica e hipercolesterolemia) remitidos para descartar arteriopatía de miembros inferiores en un área sanitaria de España, que incluye población urbana y rural. Estos pacientes fueros derivados a Cirugía Vascular desde Atención Primaria y Especializada. En todos los casos se realizó exploración física general y vascular y recogida de factores de riesgo. Los participantes fueron informados de este estudio y firmaron un consentimiento informado aceptando la entrada en dicho estudio.
Las variables registradas fueron edad, tabaquismo (fumador, exfumador de más de 1 año y no fumador), HTA (cifras de presión arterial sistólica > 140 mmHg o diastólica > 90 mmHg o en tratamiento antihipertensivo), dislipemia (colesterol unido a lipoproteínas de baja densidad > 160 mg/dl en prevención primaria y > 100 mg/dl en secundaria o trigliceridemia > 150 mg/dl o en tratamiento hipolipemiante), diabetes mellitus (definida según criterios vigentes o en tratamiento hipoglucemiante), índice de masa corporal (IMC) (peso en kg/talla en metros), considerando IMC normal cuando es < 25 y sobrepeso cuando es mayor o igual a este valor, e insuficiencia renal crónica (creatinina plasmática > 1,3 mg/dl). También se consideraron los antecedentes: a) cardiopatía isquémica: asintomática (isquemia miocárdica en test de provocación, antecedentes de angina o infarto de miocardio y/o presencia en coronariografía de lesiones obstructivas > 50% de las coronarias principales); b) enfermedad cerebrovascular isquémica: accidente isquémico transitorio o ictus; c) enfermedad arterial periférica (EAP): índice tobillo-brazo (ITB) < 0,9 o IDB < 0,6, cuando el ITB era mayor de 1,2 o no colapsaban los vasos al realizar ITB, y d) broncopatía crónica (EPOC): toma de broncodilatadores o CVF o FEV1 menor del 60%. También se registró si tomaba algún antiagregante o estatina.
Se utilizó un ecógrafo Philips HD11 con sonda convexa de 3,5 MHz. Las exploraciones fueron realizadas por cinco exploradores, validados por el Capítulo de Diagnóstico Vascular No Invasivo de la SEACV, siguiendo un mismo protocolo recomendado por la American Institute of Ultrasound Medicine (13). Según este protocolo, todos los estudios se realizaron con el paciente en ayunas de 8 horas. Las mediciones de las aortas proximal, media y distal se obtuvieron utilizando predominantemente la vista del eje largo para medir la dimensión anteroposterior. También se obtuvieron vistas transversales o coronales para medir el ancho. Las mediciones se tomaron en el diámetro más grande de la aorta desde el borde exterior hasta el borde exterior.
Se consideró que existía un AAA si el diámetro máximo de la aorta infrarrenal era ≥ 30 mm, aorta normal cuando el diámetro máximo era ≤ 25 mm y ectasia cuando tenía 25-29 mm. Se consideró aneurisma ilíaco cuando la arteria ilíaca común presentaba diámetro superior a 1,5 cm.
Análisis estadístico
Inicialmente se realizó un estudio descriptivo, expresando los resultados de las variables cuantitativas como media ± desviación estándar y los de las discretas en número y porcentaje. Para determinar si había diferencias significativas entre las características de los pacientes con y sin aneurisma, se utilizó el test de chi cuadrado para las variables categóricas y el de la t de Student para las variables continuas; en los casos en que no se cumplieron las condiciones de aplicación de los tests, se utilizó el estadístico exacto de Fisher y la prueba U de Mann-Whitney. Posteriormente, se realizó un análisis multivariable mediante regresión logística, introduciendo en el análisis las variables con p < 0,05. El nivel de significación establecido para todos los test fue p < 0,05. Los análisis se realizaron con el paquete estadístico SPSS versión 16.0.
RESULTADOS
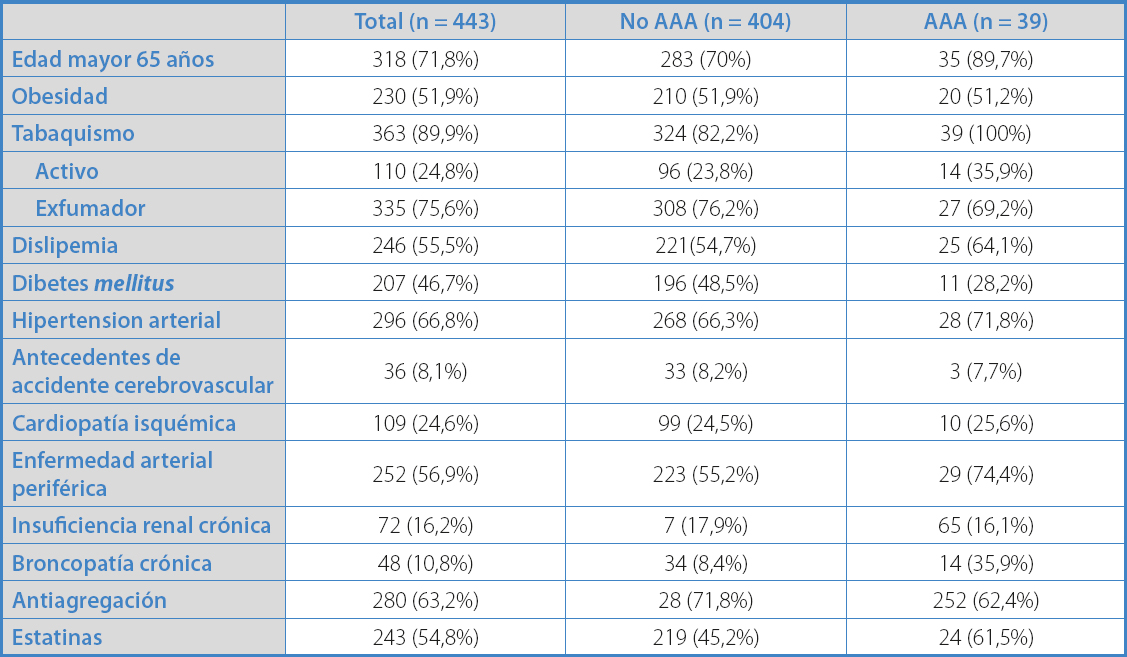
El estudio incluyó a 454 pacientes. De estos, se excluyeron 11 porque no fue posible la medición del diámetro del aneurisma por obesidad/gas abdominal. En total, se estudiaron 443 pacientes. La prevalencia en la población estudiada de aneurisma fue del 8,8% (n = 39). La media del diámetro de los aneurismas diagnosticados fue 4,1 cm (± 1,1). El diámetro medio de las aortas normales fue 1,7 cm (± 0,33). Se detectaron 24 aortas ectásicas, con diámetro medio de 2,6 cm (± 0,1) cm. De los aneurismas detectados, en los menores de 4 cm se realizó seguimiento con eco Doppler anual, y entre 4-5 cm cada 6 meses, mientras que los que presentaron un diámetro mayor de 5 cm se programaron para reparación electiva. De los 39 aneurismas diagnosticados, 7 acabaron interviniéndose, con una media de 6,6 meses: 4 por diámetro mayor de 5 cm, 2 por asociarse a patología aortoilíaca isquémica y en un caso por crecimiento > 0,5 cm en 6 meses.
Se diagnosticaron 47 aneurismas ilíacos, 14 de ellos bilaterales, con un diámetro medio de 2,25 cm (± 1,7 cm). En 10 casos, el diagnóstico se realizó asociado al de AAA.
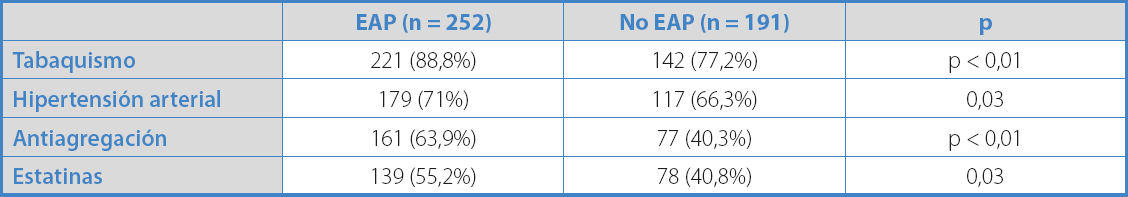
Del total de pacientes remitidos a la consulta por sospecha de EAP, finalmente en 252 (56,9%) se diagnosticó EAP por el estudio hemodinámico. En este grupo de pacientes, la prevalencia de AAA fue del 11,5%. Al analizar los distintos factores de riesgo cardiovascular de los pacientes que presentaron EAP respecto al resto de la serie, observamos que los pacientes con EAP presentaron un mayor porcentaje de HTA y tabaquismo, y también en un mayor porcentaje ya estaban con tratamiento antiagregante y estatinas (p < 0,05) (Tabla I). Además, los pacientes con EAP presentaban una mayor prevalencia de aneurisma de forma estadísticamente significativa.
Tabla I. Variables asociadas significativamente en el análisis univariante con la enfermedad arterial periférica
Los mayores de 65 años presentaban mayor prevalencia de AAA (p < 0,05). En las tablas II y III se muestran los factores de riesgo y comorbilidades asociadas.
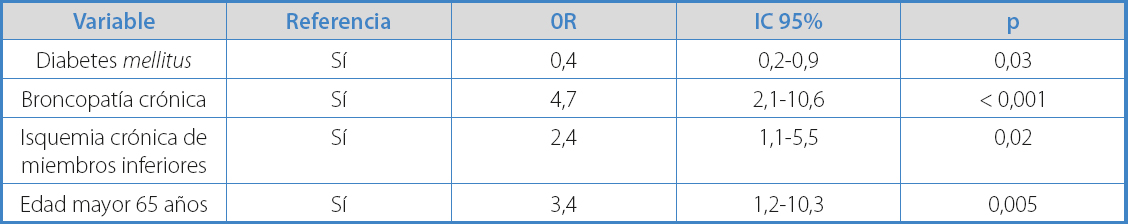
Tabla III. Variables que presentan asociación estadísticamente significativa en el análisis univariante con la probabilidad de aparición de aneurisma de aorta abdominal
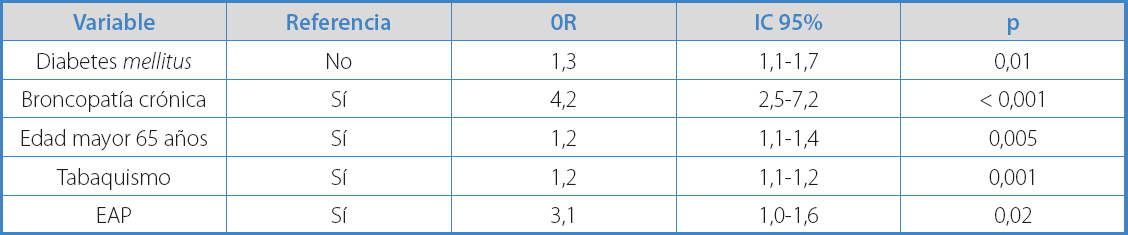
Respecto al tabaquismo, un 24,8% eran fumadores activos y un 75,6%, exfumadores. No obstante, los fumadores, tanto activos como exfumadores, presentaron una probabilidad significativamente mayor que los no fumadores para tener un AAA (p = 0,001).
Los diabéticos mostraron menor probabilidad que los no diabéticos de presentar AAA (p = 0,01).
Un 55,5% (n = 246) de los pacientes remitidos a consulta de cirugía vascular para descartar EAP presentaban dislipemia, y el 98,7% (n = 243) de estos recibían tratamiento con estatinas. No hubo asociación estadísticamente significativa entre ser portador de AAA y tener dislipemia. Como puede observarse, un 63,2% (n = 280) de los pacientes ya tomaba algún tratamiento antiagregante como prevención primaria o secundaria cardiovascular.
Para determinar los factores de riesgo del AAA, se realizó un análisis de regresión logística, introduciendo las variables estadísticamente significativas en el análisis univariante (Tabla IV). Obtuvimos que la presencia de EPOC (OR 4,7), edad > 65 años (OR 3,4) y EAP (OR 2,4) se mostraron como factores de riesgo, mientras que la DM se mostró como factor protector (OR 0,44) (Tabla IV).
DISCUSIÓN
Los resultados de este estudio muestran la factibilidad y utilidad de realizar un cribado de aneurismas en pacientes seleccionados que acuden a la consulta de Cirugía Vascular.
La exploración vascular rutinaria que se realiza en la consulta de Cirugía Vascular no permite detectar precozmente un AAA en un alto porcentaje de casos. Añadir un estudio de un eco Doppler aortoilíaco en pacientes seleccionados que acuden a la consulta del cirujano vascular para su valoración permite detectar un AAA en un 8,8% de los pacientes (se trata de una prueba no invasiva y no somete al paciente a radiación). El tiempo requerido para completar la ecografía abdominal y medir el diámetro de aorta por personal cualificado es de aproximadamente 10 minutos, según estudios previos (14).
El hecho de que esta prueba se realice en el Laboratorio de Diagnóstico Vascular del Servicio de Angiología y Cirugía Vascular, muchas veces en el contexto de otras pruebas que se hayan solicitado al paciente y, por lo tanto, como consulta de alta resolución, creemos que facilita la realización del estudio de cribado.
La ecografía es un método con gran fiabilidad y reproducible, tanto para el diagnóstico como para el seguimiento, y, aunque en nuestro caso han sido 5 los exploradores implicados en este estudio, la variabilidad entre dos observadores acostumbrados a este tipo de exploraciones es menor a 2,5-3 mm (15,16). En este trabajo, al igual que en la mayoría de los estudios en la actualidad, se ha utilizado la definición que considera AAA cuando la aorta infrarrenal es de un diámetro ≥ 3 cm (6,12).
En una revisión de estudios de cribado realizados en diversos países, se estimaba una prevalencia de 3,9 al 5,1% en mayores de 65 años (17). La prevalencia de nuestra serie es superior (8,8%). La mayor prevalencia de AAA en nuestra muestra estaría relacionada con la mayor presencia de factores de riesgo cardiovascular en nuestra serie, ya que son pacientes con artropatía periférica o con factores de riesgo para ella, que son remitidos a la consulta del cirujano vascular, y está en concordancia con otros estudios publicados de prevalencia de AAA en pacientes con EAP (10). Lindton y Norman (18), en su análisis de los principales estudios aleatorizados sobre prevalencia de AAA, confirman que las prevalencias dependen del medio y que cualquier tipo de cribado de AAA disminuye de forma significativa la muerte por AAA si la prevalencia es mayor del 4% en la población estudiada. Por lo tanto, los pacientes remitidos a la consulta de cirugía vascular se encuadrarían dentro de esta población en la que el cribado sería beneficioso.
La relación encontrada entre mayor edad y la aparición de aneurismas ha sido señalada por diversos autores (17,19). El odds ratio de encontrar un aneurisma de al menos 4 cm, ajustado a otros factores de riesgo, se incrementa en 1,7 (IC, 1,61-1,82) por cada intervalo de 7 años (20). En el estudio ADAM la prevalencia de aneurismas en los pacientes entre 50-79 años era del 4,6%, y del 7,2% en pacientes de edades comprendidas entre 60-75 años (21). Actualmente, las principales sociedades vasculares implicadas en el manejo de los AAA recomiendan el cribado mediante ecografía abdominal en varones en edades comprendidas entre 65 y 75 años (22 23-24). En una revisión Cochrane del año 2007 sobre cribado de AAA, se confirmó una reducción significativa de la mortalidad por AAA en varones de 65 a 79 años que se sometieron a cribado mediante una sola ecografía a lo largo de su vida (25), si bien estudios de cribado de AAA en población arterosclerosa lo recomiendan en varones ≥ 55 años (26).
Hemos observado también que la diabetes mellitus se muestra como factor protector frente a la aparición de AAA. Estos resultados concuerdan con los publicados por otros autores (17,19), aunque aún se desconocen sus causas.
La EPOC en nuestro medio es una patología que se ha correlacionado con la mayor prevalencia de aneurismas (27), tal y como puede verse también en nuestra población.
La arteriopatía periférica como factor aislado ha mostrado ser factor de riesgo para AAA en algunos grupos (27,28), y también en el nuestro. La guía reciente de la AHA recomienda el cribado de AAA en pacientes con EAP sintomática (29).
Respecto a la comparación de nuestros resultados con otros estudios de cribado realizados en poblaciones similares de nuestro entorno, el estudio de Barba y cols., en el que se estudió la prevalencia de AAA en otra área poblacional de España, comunicaron una prevalencia de aneurismas en la población global de 4,7%, con mayor prevalencia de AAA en hipertensos, fumadores y pacientes con EAP, similar a los factores de riesgo encontrados en nuestra serie (30). Estos autores publican también otro trabajo (10) en el que analizaron la prevalencia de AAA en pacientes ya diagnosticados de EAP, entre los años 1999 y 2004, comunicando en esta población una prevalencia de AAA del 13%, mayor respecto al estudio en población general. Observan también una mayor incidencia de factores de riesgo cardiovascular en esta población. Fernández y cols. (31) publicaron otro estudio de cribado en otra área sanitaria de España, con una prevalencia del 4,3%, aunque en su caso no objetivaron un aumento de prevalencia en pacientes con EAP.
De nuestros resultados se deduce la fuerte relación que existe con el tabaquismo, actual o pasado, ya que tanto la EPOC como la EAP son patologías íntimamente ligadas al tabaquismo (22). El tabaquismo aumenta la prevalencia de aneurisma de 3 a 5 veces respecto a la población general (23). Así, las guías más actuales recomiendan con un grado de evidencia B realizar cribado de AAA en pacientes de 65-75 años que hayan fumado alguna vez (22 23-24). En nuestro grupo, el tabaquismo aparecía como factor de riesgo en el análisis univariante.
El estudio presenta algunas limitaciones. Este estudio se ha realizado sobre pacientes remitidos a la consulta de cirugía vascular, lo que ya en sí conlleva un sesgo de selección de pacientes. Además, hay un porcentaje de pacientes que no han podido estudiarse con eco Doppler por distintos motivos, como se ha comentado anteriormente. En segundo lugar, las determinaciones analíticas para el diagnóstico de los diferentes factores no se realizaron en el momento de la consulta, sino que eran determinaciones realizadas en Atención Primaria.
Por último, faltaría realizar el análisis coste-efectividad en estos pacientes, una población con mayor morbilidad cardiovascular.
CONCLUSIÓN
El cribado de aneurisma de aorta abdominal de los pacientes varones remitidos a la consulta de cirugía vascular ha permitido diagnosticarlo en un 8,8% de los pacientes.
En este grupo de pacientes estudiado, EPOC, EAP y edad > 65 años son factores de riesgo de AAA, mientras que la DM es un factor protector.
Dentro de las estrategias encaminadas a optimizar la detección de AAA, el análisis de estos datos puede ayudar a definir la población de riesgo para estudios de cribado en población remitida a la consulta de cirugía vascular.