INTRODUCCIÓN
En el síndrome de estrecho torácico (SET) existe compresión del paquete vasculonervioso en su paso por el espacio costoclavicular debido a la presencia de costilla cervical o a la inserción anómala de los músculos escaleno anterior y medio. La compresión repetida causa sintomatología neurológica en más del 90% de los casos (1). Con menos frecuencia se ocasiona sintomatología por compresión venosa que puede causar trombosis venosa profunda (TVP) de la vena subclavia, también denominada “síndrome de Paget-Schrotter”. Aún más infrecuente es la clínica arterial (2).
El síndrome de Paget-Schrotter prevalece en pacientes jóvenes y atléticos, que manifiestan más comúnmente hinchazón repentina del brazo, pesadez y, ocasionalmente, incluso cianosis, dolor y claudicación venosa. Es más frecuente en mujeres con ratio de 2:1 y es tres veces más incidente en el brazo derecho (3).
El manejo conservador de la TVP mediante medidas posturales, elevación del brazo y anticoagulación no evita la aparición de síndrome postrombótico en hasta el 60% de los casos (4). En este sentido, el uso de técnicas endovasculares para el tratamiento de la TVP aguda proximal, incluyendo la trombectomía farmacomecánica (TFM) y la trombólisis mediante catéter (TC), ha demostrado disminuir la incidencia del síndrome postrombótico, reduciendo la comorbilidad, los costes y la hospitalización (5).
CASO CLÍNICO
Mujer de 23 años, de constitución delgada y sin antecedentes de interés, se presentó en el servicio de urgencias con edema y pesadez de brazo derecho (MSD) desde la raíz del miembro de menos de un día de evolución. La paciente refería ejercer hípica y jugar al tenis. La exploración reveló colateralidad venosa a nivel del hombro derecho. La exploración ecográfica reveló trombosis subclavioaxilar. Se sospecho síndrome de Paget-Schrotter y se inició anticoagulación con HBPM ajustada a peso, programando tratamiento mediante TFM (Fig. 1). Una vez cruzado el trombo, tras infusión local de 172 000 UI de uroquinasa y 20 min de espera, se procedió a la tromboaspiración power pulse durante 170 segundos seguida de angioplastia simple del eje axilosubclavio (Figs. 1A y 1B) y repetida de la unión subclaviocava (Fig. 1C), con lo que se obtuvo un resultado angiográfico satisfactorio (Fig. 1D).
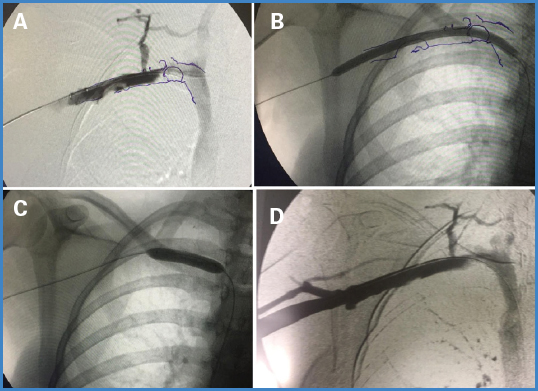
Figura 1. Trombosis subclavioaxilar derecha tratada con trombectomía farmacomecánica utilizando el sistema AngioJet. A. Angiografía inicial que muestra oclusión a nivel de la unión subclaviocava y otra a nivel de la transición subclavioaxilar. B. Tras infusión local de uroquinasa y trombectomía mecánica, se realiza angioplastia de todo el eje. C. Angioplastia de la unión subclaviocava. D. Resultado angiográfico satisfactorio.
A menos de 24 horas de la intervención, la paciente presentó oligoanuria sin hematuria junto con empeoramiento paulatino de la función renal, por lo que se precisó iniciar hemodiálisis 4 días después la intervención, a pesar de medidas de hidratación y alcalinización de la orina (Fig. 2). Cursó con anemización paulatina y precisó transfusión sanguínea 10 días tras la intervención (Fig. 3). Presentó, además, leucocitosis (Fig. 4) y fiebre de hasta 38,5°C con sospecha de infección de tracto urinario y necesitó tratamiento antibioterápico. Los cultivos de sangre y de orina fueron negativos y la ecografía renal, normal. La función renal se recuperó 20 días tras la intervención. El estudio hematológico descartó coagulopatías u otras alteraciones de la coagulación. El sistema venoso profundo y axilosubclavio del MSD se mantienen permeables mediante ecografía Doppler seis meses tras la intervención y la paciente se mantiene asintomática.

Figura 2. Evolución de los valores de creatinina (Cr, mg/dl) y filtrado glomerular estimado (FGE, ml/min).

Figura 3. Valores de hemoglobina (Hb, g/dl) y hematocrito (Hcto, porcentaje). Nótese la anemización progresiva hasta precisar transfusión sanguínea.

Figura 4. La paciente llega a presentar elevación de leucocitos (× 109/l) sin llegar a establecer foco infeccioso.
Objetivo
En vista de la complicación observada por nuestra parte, buscamos en la literatura publicada hasta la actualidad relacionada con el fracaso renal agudo (FRA) tras el uso del sistema de TFM para el tratamiento de TVP.
Desarrollo
La trombólisis y posterior descompresión del opérculo torácico se considera el estándar de tratamiento para los pacientes con SET venoso (6,7). Los dispositivos utilizados para la TFM combinan la trombectomía mecánica con la infusión local de agentes trombolíticos. Fueron diseñados para aminorar la dosis de agentes trombolíticos utilizada en la TC, disminuyendo posibles complicaciones hemorrágicas derivadas y el tiempo de ingreso hospitalario. El sistema AngioJet (Boston Scientific, Marlborough, Massachusetts, Estados Unidos) ha demostrado su efectividad (7,8) y superioridad frente a la TAC para el tratamiento de TVP proximal (9,10). Se trata de un sistema de trombectomía reolítica con aspiración de los fragmentos de trombo generados previa instilación de uroquinasa de forma local. La alta presión de flujo de suero salino que genera no solo fragmenta el trombo, sino que también destruye células sanguíneas, lo que produce hemólisis (11). Por ello, cierto grado de hematuria o de hematuria franca es relativamente habitual tras el tratamiento con el sistema AngioJet, que se describe como efecto adverso benigno en las instrucciones de uso del dispositivo (12). Tanto es así que en el estudio más grande multicéntrico, prospectivo y aleatorizado sobre tratamiento de TVP aguda hasta el momento, el estudio ATTRACT, ni siquiera recoge la incidencia de insuficiencia renal tras el uso de TFM (5). Sin embargo, la hematuria por sí sola, al igual que ocurre en la hemoglobinuria paroxística nocturna, ha demostrado ser causante de toxicidad renal (13,14).
Varios casos clínicos y análisis retrospectivos documentan los efectos nefrotóxicos de la hematuria tras TFM (8,11-17). En 2007, Arslan y cols. describieron un caso clínico de FRA autolimitado que precisó hemodiálisis en una paciente de 16 años tras la TFM de TVP iliocava (15). Como en nuestro caso, la paciente recuperó la función renal 20 días tras la intervención. En 2011, Mathews y cols. publicaron el caso de un varón de 48 años que presentó FRA prolongado tras TFM para TVP extensa de una extremidad inferior que precisó hemodiálisis incluso 5 meses después de la intervención (16).
La primera revisión más extensa sobre el tema se publicó en 2017 por Escobar y cols., quienes analizaron su serie de casos tratados durante cinco años para evaluar el riesgo de padecer FRA tras TAC o uso de AngioJet (12). De un total de 102 pacientes tratados, 18 (33%) fueron TVP y el resto, trombosis arteriales. Un 29% de los pacientes presentaron FRA tras el tratamiento. Dos pacientes del grupo tratado con AngioJet precisaron hemodiálisis, iniciada dos días tras la intervención, y murieron durante su hospitalización (las causas de la muerte fueron isquemia mesentérica y embolia pulmonar, respectivamente) (12). El uso de AngioJet mostró ser un factor de riesgo independiente para FRA (OR 8,2; p = 0,004, IC 95%, 1,98-34,17), que podría deberse a la hemólisis producida por el dispositivo.
Los autores averiguaron, además, que haber presentado cirugía abierta en los últimos tres meses previos a la intervención o padecer caída posoperatoria de hematocrito (Hcto) superior al 10% son factores de riesgo independientes para padecer FRA (12).
El mismo año Morrow y cols. publicaron una revisión unicéntrica de 145 pacientes, de los cuales 92 pacientes (63%) presentaban TVP (17). Se compararon cuatro grupos de tratamiento. La TFM presentó tasas significativamente más altas de disfunción renal posoperatoria (21%, p = ,46), seguida por trombectomía únicamente mecánica (20%) y TFM asociada a TAC (14%). La TAC por sí sola no se asoció con FRA. Ninguno de los pacientes precisó hemodiálisis durante el mismo ingreso (17).
En 2018 el equipo de Arias Laverde y cols. publicaron su experiencia con TFM. Trataron 30 pacientes con TVP aguda (8). De ellos, 1 paciente (3,4%) desarrolló FRA posoperatorio. Recuperó la función renal a los 23 días después de la intervención. El mismo año, Shen y cols. publicaron su serie de 198 paciente tratados mediante TFM con el sistema AngioJet (79 pacientes) o TAC (119 pacientes) para el tratamiento de TVP iliofemoral (11). Los pacientes en el grupo de TFM sufrieron más FRA (22,8% frente a 9,2%; p = ,013 y hemólisis (p = ,018). Dos pacientes del grupo de TFM precisaron hemodiálisis a corto plazo. La TFM mostró ser factor de riesgo para padecer FRA (OR 2,82; IC 95%, 1,16-6,82; p = ,02) (11). Los antecedentes de cirugía abierta durante los últimos tres meses y el descenso posoperatorio del Hcto > 14% también demostraron ser factores de riesgo independientes para el desarrollo de FRA posoperatorio (11).
Parece que la patogenia del FRA subyace en la hemólisis producida por la TFM que frecuentemente resulta en hemoglobinuria (18). Existen diversos mecanismos fisiológicos para eliminar la hemoglobina (Hb) tetramérica libre. Sin embargo, en la presencia de hemólisis masiva, dichos mecanismos se sobrecargan y la Hb libre llega a filtrarse en los túbulos renales. Se cree que el efecto nefrotóxico de las proteínas del grupo Hemo se debe a su precipitación y obstrucción a nivel de los túbulos proximales del riñón, lo que produce necrosis tubular aguda, oligoanuria, azotemia y fallo renal (12,18). Por lo general, el pronóstico del FRA tras TFM es bueno; sin embargo, como hemos visto, podría no ser autolimitado y precisar hemodiálisis de forma prolongada (16). La administración de contraste yodado durante el procedimiento podría exacerbar este efecto. Otras complicaciones descritas del TFM son la presentación de hematoma retroperitoneal o pancreatitis (19).
Nuestra paciente presentaba función renal, valores de hemoglobina (Hb) y hematocrito (Hcto) preoperatorio normales (Figs. 2 y 3) y no tenía antecedentes quirúrgicos. A pesar de seguir las recomendaciones indicadas para TFM (infundir dosis de uroquinasa casi a la mitad de las habituales máximas de 300 000 UI y tiempos de trombectomía la mitad del máximo de 300 segundos indicados por el fabricante), nuestra paciente sufrió FRA. Aunque la hematuria sea un hallazgo habitual, no se presentó en nuestro caso. Sin embargo, la paciente mostró descenso paulatino de Hb en sangre y llegó a precisar transfusión sanguínea. La trombólisis inicial, junto a la propia hemodiálisis y la necesidad de controles sanguíneos repetidos, pueden explicar esta bajada. Estimamos que nuestra paciente presentaba una superficie corporal de 1,35 m2 (fórmula de DuBois) y volemia de 2,8 litros (fórmula de Nadler). Dichos parámetros, por debajo de la media general, podrían ser significativos a la hora de indicar TFM. La proporción de células sanguíneas lisadas en individuos con menor volemia diferiría de las producidas en un individuo con comparativamente mayor volemia para las mismas dosis de trombolítico y tiempos de tratamiento, y con ello, agravaría los efectos nefrotóxicos de la hemoglobinuria. Dicha asociación debería evaluarse en futuros trabajos para definir mejor los pacientes y técnicas ideales y optimizar el tratamiento mediante TFM en las trombosis agudas.
El tratamiento del FRA se basa en la hidratación abundante y alcalinización de la orina mediante la administración intravenosa de bicarbonato sódico para mantener un pH mayor a 6,5 y disminuir la nefrotoxicidad del grupo hemo (18). Se indica diálisis para control volémico e iónico en espera de eliminación de la Hb tetramérica libre por el propio organismo, ya que su paso por los filtros de diálisis es mínimo debido a su alto peso molecular.
Aunque la TFM ha demostrado ser un método efectivo para la lisis del trombo agudo, disminuyendo los tiempos de tratamiento y las dosis de agentes líticos administrados, su posible afectación a la función renal ha de ser considerada antes de indicar el tratamiento. La hemólisis intravascular que produce podría comprometer la función renal y, por lo tanto, probablemente debería evitarse en pacientes con disfunción renal preexistente o volemia baja.
CONCLUSIÓN
El riesgo de FRA tras TFM es considerable y, aunque el pronóstico sea por lo general benigno, dicha complicación debería advertirse en la lista de posibles complicaciones asociadas a la TFM. Se ha de insistir en una hidratación adecuada, limitando los tiempos de trombectomía mecánica y cuantificando el efluente obtenido para reducir el posible daño nefrológico. Por último, enfatizamos la prudencia al indicar TFM en mujeres jóvenes y delgadas.














