INTRODUCCIÓN
El mayor inconveniente del uso de contrastes yodados en la práctica clínica es la nefropatía por contraste, que aumenta la morbimortalidad y los costes hospitalarios. El empeoramiento de la función renal ocurre en un 18-23 % de los pacientes intervenidos de EVAR en el potoperatorio (1). Se define nefropatía inducida por contraste (NIC) como un empeoramiento agudo de la función renal entre el segundo y el séptimo día tras la administración de contraste yodado, que debe ser > 0,5 mg/dl; 44 µmol/L en términos absolutos o > 25 % en términos relativos (2-5). La fisiopatología de la NIC es el resultado de una desregulación entre la vasoconstricción y la vasodilatación de los vasos medulares del parénquima renal sumada al efecto citotóxico directo del contraste (6,7).
Además de los factores de riesgo modificables y no modificables (8) ya conocidos, que influyen en el desarrollo de la NIC, los pacientes intervenidos de EVAR presentan de manera adicional otros mecanismos de lesión, como microembolismos de la arteria renal durante el despliegue del dispositivo (9), disección del ostium de la arteria renal, síndrome de isquemia reperfusión (10), hipovolemia y factores de riesgo cardiovascular añadidos (7,11).
Se recomienda un análisis del riesgo de padecer NIC, de reducir en lo máximo posible el volumen contraste y drogas nefrotóxicas y un protocolo de prehidratación de 1-1,5 mL/kg/h de suero salino fisiológico al 0,9 % desde al menos 12 horas hasta 24 horas después de la exposición al contraste (3,6,12,13). No obstante, existen otras estrategias de nefroprotección, como el PCIR 14,15.
El preacondicionamiento isquémico remoto (PCIR) es una técnica de protección tisular no invasiva que ha demostrado ser capaz de disminuir la afectación renal tras la administración de contraste. Su mecanismo de acción es desconocido (1), aunque existen hipótesis que postulan la interacción del mecanismos humorales, neuronales, sistémicos y moleculares complejos (16) que producen un efecto antiinflamatorio y un descenso de los niveles extravasculares de radicales libres y lactato (17).
El objetivo de este estudio es cuantificar la incidencia real de la NIC y evaluar el papel del PCIR como estrategia para reducir la incidencia NIC en pacientes intervenidos de EVAR electivo.
MATERIAL Y MÉTODOS
Se diseñó un estudio aleatorizado prospectivo con pacientes sometidos a reparación endovascular de patología aórtica aneurismática exclusivamente de forma electiva en el periodo de enero de 2017 y enero de 2019 en el Hospital Clínico Universitario de Valladolid. Este estudio no recibió financiación por parte de la industria. Se realizó bajo los preceptos de la Declaración de Helsinki y el protocolo de investigación se aprobó por el Comité de Ética en Investigación Clínica del Área Este de Valladolid (PI-20-1745). Este estudio se encuentra registrado en ClinicalTrials.gov con la referencia NCT05350683. La inclusión en este estudio fue voluntaria y previa firma de un consentimiento informado.
Los criterios de exclusión se aplicaron en pacientes con enfermedad arterial periférica en extremidad superior, pacientes en diálisis, que tuvieran descompensación cardíaca en el momento de la intervención o aquellos que no toleraron el protocolo de preacondicionamiento.
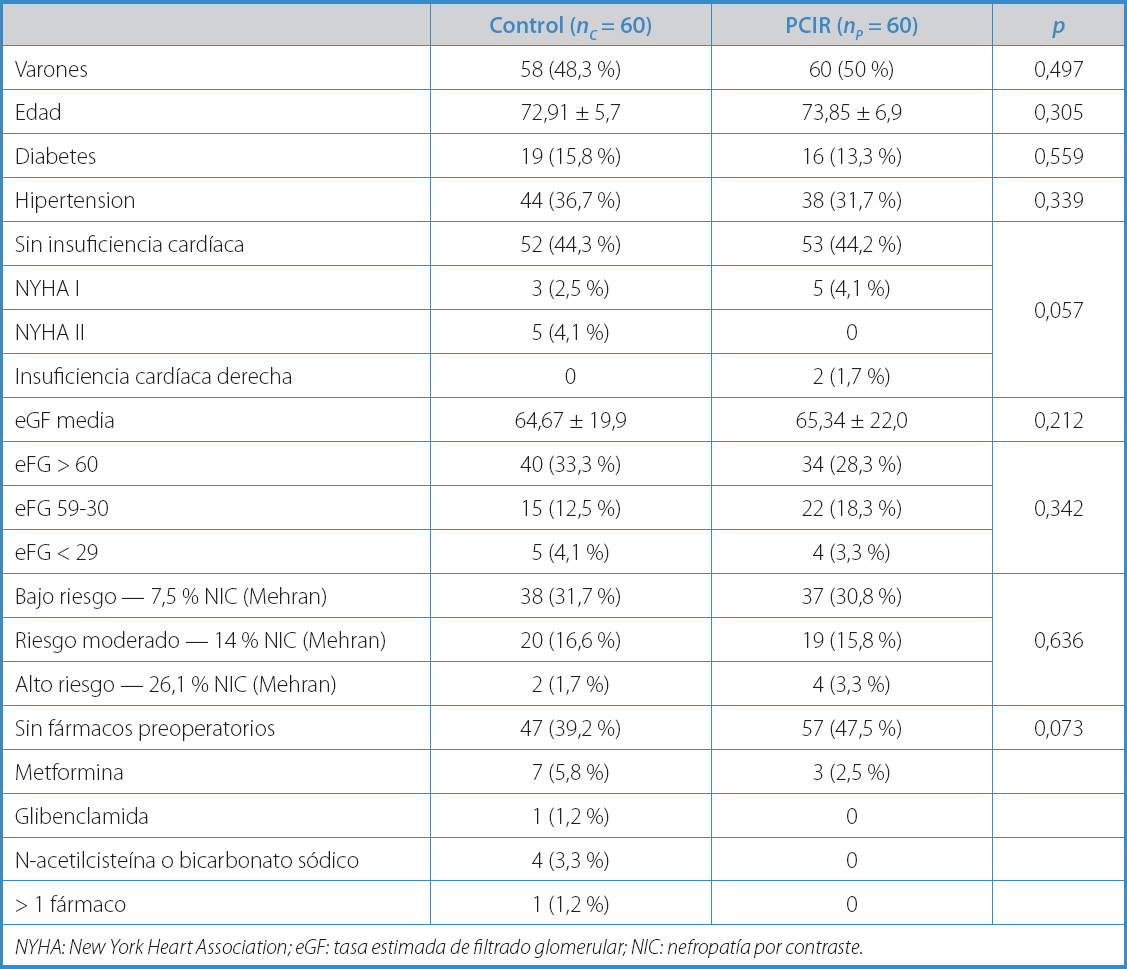
Las variables del estudio pueden verse reflejadas en la tabla I. El impacto del PCIR se midió en términos absolutos y relativos de variación de creatinina en las primeras 48 horas tras la administración de contraste de acuerdo con la definición de NIC detallada previamente.
Tabla I. Descripción de la muestra
NYHA: New York Heart Association; eGF: tasa estimada de filtrado glomerular; NIC: nefropatía por contraste.
Se administró sueroterapia a todos los pacientes, empezando en las 12 horas previas a la administración de contraste, a razón de 1ml/kg/h e independientemente del riesgo de desarrollar NIC (según la escala Mehran [18]). Se retiraron los fármacos nefrotóxicos 24 horas antes de la cirugía y no se utilizó otro fármaco de nefroprotección salvo indicado por otro especialista.
En las 12 horas previas a la cirugía, el investigador principal realizó el PCIR de forma protocolizada: alternando 4 ciclos de 5 minutos de inflado de esfignomanómetro en extremidad superior no dominante hasta TAS + 20 mmHg seguidos de 5 minutos de desinflado. Los pacientes se reclutaron a razón de 1:1 de forma consecutiva.
El objetivo de este estudio es cuantificar la incidencia real de la NIC en los pacientes intervenidos de EVAR electivo y evaluar el papel del PCIR como estrategia de nefroprotección en estos pacientes.
El tamaño de la muestra se calculó utilizando la calculadora GRANMO 5.2 en función de una diferencia de la media de cifras de creatinina en el posoperatorio de 0,7 mg/dl entre los grupos control y precondicionado (C y P, respectivamente) en una población similar a la del presente estudio (17) para una potencia del 80 % y un error de tipo 1 bilateral del 5 %. Un primer cálculo previo al reclutamiento tuvo como resultado 37 pacientes en cada brazo del estudio. Al reclutar 18 pacientes se repitió el cálculo, que tuvo como resultado 65 pacientes en cada brazo del estudio. Se estimó una pérdida del 10 % durante el seguimiento.
Las variables continuas se testaron para distribución normal utilizando Shapiro-Wilk. Las variables con distribución normal se describen utilizando la media y la desviación estándar y se compararon utilizando pruebas t para muestras independientes y ANOVA para variables continuas con medidas repetidas; en caso de distribución no normal se utilizó el test de Mann-Whitney. Las variables categóricas se expresan como frecuencia y porcentaje y se compararon utilizando la χ2 de Pearson y el test exacto de Fisher.
Se consideró como estadísticamente significativo un valor de p < 0,05. Todos los análisis se realizaron utilizando el SPSS versión 27.0; IBM Corporation, Somers, Nueva York, EE. UU.
RESULTADOS
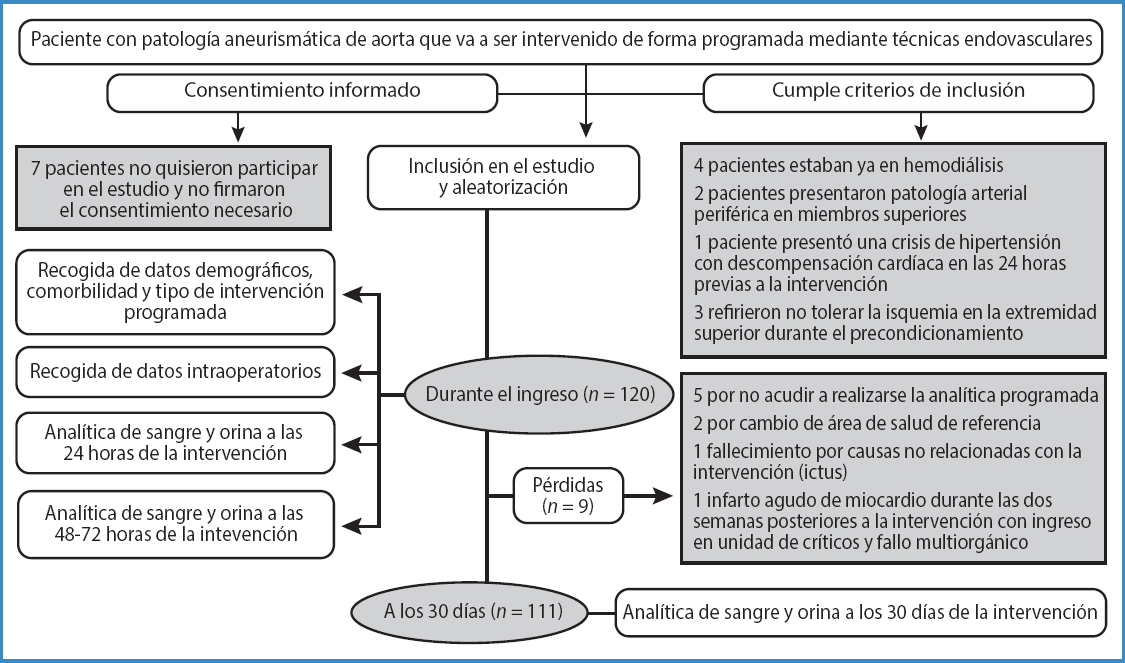
Se incluyeron 120 pacientes (ver diagrama de flujo en la figura 1) con patología aneurismática de aórtica sometidos a EVAR electivo: 58 hombres y 2 mujeres en el grupo C y 60 hombres en el grupo P; edad media de 72,91 ± 5,7 años (rango: 60-83) en el grupo C y de 73,85 ± 6,9 (rango 56-87) en el grupo P.
La tabla I resume el análisis descriptivo de las variables incluidas según los grupos de estudio. Las características de la cirugía se muestran en la tabla II y las correspondientes al posoperatorio se encuentran en la tabla III. Las únicas diferencias observadas entre ambos grupos fueron una mayor incidencia de insuficiencia cardíaca de clase II de la NYHA en el grupo C (5 [4,1 %] frente a 0; p = 0,057) y el uso de metformina (7 [5,8 %] frente a 3 [2,5 %]; p = 0,073) (Tabla I). La función renal basal en términos de creatinina y de urea séricas y de tasa de filtración glomerular estimada fueron comparables en ambos grupos (Tabla IV).
Tabla II. Características quirúrgicas

EVAR: reparación endovascular de aneurisma; FEVAR: reparación endovascular de aneurisma fenestrado.
Tabla IV. Variables continuas. Preoperatorias y posoperatorias
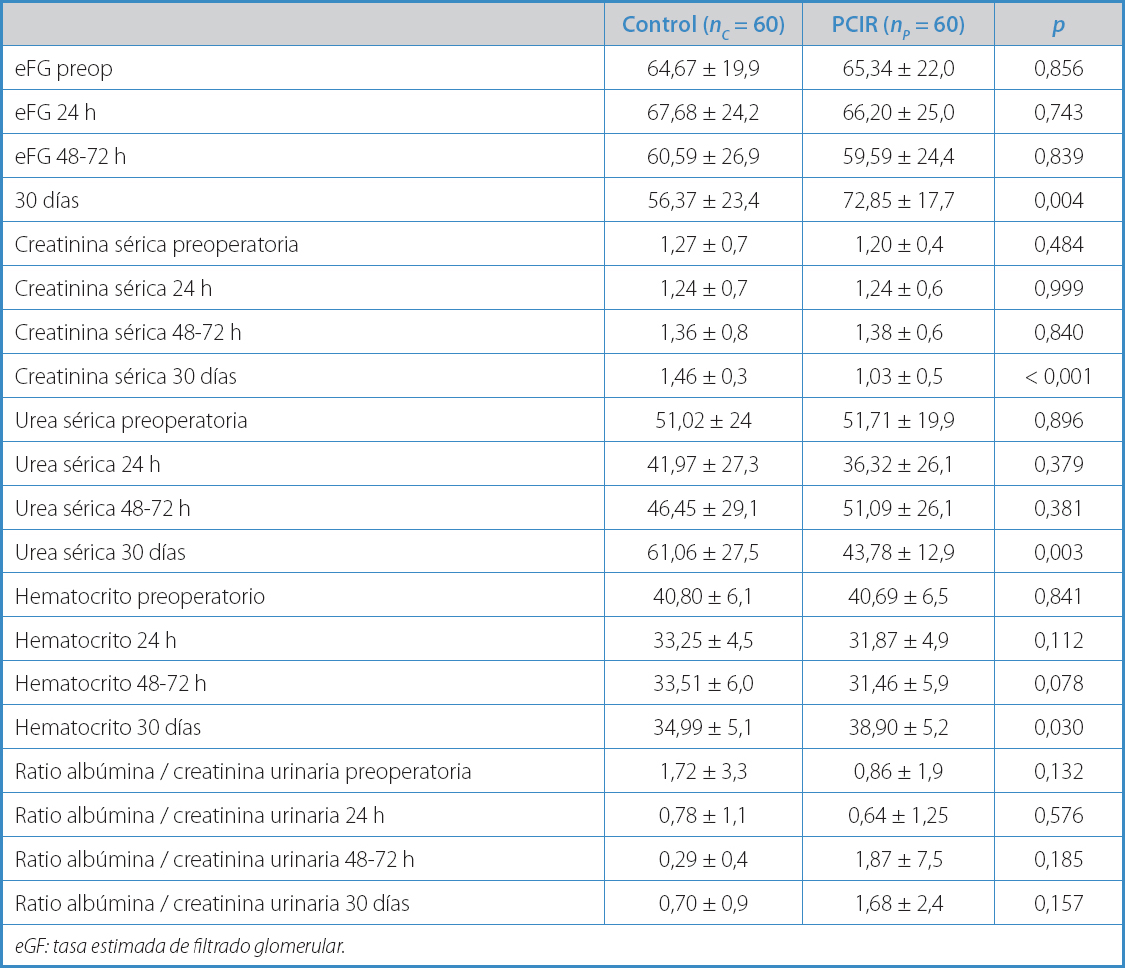
eGF: tasa estimada de filtrado glomerular.
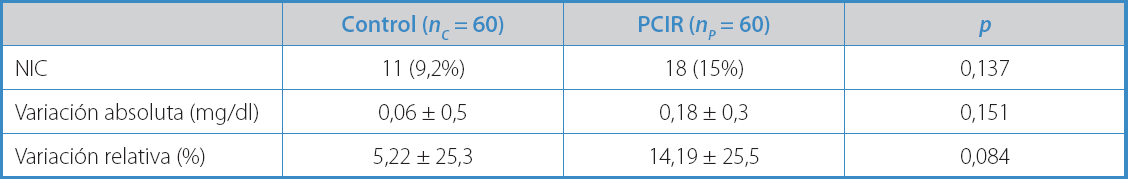
Las variables que describen el objetivo principal se resumen en la tabla V, sin diferencias estadísticamente significativas entre el grupo P y el grupo C en términos de variación relativa (5,22 % ± 25,3 frente a 14,19 % ± 25,5; p = 0,084) o absoluta (0,06 mg /dl ± 0,5 frente a 0,18 mg/dl ± 0,3; p = 0,151) de la creatinina sérica y, por tanto, en la incidencia de nefropatía por contraste (11 pacientes [9,2 %] frente a 18 pacientes [15 %]; p = 0,137), considerando la definición previamente descrita de NIC.
Las variables intraoperatorias, incluido el volumen de contraste administrado (106,28 ± 36,4 frente a 115,35 ± 30,8; p = 0,885), no difieren significativamente entre los grupos (Tabla II). Los valores posoperatorios se resumen en la tabla III.
No obstante, sí se hallaron diferencias significativas en creatinina y urea sérica (1,46 ± 0,3 frente a 1,03 ± 0,5; p < 0,001; 61,06 ± 27,5 frente a 43,78 ± 12,9; p = 0,003), tasa de filtración glomerular estimada (56,37 ± 23,4 frente a 72,85 ± 17,7; p = 0,004) y hematocrito (34,99 ± 5,1 frente a 38,90 ± 5,2; p = 0,030) a los 30 días a favor del grupo preacondicionado, sin variación estadística entre los grupos durante el inmediato posoperatorio (24-48 h) (Tabla IV).
En un análisis de subgrupos, se compararon exclusivamente los pacientes de alto riesgo (marcador Mehran > 11) que desarrollaron NIC durante el periodo posoperatorio inmediato. Se obtuvieron 4 pacientes con NIC, todos los cuales se habían asignado aleatoriamente en el grupo precondicionado. Ninguno de los dos pacientes de alto riesgo asignados aleatoriamente en el grupo de control sufrió NIC (p = 0,014).
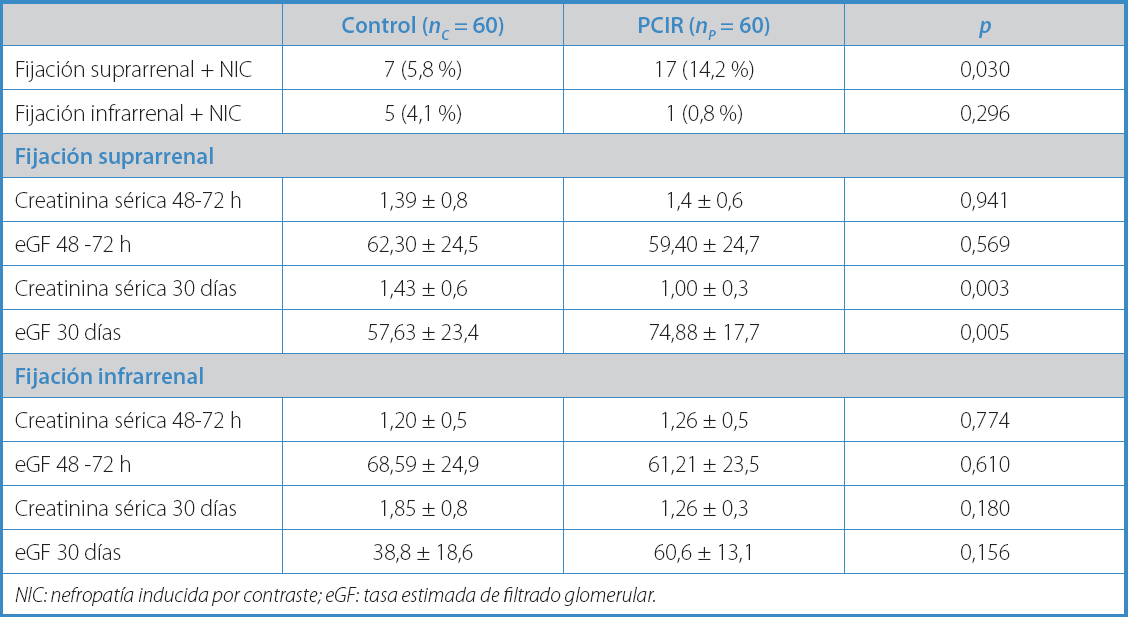
Se creó otro subgrupo según el tipo de fijación de la endoprótesis. En un primer análisis, las endoprótesis se ordenaron según la casa comercial y no se observaron diferencias significativas entre los brazos del estudio (p = 0,843). Sin embargo, las endoprótesis de fijación suprarrenal fueron mucho más frecuentes en ambos grupos (104 frente a 12; p = 0,034). Las endoprótesis torácicas se excluyeron de este subanálisis. Con respecto a la función renal, este nuevo análisis no mostró diferencias significativas entre los brazos del estudio en creatinina sérica o eGF a las 48 horas. Por otro lado, se observó una reducción significativa de la creatinina sérica y una mejora del eFG en aquellos pacientes precondicionados con fijación suprarrenal frente a los del brazo control a los 30 días (Tabla VI).
DISCUSIÓN
El objetivo de este estudio fue evaluar el impacto del PCIR en la incidencia de NIC en pacientes sometidos a EVAR de forma electiva. En este caso, la incidencia de CIN varió entre el grupo C y el grupo P, aunque esa diferencia no fue clínicamente significativa.
Posiblemente, las tasas más altas de nefropatía en el grupo P pueden deberse a que hay más pacientes clasificados como de alto riesgo según la escala de Mehran (18). Dado que ambos brazos del estudio eran inicialmente comparables (Tabla I), se realizó un análisis de la incidencia de nefropatía por subgrupos de riesgo. Esto reveló solo 6 pacientes con una puntuación de Mehran > 11. Es posible que un número tan pequeño diera lugar a una aleatorización subóptima.
La incidencia real de nefropatía por medio de contraste en pacientes sometidos a cirugía EVAR electiva se desconoce debido a que no existe una definición ampliamente aceptada que se utilice de manera consistente en la literatura (1). Por tanto, la incidencia documentada de NIC varía del 8,5 % al 28 %, según la serie (1,11,19).
La búsqueda en PubMed utilizando los términos reparación de aneurisma endovascular (términos MeSH) y preacondicionamiento isquémico (términos MeSH) dio como resultado un artículo publicado por Walsh y cols. en 2009 (14) que incluía específicamente la población diana de nuestro estudio. También se encontró un metaanálisis reciente de Stather y cols. (15) que incluía todas las cirugías aórticas, no solo los pacientes con EVAR.
El protocolo de preacondicionamiento en este estudio utilizó el miembro superior no dominante, ya que el riesgo de enfermedad arterial periférica es menor que en los miembros inferiores, y 4 ciclos de 5 minutos de isquemia y aplicadas en las 12 horas previas a la cirugía. En un protocolo de estudio publicado por Healy en 2015 (20) también se utilizó el miembro superior, aunque la masa muscular esquelética del miembro inferior es mayor que la del brazo. El miembro superior se ha utilizado más ampliamente para el preacondicionamiento debido a la resistencia potencial al PCIR en pacientes diabéticos y de edad avanzada (20-22).
Tradicionalmente, la única estrategia de nefroprotección demostrada como efectiva es la fluidoterapia (23), que se considera obligatoria en pacientes con filtrado glomerular estimado inferior a 60 ml / min / 1,73 m2 (24,25). En este estudio, la fluidoterapia se utilizó en ambos grupos para evitar sesgos derivados de su efecto nefroprotector ya conocido. Una revisión publicada en 2016 por Koch (26) muestra que todos los estudios aplicaban protocolos de hiperhidratación antes y después de la infusión de contraste utilizando solución acuosa de cloruro de sodio al 0,9 % a razón de 1-4 ml/kg/h con diferencias en la duración.
En este estudio, los biomarcadores de función renal utilizados fueron la creatinina sérica y urinaria, la tasa de filtración glomerular estimada y la relación albúmina-creatinina urinaria. Recientemente se han descrito numerosos biomarcadores de la función renal y se ha intentado su incorporación a la práctica clínica habitual (27). A pesar de sus inconvenientes (8), la creatinina sérica sigue siendo un biomarcador de uso universal para la función renal (28).
Después de 30 días de seguimiento, el grupo precondicionado presentó creatinina y urea séricas significativamente más bajas y una eFG aumentada. La mayor parte de la literatura sobre la PCIR se centra en su potencial como medida de protección inmediata frente a la disfunción renal, por lo que la cuantificación del biomarcador renal suele detenerse a las 48-72 horas (29). Otros estudios continúan el seguimiento contabilizando los eventos cardiovasculares adversos mayores hasta los 12 meses (20 21), pero no se centran en la disminución de la función renal. Curiosamente, la revisión publicada por Koch (26) establece una reducción significativa de la morbimortalidad a las 6 semanas, incluido el exitus, la rehospitalización y la necesidad de diálisis. El efecto prolongado del PCIR puede justificarse por cambios epigenéticos (30) y conformacionales en los cromosomas (31), así como por procesos moleculares (27,30) e histológicos en el riñón, que desencadenan mecanismos de protección/reparación de los tejidos encaminados a reducir la reacción inflamatoria provocada por la isquemiareperfusión.
Los casos de NIC combinados con eventos ateroembólicos presentan peor pronóstico (11,32). El deterioro de la función renal observado a los 30 días de seguimiento en el grupo C de este estudio podría ser el resultado de la NIC y de microembolias. En el grupo P se observó una evolución significativamente positiva de la creatinina, de la urea y de la función renal (33).
Causas de la microembolia y del empeoramiento a largo plazo de la función renal después del EVAR son la fijación suprarrenal de la endoprótesis (34), la administración repetida de contraste durante el seguimiento (35,36) o incluso el tiempo quirúrgico (19). En este estudio, un análisis de subgrupos según la fijación de la endoprótesis mostró que el PCIR puede ser útil especialmente en casos con fijación suprarrenal, en los que la función renal se ve afectada principalmente a largo plazo.
En este estudio se observó una caída del hematocrito del 7,55 % ± 1,6 % en el grupo control y del l8,82 % ± 1,6 % en el grupo de preacondicionamiento durante las primeras 24 horas posteriores a la cirugía. La anemia en el posoperatorio de cirugía aórtica endovascular se debe principalmente al cambio de catéteres e introductores durante la cirugía (37). En el día 30 de seguimiento de nuestro estudio, la recuperación del hematocrito fue mayor en el grupo P.
Estudios experimentales han demostrado que incluso con niveles reducidos de hematocrito, los niveles de eritropoyetina en un riñón afectado por lesión por isquemiareperfusión permanecen bajos debido a una disminución en la sensibilidad al oxígeno circulante (38). Es posible que la evolución positiva de los niveles de hematocrito en pacientes sometidos a PCIR pudiera estar justificada por el efecto protector del preacondicionamiento sobre la lesión por isquemiareperfusión, que podría haber amortiguado la caída de la síntesis de eritropoyetina, lo que favorece la recuperación de los niveles de eritropoyetina y, por tanto, del hematocrito a largo plazo. Este ha-llazgo constituye la base de una hipótesis aún no descrita en la literatura, que podría ser objeto de futuros estudios.
Este estudio presenta varias limitaciones. En primer lugar, se realizó un preacondicionamiento en las 12 horas previas a la administración del contraste. Estudios experimentales muestran que el preacondicionamiento isquémico genera cambios a nivel molecular que producen un efecto protector sobre los tejidos, no solo a corto plazo, sino también a largo plazo (39). Es posible que los resultados de los niveles de creatinina sérica en el posoperatorio pudieran haber sido diferentes si el preacondicionamiento se hubiera realizado más de 12 horas antes de la administración de contraste. En segundo lugar, las poblaciones de control y de preacondicionamiento no mostraron diferencias significativas en cuanto al tipo de anestesia utilizada. Sin embargo, se sabe que existen ciertos anestésicos que pueden amortiguar el efecto del preacondicionamiento. Desafortunadamente, los estudios sobre este tema no abordan específicamente la nefropatía por contraste en pacientes sometidos a EVAR, por lo que los resultados no necesariamente pueden extrapolarse (40-42). Por último, este estudio no puede demostrar si existen diferencias raciales o de género, dado que la población incluida mayoritariamente fue caucásica y compuesta por varones.
CONCLUSIONES
En este estudio, el PCIR no reflejó un efecto significativo sobre la incidencia de NIC durante el periodo posoperatorio temprano en pacientes intervenidos de EVAR. Por otro lado, el grupo PCIR presentó una evolución favorable en creatinina y urea séricas, eGF y hematocrito a los 30 días de la cirugía, incluso en casos con fijación suprarrenal, lo que demostró ser una estrategia de nefroprotección sencilla y ampliamente disponible en pacientes tratados por EVAR.











 texto en
texto en