Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Archivos Españoles de Urología (Ed. impresa)
versión impresa ISSN 0004-0614
Arch. Esp. Urol. vol.63 no.7 sep. 2010
Desafíos quirúrgicos de las anomalías del desarrollo sexual
The surgical challenges of Disorders of Sex Development (DSD)
Daniela Gorduza, Isabelle Vidal, Jacques Birraux, Claire-Lise Gay, Delphine Deméde, Pierre-Yves Mure y Pierre Mouriquand
Departamento de Urología Pediátrica. Hospital Mére-Enfant. Groupement Hospitalier. Bron. Francia.
Dirección para correspondencia
RESUMEN
Las Anomalías del Desarrollo Sexual (ADS) siguen siendo un desafío fascinante para los pediatras, endocrinos, biólogos, psiquiatras, genetistas, radiólogos, cirujanos y para toda la sociedad. Este artículo busca destacar las controversias y cuestiones actuales de la reconstrucción genital en niños nacidos con genitales anormales. Se revisan las principales técnicas actuales de masculinización y feminización junto con sus progresos y sus problemas. Se discuten las herramientas de decisión utilizadas para asignar un género en algunos recién nacidos con ADS complejas mostrando que en el amanecer del tercer milenio, uno todavía no conoce por qué un niño es un niño y una niña es una niña.
Palabras clave: Anomalías del desarrollo sexual. Hipospadias. Disgenesia gonadal mixta. Hiperplasia adrenal congénita. Feminización. Masculinización.
SUMMARY
Disorders of Sex Development (DSD) remain a fascinating challenge for the paediatricians, endocrinologists, biologists, psychiatrists, geneticists, radiologists, surgeons and for the whole society. This article aims at highlighting the current controversies and questions met with genital reconstruction in children born with abnormal genitalia. The main current techniques of masculinization and feminization are reviewed with their progress and their problems. The tools of decision used to assign a gender in some newborns with complex DSD are discussed showing that at the dawn of the third millenium, one still does not know why a boy is a boy, and a girl is a girl.
Key words: Disorders of Sex Development. Hypospadias. Mixed Gonadal Dysgenesis. Congenital Adrenal Hyperplasia. Feminization. Masculinization.
Introducción
Las Anomalías del Desarrollo Sexual (ADS) presentan desafíos desde todas las perspectivas incluyendo la cirugía reconstructiva hacia el género masculino o femenino. La conferencia de consenso de Chicago en 2005 (1) es un intento de clasificar estas anomalías y de delinear los abordajes actuales y las controversias encontradas en su manejo (Tabla I). Las técnicas quirúrgicas son complejas y deberían ser sólo realizadas en pocos centros seleccionados en cada país ya que se trata de número limitado de pacientes y requieren una gran maestría de varios especialistas que deberían trabajar juntos. Endocrinos, genetistas, biólogos, psicólogos y cirujanos constituyen el entorno esencial alrededor de un/a niño/niña con una anomalía del desarrollo sexual. Un cirujano especializado en ADS debería estar familiarizado con al menos cinco grupos de pacientes que comparten algunas similitudes anatómicas aunque tengan diagnósticos muy distintos:

1) El hipospadias severo (ADS 46, XY), que puede definirse como un pene mal desarrollado con una división del cuerpo espongioso localizada en la mitad proximal de pene (Figura 1).

2) La disgenesia gonadal mixta (ADS 45,XO/46,XY) y algunas ADS 46,XX con genitales asimétricos, hipospadias severo, gónadas disgenéticas no descendidas y una cavidad mulleriana localizada detrás del conducto uretral (Figura 2).

3) Los pacientes con hiperplasia adrenal congenita 46,XX que requieren una operación de "desvirilizacion", que presentan una vagina insuficientemente desarrollada que se abre en la pared posterior de la uretra asociada con un gran tubérculo genital (Figura 3).

4) El pene con epispadias, que no pertenece al grupo de las ADS pero cuya corrección incluye una disección de las bandeletas neurovasculares hasta el glande y disección de los cuerpos cavernosos muy similar a la realizada en pacientes con hiperplasia adrenal congénita.
5) El síndrome de Rokitansky en el que a veces es necesaria una vaginoplastia de sustitución.
Las técnicas han sido descritas ampliamente con anterioridad (2-4). Nuestro objetivo es señalar los mayores desafíos y controversias a las que nos enfrentamos en las cirugías de masculinización y feminización.
Cirugía de masculinización
La cirugía de masculinización está esencialmente representada por la cirugía del hipospadias que incluye tres pasos principales:
1) Disección completa del aspecto ventral del pene (radius ventral) e identificación del grado de severidad del hipospadias. Éste paso permite la corrección de la curvatura ventral del pene en la mayoría de casos mediante la liberación de todos los tejidos ventrales hipoplásicos. En casos raros en nuestra experiencia, es necesaria la plicatura dorsal de la albugínea de los cuerpos cavernosos para corregir la incurvación del pene. Cuando es necesario, la plicatura de la túnica albugínea descrita por el grupo de Filadelfia (5-7), en el vértice de la curvatura, identificado mediante un test de erección, proporciona una corrección satisfactoria de la incurvación del pene. El mérito del grupo de Baskin ha sido demostrar que en la corporoplastia dorsal no es necesaria la separación de las bandeletas neurovasculares de la albugínea de los cuerpos cavernosos porque la línea media dorsal está prácticamente libre de fibras nerviosas.
2) Una vez corregida la incurvación del pene, la elección de la uretroplastia es esencial y realmente depende de la calidad de la placa uretral, la longitud de la uretra a reconstruir y del grado de hipoplasia de la misma, estrechamente relacionado con el nivel donde se divide el cuerpo espongioso. La cuestión central es: ¿Cómo es de segura a largo plazo una uretroplastia utilizando tejidos ventrales displásicos? Si la placa uretral es amplia y el tejido sano, muchos cirujanos harían una operación de Thiersch-Duplay (9) que tiene el mérito de utilizar únicamente tejido uretral.
Sin embargo, nuestra experiencia muestra que sólo unas pocas placas son adecuadas para esta operación. Lo siguiente es la TIP (tubularizad incised plate) o incisión y tubularización de la placa, operación descrita por Orkiszewski (10) y Snodgrass (11) que busca aumentar la anchura de la placa ureteral mediante una incisión longitudinal en la línea media de la misma. Estos autores refieren que la zona cruenta que se deja en el medio va a reepitelizar y a formar un conducto recubierto de urotelio. Aunque este procedimiento es fácil de realizar con una tasa de complicaciones a corto plazo razonablemente baja (12), su evolución a largo plazo necesita evaluación porque no está claro si la uretra reconstruida crece de forma satisfactoria.
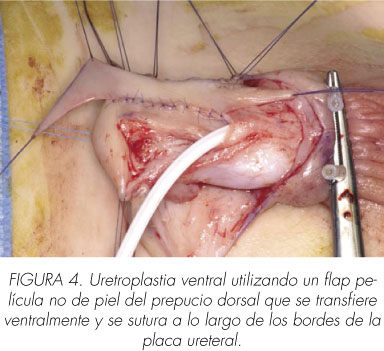
En nuestra experiencia no son raros los resultados tardíos inadecuados de la uretra reconstruida con las operaciones de Thiersch-Duplay y TIP, suscitando el interrogante sobre lo apropiado de utilizar exclusivamente tejidos ventrales displásicos para reconstruir la uretra que falta. Estas preocupaciones nos han llevado a favorecer la utilización de los tejidos dorsales en la uretroplastia con colgajo (13), que es una operación más sofisticada con una curva de aprendizaje más larga pero que da unos resultados a largo plazo razonablemente buenos (14) (Figura 4). Una de sus ventajas es traer ventralmente tejidos bien vascularizados con una plataforma que tiene un mejor balance proteico, lo que hace más probable que contribuya a la calidad de la cicatrización (15). Una crítica de esta técnica es el uso de tejidos no uretrales para reparar la uretra que falta. La misma crítica puede hacerse a la operación de Mathieu, que parece estar un poco desfasada actualmente aunque sus resultados a largo plazo son bastante satisfactorios (16) y comparables con los datos publicados de la TIP. También es una técnica fiable como intervención de rescate después de deshacerse el glande. La movilización uretral de Koff (17) es una técnica elegante (Figura 5) para recolocar el meato en la punta del glande mediante la movilización de toda la uretra peneana en casos primarios o reintervenciones. Esta operación tiene la ventaja de evitar la utilización de tejidos no uretrales y tiene pocas complicaciones en nuestra experiencia (18), siempre que la indicación esté bien seleccionada. La uretra distal debe estar sana porque si no el riesgo de estenosis del meato es significativo. En nuestra práctica, damos preferencia a esta operación cuando la longitud de la uretroplastia es corta (menor de 1,5 cm) y cuando la uretra distal circular está sana, es decir rodeada de esponjoso.

En los hipospadias más severos en los que todo el radio ventral es hipoplásico, la elección incluye varias técnicas: nuestras favoritas son la operación de Koyanagi (19) y su variante la intervención de Hayashi (20) (Figura 6). Consisten en la movilización completa y transferencia ventral de los tejidos laterales y el aspecto más interno del prepucio para reconstruir la placa uretral y posteriormente tubularizarla. Esta técnica proporciona un resultado cosmético excelente pero son comunes complicaciones como uretrocele o estenosis distal que conducen a un ajuste quirúrgico secundario en la mayoría de los casos (60% de reintervenciones en nuestra serie) (14, 21,22). Nuestra experiencia muestra que aunque la mayoría los pacientes necesiten dos intervenciones el resultado final es satisfactorio. Alternativamente, las intervenciones en dos etapas (Bracka (23)) utilizando un injerto de prepucio o mucosa oral son fiables con un mayor riesgo de estenosis proximal en la unión entre la uretra nativa y la reconstruida.

Los tejidos de sustitución como la mucosa bucal tienen su mejor indicación en reintervenciones en las que los tejidos locales son cicatriciales o insuficientes.
Entre las operaciones utilizadas comúnmente en reintervenciones, la uretroplastia dorsal es una técnica adicional útil en el armamentario. Consiste en dividir la placa ureteral como se ha descrito en la técnica TIP y poner un injerto libre de mucosa bucal o prepucio. En nuestra experiencia, al tubo de Asopa-Duckett le quedan pocas indicaciones cuando la placa ureteral no se puede preservar y cuando no hay tejido prepucial disponible. Aunque las tasas comunicadas de complicaciones son muy variables (24-26), estas operaciones utilizan anastomosis circulares que tienen un mayor riesgo de estenosis ureteral.
3) El tercer paso de esta cirugía es la reconstrucción del radio ventral del pene lo que incluye meatoplastia, plastia de glande y recubrimiento con una funda de piel. A algunos cirujanos les gusta reconstruir el prepucio cuando no se ha utilizado para la uretroplastia. Nosotros preferimos la circuncisión porque un prepucio reconstruido siempre queda asimétrico y es difícil de movilizar.
Cualquiera que sea la operación utilizada, puede ser necesario preparar el pene con un tratamiento hormonal perioperatorio con tres objetivos principales: aumentar el tamaño del pene, disminuir la severidad del hipospadias (27,28) e incrementar el aporte sanguíneo tisular especialmente en reintervenciones. Nuestra experiencia mostró que el tratamiento androgénico perioperatorio menos de tres meses antes de la cirugía aumenta significativamente la tasa de complicaciones de la cicatrización (14, 29,30). Esto se explica por el papel de los andrógenos que enlentecen el proceso de cicatrización de la piel como han demostrado varias complicaciones (31-34). Nosotros aconsejaríamos por lo tanto utilizar andrógenos más de seis meses antes de la cirugía cuando sean necesarios.
La extirpación laparoscópica de los remanentes mullerianos podría estar indicada cuando el paciente refiere disuria e infecciones urinarias recurrentes (35,36).
Se considerará cirugía gonadal cuando el testículo no esté en el escroto (orquiopexia en una o dos etapas (37,38)) o cuando existe un riesgo significativo de tumores (orquiectomía (39)) lo cual depende del diagnóstico de anomalía del desarrollo sexual.
Durante años, la feminización era la elección por defecto en casos de ADS compleja (40) porque la creación de un conducto penetrante era quirúrgicamente más simple que construir un falo. Sin embargo, se han hecho grandes progresos en la faloplastia especialmente con los trabajos hechos por de Castro y Hoebecke (41-43). Es una operación difícil que debería restringirse para casos específicos remitidos a discusión colegiada.
Cirugía de feminización
Estas técnicas se utilizan principalmente en ADS de tipo hiperplasia adrenal congénita 46,XX, ADS 45,XO/46,XY, a algunas 46,XY orientadas al género femenino y en pacientes con ADS ovotesticular que son mayoritariamente educadas como mujeres. La operación incluye tres pasos principales (Figuras 7 A-G):
1) La conexión de la cavidad mulleriana (vagina) al suelo pélvico (44). La dificultad de este paso está relacionada con el nivel de confluencia de la unión entre la vagina y la pared uretral. Si la confluencia está a menos de dos centímetros del suelo pélvico, se utiliza con frecuencia la vaginoplastia de arriba abajo que exterioriza la uretra hasta arriba en la confluencia. Se describe como movilización del seno urogenital parcial o total (PUM, TUM (45-49)). El tejido uretral exteriorizado se utiliza para reconstruir el introito vaginal. Esta técnica tiene la ventaja de crear un introito recubierto de mucosa y separar claramente la vagina del meato uretral. Una de las críticas es el daño potencial de los nervios en relación con la movilización, que podría afectar a la continencia a largo plazo de la niña (50). Alternativamente, cuando hay una distancia corta entre el suelo del periné y la confluencia preferimos una operación de abajo arriba (51). El fondo de saco vaginal se moviliza lo mínimo. Los tejidos uretrales que forman la placa ureteral situados en el aspecto ventral del tubérculo genital se utilizan para reconstruir el introito y separar y llevar a la superficie la uretra y el meato vaginal. Esta técnica que crea un infundíbulo con mucosa debería, siendo optimistas, reducir el número de revisiones del introito frecuentemente necesarias al llegar a la pubertad cuando se utilizan las técnicas clásicas.
Cuando la confluencia está alta, cerca del esfínter o del cuello vesical, la movilización de la copa vaginal pueda hacerse bien por un abordaje sagital posterior (Peña (52,53)), o más frecuentemente en nuestros días por vía laparoscópica (54). El abordaje transtrigonal descrito por Passerini (55) se utiliza raras veces.
En el síndrome de Rockitansky o en el síndrome de falta de sensibilidad completa a andrógenos la mayoría de los pacientes pueden beneficiarse de las dilataciones vaginales (56). Algunos de ellos requieren una sustitución vaginal para la cual se han descrito varias operaciones, principalmente en pacientes adultos: los injertos de piel de grosor reducido de Mcindoe (57), la expansión tisular (58), el flap cutáneo rotado (59), los flaps de amnios (60) y peritoneo (61), la técnica de Vechietti's (62,63), la reconstrucción vaginal intestinal (64). Hay pocas publicaciones sobre estas técnicas en niños (65,66). Nuestra experiencia se basa en la utilización del colon sigmoide (64,67).
2) Una de las principales controversias de los procedimientos de feminización es la reducción de clítoris. Varios estudios muestran que la cirugía de reducción puede afectar a la sensibilidad del clítoris y por lo tanto aconsejan no tocarlo si es menor de tres centímetros de longitud (68,69). Con el trabajo realizado por el equipo de Baskin (70) y las lecciones aprendidas de la cirugía del epispadias (71) y del hipospadias (72), la disección de los cuerpos cavernosos y la preservación de los haces neurovasculares parece ser mucho más segura aunque uno tiene que esperar 15 o 20 años antes de evaluar el resultado de estas nuevas técnicas. La escisión completa de los cuerpos cavernosos después de la disección circunferencial de los haces neurovasculares tiene el mérito de evitar la clásica caverno-cavernosostomía utilizada en técnicas anteriores y evitar el recrecimiento del tuberculo genital durante el periodo crítico de la adolescencia cuando los pacientes con frecuencia son menos cumplidores con su tratamiento hormonal sustitutivo. La preservación del aporte sanguíneo del clítoris y su inervación es de lejos más extensa con la disección circunferencial similar a la técnica descrita por Ransley para la corrección del epispadias (datos no publicados). El anclaje del clítoris en los muñones cavernosos da un excelente resultado cosmético y evita el largo deslizamiento mucoso que se apreciaba con frecuencia en las técnicas anteriores. Alternativamente, algunos autores han sugerido excavar el tejido esponjoso localizado dentro de los cuerpos para reducir su volumen y preservar las bandeletas neurovasculares (73).
3) El último paso de esta reconstrucción femenina es la formación de los labios menores y la reducción y rebaje de los labios mayores, la cual da una apariencia perineal femenina satisfactoria (74-76).
El desafío de la asignación de género
Los recién nacidos con genitales anormales provocan muchas interrogantes desafiantes que afectan a médicos y padres. Paradójicamente, el paciente no es parte activa de la discusión esencial sobre su identidad de género, es decir su identidad social. La decisión de un género en el periodo neonatal ha sido cuestionada pues algunos pacientes sienten que los doctores no deberían imponer una elección sin una mayor comprensión de la identidad sexual individual. El desafío en el recién nacido es dar una identidad social o de género a un individuo sin saber cuál será su identidad sexual individual o su identidad de comportamiento. Esta situación ha llevado a algunos especialistas a sugerir posponer cualquier decisión hasta que el niñ@ exprese más claramente su identidad sexual individual (77). Esta opinión ha levantado muchas controversias y en la conferencia de consenso sobre ADS de Chicago en 2005 (78) se dio preferencia a la asignación temprana de género en los casos más complejos de anomalías de genitales para evitar situaciones insoportables para los padres (79).
La decisión tomada por el equipo especialistas se basa en cuatro grupos de indicadores:
1) Los perfiles hormonal, genético y tisular del niño lo que podría llamarse el "sexo interior".
2) Anatomía de los genitales, es decir la talla del tubérculo genital y la presencia de una cavidad mulleriana representan el "sexo externo" lo cual es la parte visible del iceberg. La talla futura del paciente debería también ser un criterio significativo para decidirse por un género femenino si la talla futura se espera que sea corta.
3) También es necesario evaluar la capacidad potencial del paciente para tener relaciones sexuales e hijos, y se puede definir como el "sexo funcional".
4) Quizás el indicador más importante viene del medio cultural y educativo del niño/a y representa el "sexo social". No se puede hacer una asignación de género sin una comprensión completa y la aceptación por parte de los padres, conociendo el hecho de que su opinión está influenciada de forma marcada por las palabras de los médicos. Los sentimientos de los padres y especialmente de la madre sobre la situación son de la máxima importancia para tomar la decisión final.
Pocas publicaciones comunican los resultados a largo plazo de la cirugía de las ADS. La literatura es un poco más prolífica para la cirugía del hipospadias que para la de feminización y está bastante más basada en opiniones, en impresiones que en evidencia. Los datos recogidos de pacientes o especialistas basados en la medicina observacional son más subjetivos que objetivos de la que mayormente se refieren a calidad de vida e integración en la sociedad. Aunque se han hecho progresos técnicos en ambos tipos de cirugía, la reconstrucción a fondo de los genitales tanto en varones como hembras lleva a menudo a resultados funcionales y cosméticos pobres con pacientes frustrados. Desde hace varios años, se están haciendo esfuerzos multicéntricos para mejorar nuestra comprensión y manejo de estas situaciones complejas con un abordaje mejor y más consensuado de los factores determinantes potenciales que pueden afectar la construcción de la identidad sexual individual.
Agradecimientos
A todo el equipo de ADS de Lyon. Endocrinos: Marc Nicolino, Pierre Chatelain, Michel David; Biólogos: Yves Morel, Véronique Tardy, Ingrid Plotton, Maguelone Forest, Marie-Thérése Zabot; Genetistas: Patrick Edery, Massimilio Rossi, Marianne Till; Radiólogos: Jean-Pierre Pracros, Laurent Guibaud; Patólogos: Frédérique Dijoud, Rolande Bouvier; Psiquiatras y psicólogos: Jean-Yves Tamet, Corinne Chich.
Bibliografía y lecturas recomendadas (*lectura de interés y **lectura fundamental)
**1. Hughes IA, Houk C, Ahmed SF, Lee PA. Consensus statement on management of intersex disorders. J Pediatr Urol 2006;2(3):148-62. [ Links ]
*2. Mouriquand P, Deméde D, Gorduza D, Mure P-Y. Hypospadias. In Pediatric Urology 2nd Edition. Gearhart, Rink, Mouriquand Editors. Saunders Elsevier Publishers 2009. pp.526-543. [ Links ]
*3. Yerkes EB, Rink RC. Surgical management of female genital anomalies, disorders of sexual development, urogenital sinus, and cloacal anomalies. In Pediatric Urology 2nd Edition. Gearhart, Rink, Mouriquand Editors. Saunders Elsevier Publishers 2009. pp.476-499. [ Links ]
4. Hinman F, Baskin LS. Hinman's Atlas Of Pediatric Urologic Surgery 2nd ed, editor: Saunders; 2008. [ Links ]
*5. Baskin LS, Duckett JW. Dorsal tunica albuginea plication for hypospadias curvature. J Urol 1994;151(6):1668-71. [ Links ]
*6. Duckett JW. The island flap technique for hypospadias repair. Urol Clin North Am 1981;8(3):503-11. [ Links ]
7. Baskin LS, Duckett JW, Lue TF. Penile curvature. Urology 1996 Sep;48(3):347-56. [ Links ]
8. Baskin LS. Fetal genital anatomy reconstructive implications. J Urol 1999;162(2):527-9. [ Links ]
9. Duplay S. De l'hypospade penoscrotal et de son traitement chirurgical. Arch Gen Med 1874;1:613-57. [ Links ]
*10. Orkiszewski M. Repair of mild hypospadias. Z Kinderchir 1989 Feb;44(1):47-9. [ Links ]
*11. Snodgrass W. Tubularized, incised plate urethroplasty for distal hypospadias. J Urol 1994; 151(2):464-5. [ Links ]
12. Snodgrass W, Koyle M, Manzoni G, Hurwitz R, Caldamone A, Ehrlich R. Tubularized incised plate hypospadias repair for proximal hypospadias. J Urol 1998 Jun;159(6):2129-31. [ Links ]
13. Elder JS, Duckett JW, Snyder HM. Onlay island flap in the repair of mid and distal penile hypospadias without chordee. J Urol 1987;138(2):376-9. [ Links ]
*14. de Mattos e Silva E, Gorduza DB, Catti M, Valmalle AF, Demede D, Hameury F, et al. Outcome of severe hypospadias repair using three different techniques. J Pediatr Urol 2009;5(3):205-11; discussion 12-4. [ Links ]
15. Morera A, Chauvin M, Asensio M, Valmalle A, Mouriquand P. Is hypospadias due to a metalloproteinase overactivity? ESPU; Regensburg, Germany 2004. [ Links ]
16. Minevich E, Pecha BR, Wacksman J, Sheldon CA. Mathieu hypospadias repair: experience in 202 patients. J Urol 1999;162(6):2141-2; discussion 2-3. [ Links ]
*17. Koff SA. Mobilization of the urethra in the surgical treatment of hypospadias. J Urol 1981;125(3):394-7. [ Links ]
18. Paparel P, Mure PY, Garignon C, Mouriquand P. [Koff's urethral mobilization: report of 26 hypospadias presenting a distal division of the corpus spongiosum]. Prog Urol 2001;11(6):1327-30. [ Links ]
*19. Koyanagi T, Matsuno T, Nonomura K, Sakakibara N. Complete repair of severe penoscrotal hypospadias in 1 stage: experience with urethral mobilization, wing flap-flipping urethroplasty and "glanulomeatoplasty". J Urol 1983 ;130(6):1150-4. [ Links ]
*20. Hayashi Y, Kojima Y, Mizuno K, Nakane A, Kohri K. The modified Koyanagi repair for severe proximal hypospadias. BJU Int 2001;87(3):235-8. [ Links ]
*21. Catti M, Demede D, Valmalle A-F, Mure P-Y, Hameury F, Mouriquand P. Management of severe hypospadias. Indian J Urol 2008;24(2):233-40. [ Links ]
*22. Catti M, Lottmann H, Babloyan S, Lortat-Jacob S, Mouriquand P. Original Koyanagi urethroplasty versus modified Hayashi technique: outcome in 57 patients. J Pediatr Urol 2009;5(4):300-6. [ Links ]
*23. Bracka A. Hypospadias repair: the two-stage alternative. Br J Urol 1995;76 Suppl 3:31-41. [ Links ]
*24. Kolon TF, Gonzales ET, Jr. The dorsal inlay graft for hypospadias repair. J Urol 2000;163(6): 1941-3. [ Links ]
25. Asanuma H, Satoh H, Shishido S. Dorsal inlay graft urethroplasty for primary hypospadiac repair. Int J Urol 2007;14(1):43-7. [ Links ]
26. Schwentner C, Gozzi C, Lunacek A, Rehder P, Bartsch G, Oswald J, et al. Interim outcome of the single stage dorsal inlay skin graft for complex hypospadias reoperations. J Urol 2006;175(5):1872-6; discsussion 6-7. [ Links ]
*27. Koff SA, Jayanthi VR. Preoperative treatment with human chorionic gonadotropin in infancy decreases the severity of proximal hypospadias and chordee. J Urol 1999;162(4):1435-9. [ Links ]
28. Husmann DA. Microphallic hypospadias-the use of human chorionic gonadotropin and testosterone before surgical repair. J Urol 1999;162(4):1440-1. [ Links ]
**29. Mouriquand P, Gorduza D, Gay C, de Mattos E Silva E, Demede D, Hameury F, Mure P-Y, et al. Androgen stimulation prior to hypospadias surgery increases the rate of healing complications. AAP National Conference; Washington 2009. [ Links ]
30. Gorduza D, de Mattos e Silva E, Gay C, Catti M, Valmalle A, Demede D, Mure P-Y;, Mouriquand P. Hypospade sévère: suivi à long terme de 3 techniques chirurgicales différentes. Angers, SFCP 2009. [ Links ]
**31. Gilliver SC, Ashworth JJ, Ashcroft GS. The hormonal regulation of cutaneous wound healing. Clin Dermatol 2007;25(1):56-62. [ Links ]
32. Gilliver SC, Ashworth JJ, Mills SJ, Hardman MJ, Ashcroft GS. Androgens modulate the inflammatory response during acute wound healing. J Cell Sci 2006;119(Pt 4):722-32. [ Links ]
33. Gilliver SC, Ruckshanthi JP, Atkinson SJ, Ashcroft GS. Androgens influence expression of matrix proteins and proteolytic factors during cutaneous wound healing. Lab Invest 2007;87(9):871-81. [ Links ]
34. Gilliver SC, Wu F, Ashcroft GS. Regulatory roles of androgens in cutaneous wound healing. Thromb Haemost 2003;90(6):978-85. [ Links ]
35. Marcus KA, Halbertsma FJ, Picard JY, Otten BJ. A visual pitfall: persistent Mullerian duct syndrome (PMDS). Acta Paediatr 2008;97(1):129-32. [ Links ]
36. Vandersteen DR, Chaumeton AK, Ireland K, Tank ES. Surgical management of persistent mullerian duct syndrome. Urology 1997;49(6):941-5. [ Links ]
37. Backer L, Silver R, Docimo S. Cryptorchidism. In: J Gearhart RRPM, editor. Pediatric Urology 1ed. Philadelphia: W.B.Saunders 2001. p. 738-53. [ Links ]
38. Mouriquand PD. Undescended testes in children: the paediatric urologist's point of view. Eur J En-docrinol 2008;159 Suppl 1:S83-6. [ Links ]
*39. Joseph D. Gonadal Tumors in DSD Dialogues in Ped Urol 2008 august;29(6):7-8. [ Links ]
*40. Reiner WG. Psychosexual development in genetic males assigned female: the cloacal exstrophy experience. Child Adolesc Psychiatr Clin N Am 2004;13(3):657-74, ix. [ Links ]
*41. De Castro R, Merlini E, Rigamonti W, Macedo A, Jr. Phalloplasty and urethroplasty in children with penile agenesis: preliminary report. J Urol 2007;177(3):1112-6; discussion 7. [ Links ]
42. Lumen N, Monstrey S, Ceulemans P, van Laecke E, Hoebeke P. Reconstructive surgery for severe penile inadequacy: phalloplasty with a free radial forearm flap or a pedicled anterolateral thigh flap. Adv Urol 2008:704343. [ Links ]
*43. Lumen N, Monstrey S, Selvaggi G, Ceulemans P, De Cuypere G, Van Laecke E, et al. Phalloplasty: a valuable treatment for males with penile insufficiency. Urol, 2008;71(2):272-6; discussion 6-7. [ Links ]
*44. Fortunoff S, Lattimer JK, Edson M. Vaginoplasty Technique for Female Pseudohermaphrodites. Surg Gynecol Obstet 1964;118:545-8. [ Links ]
*45. Rink RC, Metcalfe PD, Kaefer MA, Casale AJ, Meldrum KK, Cain MP. Partial urogenital mobilization: A limited proximal dissection. J Pediatr Urol 2006;2(4):351-6. [ Links ]
46. Kalfa N, Liu B, Cao M, Vilella M, Hsieh M, Baskin LS. 3-dimensional neuroanatomy of the human fetal pelvis: anatomical support for partial urogenital mobilization in the treatment of urogenital sinus. J Urol 2008;180(4 Suppl):1709-14; discussion 14-5. [ Links ]
47. Hamza AF, Soliman HA, Abdel Hay SA, Kabesh AA, Elbehery MM. Total urogenital sinus mobilization in the repair of cloacal anomalies and congenital adrenal hyperplasia. J Pediatr Surg 2001;36(11):1656-8. [ Links ]
48. Jenak R, Ludwikowski B, Gonzalez R. Total urogenital sinus mobilization: a modified perineal approach for feminizing genitoplasty and urogenital sinus repair. J Urol 2001;165(6 Pt 2):2347-9. [ Links ]
*49. Ludwikowski B, Oesch Hayward I, Gonzalez R. Total urogenital sinus mobilization: expanded applications. BJU Int 1999;83(7):820-2. [ Links ]
50. Davies MC, Crouch NS, Woodhouse CR, Creighton SM. Congenital adrenal hyperplasia and lower urinary tract symptoms. BJU Int 2005;95(9):1263-6. [ Links ]
51. Mure PY, Gelas T, Ripepi M, Hoch M, Mouriquand P. [Surgical management of congenital adrenal hyperplasia in young girls]. Prog Urol 2003;13(6):1381-91. [ Links ]
52. Pena A, Filmer B, Bonilla E, Mendez M, Stolar C. Transanorectal approach for the treatment of urogenital sinus: preliminary report. J Pediatr Surg 1992;27(6):681-5. [ Links ]
*53. Rink RC, Pope JC, Kropp BP, Smith ER, Jr., Keating MA, Adams MC. Reconstruction of the high urogenital sinus: early perineal prone approach without division of the rectum. J Urol 1997;158(3 Pt 2):1293-7. [ Links ]
54. Darai E, Ballester M, Bazot M, Paniel BJ. Laparoscopic-assisted uterovaginal anastomosis for uterine cervix atresia with partial vaginal aplasia. J Minim Invasive Gynecol 2009;16(1):92-4. [ Links ]
*55. Passerini-Glazel G. Feminizing genitoplasty. J Urol 1999;161(5):1592-3. [ Links ]
*56. Frank R. The formation of artificial vagina without operation. Am J Obstet Gynecol 1938;35:1053-5. [ Links ]
57. McIndoe A. The treatment of congenital absence and obliterative conditions of the vagina. Br J Plast Surg 1950;2(4):254-67. [ Links ]
58. Chudacoff RM, Alexander J, Alvero R, Segars JH. Tissue expansion vaginoplasty for treatment of congenital vaginal agenesis. Obstet Gynecol 1996;87(5 Pt 2):865-8. [ Links ]
59. Becker DW, Jr., Massey FM, McCraw JB. Musculocutaneous flaps in reconstructive pelvic surgery. Obstet Gynecol 1979 Aug;54(2):178-83. [ Links ]
60. Ashworth MF, Morton KE, Dewhurst J, Lilford RJ, Bates RG. Vaginoplasty using amnion. Obstet Gynecol 1986;67(3):443-6. [ Links ]
61. Sheth NP, Chainani MS, Sheth SN. Vaginoplasty from peritoneal tube of Douglas' pouch for congenital vaginal agenesis. Eur J Pediatr Surg 2003;13(3):213-4. [ Links ]
62. Fedele L, Busacca M, Candiani M, Vignali M. Laparoscopic creation of a neovagina in Mayer-Rokitansky-Kuster-Hauser syndrome by modification of Vecchietti's operation. Am J Obstet Gynecol 1994;171(1):268-9. [ Links ]
*63. Vecchietti G. [Creation of an artificial vagina in Rokitansky-Kuster-Hauser syndrome]. Attual Ostet Ginecol 1965;11(2):131-47. [ Links ]
64. Baldwin JF. The Formation of an Artificial Vagina by Intestinal Trransplantation. Ann Surg 1904;40(3):398-403. [ Links ]
*65. Hensle TW, Reiley EA. Vaginal replacement in children and young adults. J Urol 1998;159(3):1035-8. [ Links ]
66. Hitchcock RJ, Malone PS. Colovaginoplasty in infants and children. Br J Urol 1994;73(2):196-9. [ Links ]
67. Urbanowicz W, Starzyk J, Sulislawski J. Laparoscopic vaginal reconstruction using a sigmoid colon segment: a preliminary report. J Urol 2004;171(6 Pt 2):2632-5. [ Links ]
**68. Crouch NS, Liao LM, Woodhouse CR, Conway GS, Creighton SM. Sexual function and genital sensitivity following feminizing genitoplasty for congenital adrenal hyperplasia. J Urol 2008;179(2):634-8. [ Links ]
69. Crouch NS, Minto CL, Laio LM, Woodhouse CR, Creighton SM. Genital sensation after feminizing genitoplasty for congenital adrenal hyperplasia: a pilot study. BJU Int 2004;93(1):135-8. [ Links ]
*70. Baskin LS, Erol A, Li YW, Liu WH, Kurzrock E, Cunha GR. Anatomical studies of the human clitoris. J Urol 1999;162(3 Pt 2):1015-20. [ Links ]
71. Hurwitz RS, Woodhouse CR, Ransley P. The anatomical course of the neurovascular bundles in epispadias. J Urol 1986;136(1):68-70. [ Links ]
*72. Perovic SV, Djordjevic ML, Kekic ZK, Djakovic NG. Penile surgery and reconstruction. Curr Opin Urol 2002;12(3):191-4. [ Links ]
73. Kogan SJ, Smey P, Levitt SB. Subtunical total reduction clitoroplasty: a safe modification of existing techniques. J Urol 1983;130(4):746-8. [ Links ]
74. Miranda ML, Oliveira-Filho AG, Lemos-Marini SH, Guerra G, Jr., Bustorff-Silva JM. Labioscrotal island flap in feminizing genitoplasty. J Pediatr Surg 2004;39(7):1030-3. [ Links ]
75. Farkas A, Chertin B, Hadas-Halpren I. 1-Stage feminizing genitoplasty: 8 years of experience with 49 cases. J Urol 2001;165(6 Pt 2):2341-6. [ Links ]
76. Roll MF, Kneppo C, Roth H, Bettendorf M, Waag KL, Holland-Cunz S. Feminising genitoplasty: one-stage genital reconstruction in congenital adrenal hyperplasia: 30 years' experience. Eur J Pediatr Surg 2006;16(5):329-33. [ Links ]
*77. Reiner WG, Kropp BP. A 7-year experience of genetic males with severe phallic inadequacy assigned female. J Urol 2004;172(6 Pt 1):2395-8; discussion 8. [ Links ]
78. Hughes IA. Disorders of sex development: a new definition and classification. Best Pract Res Clin Endocrinol Metab 2008;22(1):119-34. [ Links ]
**79. Cheikhelard A, Gapany C, Catti M, Mouriquand P. Potential determinant factors of sexual identity in ambiguous genitalia. J Pediatr Urol 2005;1(6):383-8. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Pierre Mouriquand
Departamento de Urología Pediátrica
Hospital Mére-Enfant
Groupement Hospitalier Est - 59,
boulevard Pinel
69500 Bron (Francia)
Aceptado para publicar: 27 de noviembre 2009.














