La epidemiología de la diabetes mellitus ha cambiado en los últimos años
La diabetes mellitus (DM) ha supuesto una creciente epidemia en las últimas décadas, dando veracidad a las predicciones del World Health Report en 1997 que estimaban un crecimiento progresivo de la enfermedad en los siguientes 20 años1. En 2012, la prevalencia de diabetes en EE. UU. era de un 14% (9% con diagnóstico conocido), pero como dato especialmente destacable y alarmante, existía un 38% de población en situación de prediabetes2. De continuar esta tendencia, uno de cada 3 adultos en EE. UU. será diabético en 20503. El incremento de la prevalencia de DM se ha producido especialmente a expensas de la DM tipo 2 (DM-2), debido a cambios en el estilo de vida y aumento de la obesidad4. En EE. UU., el coste de la DM en 2012 ascendió a 245.000 millones de dólares, incluyendo la repercusión derivada de la falta de productividad del paciente con complicaciones. Afortunadamente, si bien entre 1990 y 2010 la población diabética en EE. UU. creció un 27%, el porcentaje de complicaciones ligadas a la DM descendió: amputaciones, del 22,6% al 18,8%; insuficiencia renal crónica terminal, del 13,7% al 6,1%; infarto de miocardio, del 3,8% al 1,8%; e ictus, del 3,1% al 1,5%5, probablemente por un mejor diagnóstico y cuidado tanto de la DM como de sus complicaciones.
La globalización de la DM es un problema de salud mundial, con incrementos en la incidencia y prevalencia que incluyen la diabetes gestacional y la DM tipo MODY (Maturity Onset Diabetes of the Young), es decir, diabetes de la edad madura que se presenta en el joven6,7. En España, el estudio Di@bet.es, realizado en 100 centros con distribución geográfica amplia, encontró algún trastorno del metabolismo hidrocarbonado en cerca del 30% de la población estudiada8. La prevalencia de DM, ajustada por edad y sexo, fue del 13,8% (IC 95%: 12,8-14,7%), existiendo un 6% (IC 95%: 5,4-6,7%) de la población que desconocía que era diabética. La repercusión socioeconómica de la DM y sus complicaciones en nuestro país es importante, con un coste global estimado de 2.132€/paciente/año en presencia de complicaciones micro- y macrovasculares9. Una reducción de la enfermedad renal crónica estadio 5 (ERC-5) podría suponer un ahorro de entre 15 y 25 millones de euros en 3 años en Canarias10.
Un concepto más reciente: de «nefropatía diabética» a «enfermedad renal diabética»
Hasta fechas recientes, la nefropatía diabética se definía como la presencia de proteinuria igual o superior a 500 mg/día en un paciente diagnosticado de DM. Generalmente se acompaña de retinopatía, hipertensión arterial y progresión hacia la insuficiencia renal avanzada. La historia natural de la nefropatía difiere entre la DM-1 y DM-211. La DM-2 se diagnostica en ocasiones después de la hipertensión arterial o de la propia insuficiencia renal, presentando en la mayoría de las ocasiones solapamiento de lesiones de DM y nefroesclerosis, lo que hace difícil establecer el momento de inicio real de la DM-2.
La presencia de albuminuria patológica y la progresión hacia proteinuria han sido las formas más comunes de expresión clínica de la nefropatía. Sin embargo, en los últimos años se describe con frecuencia creciente la progresión hacia la insuficiencia renal sin desarrollar proteinuria12, postulándose así la existencia de un «fenotipo no proteinúrico»13. Tervaert et al.14 propusieron en 2010 una nueva clasificación histopatológica de las lesiones renales en la DM, insistiendo en el hallazgo de lesiones túbulo-intersticiales y/o vasculares en ausencia de lesiones glomerulares como forma inicial de afectación renal (tabla 1). Todo ello conduce a un cambio desde el concepto clásico de nefropatía diabética hacia un concepto más genérico de enfermedad renal diabética4.
Tabla 1 Clasificación histopatológica de la nefropatía en la diabetes mellitus
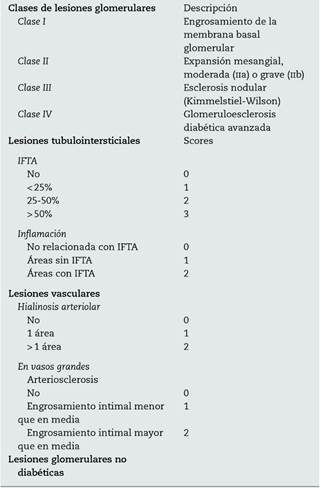
IFTA: fibrosis intersticial y atrofia tubular.
Modificada de Tervaert et al.14.
Insuficiencia renal avanzada en la diabetes mellitus: ¿ha aumentado la incidencia de enfermedad renal diabética en paralelo al incremento de la diabetes mellitus?
En 2005, con datos extrapolados de los estudios realizados hasta entonces, estimábamos que en España podían existir alrededor de 33.000 enfermos con DM-1 y cerca de 405.000 con DM-2 que podían padecer nefropatía en grado variable, desde microalbuminuria hasta ERC-515. Datos más recientes del registro de la Sociedad Española de Nefrología y de la Organización Nacional de Trasplante muestran que, aunque la DM continúa siendo la primera causa de ERC-5 que requiere tratamiento sustitutivo renal (TSR), en los últimos 5 años se ha estabilizado el porcentaje de pacientes incidentes que requieren dicha terapia y cuya causa primaria de insuficiencia renal es la DM. Así, los datos de incidencia anual en los años 2011-2015 oscilaban entre un 24-25%16. Parece pues observarse una estabilización de la DM como causa de ERC-5.
Estos datos se confirman en otros estudios, como el registro de End-Stage Renal Disease en EE. UU., que muestra una estabilización en la incidencia de ERC-5 diabética en 150 pacientes/pmp de 2002 a 200317, e incluso una reducción en el período 1996-200618. Por su parte, el registro australiano y neozelandés de Diálisis y Trasplante objetivó una estabilización similar por grupos de edad en los últimos 5 años19.
La aparente paradoja del no incremento en la insuficiencia renal terminal de causa diabética con tasas de incidencia y prevalencia crecientes de DM puede ser debida al diagnóstico más precoz de la DM y al mejor control de los factores de progresión de la nefropatía ligados a la intervención multifactorial y multidisciplinar. La implicación de los médicos de atención primaria y de otras especialidades, así como los documentos de consenso, tanto de DM y nefropatía en 1997 y 200220,21, como de ERC en 2008 y 201422,23, pueden haber desempeñado un papel decisivo en nuestro medio. Igualmente, el documento de consenso del manejo de la DM-2 en el paciente con ERC ha precisado los aspectos más cruciales del manejo compartido del paciente con DM y ERC24. En este sentido, el control adecuado de los factores de riesgo de progresión de la nefropatía, especialmente la hipertensión arterial y el metabolismo glucémico, son fundamentales. Por otra parte, una mayor precisión en la codificación de las enfermedades asociadas, así como de los datos histológicos en las biopsias renales, ayudan a disminuir los sesgos al considerar la causa primaria de la nefropatía.
La guía European Renal Best Practice sobre diabetes mellitus en la enfermedad renal crónica avanzada
El papel desempeñado por las sociedades científicas en la creación y aplicación de documentos de consenso y guías de práctica clínica para la detección, prevención y tratamiento integral del paciente con DM y ERC es fundamental. Los profesionales somos conscientes de que el manejo clínico del paciente con DM que ha desarrollado insuficiencia renal es complejo, entre otros factores por la dificultad de lograr un buen control glucémico. Existen actualmente numerosos grupos terapéuticos para un adecuado control metabólico, y hemos de tener presente que muchos de los fármacos se eliminan por vía renal. La importancia de evitar o minimizar los episodios de hipoglucemia es clave para reducir la morbimortalidad cardiovascular.
La American Diabetes Association publica anualmente las Clinical Practice Recommendations, en las que se introducen los consejos adecuados en función de la evidencia que se va generando en el manejo de la DM. En la Web de la Sociedad Española de Nefrología (http://www.senefro.org/readcontents.php?file=guias/58d8ead732db1.pdf) puede accederse a la adaptación al castellano de la versión resumida de la Clinical Practice Guideline on Management of patients with diabetes and chronic kidney disease stage 3B or higher (<45 mL/min) de la guía European Renal Best Practice (ERBP)24,25. La guía contiene recomendaciones basadas en el grado (1, fuerte; o 2, débil) y la calidad de la evidencia (A, alta; B, moderada; C, baja; o D, muy baja). Contiene 3 capítulos fundamentales, que contemplan aspectos relacionados con el manejo del control glucémico, el manejo de los factores de riesgo cardiovascular y de la cardiopatía isquémica, y la elección del TSR. Cabe resaltar la importancia concedida al manejo de la diana adecuada de HbA1c para evitar los episodios de hipoglucemia, la recomendación de cambios de dosis según el grupo farmacológico en función del estadio de ERC, así como el impacto de los diferentes agentes sobre mortalidad, episodios cardiovasculares, riesgo de hipoglucemia, cambios de HbA1c y adaptación de dosis en la ERC avanzada.
Como generalmente sucede con este tipo de documentos, la guía original se publicó en julio de 201526, habiendo surgido con posterioridad nuevos fármacos y evidencias de manejo compartido del enfermo con DM e insuficiencia renal. Entre ellos destacan los recientes resultados del ensayo EMPA-REG OUTCOME27, que aleatorizó a pacientes con DM-2 con filtrado glomerular estimado (FGe) >30 mL/min/1,73 m2 a empaglifozina, un inhibidor del cotransportador sodio-glucosa tipo 2, o placebo añadidos al tratamiento habitual, y por lo tanto, sus resultados serían aplicables a la población objeto de la guía ERBP. Inesperadamente, empaglifozina tuvo claras ventajas respecto a eventos cardiovasculares y supervivencia, y es muy posible que esto tenga repercusiones a corto plazo en próximas guías clínicas y en la práctica clínica.
Más recientemente, Wanner et al.28 han publicado los resultados del estudio EMPA-REG Renal, con los datos de los pacientes en el mismo ensayo clínico. La empagliflozina retrasó la progresión del daño renal y redujo el deterioro del FGe. Concretamente, se observó una reducción significativa de un 46% del riesgo relativo para el objetivo combinado de duplicación de la creatinina sérica, inicio de TSR o muerte debida a fallo renal. Uno de los factores más importantes que se ha propuesto como mecanismo para explicar estos beneficios renales está en probable relación con la disminución de la hiperfiltración glomerular. Posiblemente el efecto hemodinámico es la clave para explicar el beneficio de la empagliflozina en pacientes con DM-2, deterioro de la función renal y elevado riesgo cardiovascular.
Un aspecto novedoso de la guía es el énfasis en el uso de metformina como antidiabético de elección en todos los estadios de ERC. La guía recomienda su uso, con ajuste de dosis, hasta en FGe de 15 mL/min/1,73 m2 y no lo contraindica en pacientes en diálisis o con FGe <15 mL/min/1,73 m2. El argumento principal es que los beneficios de la metformina superan los riesgos de acidosis láctica, especialmente si se ajusta la dosis a la función renal y se instruye al paciente en los factores de riesgo. En este sentido, la guía es quizá la manifestación más extrema de una tendencia mundial hacia el uso de metformina en estadios avanzados de ERC. La American Diabetes Association, por su parte, indica que hay datos observacionales que sugieren que la metformina se puede usar de forma segura hasta FGe de 30-45 mL/min/1,73 m2, con ajuste de dosis, pero mantiene la ERC como una contraindicación29. La European Medicines Agency anunció en enero de 2016 que está revisando la seguridad y eficacia de metformina en la ERC, a petición de la agencia holandesa que sugirió que existían grandes diferencias entre países en las contraindicaciones de la metformina en función del FGe y que las restricciones más estrictas podrían no estar justificadas30. La Food and Drug Administration de EE. UU. emitió un comunicado de seguridad en abril de 2016 indicando que había revisado las instrucciones sobre el uso de metformina en la insuficiencia renal a fin de extender su uso a pacientes con FGe más reducido31. El nuevo etiquetado aconseja estimar el FG antes de prescribir metformina y luego de forma periódica, contraindica el fármaco cuando FGe <30 mL/min/1,73 m2, y no recomienda comenzarlo cuando el FGe es 30-45 mL/min/1,73 m2. Si el paciente ya tomaba metformina y el FGe baja por debajo de 45 mL/min/1,73 m2 hay que reevaluar el riesgo-beneficio, y si cae por debajo de 30 mL/min/1,73 m2, suspender el fármaco.
Conclusiones e implicaciones en el manejo actual de la enfermedad renal diabética
A pesar del incremento de la DM en la población general, parece existir una estabilización de la DM como causa fundamental de ERC avanzada que requiere inicio de TSR. La detección precoz, tanto de la DM como de sus complicaciones, incluyendo la enfermedad renal diabética, es crucial para disminuir la morbilidad, especialmente de origen cardiovascular, y la mortalidad, así como para mitigar el grave impacto socioeconómico de la enfermedad. Resulta igualmente vital reducir las complicaciones una vez que el paciente con DM ha iniciado TSR, siendo imperativo el manejo multifactorial y multidisciplinar integrado, así como conocer y aplicar los documentos de consenso y las guías de práctica clínica, que se van modificando en función de la evidencia generada. La guía ERBP sobre DM y ERC avanzada supone un nuevo paso en este proceso de mejora continua, aunque será preciso evaluar el impacto de la recomendación de ampliar la indicación de metformina a estadios más avanzados de insuficiencia renal mientras sigue formalmente contraindicada por agentes regulatorios, y es posible que sean necesarias actualizaciones a corto plazo, sobre todo en lo que respecta al empleo de inhibidores del cotransportador sodio-glucosa tipo 2.














