Introducción
El síndrome de piernas inquietas (SPI) es una entidad caracterizada por una necesidad incontrolable de mover los miembros, especialmente los inferiores, acompañada de molestias o sensaciones desagradables (como picor, hormigueo, dolor, sensación de estirar, etc.) en dichas extremidades, que aparecen después de un periodo de reposo y se alivian o desaparecen con el movimiento1,2.
Su diagnóstico es clínico y la prevalencia en la población general se sitúa entre el 5 y el 10%; es más frecuente en mujeres y en edades avanzadas de la vida3,4. El diagnóstico de SPI se asocia a alteraciones en la calidad de vida del paciente, fundamentalmente clínica depresiva o ansiosa, así como a un deterioro de la higiene de sueño con aparición de somnolencia diurna y fatiga. Algunos estudios señalan, incluso, una relación directa entre el SPI y un aumento de la mortalidad5-7.
Las lteraciones hipotalámicas de las células dopaminérgicas como respuesta a niveles elevados de algunos neurotransmisores, la reducción de la inhibición a nivel de córtex motor, la hiperreactividad del reflejo flexor espinal o alteraciones de reflejos troncales cerebrales han sido algunos de los diversos y complejos mecanismos neurológicos implicados en la fisiopatología de este síndrome8-10.
Desde el punto de vista etiológico, fundamentalmente existen las formas primarias o idiopáticas y las secundarias. En cuanto a las formas secundarias, existen multitud de etiologías descritas, si bien las más frecuentes son las asociadas a anemia con déficit de hierro, neuropatía diabética, enfermedades neurodegenerativas —como la esclerosis múltiple o la enfermedad de Parkinson— y a la presencia de enfermedad renal crónica en situaciones de uremia avanzadas11-13.
Con relación al SPI asociado a la uremia, muchas veces es un síndrome infradiagnosticado. Su prevalencia es variable y se estima entre un 12 y un 30%. Esta prevalencia resulta superior entre los pacientes incluidos en programas de terapia sustitutiva renal, fundamentalmente en hemodiálisis (HD)5,14,15. No obstante, los estudios publicados en la literatura son pocos, de pequeño tamaño y en algún caso con información contradictoria.
Actualmente, la terapia farmacológica de SPI se basa principalmente en el uso de agonistas dopaminérgicos no ergotamínicos14,15. Su principal ventaja, en comparación con el uso clásico de levodopa y gabapentina, radica principalmente en la presencia de menores efectos adversos a nivel gastrointestinal. Los más utilizados son pramipexol, ropinirol y, más recientemente, rotigotina16-18. Rotigotina, adicionalmente presenta un mejor control de la sintomatología, menor incidencia de efectos adversos y de potenciación paradójica de síntomas (augmentation effect) así como facilidad de administración y dosificación en el paciente en HD18.
Dada la potencial repercusión en la calidad de vida y las implicaciones médicas que conlleva su tratamiento, junto con la ausencia de series publicadas a nivel nacional con relación al SPI, pensamos que sería interesante realizar este estudio para describir la prevalencia de SPI en nuestra unidad de HD así como analizar los posibles efectos de la rotigotina sobre la sintomatología, la calidad de vida y la higiene del sueño de nuestros pacientes con SPI.
Material y métodos
Durante los meses de enero a abril de 2015 se realizó un estudio unicéntrico prospectivo de 12 semanas de duración en los pacientes en programa de HD periódica de nuestro centro diagnosticados de SPI. El estudio fue aprobado por el Comité de Ética e Investigación Clínica hospitalaria y realizado de acuerdo con las normas de la declaración de Helsinki.
Los criterios de inclusión fueron los siguientes: edad igual o superior a 18 años de edad, ser diagnosticados de SPI y otorgar el consentimiento informado. Los criterios de exclusión establecidos fueron: falta de consentimiento informado e incapacidad intelectual para contestar a las preguntas de los cuestionarios.
El programa de HD periódica de nuestro hospital distribuye a los pacientes principalmente en 6 grupos de 10-12 pacientes. Estos grupos realizan sesiones solo en la modalidad de HD de alto flujo con una duración de 3,5-4 h en días alternos (L-X-V o M-J-S), en unos horarios de mañana, mediodía (3,5 h) y tarde.
Se establecieron 2 fases comparativas de estudio con una duración de 6 semanas cada una. En la primera fase (fase 1) los pacientes en HD de nuestro centro fueron diagnosticados de SPI de acuerdo con los criterios clínicos internacionales del International Restless Leg Syndrome Study Group (IRLSSG, 2012)1. Todos los pacientes con SPI fueron evaluados por el mismo neurólogo de nuestro hospital. Los pacientes que reunían 4 criterios fueron diagnosticados de SPI. En la segunda fase (fase 2) se procedió a la administración de parches transdérmicos de rotigotina de forma progresiva durante las primeras 2 semanas (1 mg/día) y en caso de correcta tolerancia y ausencia de efectos adversos se progresó en la dosis diaria recibida (2 mg/día). Tras una sesión explicativa individualizada de la sistemática de administración, los parches transdérmicos de rotigotina se mantuvieron durante las 24 h, con rotación en los sitios de aplicación. En caso de requerir disminución de la dosis, esta se hizo de forma progresiva para evitar el efecto rebote de la sintomatología.
Al inicio del estudio se recogieron los principales datos demográficos (edad, sexo, etiología de la insuficiencia renal crónica, tiempo de permanencia en HD) y comorbilidades asociadas (diabetes mellitus, hipertensión arterial, vasculopatía periférica, cardiopatía isquémica, índice de comorbilidad de Charlson, tabaquismo, hábito enólico, toma de derivados de cafeína). Tanto al inicio como al final de cada una de las fases previamente establecidas, se analizaron los principales datos bioquímicos, la medicación habitual del paciente relacionada con el SPI, así como las características y datos de adecuación en HD (Kt/V, método 2.ª generación Daugirdas). Del mismo modo se analizaron las siguientes variables:
Grado de gravedad de los síntomas del síndrome de piernas inquietas y cuestionario específico de síntomas
Se determinó el grado de gravedad de los síntomas mediante la escala de gravedad (GRLS) establecida por el IRLSSG19 y la sintomatología en ambas extremidades inferiores mediante un cuestionario propio de síntomas específicos (QS). El GRLS es una encuesta validada con relación a la repercusión de la sintomatología del SPI en cada paciente. Consta de 10 preguntas con 5 posibles respuestas. Cada respuesta se puntúa de 0 a 4. La forma más sencilla de analizar es la suma de la puntuación total. A partir de 15 puntos, se considera sintomatología grave. A mayor puntuación, mayor gravedad. El QS valora mediante una escala cualitativa (1: nulo, 2-3: poco 4: bastante; 5: mucho) la presencia de los siguientes síntomas: dolor muscular, calambres, hormigueo, quemazón y entumecimiento.
Calidad de vida e higiene de sueño
La calidad de vida se evaluó mediante el cuestionario de salud homologado adaptado a SPI: John Hopkins RLS QoL (JH-QoL)20. Consta de 18 preguntas con 5 posibles respuestas y puntuación de 0 a 4. La forma más sencilla de analizar es la suma de la puntuación total. De forma global, a mayor puntuación, peor calidad de vida para SPI. Por último, la higiene del sueño fue evaluada mediante la encuesta validada SCOPA21. Se compone de 2 apartados. En el primero se valora el sueño nocturno. Consta de 6 cuestiones, 5 más específicas y valoradas desde 0 (no) hasta 3 (mucho) y una sexta de valoración global con 7 posibilidades desde 0 (muy mal) hasta 7 (muy bien). En el segundo apartado se valora la somnolencia diurna. Consta de 6 cuestiones específicas valoradas de 0 (nunca) a 3 (frecuentemente). El análisis global se hace mediante la suma de puntos en cada apartado (sueño nocturno/somnolencia diurna).
Eficacia del tratamiento, cumplimentación terapéutica y efectos adversos
Con relación a la eficacia del tratamiento, se definió como respuesta parcial a una reducción superior al 20% en la QS; respuesta completa se definió como una reducción superior al 80% en la QS y la presencia de síntomas «cero» se definió por una puntuación inferior a 5 puntos en la QS.
La cumplimentación terapéutica, al tratarse de un parche transdérmico de fácil aplicación, se evaluó mediante revisión al inicio de la sesión de HD. Aquellos pacientes que presentaban ausencia del parche transdérmico en 3 revisiones ordinarias fueron catalogados como incumplidores.
Los efectos adversos analizados mediante anamnesis durante las sesiones habituales de HD fueron: reacciones de tipo alérgico en la zona de aplicación (eritema o induración, dolor local, prurito), cefalea, somnolencia, náuseas, vómitos, dispepsia, hipertensión y potenciación paradójica de los síntomas (augmentation effect).
El análisis estadístico se realizó con el programa SPSS versión 18.0 (SPSS Inc, Chicago, IL, EE. UU.). Los datos no presentaron una distribución normal tras el test de Kolmogorov-Smirnov. Las variables cuantitativas se expresaron mediante la media y desviación estándar. Las variables cualitativas, mediante porcentaje. La comparación de los datos cuantitativos se realizó mediante el test de Wilcoxon para variables relacionadas no paramétricas y los datos cualitativos mediante el test de McNemar. El análisis intergrupos se realizó mediante la prueba U de Mann-Whitney, considerando significación estadística un valor de p < 0,05.
Resultados
Se analizaron un total de 66 pacientes prevalentes en programa de HD. Cinco fueron excluidos (3 por demencia, uno por negativa y otro por alteración psiquiátrica). De los 61 pacientes restantes, 14 fueron diagnosticados de SPI, con una prevalencia del 22,9%. Durante el periodo de estudio hubo 5 abandonos (uno por paro cardiorrespiratorio, 3 por revocación de consentimiento informado y uno por enfermedad hematológica maligna), ninguno relacionado con el tema del presente estudio. De los 9 pacientes restantes, un 44,4% eran hombres, con una edad media de 70,2 ± 9,9 años y un tiempo medio de permanencia en HD de 111,1 ± 160,8 meses. El índice de Charlson medio fue de 10,2 ± 2. Las principales comorbilidades fueron: hipertensión arterial (88,9%), diabetes mellitus (77,8%), vasculopatía periférica (55,6%) y cardiopatía isquémica (22,2%). La principal etiología de enfermedad renal crónica fue la diabetes mellitus (44,4%). El resto de las etiologías se muestran en la figura 1. Entre los factores desencadenantes, un 44,4% consumía derivados de cafeína de forma regular, un 25% presentaba consumo de alcohol y un 35,7% presentaba tabaquismo activo.

Figura 1 Principal etiología de la enfermedad renal crónica en pacientes con SPI en HD. Resultados expresados en porcentajes (%).
No se observaron diferencias significativas en cuanto a los principales parámetros bioquímicos y datos de adecuación de HD en ambas fases del estudio (tabla 1). Del mismo modo, no se realizaron modificaciones en la medicación habitual del paciente relacionada con SPI durante el estudio (88,9% analgesia convencional, 33,3% antidepresivos o ansiolíticos y un 11,1% tomaba opioides, respectivamente). Ningún paciente tomaba levodopa, clonidina, gabapentina, L-carnitina ni antieméticos. No se realizaron cambios en las características del filtro de HD (helixona 33%, polisulfona 44%, polisulfona hi-flow 11%, poliacrilonitrilo 11%) ni se encontraron cambios relevantes en relación con el tratamiento habitual administrado durante las sesiones de HD (hierro intravenoso 77,8 vs. 72,5%; agentes eritropoyéticos 30,9 ± 11,6 vs. 28,8 ± 10,4 mcg darbopoetina/semana) a lo largo del estudio.
Tabla 1 Parámetros bioquímicos y de adecuación de hemodiálisis
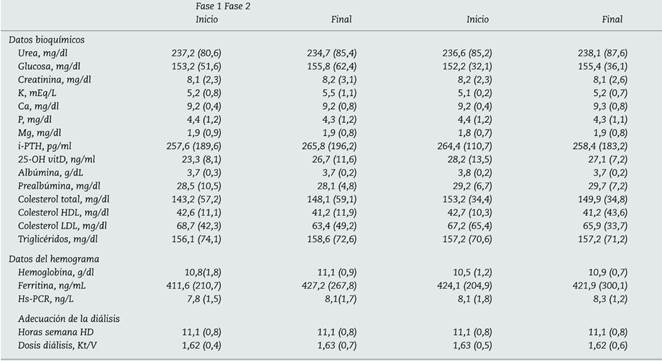
Fase 1 y fase 2 (rotigotina 2 mg/día): resultados expresados: media (desviación estándar). Inicio vs. final.
Ca: calcio; Hs-PCR: proteína C reactiva; i-PTH: hormona paratiroidea intacta; K: potasio; Kt/V: método 2.ª generación Daurgirdas; Mg: magnesio; P: fósforo; VitD: vitamina D.
No se encontraron diferencias significativas entre los grupos estudiados.
Los resultados de las principales variables analizadas en las distintas fases del estudio quedan reflejados en la tabla 2. Con relación a la gravedad de los síntomas relacionados con SPI, un 73,3% presentaba sintomatología grave (GRLS > 15 ptos). Por otra parte, un 35,7% refería calambres, un 28,5% entumecimiento y un 21,4% dolor muscular y quemazón, respectivamente, en el QS de extremidades inferiores. No se objetivaron cambios relevantes en la escala GRLS (19,1 ± 9,2 vs. 21,1 ± 4,2; p 0,524) ni en el cuestionario QS (9,3 ± 1,7 vs. 10,2 ± 2,4; p 0,428) durante la fase 1 del estudio.
Tabla 2 Escala de gravedad de síntomas (GRLS), Cuestionario de síntomas de las extremidades inferiores (QS), Calidad de vida relacionada con SPI (JH-QoL) e higiene de sueño (SCOPA)

Fase 1 y fase 2 (rotigotina 2 mg/día): Resultados expresados: media (desviación estándar). Inicio vs. final.
GRLS: escala de gravedad de síntomas del International restless leg syndrome study Group; JH-QoL: John Hopkins restless leg syndrome quality of life; QS: escala de síntomas de extremidades inferiores; SCOPA: escala de higiene de sueño.
*Significación estadística: p < 0,05.
Durante la fase 2 del estudio, observamos una mejoría significativa en GRLS (21,1 ± 4,3 vs. 5,7 ± 4,6; p 0,001) y QS (10,2 ± 2,4 vs. 5,7 ± 1,1; p 0,004) tras la introducción del tratamiento con rotigotina. La dosis de rotigotina transdérmica administrada fue de 2 mg/día, con un cumplimento terapéutico completo. Un 88,8% de los pacientes respondieron al tratamiento con rotigotina, con una reducción media de 15,2 ± 17,2 puntos en la escala GRLS al finalizar la fase 2 del estudio. Un 77,7% presentó una respuesta parcial (reducción superior al 20% QS) y un 11,1% presentó una remisión completa (reducción superior al 80% QS). Un 55,5% alcanzó sintomatología «cero», definida por una puntuación inferior a 5 puntos en la QS. No se objetivaron reacciones alérgicas en la zona de aplicación de los parches transdérmicos. Únicamente un paciente presentó intolerancia digestiva leve en forma de dispepsia, que cedió tras la reducción de rotigotina a 1 mg/día. Ninguno de los pacientes de nuestro estudio presentó augmentation effect.
En cuanto a los resultados obtenidos para la calidad de vida relacionada con SPI e higiene de sueño, observamos un empeoramiento para las escalas JH-QoL (19,8 ± 4,3 vs. 22,1 ± 4,4; p 0,096) y SCOPA (total 15,1 ± 5,3 vs. 16 ± 5,3; p 0,124; diurno 5,3 ± 3,6 vs. 5,5 ± 3,6; p 0,368; nocturno 9,8 ± 2,7 vs. 10,4 ± 2,7; p 0,347, respectivamente) durante la fase 1 del estudio, si bien estos resultados no alcanzaron la significación estadística previamente establecida. De forma global, tras la introducción de rotigotina (fase 2), observamos una mejoría significativa en términos de calidad de vida relacionada con SPI (JH-QoL 22,1 ± 4,4 vs. 4,3 ± 4,1; p 0,004) y en los distintos apartados de la higiene del sueño (SCOPA total 16 ± 5,3 vs. 6,7 ± 1,9; p 0,001; diurno 5,5 ± 3,6 vs. 1,4 ± 0,7; p 0,013; nocturno 10,4 ± 2,7 vs. 6,1 ± 1,1; p 0,001; respectivamente).
La tabla 3 muestra los resultados del análisis comparativo de la diferencia de las medias de las principales variables entre las fases de estudio. Se evidenció una mejoría significativa en términos de gravedad de los síntomas (1,8 ± 8,5 vs. −13,3 ± 8,7; p 0,003), presencia de síntomas específicos en extremidades inferiores (0,6 ± 2,4 vs. −4,2 ± 3,1; p 0,004), calidad de vida relacionada con el SPI (2,3 ± 1,6 vs. −12,7 ± 3,8; p 0,001) e higiene del sueño (total 0,9 ± 1,1 vs. −9,2 ± 5,3; p 0,001; diurno 0,2 ± 0,6 vs. −4,1 ± 3,9; p 0,001; nocturno 0,6 ± 0,7 vs. −4,4 ± 2,3; p 0,001, respectivamente) tras la introducción de rotigotina.
Tabla 3 Análisis entre grupos de estudio
| Fase 1 | Fase 2 | |
| GRLS | 1,8 (8,5) | −13,3 (8,7)* |
| QS | 0,6 (2,4) | −4,2 (3,1)* |
| JH-QoL | 2,3 (1,6) | −12,7 (3,8)* |
| SCOPA total | 0,9 (0,9) | −9,2 (5,3)* |
| SCOPA diurno | 0,2 (0,6) | −4,1 (3,9)* |
| SCOPA nocturno | 0,6 (0,7) | −4,4 (2,3)* |
Análisis de las diferencias de las medias de las principales variables entre los grupos de estudio. Resultados expresados: media (desviación estándar).
GRLS: escala de gravedad de síntomas del International restless leg syndrome study Group; JH-QoL: John Hopkins restless leg syndrome quality of life; QS: escala de síntomas de extremidades inferiores; SCOPA: escala de higiene de sueño.
Análisis mediante el test estadístico no paramétrico U de Mann Whitney.
*Significación estadística: p < 0,05.
Discusión
Los resultados de nuestro estudio demuestran que el SPI presentó una prevalencia considerable en nuestra unidad de HD. Del mismo modo, el uso de rotigotina mejoró la sintomatología clínica, la calidad de vida e higiene de sueño en nuestros pacientes con SPI en HD, por lo que resulta ser un fármaco seguro, con mínimos efectos adversos y con cumplimento terapéutico completo.
Con relación a la prevalencia de SPI en nuestra unidad de HD, es prácticamente superponible a la descrita con anterioridad en la literatura4,22: oscila entre un 12 y un 30%, a pesar de la gran comorbildidad y tiempo de permanencia en HD de nuestros pacientes. Con relación a la sintomatología, el diagnóstico de SPI se asocia a alteraciones en la calidad de vida del paciente, fundamentalmente clínica depresiva o ansiosa, al igual que a un deterioro de la higiene de sueño, con aparición de somnolencia diurna y fatiga5,19,20. Estos datos son similares a los observados en nuestro estudio, en el que más de un 75,5% de los pacientes presentaba sintomatología grave. La presencia de todos estos síntomas repercutía en la calidad de vida y en la higiene del sueño.
Actualmente, la terapia con agonistas dopaminérgicos no ergotamínicos se ha convertido en la terapia de primera línea para la afectación moderada-severa de SPI. Los más utilizados son pramipexol, ropinirol y más, recientemente, rotigotina15-17. No obstante, todavía son escasos los trabajos publicados de cara a establecer el mejor tratamiento del SPI en los pacientes en HD23 (tabla 4).
Tabla 4 Principales estudios clínicos aleatorizados con intervención farmacológica en pacientes con síndrome de piernas inquietas en terapia sustitutiva renal
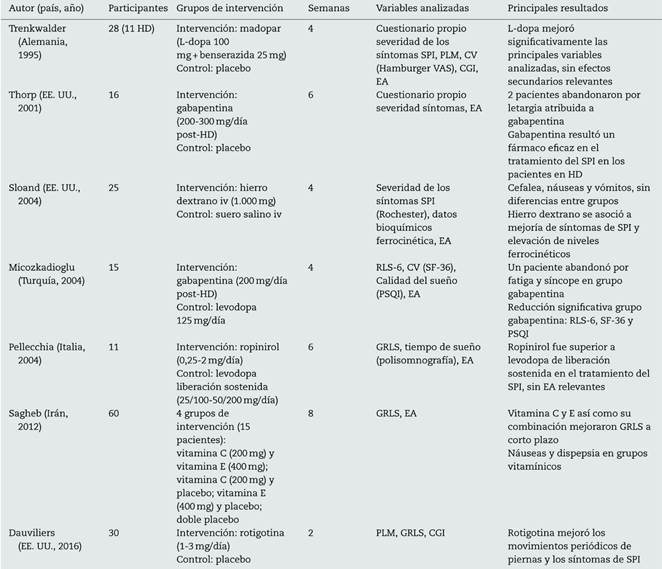
CGI: clinical global impression; CV: calidad de vida; EA: efectos adversos; EE. UU.: Estados Unidos; GRLS: escala de gravedad de síntomas del International Restless Leg Syndrome Study Group; HD: hemodiálisis; iv: intravenoso; PLM: movimientos de piernas periódico; PSQI: Pitsburg Sleep Quality Index; RLS-6: Restless leg syndrom scale 6; SPI: síndrome de piernas inquietas; VAS: escala visual analógica.
Dentro de este grupo de fármacos, el uso de rotigotina se ha extendido en la actividad diaria debido a su eficacia, buena tolerancia, pocos efectos adversos, baja prevalencia de potenciación paradójica de síntomas o augmentation efect y la no necesidad de ajuste de dosis en los pacientes con insuficiencia renal24,25. Estas ventajas se deben sobre todo a la administración en forma de parche transdérmico, que garantiza una liberación continuada a lo largo de todo el día y con la que se obtienen niveles séricos estables que minimizan la posibilidad de acúmulo sin necesidad de monitorizar los niveles sanguíneos y la aparición de efectos adversos relevantes. Por otro lado, la aplicación transdérmica facilita la adherencia terapéutica, al disminuir el número de comprimidos en unos pacientes en su mayoría polimedicados, al igual que es una herramienta adicional de cara a la valoración del cumplimiento terapéutico. Su principal desventaja es el elevado coste económico, superior al resto de los agonistas no ergotamínicos.
En nuestro estudio, rotigotina resultó un fármaco seguro y eficaz, con mínimos efectos adversos y con cumplimento terapéutico completo, no hubo abandonos y se alcanzó una mejoría significativa en la sintomatología clínica, la calidad de vida relacionada con SPI y la higiene del sueño.
En nuestro caso, debemos mencionar que, hasta la fecha, el SPI urémico era una entidad infravalorada en nuestra unidad de HD, como lo demuestra el hecho de que ninguno de los pacientes diagnosticados recibiera tratamiento específico para SPI. Este hecho probablemente obedecía, entre otros motivos, a que gran parte de la sintomatología en los miembros inferiores de los pacientes pudiera ser atribuida a otros factores o comorbilidades asociadas, al escaso interés que suscitaba en el personal médico debido al poco conocimiento fisiopatológico de esta entidad y a la ausencia de un tratamiento altamente eficaz sin efectos adversos relevantes. Todos estos aspectos conllevaban el uso de diversos medicamentos sin pautas claras, basado en las propias experiencias clínicas o en los escasos trabajos publicados.
Dada la prevalencia de SPI, con la importante e intensa sintomatología que conlleva y el deterioro de la calidad que asocia, junto con el hecho de que no existan -al menos en nuestro estudio- alteraciones en los datos del hemograma ni en los parámetros bioquímicos de la práctica clínica habitual que permitan relacionarlos con este síndrome, consideraremos establecer diversas estrategias de actuación para valorar la presencia de SPI en nuestros pacientes a partir de los resultados obtenidos en este estudio.
En este sentido, a todos los pacientes incidentes en nuestra unidad de HD se les aplicarán los criterios clínicos de la IRLSSG para su diagnóstico. Aquellos casos con dudas razonables serán comentados con el Servicio de Neurología para una valoración más exhaustiva. Del mismo modo, se valorará la gravedad de los síntomas y la calidad de vida e higiene del sueño mediante los test anteriormente descritos y se ofrecerá, además de unos consejos higiénicos dietéticos, el tratamiento médico oportuno en función de las características clínicas.
Dentro de las múltiples limitaciones de nuestro estudio, debemos mencionar el reducido número de pacientes incluidos —que obligó a la utilización de test estadísticos no paramétricos— así como el corto tiempo de seguimiento. El tamaño muestral estuvo condicionado por nuestra limitada población en HD, mientras que el período de 12 semanas se estableció para evitar posibles confusiones tras los cambios habituales en los medicamentos prescritos después de los resultados de las determinaciones analíticas trimestrales en nuestra unidad de HD. Así pues, no podemos descartar la posibilidad de que un período de estudio mayor pudiese conllevar algún cambio con relación a la efectividad, seguridad y tolerancia de la rotigotina. Estudios con mayor número de pacientes y tiempo de duración serían necesarios para confirmar los beneficios observados tras el uso de rotigotina en el tratamiento del SPI de nuestros pacientes en HD.
Como conclusiones podemos decir que el SPI presentó una prevalencia considerable en nuestro estudio, con una intensa sintomatología y una calidad de vida e higiene del sueño deterioradas. El uso de rotigotina mejoró la sintomatología clínica, la calidad de vida y la higiene de sueño en los pacientes con SPI en HD: resultó ser un fármaco seguro, con mínimos efectos adversos y con cumplimento terapéutico completo. No obstante, serían necesarios futuros estudios para confirmar el beneficio de rotigotina en la población en HD con SPI.














