Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.22 no.1 Madrid ene./feb. 2007
ORIGINAL
Utilización de glutamina en nutrición parenteral en paciente crítico: efectos sobre la morbi-mortalidad
Glutamine use for parenteral nutrition in the critically ill patient: effects on morbimortality
G. Mercadal Orfila, J. M. Llop Talaverón, B. Gracia García, C. Martorell Puigserver, M.ª B. Badía Tahull, M.ª Tubau Molas y R. Jodar Masanes
Servicio de Farmacia. Hospital Universitari de Bellvitge. Hospitalet de Llobregat. Barcelona. España.
Dirección para correspondencia
RESUMEN
Objetivo: Determinar la relación entre aditivar dipéptidos de glutamina a la nutrición parenteral (NP) y la morbi-mortalidad en paciente crítico.
Materiales y métodos: Estudio retrospectivo de casos y controles. Como casos se recogieron pacientes a los que se administró NP suplementada con 2 g de nitrógeno (glutamina) durante el período 2001-2004. Los controles fueron pacientes con NP sin glutamina recogidos durante el 2000.
Todos los pacientes incluidos presentaban infección definida como la presencia de un foco infeccioso más 2 de los siguientes criterios: leucocitos > 12.000 x 106/L, fiebre > 38 ºC, frecuencia cardíaca > 90 latidos/minuto o PCO2 < 31 mm Hg. Además, tenían niveles plasmáticos de prealbúmina < 15 g/L o albúmina < 25 g/L, PCR > 100 mg/L o fístula.
Se excluyeron los pacientes con insuficiencia renal, diálisis previa, encefalopatía hepática o dieta mixta. Las variables de morbi-mortalidad registradas fueron: hiperglucemia, fracaso renal, días con NP, días en UCI, días de hospitalización y mortalidad.
Resultados: Se incluyeron 202 pacientes (75 casos y 127 controles). En el estudio univariante previo no aparecieron diferencias significativas para las variables independientes entre los 2 grupos. En el estudio multivariante, la aditivación de glutamina se asoció significativamente a menor incidencia de fracaso renal (OR:0,28; IC:0,08-1,00), menor hiperglucemia (OR:0,38; IC:0,19-0,75), menos días de hospitalización (OR:0,64; IC: 0,44-0,92) y menos días en UCI (OR:0,64; IC: 0,45-0,93). Para la variable exitus, la adición de glutamina mostró tendencia a la inclusión en el modelo (p = 0,097). En cuanto a los días con NP la variable glutamina no se incluyó en modelo.
Conclusión: En pacientes críticos, la adición de glutamina a la NP conlleva una recuperación más rápida y menor incidencia de hiperglucemia y fracaso renal. Dados estos resultados, la adición de glutamina a las NP de determinados pacientes es un recurso efectivo para acelerar su recuperación y evitar determinadas complicaciones.
Palabras clave: Glutamina. Nutrición parenteral. Paciente crítico.
ABSTRACT
Objetive: To determine the relationship between adding glutamine dipeptides to parenteral nutrition (PN) and morbimortality in the critically ill patient.
Material and methods: Case-control retrospective study.
The cases were patients to whom PN supplemented with 2 g of nitrogen (glutamine) was administered during the period 2001-2004. Controls were patients with PN without glutamine, collected during the year 2000.
All included patients had infection defined as the presence of an infectious site plus more than two of the following criteria: leucocytes > 12.000 x 106/L, fever > 38 ºC, heart rate > 90 bmp, or PCO2 < 31 mmHg. Besides, they had to have prealbumin plasma levels < 15 g/L or albumin levels < 25 g/L, and CRP > 100 mg/L or a fistula.
Patients with renal failure, previous dialysis, hepatic encephalopathy, or mixed diet were excluded from the study.
Morbimortality variables collected were: hyperglycemia, renal failure, days on PN, days in the ICU, hospitalization days, and mortality.
Results: Two hundred and two patients (75 cases and 127 controls) were included. In the previous univariate analysis no significant differences appeared for independent variables between both groups. In the multivariate analysis, glutamine addition was significantly associated to lower renal failure incidence (OR: 0.28; CI: 0.08- 1.00), lower hyperglycemia (OR: 0.38; CI: 0.19-0.75), less hospitalization days (OR: 0.64; CI: 0.44-0.92), and fewer days in the ICU (OR: 0.64; CI: 0.45-0.93). For the variable "exitus", glutamine addition showed a trend towards inclusion into the model (p = 0.097). About the days on PN, the variable glutamine was not included into the model.
Conclusion: In critically ill patients, adding glutamine to PN leads to quicker recovery and lower incidence of hyperglycemia and renal failure. In view of these results, adding glutamine to PN of particular patients is an effective measure to speed up their recovery and avoid certain complications.
Key words: Glutamine. Parenteral nutrition. Critically-ill patient.
Introducción
Los pacientes ingresados en las unidades de críticos con frecuencia se encuentran en estados de catabolismo intenso, asociado a menudo a complicaciones metabólicas y sépticas. En estas situaciones es común la aparición de fracaso intestinal y de intolerancia a la nutrición enteral, produciéndose un estado de malnutrición relacionado con una prolongación de la estancia en la Unidad de Críticos así como con un aumento de la mortalidad1.
La situación de estrés presente en el paciente crítico se caracteriza, entre otros aspectos, por la pérdida de la competencia inmune produciéndose un aumento de las concentraciones plasmáticas de las citocinas proinflamatorias (TNF, IL-6, IL-8), una disminución de los niveles de las citocinas reguladoras (IL-1, IL-2, IL-10, IFG), una desmedida activación del sistema monocito/macrófago, un descenso de la proliferación linfocitaria y una menor potencia bactericida de los neutrófilos.
Como consecuencia se produce un estado de inmunosupresión relativa que asociado al hipercatabolismo típico de las situaciones de estrés hace de los pacientes críticos, pacientes de difícil manejo clínico y nutricional.
Tenemos evidencia experimental y clínica de que algunos sustratos específicos incluidos en la composición de la dieta pueden actuar sobre estas alteraciones, favoreciendo la resistencia a las infecciones y disminuyendo la estancia hospitalaria y la mortalidad.
En los últimos años se ha utilizado el término inmunomodulador par designar nutrientes específicos que administrados en cantidades superiores a las habituales adquieren propiedades farmacológicas. Entre ellos se encuentran los ácidos grasos omega-3, aminoácidos sulfurados, glutamina, arginina, nucleótidos, factores de crecimiento...2
La glutamina descrita inicialmente como un aminoácido no esencial, ya que es sintetizada "de novo" en muchos tejidos, hoy día puede ser reclasificada como esencial en ciertas condiciones en las que las necesidades exceden la capacidad del organismo para producirla3. La glutamina juega un papel clave en el transporte de nitrógeno, interviene en la regulación de la síntesis proteica, es el sustrato más importante para la amoniogénesis renal y la neoglucogénesis hepática y el precursor de muchas moléculas biológicamente activas. Asimismo, es esencial para las células de crecimiento rápido como el enterocito y las células del sistema inmune4. A nivel del sistema immunitario, juega un papel decisivo en la proliferación de los linfocitos y en la síntesis y la actividad del sistema monocito/macrófago y restaura la depleción immunológica del paciente crítico5.
Sobre el tracto gastrointestinal, sirve como precursor para la síntesis del enterocito, mejora el flujo y la perfusión esplácnica y se comporta como un secretagogo con efectos tróficos sobre la mucosa intestinal. Además, reduce la respuesta inflamatoria y la permeabilidad intestinal en el paciente crítico6-9, mejora el metabolismo proteico intestinal y reduce la proteólisis intestinal ubiquitinín-dependiente10. En definitiva, la glutamina mejora el hipercatabolismo y la respuesta sistémica. Por todo ello, podría considerarse un inmunonutriente ideal.
La caída de los niveles de glutamina de hasta un 50% es un hallazgo frecuente y de aparición precoz en el paciente crítico. Esta depleción se acompaña de una disminución de la extracción, del contenido y del consumo de glutamina por parte de los órganos centrales, especialmente el intestino y el sistema inmunológico3,4. En estos casos, el aporte exógeno de glutamina puede ser considerado como la corrección de una deficiencia, dado el importante papel que desempeña a nivel fisiológico en condiciones de estrés.
Por todo ello, dentro de las nuevas estrategias nutricionales, que incluyen la immunonutrición, la utilización de dipéptidos de glutamina en estudios controlados ha demostrado conseguir una reducción en la morbi-mortalidad en paciente crítico11.
Los efectos beneficiosos de la glutamina se han observado mayoritariamente en estudios randomizados dirigidos a evaluar la eficacia de la adición de este dipéptido en la nutrición de los pacientes. Pero todavía es necesaria la evaluación de la efectividad de este tratamiento en la práctica clínica diaria, así como la definición de parámetros clínicos y/o analíticos que permitan la evaluación de sus efectos en un contexto diferente al de los ensayos clínicos.
El presente estudio se diseñó con el propósito de determinar la relación entre aditivar dipéptidos de glutamina a la nutrición parenteral y la morbi-mortalidad en el paciente crítico, en el contexto de la práctica clínica.
Material y métodos
Se diseñó un estudio retrospectivo de casos y controles en el que se incluyeron pacientes mayores de 18 años ingresados en el Hospital Universitari de Bellvitge entre 2000 y 2004 y que recibieron tratamiento con nutrición parenteral (NP). El criterio de tratamiento nutricional fue el mismo para ambos grupos de tratamiento.
Como casos se incluyeron los pacientes a los que se administró NP suplementada con 2 g de nitrógeno en forma de dipéptidos de glutamina durante el período 2001-2004. Los controles fueron pacientes con NP sin glutamina tratados durante el 2000.
Todos los pacientes incluidos presentaban infección definida como la presencia de un foco infeccioso más 2 de los siguientes criterios: leucocitos > 12.000 x 106/L, fiebre > 38 ºC, frecuencia cardíaca > 90 latidos/minuto o PCO2 < 31 mm Hg. Además, tenían niveles plasmáticos de prealbúmina < 15 g/L, albúmina < 25 g/L, PCR > 100 mg/L o fístula. Se excluyeron los pacientes con insuficiencia renal (creatinina > 200 mmol/L), diálisis previa, encefalopatía hepática o dieta mixta. Los criterios de tratamiento nutricional fueron comunes en los dos grupos, excepto la adición de glutamina.
Se registraron las siguientes variables (tabla I):
– demográficas: sexo y edad
– clínicas: fístula (dehiscencia de sutura o espontánea), fracaso intestinal (sangrado retroperitoneal, absceso y/o peritonitis), incidencia de fracaso renal (creatinina sérica > 200 mmol/L o urea sérica > 15 mmol/L), incidencia de hiperglucemia (glucosa sérica > 9 mmol/L), días con NP, días en UCI y días de hospitalización
– analíticas: glucosa, albúmina, prealbúmina, proteína C reactiva (PCR), triglicéridos
– éxitus durante el periodo de hospitalización.
Para el estudio estadístico, se realizó un ajuste univariante previo de las variables independientes mediante los tests de chi-cuadrado y t-Student, con significación para p ≤ 0,05. Posteriormente, se construyeron 3 modelos de regresión logística para las variables binarias y 3 modelos de regresión proporcional de Cox para las variables continuas, todos con significación estadística determinada a partir de los intervalos de confianza de la odds ratio y con criterios de inclusión por pasos para p ≤ 0,05.
Resultados
Se incluyeron un total de 202 pacientes (75 casos y 127 controles) tratados con NP en el periodo comprendido entre 2000 y 2004.
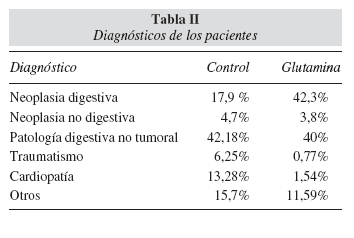
En el grupo glutamina, los diagnósticos mayoritarios para la indicación inicial de tratamiento con NP (tabla II) correspondieron a neoplasia digestiva en un 42,3% de los casos y patología digestiva de origen no tumoral en un 40%. En el grupo control, precisaron tratamiento con NP por una patología digestiva de origen no tumoral el 42,18% de los pacientes y por neoplasia digestiva el 17,9%.
Los grupos no presentaban diferencias estadísticamente significativas entre ellos al inicio del estudio en cuanto a edad, sexo, niveles de glucosa y triglicéridos y presencia de fístula y fracaso renal (tabla III). En el grupo glutamina, los niveles iniciales de prealbúmina fueron algo superiores (12,2 g/L vs 8,47 g/L) sin llegar a ser estadísticamente significativo. En cambio, los valores de albúmina al inicio del estudio en el grupo glutamina eran inferiores al grupo control (p = 0,043).
La media de días de tratamiento con NP fue de 25,35 días (2 a 260) en el grupo glutamina y de 22,83 días (1 a 96) en el grupo control. Al finalizar el tratamiento la media de días con NP, la media de días en UCI y de ingreso así como el porcentaje de mortalidad y de pacientes con fracaso renal fue similar en ambos grupos (tabla IV). Cabe destacar la menor incidencia de hiperglucemia en el grupo glutamina (45,3 % vs 60,6%), siendo esta diferencia estadísticamente significativa (p = 0,041).
En los modelos de regresión (tablas V y VI), la aditivación con glutamina se asoció significativamente a una menor incidencia de fracaso renal (OR: 0,28; IC: 0,080-1,00), menor incidencia de hiperglucemia (OR: 0,38; IC: 0,19-0,75), menos días de hospitalización (OR: 0,64; IC: 0,44-0,92) y menos días de estancia en UCI (OR: 0,64; IC: 0,45-0,93).
Además, el modelo de regresión de Cox (tabla VI) mostró que la presencia de fracaso intestinal se relaciona con una estancia hospitalaria más larga (OR: 1,61; IC: 1,05-2,48) y con más días en tratamiento con NP (OR: 1,75; IC: 1,13- 2,7), mientras que un valor elevado de albúmina se relaciona con una menor estancia hospitalaria y una menor estancia en UCI así como con una menor duración del tratamiento con NP.
Finalmente, la adición de glutamina a la fórmula de NP no se relacionó ni con los días de NP ni con la variable éxitus, aunque mostró tendencia a la inclusión en el modelo de regresión para la variable dependiente éxitus (p = 0,097). En cambio, un valor de prealbúmina bajo se relacionó con una mayor mortalidad (OR: 2,041; IC: 1,03-4,05) (tabla V).
Discusión
En nuestro centro, la adición de dipéptidos de glutamina a las fórmulas de NP se realiza de forma habitual en el paciente crítico desde el año 2001. Basándose en los resultados publicados en la literatura reciente, realizamos un estudio retrospectivo con el objetivo de conocer los efectos de la glutamina en la evolución de dichos pacientes.
Según nuestros resultados, podemos decir que la adición de glutamina a la NP conlleva una recuperación más rápida (menos días de hospitalización y de UCI) y una menor incidencia de hiperglucemia y de fracaso renal sin relacionarse directamente con la mortalidad.
Como hemos indicado anteriormente, el análisis multivariante indica que la aditivación de glutamina a la NP se asocia a una menor hiperglucemia (OR = 0,38), reafirmando el efecto sobre el metabolismo glucídico por parte de la glutamina. Estos resultados están en concordancia con los obtenidos en el reciente estudio realizado por Déchelotte y cols.12, en el que el 53,6% de pacientes del grupo control presentaron hiperglucemia (> 10 mmol/L), respecto un 34,4% del grupo suplementado con glutamina (p < 0,05). En este estudio, además, el 39,3% de los pacientes en el grupo control vs el 24,1% en el grupo glutamina necesitaron insulina (p < 0,05).
La mejora en la tolerancia de la glucosa por parte de la glutamina, se ha observado tanto en estudios experimentales previos como en estudios clínicos posteriores12. Los mecanismos a través de los cuales mejora esta tolerancia incluyen tanto la capacidad de la glutamina por reducir la resistencia a la insulina13,14 como el incremento de la utilización de glucosa y reducción de la producción hepática15. Asimismo, en voluntarios sanos se ha observado un incremento de insulina en plasma tras la administración enteral de glutamina10.
La hiperglicemia asociada a la resistencia a la insulina es común en el paciente crítico y de hecho puede ser la causante de parte de la morbi-mortalidad de este tipo de pacientes16. El reciente estudio de Van den Berghe17 indica que el control estricto e intensivo de la glucemia en el paciente crítico, reduce la mortalidad y morbilidad, si bien el mecanismo beneficioso exacto se desconoce.
Otro de los hallazgos a nivel metabólico de nuestro estudio fue la menor incidencia de fracaso renal en el grupo tratado con glutamina respecto al grupo control (6,8 % vs 14,2%), resultados confirmados en el análisis multivariable posterior. Estos resultados son de especial relevancia considerando el fracaso renal como una situación clínica asociada frecuentemente a sepsis, trauma y fracaso multiorgánico en el paciente crítico18.
Al estudiar la morbilidad del paciente crítico de una forma más inespecífica a partir de la estancia hospitalaria y en UCI, nuestros resultados muestran que la adición de glutamina se relaciona con una disminución de la morbilidad de los pacientes valorada a través de la estancia en UCI y de la estancia hospitalaria. Estos resultados difieren de los obtenidos en estudios más recientes en los que no se ha detectado un efecto significativo de la glutamina en la estancia hospitalaria y en UCI en el paciente crítico11,12,19.
En cambio, sí se ha observado una reducción en la estancia hospitalaria en estudios de utilización de glutamina en NP para el tratamiento de pacientes transplantados de médula ósea (29 +/- 1 día comparado con 36 +/- 2 días; p = 0,017)20,21, y también en un estudio en pacientes quirúrgicos, en el que se observó una media de 4 días menos de ingreso hospitalario respecto al grupo control (12,5 días vs 16,5 días; p = 0,02)22.
Aunque en varios estudios se ha visto una reducción significativa de la mortalidad al aditivar glutamina a la NP23,24, en nuestro estudio, el tipo de fórmula no se relacionó con la mortalidad, si bien, se observó una tendencia a su inclusión en el modelo. Así, por ejemplo, en el estudio de Goeters23 se observó una mayor supervivencia a los 6 meses en los pacientes tratados 9 o más días con NP suplementada con dipéptidos de glutamina. También se observó una mayor supervivencia a los 6 meses en el estudio de Griffiths24.
En nuestro caso no valoramos la supervivencia a los 6 meses, lo cual podría explicar porque no encontramos diferencias a nivel de mortalidad, dado que dicho parámetro lo medimos durante el ingreso hospitalario.
Los resultados obtenidos en el estudio, comportan ciertas reservas dado que no se trata de un estudio de intervención y que los datos se han recogido de manera retrospectiva y en periodos de tiempo diferentes.
No obstante, la complejidad de este tipo de pacientes hace necesario abrir la opción de realizar estudios en situaciones "no ideales", es decir, diferentes de las establecidas en los ensayos clínicos y que reflejen la realidad de la práctica clínica diaria.
Desde un punto de vista teórico, nuestros resultados confirman lo establecido en diferentes estudios experimentales y se explicarían por la actividad de la glutamina tanto a nivel intestinal, reduciendo la permeabilidad, como a nivel sistémico por su efecto inmunomodulador.
En conclusión, nuestros resultados muestran que la adición de glutamina a la NP conlleva una recuperación más rápida, reflejada en menos días de ingreso y en UCI, y una menor incidencia de hiperglucemia y fracaso renal, variables relacionadas con un peor pronóstico en los pacientes críticos. Por lo tanto, la adición de dipéptidos de glutamina a la NP de determinados pacientes es un recurso efectivo para acelerar su recuperación y evitar determinadas complicaciones clínicas y metabólicas.
Referencias
1. Montejo JC. Enteral nutrition-related gastrointestinal complications in critically ill patients. A multicenter study. Crit Care Med 1999; 27:1447-1453. [ Links ] 2. Grimble R. Immunonutrition. Curr Opin Gastroenterol 2005, 21:216-222 [ Links ] 3. Souba WW. Nutritional support. N Engl J Med 1997; 336:41-8 [ Links ] 4. Planas M, Schwartz S, Arbos MA, Farriol M. Plasma glutamine levels in septic patients. J Parenter Enteral Nutr 1993; 17: 299-300. [ Links ] 5. Ockenga J, Borchert K, Rifai K, Manns MP, Bischoff. Effect of glutamine-enriched total parenteral nutrition in patients with acute pancreatitis. Clin Nutr 2002; 21:409-16. [ Links ] 6. Coëffier M, Marion R, Ducrotte P, Dechelotte P. Modulating effect of glutamine on IL-1ß-induced cytokine production by human gut. Clin Nutr 2003; 22:407-13. [ Links ] 7. Van der Hulst RR, Van Kreel BK, Von Meyenfeldt MF y cols. Glutamine and the preservation of gut integrity. Lancet 1993; 3 41:1363-1365. [ Links ] 8. De Sousa DA, Greene LJ. Intestinal permeability and systemic infections in critically ill patients: Effect of glutamine. Crit Care Med 2005; 33:1125-1135. [ Links ] 9. Zhou YP, Jiang Zm, Sun YH y cols.The effect of supplemental enteral glutamine on plasma levels, gut function, and outcome in severe burns: a randomized double-blind controlled clinical trial. JPEN J Paren Enteral Nutr 2003; 27:241-245. [ Links ] 10. Coëffier M, Claeyssens S, Hecketsweiler B, Lavoinne A, Ducrotte P, Déchelotte P. Enteral glutamine stimulates protein synthesis and decreases ubiquitin mRNA level in human gut mucosa. Am J Physiol Gastrointest Liver Physiol 2003 Aug; 285(2):G266-73. [ Links ] 11. Novak F, Heyland DK, Avenell A y cols. Glutamine supplementation in serious illness: a systematic review of the evidence. Crit Care Med 2002; 30;2022-2029. [ Links ] 12. Dechelotte P, Hasselmann M, Cynober L, Allaouchiche B, Coeffier M, Hecketsweiler B, Merle V, Mazerolles M, Samba D, Guillou YM, Petit J, Mansoor O, Colas G, Cohendy R, Barnoud D, Czernichow P, Bleichner G.L-alanyl-L-glutamine dipeptide- supplemented total parenteral nutrition reduces infectious complications and glucose intolerance in critically ill patients: the French controlled, randomized, double-blind, multicenter study. Crit Care Med 2006 Mar; 34(3):598-604. [ Links ] 13. Coëffier M, Déchelotte P. Parenteral glutamine in critically ill patients effects on complication rate and glucose homeostasis. Clin Nutr 2004; 1:33-36. [ Links ] 14. Bakalar B, Duska F, Pachl J, Fric M, Otahal M, Pazout J, Andel M. Parenterally administered dipeptide alanyl-glutamine prevents worsening of insulin sensitivity in multiple-trauma patients.Crit Care Med 2006 Feb; 34(2):381-6. [ Links ] 15. Borel MJ, Williams PE, Jabbour K, Levenhagen D, Kaizer E, Flakoll PJ. Parenteral glutamine infusion alters insulin mediated glucose metabolism. J Parent Enter Nutr 1998; 22:280-5. [ Links ] 16. Preiser JC, Devos P, Van der Berghe G, Tight control of glycaemia in critically patients. Curr Opin Clin Nutr Metab Care 2002; 5:533-537. [ Links ] 17. Van den Berghe G, Wouters P, Weekers F y cols. Intensive insulin therapy in tehe critically ill patients. N Engl J Med 2001; 345:1359-1367. [ Links ] 18. Wooley JA, Btaiche IF, Good KL. Metabolic and nutritional aspects of acute renal failure in critically ill patients requiringcontinuous renal replacement therapy. Nutr Clin Pract 2005 Apr; 20(2): 176-91. [ Links ] 19. Fuentes-Orozco C, Anaya-Prado R, González-Ojeda A, Arenas-Márquez H, Cabrera-Pivaral C, Cervantes-Guevara G, Barrera-Zepeda LM. L-alanyl-L-glutamine-supplemented parenteral nutrition improves infectious morbidity in secondary peritonitis. Clin Nutr 2004 Feb; 23 (1):13-21. [ Links ] 20. Ziegler TR, Young LS, Benfell K, Scheltinga M, Hortos K, Bye R, Morrow FD, Jacobs DO, Smith RJ, Antin JH y cols. Clinical and metabolic efficacy of glutamine-supplemented parenteral nutrition after bone marrow transplantation. A randomized, double-blind, controlled study. Ann Intern Med 1992 May 15; 116(10):821-8. [ Links ] 21. Schloerb PR, Amare M. Total parenteral nutrition with glutamine in bone marrow transplantation and other clinical applications (a randomized, double-blind study) J Parenter Enteral Nutr 1993 Sep-Oct; 17(5):407-13. [ Links ] 22. Jian ZM, Cao JD, Zhu XG, Zhao WX, Yu JC, MA El, Wang XR, Zhu MW, Shu MW, Shu H, Liu YW. The impact of alanyl-glutamine on clinical safety, nitrogen balance, intestinal permeability, and clinical outcome in postoperative patients: a randomized, double-blind, controlled study of 120 patients. J Parenter Enteral Nutr 1999 Sep-Oct; 23(5 Supl.):S62-6. [ Links ] 23. Goeters C, Wenn A, Mertes N, Wempe C, Van Aken H, Stehle P, Bone HG. Parenteral L-alanyl-L-glutamine improves 6- month outcome in critically ill patients. Crit Care Med 2002 Sep; 30(9):2032-7. [ Links ] 24. Griffith RD, Jones C, Palmer TE. Six-month outcome of critically ill patients given glutamine-supplemented parenteral nutrition. Nutrition Apr, 1997; 13(4):295-302.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Gabriel Mercadal Orfila
Hospital Universitari de Bellvitge
Fexa Llarga, s/n
08907 Hospitalet de Llobregat. Barcelona
E-mail: gmercadal@smen.es
Recibido: 25-IX-2006.
Aceptado: 20-X-2006.