Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.33 supl.1 Madrid 2016
Interacción entre tratamientos oncológicos y soporte nutricional
Interaction between oncological treatments and nutritional support
Eduard Fort Casamartina1,2, Lorena Arribas Hortiguela2, Carmen Bleda Pérez1,2, Carme Muñoz Sánchez1, Imma Peiro Martínez2, María Perayre Badía1 y Ana Clopés Estela1
1 Servicio de Farmacia.
2 Unidad Funcional de Nutrición Clínica. Hospital Duran i Reynals. Hospitalet de Llobregat, Barcelona.
Dirección para correspondencia
RESUMEN
Durante la última década, el conocimiento de nuevos mecanismos implicados en el desarrollo del cáncer ha permitido el diseño de nuevos fármacos para su tratamiento y la mayor parte de ellos son fármacos que se administran por vía oral.
Uno de los principales problemas de los pacientes oncohematológicos es la desnutrición, que suele tener causas multifactoriales (de la propia enfermedad, de los pacientes y de los diferentes tratamientos administrados). Para minimizar el impacto de la desnutrición es necesaria una intervención nutricional, ya sea adaptando la dieta o mediante la instauración de soporte nutricional artificial, en función de la gravedad de cada caso.
En cualquier paciente que esté recibiendo un tratamiento oncológico hay que evaluar las posibles interacciones que pueden existir con el soporte nutricional instaurado, ya sea dieta oral, suplementación oral o nutrición enteral. Estas interacciones pueden disminuir la eficacia, aumentar la toxicidad de los tratamientos o producir déficits nutricionales.
Se detallan las principales interacciones que se pueden producir, las interacciones entre los tratamientos oncológicos y el soporte nutricional.
Palabras clave: Quimioterapia oral. Nutrición enteral. Interacción. Fármaco. Nutriente.
ABSTRACT
Over the past decade new knowledge on mechanisms involved in cancer growth has contributed to develop new drugs -for the most part orally administered drugs- to fight the disease.
One of the main problems affecting oncohematological patients is malnutrition, which is caused by a multitude of factors such as the disease itself, patients' condition, the treatments used, etc. In order to mitigate the impacts of malnutrition, nutritional intervention is required. Diet can be either modified or supplemented with artificial nutritional supplements, depending on the malnutrition severity of each patient.
Potential interactions between artificial nutritional support -whether dietary intervention, oral supplementation or enteral feeding- and cancer treatment should be assessed. These interactions may reduce efficiency, increase treatment toxicity or cause further nutritional deficiencies.
Major interactions between cancer treatments and nutritional supplements are described bellow.
Key words: Oral chemotherapy. Enteral nutrition. Interaction. Drug. Nutrient.
Introducción
La quimioterapia (QT), entendiéndose como tal tanto los agentes citotóxicos convencionales como los nuevos agentes dirigidos contra dianas específicas, constituye una herramienta fundamental de los tratamientos oncohematológicos.
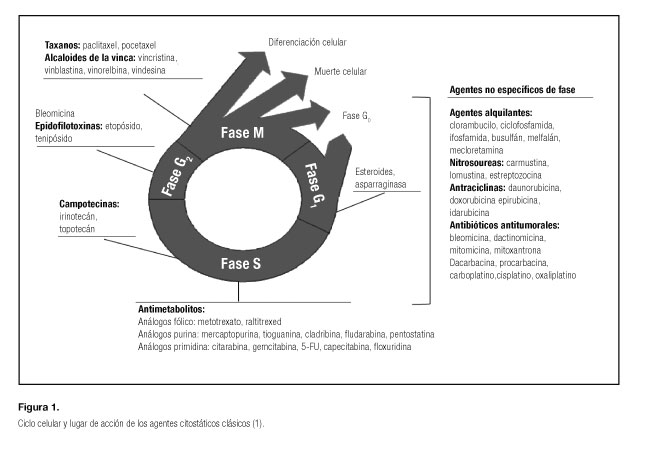
Tradicionalmente, los agentes citotóxicos clásicos se han clasificado según su efecto sobre el ciclo celular (Fig. 1) o según su mecanismo de acción, y la mayoría de ellos son de administración intravenosa (1):
- Agentes citotóxicos que afectan a la célula solamente durante una fase específica del ciclo celular, conocidos como agentes cicloespecíficos o esquemadependientes.
- Fármacos que actúan sobre las células tumorales durante cualquiera de las fases del ciclo celular, conocidos como cicloinespecíficos.
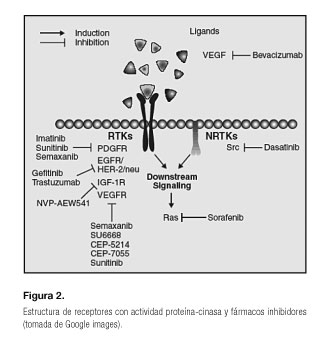
Durante los últimos años, y gracias a los múltiples avances que se han logrado tanto en la aplicación de tecnologías moleculares, bioquímicas, así como a las técnicas cristalográficas y modelos moleculares tridimensionales asistidos, se ha logrado identificar y caracterizar diferentes receptores o moléculas celulares. Una familia de estas moléculas son los receptores asociados a una actividad cinasa, conocidos como proteína-cinasas (PTKs), que desempeñan un importante papel en lo que a transducción de señales intracelulares se refiere. Estos receptores son proteínas transmembrana que están asociadas a múltiples enzimas que mediante la catalización de ATP fosforilan múltiples proteínas a nivel intracelular, regulando diferentes procesos, como la diferenciación y proliferación celular (Fig. 2). Todo ello ha permitido el diseño de nuevos fármacos; el grupo más conocido son los inhibidores de tirosina-cinasa (ITK) para el tratamiento del cáncer, que han mejorado la supervivencia de los pacientes (2) y, en determinados casos, han logrado incluso cronificar la enfermedad, como sería el caso de la leucemia mieloide crónica (3).
Así como la mayor parte de la QT convencional es administrada vía intravenosa, los ITK se caracterizan por (4):
- Ser moléculas pequeñas de bajo peso molecular capaces de atravesar la membrana celular por un proceso de difusión pasiva.
- Se administran por vía oral y es sumamente importante una correcta adherencia al tratamiento por parte del paciente. Presentan un buen perfil farmacocinético con una buena biodisponibilidad, al alcanzar las concentraciones plasmáticas terapéuticas para su acción antitumoral.
- Son metabolizados a nivel hepático por el citocromo p-450 y pueden presentar interacciones farmacocinéticas con aquellos medicamentos que puedan inhibir o estimular la misma vía de metabolización, como algunos antibióticos, antiepilépticos, antivirales, antifúngicos, que son metabolizados por diferentes isoenzimas como CYP3A4, CYP2C9 y CYP2D6. Algunos productos naturales como el zumo de pomelo también pueden presentar este problema.
En todos los casos, para que los tratamientos oncológicos sean eficaces, estos fármacos deben alcanzar un área bajo la curva determinada o una concentración plasmática situada entre la concentración mínima eficaz (CME) y la concentración máxima tolerada (CMT). Concentraciones inferiores a la CME podrían dar lugar a una respuesta inferior a la esperada, mientras que una concentración superior a la CMT podría dar lugar a un aumento en la incidencia de efectos adversos.
Desde un punto de vista nutricional, hay que tener en cuenta que la desnutrición es un problema que afecta, en gran medida, a los pacientes con cáncer a lo largo de la enfermedad y puede estar presente ya en el momento del diagnóstico o durante el tratamiento. Se estima que en el momento del diagnóstico hasta el 84% de los pacientes ha perdido peso y el 51% ha perdido más del 5% de su peso (5). La prevalencia de desnutrición varía entre los pacientes oncológicos hospitalizados y ambulatorios, 44,1% y 27,7%, respectivamente (5). En el caso de los pacientes con patologías hematológicas, la prevalencia de desnutrición no está bien estudiada, pero algunos estudios demuestran un 27% de riesgo de desnutrición en pacientes sometidos a trasplante de progenitores hematopoyéticos (6). Numerosos estudios han demostrado el impacto negativo que la desnutrición tiene en los pacientes oncológicos, ya que presentan peor tolerancia y eficacia de los tratamientos (7), con un aumento de las complicaciones globales tanto médicas (infecciosas) como quirúrgicas (8) y de la estancia hospitalaria, que se traduce en un aumento en los costes sanitarios (9,10).
La malnutrición puede estar asociada a factores relacionados con (11):
- El paciente: depresión, ansiedad, estrés, antecedentes de alcoholismo, existencia de comorbilidades (depresión, déficit cognitivo), hábitos alimentarios (vegetarianismo), entorno sociofamiliar.
- El tumor: alteraciones mecánicas (esófago, gástrica) o funcionales y por la secreción de sustancias caquetizantes y aumento de la síntesis proteica.
- Tratamientos: tanto en las intervenciones quirúrgicas, como en la radioterapia y la QT. Muchos de los tratamientos oncológicos pueden producir efectos adversos gastrointenstinales, como mucositis, diarreas y malabsorción, íleo paralítico, náuseas y vómitos, y dolor abdominal. Hay que tener en cuenta que, en muchos casos, los pacientes reciben los tres tratamientos de forma combinada para intentar la curación de la enfermedad: cirugía, quimioterapia y radioterapia, lo que puede tener un impacto nutricional muy importante en estos pacientes.
El soporte nutricional en el paciente oncológico tiene como finalidad asegurar un correcto aporte tanto de macronutrientes, sobre todo desde el punto de vista proteico, como de micronutrientes para evitar su déficit.
El principal objetivo del soporte nutricional es (12):
- Mejorar el estado nutricional o prevenir su empeoramiento.
- Mejorar la tolerancia y disminuir las complicaciones de los tratamientos oncoespecíficos.
- Mejorar la calidad de vida.
Teniendo en cuenta lo explicado anteriormente, hay que evaluar las posibles interacciones que pueden existir entre los diferentes tratamientos oncológicos administrados y el soporte nutricional, ya sea dieta oral, suplementación oral o nutrición enteral. Estas interacciones podrían tener como consecuencia:
- Disminuir la eficacia de los tratamientos oncológicos.
- Aumentar la toxicidad de los tratamientos oncológicos.
- Mala tolerancia al soporte nutricional.
- Carencias nutricionales.
Estas interacciones pueden ser (13):
- Físicas.
- Farmacocinéticas.
- Farmacodinámicas.
- Farmacológicas.
Interacciones físicas
Las interacciones físicas se deben principalmente a la alteración de la forma farmacéutica de los medicamentos. En aquellos pacientes en los que no se puede utilizar la vía oral por toxicidad a los tratamientos (mucositis, disfagia, odinofagia, trismo) es necesaria la administración de nutrición vía enteral mediante el uso de sondas u ostomías de alimentación, para asegurar un adecuado aporte nutricional. La alteración de las formas farmacéuticas para su administración por vía enteral puede producir una alteración en determinados procesos como la liberación o la disolución del principio activo, inactivándolo o aumentando su absorción.
Para minimizar dichas interacciones se recomienda (14):
- Administrar los fármacos por vía oral siempre que sea posible y no exista riesgo para el paciente.
- En el caso de tener que utilizar la vía enteral, administrar cada uno de los fármacos por separados y posteriormente lavar la sonda u ostomía con una jeringa de agua. No administrar en una única toma toda la medicación, ya que pueden producirse incompatibilidades físicas entre ellos y obturar las vías de administración.
- Se aconseja usar sondas u ostomías de silicona o poliuretano, ya que la absorción de fármacos es menor que con el cloruro de polivinilo.
- Utilizar sondas nasogástricas de 12 Fr siempre que sea posible.
Interacciones farmacocinéticas
La farmacocinética (15) estudia el paso de los fármacos, sus metabolitos y nutrientes a través del organismo, en función del tiempo y de la dosis administrada, así como su relación con la respuesta farmacológica. Es decir: "lo que el organismo hace al fármaco". Existe una gran variabilidad farmacocinética intraindividual e interindividual; así que, teniendo en cuenta esta variabilidad, la respuesta farmacológica de un fármaco o nutriente se relaciona mejor con las concentraciones plasmáticas máximas (Cmax) y con el área bajo la curva (AUC).
El conjunto de procesos farmacocinéticos que afectan al paso del fármaco por el organismo se conoce con el acrónimo LADME e incluye:
- Liberación: salida del fármaco/nutriente desde la forma farmacéutica en que ha sido administrado. Factores condicionantes: tipo de forma farmacéutica. Especialmente importante en formas farmacéuticas de liberación retardada o sostenida o macromoléculas de transporte (por ejemplo, doxorubicina liposomal).
- Absorción: acceso del fármaco inalterado a la circulación sistémica, mediante el paso a través de barreras biológicas próximas al lugar de administración. Factores condicionantes: fármaco (peso molecular, hidroliposolubilidad), zona de absorción, estado de ayuno (es uno de los puntos críticos en cuanto a interacción fármaco-nutriente). Afecta a cualquier fármaco no administrado por vía endovenosa.
- Distribución: proceso dinámico, basado en diferentes constantes de equilibrio, que describe la incorporación de un fármaco desde la circulación sistémica hasta los diferentes órganos y tejidos (biofase), así como su retorno a la circulación sistémica. Factores condicionantes: fármaco (peso molecular, hidroliposolubilidad, afinidad a proteínas plasmáticas (solo la fracción de fármaco libre en el plasma es la fracción de fármaco activa) o tisulares, flujo sanguíneo, permeabilidad de membranas, etc. Afecta a todos los fármacos.
- Metabolismo: biotransformaciones enzimáticas que un fármaco sufre y que originan metabolitos (activos o inactivos) de mayor solubilidad, para favorecer su posterior eliminación del organismo. Destaca el metabolismo hepático realizado por el citocromo p-450, que afecta a un gran número de fármacos oncológicos, como por ejemplo carmustina, busulfán, alcaloides de la vinca, antraciclinas, etc.
- Excreción: eliminación del organismo de un fármaco inalterado o de sus metabolitos. Principalmente se eliminan por vía renal (por ejemplo: carboplatino, lenalidomida y metotrexato), pero también hay que tener en cuenta la vía biliar, salivar, respiratoria, etc. Los procesos que se han de tener en cuenta en la excreción renal son: filtración glomerular, secreción tubular y reabsorción tubular.
INTERACCIONES FARMACOCINÉTICAS EN LA ABSORCIÓN
Estas interacciones pueden producirse a lo largo del tracto gastrointestinal; son las que ocurren con mayor frecuencia y pueden tener más implicación en la práctica clínica diaria. Para minimizar el riesgo de estas interacciones y asegurar una correcta absorción del fármaco, estos deben administrarse según las especificaciones que se describen en las fichas técnicas. En caso de hacerlo de forma incorrecta, sus consecuencias pueden ser:
- Modificación de la cantidad de fármaco absorbida: aumentándola o disminuyéndola.
- Modificación la velocidad de absorción.
- Mala tolerancia gastrointestinal a los tratamientos.
Estas interacciones pueden ser debidas a:
- Modificaciones en el pH gástrico: a solubilidad de los fármacos depende del pH (16). Muchos de los fármacos utilizados en oncología son bases débiles y su solubilidad es mayor en pH ácidos. El aumento del pH por efecto de los alimentos o antiácidos podría ser la causa de la disminución en la absorción de algunos de estos medicamentos. Así pues, en determinados casos, los fármacos deben administrarse en ayunas. Por lo general esto significa que deben tomarse 1 hora antes o 2 horas después de la ingesta de alimentos o del soporte nutricional. Sería el caso del lapatinib, fármaco utilizado para el tratamiento del cáncer de mama metastásico Her 2+. En el estudio de Koch y cols. (17), los valores medios de Cmax y del AUC tras administrar tres dosis de 1.500 mg de lapatinib los días 1,8 y 15 varían de forma sustancial cuando se administra en ayunas, después de una comida baja en grasas o de una comida en alto contenido en grasas. Estos valores pueden llegar a multiplicarse por cuatro, aumentando la incidencia y la duración de uno de sus efectos adversos como son las diarreas cuando se toma la medicación junto con una dieta rica en grasas.
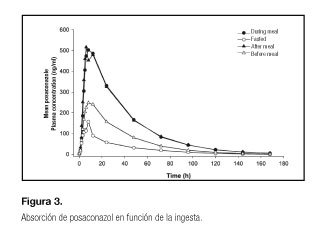
En otros casos nos interesa que la administración sea junto con alimentos para favorecer su absorción. Es el caso del posaconazol en suspensión, fármaco utilizado para el tratamiento y profilaxis de infecciones fúngicas. En este caso, la administración de posaconazol en ayunas puede disminuir los niveles de Cmax y el AUC. Según el estudio de Krishna y cols. (18), los ácidos grasos actúan como solvente, favoreciendo la solubilización del posaconazol y favoreciendo así su absorción (Fig. 3).
Y por último, también podemos encontrar casos en los que no existe ninguna interacción entre fármaco y nutriente desde el punto de vista del incremento o disminución de la absorción, y la administración conjunta permite minimizar los efectos adversos gastrointestinales, como sería el caso de imatinib y capecitabina.
- Quelación por cationes divalentes/trivalentes o fibra: los cationes divalentes o trivalentes (calcio, hierro, aluminio, etc.) que están presentes en las dietas o que son aportados como suplementos de forma exógena también pueden disminuir la absorción de determinados fármacos, mediante la formación de complejos insolubles. En el estudio de Williams y cols. (19), la administración de eltrombopag junto con un desayuno rico en calcio disminuye el AUC y la Cmax en un 59% y un 65%, respectivamente, motivo por el que esta medicación debe tomarse o 4 horas antes o 4 horas después de cualquier producto lácteo, antiácidos o suplementos minerales.
- Alteración del vaciado gástrico: los medicamentos suelen absorberse mejor en el intestino delgado que en el estómago, de forma que la mayoría de los fármacos administrados por vía oral se realiza en la parte proximal del intestino delgado. Por lo tanto, en general, aquellas situaciones que retrasen el vaciamiento gástrico podrían disminuir la absorción de los fármacos. Entre otros factores, el vaciamiento gástrico es más lento: cuanto mayor es la densidad calórica, mayor es el contenido en grasas y proteínas.
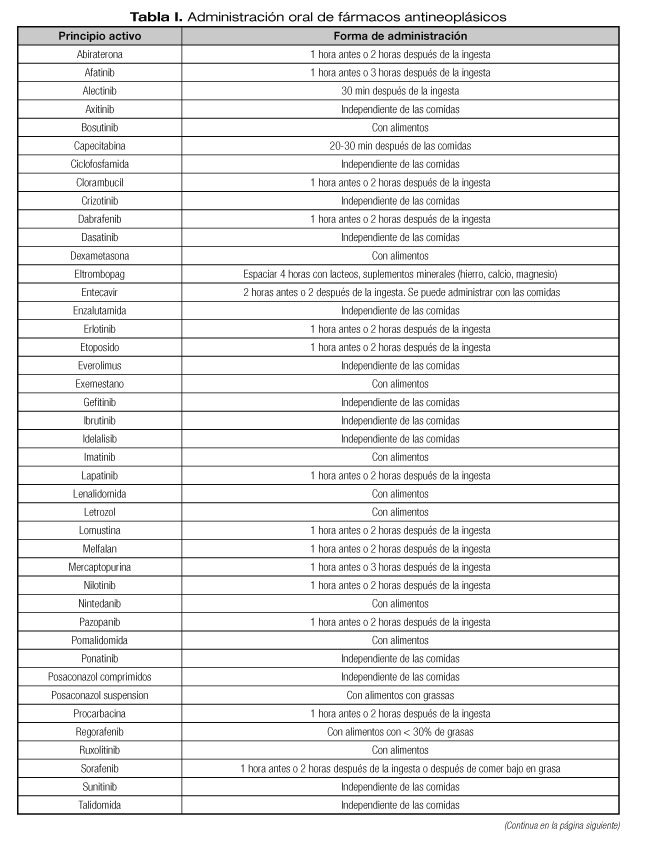
Como resumen, en la tabla I se especifica la correcta forma de administración en relación con los alimentos de cada uno de los fármacos.
INTERACCIONES FARMACOCINÉTICAS EN LA DISTRIBUCIÓN
Muchos fármacos, cuando acceden al torrente sanguíneo, se trasportan mediante la unión a proteínas plasmáticas, sobre todo la albúmina, uno de los principales parámetros de desnutrición. La unión a proteínas plasmáticas es un proceso reversible y llega a un equilibrio donde la fracción libre es farmacológicamente activa, mientras que la que permanece unida actúa como reservorio inactivo. Así pues, hay que tener en cuenta que muchos pacientes con cáncer pueden presentar hipoalbuminemias severas como consecuencia de su estado de desnutrición, que pueden aumentar la fracción de fármaco libre, sus efectos y su toxicidad. Se ha publicado un estudio en el que el riesgo relativo de toxicidad hematológica y gastrointestinal es de 5,6 veces en aquellos pacientes que presentan hipoalbuminemia de base (20). En casos de hipoalbuminemias severas, se debería intentar corregir parcialmente con un correcto soporte nutricional antes de empezar un tratamiento oncológico.
INTERACCIONES FARMACOCINÉTICAS EN EL METABOLISMO
El citocromo p-450 es la principal vía de metabolización de los fármacos y xenobióticos. Existen diferentes familias de isoenzimas implicadas y las que tienen mayor relevancia en la clínica son el CYP3A4, CYP2D6 y CYP2C19. En el caso de que dos sustancias sean metabolizadas por la misma isoenzima, esto puede producir un efecto de inhibición o estimulación por parte de una de ellas. En caso de que haya una sustancia inhibidora del metabolismo, se produciría un aumento en los niveles plasmáticos del fármaco (riesgo de toxicidad); mientras que un estimulador del metabolismo produciría el efecto contrario, unas Cmax y AUC menores (disminución de eficacia). El pomelo es el principal inhibidor del metabolismo de muchos fármacos -no solo oncológicos- por inhibición de la vía del CYP3A4 (21). Aunque los mecanismos de dicha interacción no son del todo conocidos, se cree que dicha inhibición puede ser debida a dos sustancias (flavonoides): bergamotita y 6,7-dihidorxibergamotina. Así pues, se debe desaconsejar tomar pomelo a los pacientes que reciban tratamientos oncológicos cuyos fármacos sean metabolizados por vía hepática.
Interacciones farmacocinéticas de la excreción
La principal vía de excreción de los fármacos es la vía renal y las interacciones más frecuentes entre fármaco y nutrientes suelen darse en el proceso de la reabsorción tubular. Este suele ser un proceso pasivo, que depende de la liposolubilidad del fármaco, de modo que los fármacos que estén en la orina en un estado ionizado serán menos liposolubles y, por tanto, serán menos reabsorbidos. En el caso de los fármacos que estén no ionizados, serán más liposolubles y, por tanto, más reabsorbidos hacia la sangre.
La eliminación de fármacos ácidos se favorece con la alcalinización de la orina, como sería el caso del metotrexate. Este es un agente citostático que se elimina principalmente por vía renal, y cuando se administra en dosis superiores de 1g/m2/día existe el riesgo de que este precipite cuando la orina es inferior a pH 7. Esta precipitación puede desencadenar insuficiencia renal, ya que disminuye la eliminación del fármaco y, por lo tanto, aumenta su toxicidad (mucositis, hepatotoxicidad, mielosupresión). Para disminuir el riesgo de que se produzca esta precipitación se aconseja monitorizar el pH de la orina y administrar bicarbonato para mantener el pH > 7. Existen algunos casos, publicados en los que el consumo de alimentos o soluciones ácidas, como podrían ser los refrescos con cola, pueden disminuir el pH urinario (debido a la presencia de ácido fosfórico) y favorecer la toxicidad de metotrexate (22). Por esto motivo se debe restringir la ingesta de estos alimentos durante los días en los que se administra metotrexate y hasta que sus concentraciones plasmáticas sean inferiores a 0,2 µmol/l.
Interacciones farmacodinámicas
Estas interacciones se producen en el lugar de actuación del fármaco, de forma que el efecto de este puede verse modificado por la presencia de otra sustancia. Estas interacciones pueden producirse a nivel del receptor donde se unen los fármacos o por la modificación de los procesos celulares que se ponen en marcha tras la unión fármaco-receptor. Según sea esta modificación, podemos hablar de efecto agonista (potenciación) o antagonista (inhibición). Un ejemplo de efecto agonista sería el ácido fólico que actúa potenciando el efecto del 5-fluorouracilo (5-FU) mediante la estabilización del complejo 5-fluorouracilo-timidilato-sintasa, aumentando la actividad antitumoral del 5-FU (23). Por el contrario, el ácido fólico actúa como un antagonista en aquellos pacientes que reciben tratamiento con metotrexato (24) (agente citostático que inhibe la dihidrofolato-reductasa, ya que bloquea la síntesis de timidilato y análogos de purina y produce la muerte celular).
Interacciones farmacológicas
Las principales interacciones entre fármaco y la alimento/nutrición pueden desencadenar los siguientes problemas:
- Diarreas: estas pueden ser producidas por una mala tolerancia a los suplementos o nutrición enteral, ya sea por una administración incorrecta (demasiado rápida), por componentes de la propia NE (fórmulas ricas en fibra, fórmulas hipercalóricas, elevada osmolaridad) o por inadecuada colocación de las sondas u ostomías de alimentación (25) (colocación pospilórica). Por otro lado, muchos de los fármacos oncológicos utilizados pueden producir diarrea, con una incidencia y gravedad muy variable en función de los tratamientos (26) (inhibidores de tirosincinasas, inhibidores de mTOR, anticuerpos monoclonales, fluorouracilo, irinotecan), de forma que el origen de las diarreas en estos pacientes puede ser multifactorial y es necesario establecer cuáles pueden ser sus causas más probables para intentar revertir la situación. Su gravedad se clasifica en cuatro grados, según frecuencia y consistencia. En algunas situaciones puede llegar a comportar la modificación o suspensión del tratamiento, la modificación de la fórmula de nutrición enteral, disminución de la velocidad de administración y la utilización de antidiarreicos.
- Vómitos: al igual que la diarrea, los vómitos pueden ser consecuencia tanto de los tratamientos oncológicos como del soporte nutricional o la técnica utilizada (administración a gravedad o en infusión continua). En los pacientes con cáncer, existen factores de riesgo que se asocian con una mayor probabilidad de sufrir vómitos asociados al tratamiento oncoespecífico, como son: pacientes jóvenes, mujeres, radioterapia concomitante, antecedentes de QT previas, no historial de alcoholismo.
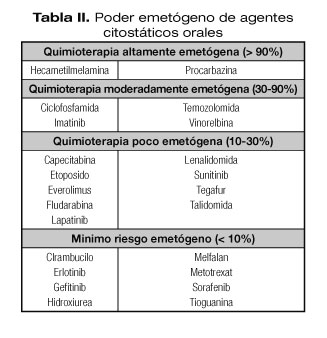
Los fármacos citostáticos poseen distinta capacidad o poder emetógeno, tal como se expone en la tabla II (27).
Teniendo en cuenta que en muchos casos los pacientes reciben tratamiento con poliquimioterapia que combina diferentes fármacos, el esquema de Hesketh (28) establece el poder emetógeno de los diferentes esquemas utilizados, clasificándolos en:
- Altamente emetógeno: incidencia de náuseas o vómitos > 90%.
- Moderadamente emetógeno: incidencia de náuseas o vómitos 30-90%.
- Bajo poder emetógeno: incidencia de náuseas o vómitos 10- 30%.
- Poder emetógeno mínimo.
De forma que para los pacientes con más riesgo se deben instaurar pautas profilácticas durante los días de tratamiento y, en caso que fuera necesario, pautas de rescate para intentar revertir dicho cuadro. En función de los neurotransmisores implicados en el reflejo del vómito, los grupos de fármacos más utilizados para la profilaxis antiemética suelen ser (29):
- Antagonistas serotoninérgicos: ondansetrón, granisetrón.
- Corticoides: dexametasona.
- Antidopaminérgicos: metoclopramida.
- Antagonistas de la sustancia NK1: aprepitant, fosaprepitant.
Los vómitos también pueden ser consecuencia de una mala tolerancia al soporte nutricional, sobre todo cuando hacemos referencia a la nutrición enteral. En la mayoría de los pacientes se administra la nutrición enteral a gravedad (administración de 500 ml en 1 h 30 min-2 h), ya que es la forma de administración más fisiológica, cómoda y la que permite mayor autonomía a los pacientes. En casos de intolerancia, una solución sería la administración de la nutrición de forma continuada con bombas de infusión, empezando a ritmos lentos de 25-50 ml/h y aumentar de forma progresiva según evolucione el cuadro (30).
Los casos más graves de intolerancia gastrointestinal pueden desencadenar un cuadro de deshidratación severa, debiéndose instaurar dieta absoluta, reposición hidroelectrolítica por vía intravenosa y soporte con nutrición parenteral.
Para el manejo de los pacientes que tienen complicaciones, es necesario un análisis individual de cada caso y establecer las posibles causas, ya sean nutricionales o farmacológicas, que nos permitan adoptar medidas concretas para solventar dichos problemas.
Bibliografía
1. Rebecca S, Finley C, Balmer M, editores. Concepts in Oncology Therapeutics. American Society of Health-System Pharmacists. 3rd ed. January 2007. [ Links ]
2. Leveque D, Delpeuch A, Gourieux B. New anticancer agents: role of clinical pharmacy services. Anticancer Res 2014;34(4):1573-8. [ Links ]
3. Thompson PA, Kantarjian HM, Cortes JE. Diagnosis and Treatment of Chronic Myeloid Leukemia in 2015. Mayo Clin Proc 2015;90(10):1440-54. DOI: 10.1016/j.mayocp.2015.08.010. [ Links ]
4. Fabbro D, Ruetz S, Buchdunger E, Cowan-Jacob SW, Fendrich G, Liebetanz J, et al. Me Protein kinases as targets for anticancer agents: from inhibitors to useful drugs. Pharmacol Ther 2002;93(2-3):79-98. [ Links ]
5. Hébuterne X, Lemarié E, Michallet M, de Montreuil CB, Schneider SM, Goldwasser F. Prevalence of malnutrition and current use of nutrition support in patients with cancer. JPEN J Parenter Enteral Nutr2014;38(2):196.204. [ Links ]
6. Horsley P, Bauer J, Gallagher B. Poor nutritional status prior to peripheral blood stem cell transplantation is associated with increased length of hospital stay. Bone Marrow Transplant 2005;35(11):1113-6. [ Links ]
7. Andreyev HJN, Norman a. R, Oates J, Cunningham D. Why do patients with weight loss have a worse outcome when undergoing chemotherapy for gastrointestinal malignancies? Eur J Cancer 1998;34(4):503-9. [ Links ]
8. Bozzetti F, Gianotti L, Braga M, Di Carlo V, Mariani L. Postoperative complications in gastrointestinal cancer patients: the joint role of the nutritional status and the nutritional support. Clin Nutr 2007;26(6):698-709. [ Links ]
9. Van Cutsem E, Arends J. The causes and consequences of cancer-associated malnutrition. Eur J Oncol Nurs 2005;9(Suppl 2):S51-63. [ Links ]
10. Tong H, Isenring E, Yates P. The prevalence of nutrition impact symptoms and their relationship to quality of life and clinical outcomes in medical oncology patients. Support Care Cancer 2009;17(1):83-90. [ Links ]
11. Witham G. Nutrition and cancer: issues related to treatment and survivorship. Br J Community Nurs 2013;Suppl Nutrition:S20-4. [ Links ]
12. Caccialanza R, Pedrazzoli P, Cereda E, Gavazzi C, Pinto C, Paccagnella A, et al. Nutritional Support in Cancer Patients: A Position Paper from the Italian Society of Medical Oncology (AIOM) and the Italian Society of Artificial Nutrition and Metabolism (SINPE). J Cancer 2016;7(2):131-5. [ Links ]
13. De Blas Matas, B Laredo Velasco, LM Vargas Castrillón. Información terapéutica del Sistema Nacional de Salud, Vol 28, n.o 1-2004. [ Links ]
14. Peña Pedrosa JA, et al. Guía de administración de medicamentos por sondas de alimentación entera. Madrid: Hospital Clínico San Carlos; 2012. [ Links ]
15. Figg WD, McLeod HL. Cancer Drug Discovery and Development. Handbook of Anticancer Pharmacokinetics and Pharmacodynamics. Totowa, NJ: Humana Press Inc; 2004. [ Links ]
16. Herbrink M, Nuijen B, Schellens JH, Beijnen JH. Variability in bioavailability of small molecular tyrosine kinase inhibitors. Cancer Treat Rev 2015;41(5):412-22. [ Links ]
17. Koch KM, Reddy NJ, Cohen RB, Lewis NK, Whitehead B, Mackay K, et al. Effects of Foof on the Relative Bioavailability of Lapatinib in Cancer Patients. Journal Clinical Oncology 2009;27(8):1191-6. [ Links ]
18. Krishna G, Moton A, Ma L, Medlock MM, McLeod J. Pharmacokinetics and absorption of posaconazole oral suspension under various gastric conditions in healthy volunteers. Antimicrob Agents Chemother 2009;53(3):958-66. [ Links ]
19. Williams DD, Peng B, Bailey CK, Wire MB, Deng Y, Park JW, et al. Effects of food and antacids on the pharmacokinetics of eltrombopag in healthy adult subjects: two single-dose, open-label, randomized-sequence, crossover studies. Clin Ther 2009;31(4):764-76. [ Links ]
20. Villagran S, Castro N, Torselli S. Hipoalbuminemia y tratamiento antineoplasico. Asociación de Medicina Interna de Guatemala 2013; enero-abril 17(1):40-3. [ Links ]
21. Fujita K. Food-drug interactions via human cytochrome P450 3A (CYP3A). Drug Metabol Drug Interact 2004;20(4):195-217. [ Links ]
22. Santucci R, Levêque D, Herbrecht R. Cola beverage and delayed elimination of methotrexate. Br J Clin Pharmacol 2010;70(5):762-4. [ Links ]
23. Kovoor PA, Karim SM, Marshall JL. Is levoleucovorin an alternative to racemic leucovorin? A literature review. Clin Colorectal Cancer 2009;8(4):200-6. [ Links ]
24. Le Guellec C, Blasco H, Benz I, Hulin A. Suivi Thérapeutique Pharmacologique de la Société Française de Pharmacologie et de Thérapeutique. (Therapeutic drug monitoring of methotrexate after its administration in high-dose protocols). Therapie 2010;65(3):163-9. [ Links ]
25. Nally DM, Kelly EG, Clarke M, Ridgway P. Nasogastric nutrition is efficacious in severe acute pancreatitis: a systematic review and meta-analysis. Br J Nutr 2014;112(11):1769-78. [ Links ]
26. Bossi P, Lucchesi M, Antonuzzo A. Gastrointestinal toxicities from targeted therapies: measurement, duration and impact. Curr Opin Support Palliat Care 2015;9(2):163-7. [ Links ]
27. Multinational Association of Supportive Care in Cancer. MASCC/ESMO antiemetic guideline 2011. In: Gralla RJ, Roila F, Tonato M, et al., eds. Perugia Consensus Conference on Antiemetic Therapy June 2009. Perugia, Italy: MASCC; 2011:1-41. [ Links ]
28. Hesketh PJ. Chemotherapy-induced nausea and vomiting. N Engl J Med 2008;358(23):2482-94. [ Links ]
29. Tageja N, Groninger H. Chemotherapy-induced nausea and vomiting: an overview and comparison of three consensus guidelines. Postgrad Med J 2016;92(1083):34-40. [ Links ]
30. Kolaček S. Enteral nutrition. World Rev Nutr Diet 2013;108:86-90. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Eduard Fort Casamartina.
Servicio de Farmacia.
Hospital Duran i Reynals.
Avinguda de la Gran Via de l'Hospitalet, 199-203.
08908 L'Hospitalet de Llobregat, Barcelona
e-mail: efort@iconcologia.net.